Hyperkalemie u nemocných se srdečním selháním ‒ některé problémy a jejich možná řešení
Key words: hyperkalaemia, heart failure, renin‑angiotensin‑aldosterone system inhibitors, finerenone, patiromer, sodium zirkonium cyclosilicate.
Úvodem
Srdeční selhání je doprovázeno aktivací celé řady neurohumorálních systémů. Farmakologická inhibice sympatoadrenálního systému (SAS) a renin angiotenzin aldosteronového systému (RAAS) má za následek významný pokles morbidity a mortality, a proto je v současnosti pilířem farmakologické léčby chronického srdečního selhání. Podle stávajících doporučených postupů má být každý nemocný se srdečním selháním se sníženou ejekční frakcí (heart failure with reduced ejection fraction, HFrEF) levé komory léčen kombinací inhibitoru RAAS s inhibitorem SAS, tj. inhibitorem angiotenzin konvertujícího enzymu (ACE) nebo sartanem a betablokátorem. Zůstává li nemocný s HFrEF stále symptomatický, pak do terapie vstupuje ještě blokátor mineralokortikoidních receptorů (mineralocorticoid receptor antagonist, MRA) spironolakton nebo eplerenon. Takováto léčba prokazatelně snižuje morbiditu i mortalitu nemocných s HFrEF, je založena na důkazech z velkých randomizovaných klinických studií, je tzv. evidence based [1,2]. Také dávky jednotlivých léků byly vyzkoušeny ve velkých klinických studiích, a proto jsou doporučovány jako dávky cílové.
Léčba HFrEF inhibitory RAAS (tj. inhibitory ACE, sartany a MRA) však s sebou nese některá rizika, především zhoršení renálních funkcí a hyperkalemie. Tato rizika výrazně zvyšuje přítomnost některých komorbidit, které jsou při srdečním selhání časté. Jsou to především chronická onemocnění ledvin často doprovázející diabetes mellitus (diabetická nefropatie) nebo arteriální hypertenzi (hypertenzní nefropatie) a jiné choroby vedoucí k poklesu glomerulární filtrace jako ukazateli vylučovací schopnosti ledvin.
Riziko hyperkalemie je častým důvodem pro suboptimální dávkování inhibitorů RAAS, nebo dokonce i k ukončení jejich podávání. To prokazatelně snižuje potenciální účinnost léčby HFrEF s nárůstem mortality. Bludný kruh se pak uzavírá tím, že pacienti s komorbiditami zvyšujícími riziko vzniku hyperkalemie, jako je např. chronické renální selhání, mají vyšší mortalitu. Na straně jedné tedy komorbidity zvyšují mortalitu a současně zvyšují riziko vzniku hyperkalemie. To má za následek vysazení nebo omezení dávek život zachraňujících inhibitorů RAAS a vice versa. Obavy z hyperkalemie při terapii inhibitory RAAS s následným omezením dávek nebo úplným ukončením podávání inhibitorů RAAS na straně druhé rovněž významně zvyšují mortalitu. V léčbě HFrEF je proto klíčové snížit riziko vzniku hyperkalemie.
Homeostáza draslíku a příčiny hyperkalemie
Draslík je distribuován převážně v intracelulárním prostoru. Jeho intracelulární koncentrace je přibližně 140 mmol/l a uvnitř buněk je ho obsaženo takřka 98 % veškerého množství. Pouze 2 % z celkového množství draslíku se nacházejí extracelulárně. Normální plazmatická koncentrace draslíku je v rozmezí 3,8–5,0 mmol/l a závisí na jeho příjmu v potravě a na jeho renálním vylučování. Naprostá většina draslíkových kationtů (K+), které se glomeruly profiltrují do primární moči, je reabsorbována v proximálním tubulu (65 %) a v Henleově kličce (20 %). Pro výslednou plazmatickou koncentraci K+ je rozhodující následná sekrece, která je regulována RAAS. Vzestup kalemie stimuluje uvolňování reninu z buněk juxtaglomerulárního aparátu a aktivuje tak RAAS. Aldosteron působí na distální tubulus a zvyšuje v něm vylučování draslíku.
Hyperkalemie může být způsobena obecně jedním ze tří mechanismů: 1. vzestup příjmu draslíku (perorálně nebo parenterálně), 2. změny v distribuci draslíku mezi intra a extracelulárním prostorem, 3. snížené renální vylučování.
U nemocných se srdečním selháním se vlivem patofyziologie a účinků léků může objevit hypo i hyperkalemie. Obě situace, pokud nejsou včas detekovány a korigovány, mohou mít závažné až fatální důsledky. Jak hypo , tak i hyperkalemie mohou vést k závažným poruchám srdečního převodu a k arytmiím. Hypokalemie je častější v počátečních fázích srdečního selhání, kdy je vylučovací schopnost ledvin ještě zachována. Intenzivní diuretická léčba může navodit významnou hypokalemii, což často vede k substituci draslíku, např. podáváním KCl nebo jiných draselných solí. V pokročilejších fázích srdečního selhání se však vylučovací schopnost ledvin nezřídka progresivně zhoršuje, klesá vylučování draslíku a zvyšuje se riziko hyperkalemie, zejména pokračuje li vysoký perorální příjem v podobě draslíkové substituce [3]. Patofyziologie vzniku hyperkalemie je typicky multifaktoriální s podílem změn v transmembranózní distribuci draslíku a změn v zevní rovnováze při poklesu renálního vylučování. Renální vylučování draslíku je totiž při srdečním selhání sníženo ze dvou důvodů: a) kvůli poklesu glomerulární filtrace (GFR), který se může objevit i při normální plazmatické koncentraci kreatininu, a b) vlivem farmakologické léčby srdečního selhání včetně inhibitorů RAAS, jako jsou inhibitory ACE, sartany a MRA. Jsou li renální funkce normální, je riziko hyperkalemie při užívání inhibitorů RAAS pro srdeční selhání malé, přibližně u 3,3 % nemocných. Ovšem v přítomnosti rizikových faktorů pro vznik hyperkalemie riziko stoupá až k 10 %. Takovýmito rizikovými faktory jsou např. chronická renální insuficience, diabetes mellitus nebo lékové interakce s jinými léky, jako jsou např. nesteroidní antirevmatika, digoxin, heparin, cyklosporin aj. [4]. Vezmeme li v úvahu věk, komorbidity, farmakoterapii pro srdeční selhání a obvyklou polyfarmakoterapii nemocných s chronickým srdečním selháním, zjistíme, že hyperkalemie je u těchto nemocných velmi častým a potenciálně nebezpečným problémem.
Prevalence hyperkalemie u nemocných se srdečním selháním
Podle definice je hyperkalemií plazmatická koncentrace K+ > 5 mmol/l. Prevalence hyperkalemie mezi hospitalizovanými z jakékoliv příčiny se odhaduje na 1‒10 % [5]. Pacienti s chronickým onemocněním ledvin, srdečním selháním, diabetes mellitus a ti, kteří užívají inhibitory RAAS, mají riziko hyperkalemie 2‒3× vyšší. Existuje dostatek dokladů o tom, že riziko úmrtí významně stoupá od kalemie vyšší než 5,5 mmol/l. Proto je v klinických studiích hranice 5,5 mmol/l často uváděna jako referenční. U nemocných s chronickou renální insuficiencí však může výskyt hyperkalemie vzrůst až ke 40‒50 % [6]. Nemocní se srdečním selháním jsou pak k hyperkalemii mimořádně náchylní, protože jsou většinou starší, často mají komorbidity, které vedou ke sníženému vylučování draslíku, a také proto, že jejich účinná a na důkazech založená léčba pravidelně obsahuje inhibitory RAAS, navíc většinou v kombinaci (inhibitor ACE nebo sartan spolu s MRA). U ambulantních pacientů se v prvním roce terapie inhibitorem ACE nebo sartanem objeví hyperkalemie přibližně v 10 % [7]. U hospitalizovaných nemocných jsou inhibitory RAAS odpovědné za 63 % případů hyperkalemie. Navíc 10‒38 % hospitalizací pro hyperkalemii je způsobeno těmito léky.
Celosvětově trpí srdečním selháním přibližně 26 milionů nemocných [8], v České republice přibližně 200 000 až 300 000 osob. Všichni tito nemocní jsou potenciálně ohroženi vznikem hyperkalemie. Tato může být klasifikována do dvou typů jako:
nezbytná hyperkalemie, do níž patří hormonální poruchy (např. Addisonova choroba, nízkoreninový hypoaldosteronismus), diabetes mellitus, chronická onemocnění ledvin a choroby s nestabilitou buněčné membrány, které vedou k přesunu intra a extracelulárního draslíku;
hyperkalemie způsobená léčbou, např. inhibitory RAAS včetně MRA, nesteroidními antirevmatiky, kalium šetřícími diuretiky, heparinem aj. (sem patří rovněž potraviny bohaté na draslík a potravinové doplňky s jeho vysokým obsahem).
Přestože v klinických studiích u nemocných s chronickým srdečním selháním patří hyperkalemie k pravidelným vylučovacím kritériím pro zařazení (podobně jako pokročilejší renální insuficience), jsou tito pacienti hyperkalemií často ohroženi. Jak již bylo uvedeno výše, u ambulantních nemocných, kteří užívají nějaký inhibitor RAAS, dosahuje riziko hyperkalemie v prvním roce užívání až 10 %, u hospitalizovaných riziko stoupá až k 38 % [7,8]. Například ve studii RALES (Randomized Aldactone Evaluation Study) se riziko mortality významně zvýšilo při kalemii vyšší než 5,5 mmol/l [9]. Vztah mezi kalemií a mortalitou měl v této studii charakter křivky U. Po publikaci výsledků klinického hodnocení RALES se výrazně zvýšilo užívání spironolaktonu u nemocných s chronickým srdečním selháním, ale bohužel také významně narostl počet hospitalizací z důvodu hyperkalemie (z 2,4/1 000 nemocných v roce 1994 na 11/1 000 nemocných v roce 2001; p < 0,001) [10]. Významně se také zvýšil počet úmrtí v souvislosti s hyperkalemií – z 0,10/1 000 nemocných v roce 1994 na 0,39/1 000 nemocných v roce 2001 [10]. Tyto údaje jasně dokládají jak význam a potenciální rizika hyperkalemie při zvýšení inhibice RAAS, tak rovněž nutnost pečlivého monitorování hodnot elektrolytů.
Jak již bylo uvedeno, riziko vzniku hyperkalemie u pacientů se srdečním selháním a s doprovodnou chronickou renální insuficiencí je zvýšené. Mezi 105 388 nemocnými zařazenými do registru ADHERE (Acute Decompensated Heart Failure National Registry) mělo více než 60 % chronické renální onemocnění. U nemocných s chronickým renálním onemocněním dosahuje prevalence hyperkalemie 20 % a je spojena s vyšším výskytem velkých kardiovaskulárních příhod včetně mortality a také s častějším přerušením léčby inhibitory RAAS [11]. Přitom je přesvědčivě doloženo, že terapie inhibitory RAAS zlepšuje významně prognózu těchto pacientů.
Symptomy a diagnóza hyperkalemie
Hyperkalemie ovlivňuje depolarizaci buněčných membrán. Může být doprovázena metabolickou acidózou, která vede k uvolnění K+ z intracelulárního do extracelulárního prostoru. Nejhorší důsledky má hyperkalemie ≥ 7 mmol/l, chronická hyperkalemie nebo situace, kdy kalemie rychle stoupne.
Klinická prezentace hyperkalemie může
být u nemocných se srdeč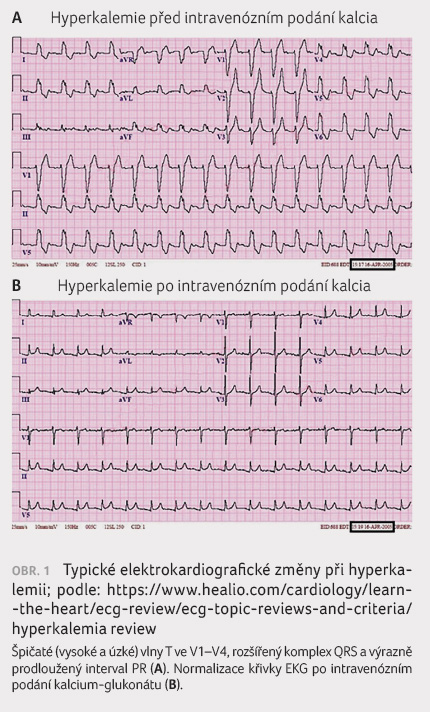 ním selháním velmi zavádějící.
Tito nemocní mohou být zcela asymptomatičtí nebo mají příznaky,
které jsou pro srdeční selhání obvyklé, jako svalová slabost,
únava, nevýkonnost, převodní srdeční poruchy nebo nejrůznější
arytmie včetně náhlé smrti. Svalová slabost může simulovat až
syndrom Guillaina‒Barrého. Nicméně nejzávažnější jsou
projevy kardiální. Na hyperkalemii, byť asymptomatickou,
mohou upozornit změny na křivce EKG (obr. 1). Elektrokardiografické abnormality však nekorelují
s kalemií, jsou velmi nespecifické a rozhodně se jich
nedá využít pro její monitorování. Nejčasnější změnou
na EKG jsou obvykle vysoké a úzké hrotnaté vlny T spolu
se zkrácením intervalu QT jako projev zkrácení akčního
potenciálu buněk myokardu. Inaktivace sodíkových kanálů
způsobená snížením klidového potenciálu na membránách
má za následek pokles rychlosti vedení vzruchu a vede
k rozšíření vlny P. Vlna P může dokonce zcela vymizet
a může se objevit skutečný nebo jen zdánlivý (tzv.
sinoventrikulární) junkční rytmus. Může se prodloužit interval
PR, mohou se objevit vyšší stupně atrioventrikulární blokády,
může dojít k rozšíření komplexu QRS nebo k poruchám
vedení až úplné blokádě v obou Tawarových raménkách. Se
zvyšováním kalemie se mohou objevit maligní komorové arytmie
(komorová tachykardie a komorová fibrilace) nebo asystolie,
vedoucí k náhlé srdeční smrti.
ním selháním velmi zavádějící.
Tito nemocní mohou být zcela asymptomatičtí nebo mají příznaky,
které jsou pro srdeční selhání obvyklé, jako svalová slabost,
únava, nevýkonnost, převodní srdeční poruchy nebo nejrůznější
arytmie včetně náhlé smrti. Svalová slabost může simulovat až
syndrom Guillaina‒Barrého. Nicméně nejzávažnější jsou
projevy kardiální. Na hyperkalemii, byť asymptomatickou,
mohou upozornit změny na křivce EKG (obr. 1). Elektrokardiografické abnormality však nekorelují
s kalemií, jsou velmi nespecifické a rozhodně se jich
nedá využít pro její monitorování. Nejčasnější změnou
na EKG jsou obvykle vysoké a úzké hrotnaté vlny T spolu
se zkrácením intervalu QT jako projev zkrácení akčního
potenciálu buněk myokardu. Inaktivace sodíkových kanálů
způsobená snížením klidového potenciálu na membránách
má za následek pokles rychlosti vedení vzruchu a vede
k rozšíření vlny P. Vlna P může dokonce zcela vymizet
a může se objevit skutečný nebo jen zdánlivý (tzv.
sinoventrikulární) junkční rytmus. Může se prodloužit interval
PR, mohou se objevit vyšší stupně atrioventrikulární blokády,
může dojít k rozšíření komplexu QRS nebo k poruchám
vedení až úplné blokádě v obou Tawarových raménkách. Se
zvyšováním kalemie se mohou objevit maligní komorové arytmie
(komorová tachykardie a komorová fibrilace) nebo asystolie,
vedoucí k náhlé srdeční smrti.
Prevence vzniku hyperkalemie
Protože hyperkalemie je u pacientů se srdečním selháním častá a potenciálně nebezpečná, je prevence jejího vzniku mimořádně důležitá. Standardní léčba nemocných s HFrEF sestává z kombinace inhibitorů RAAS; podává se inhibitor ACE nebo při jeho intoleranci blokátor receptorů AT1 pro angiotenzin II, tzv. sartan, společně s MRA (spironolaktonem nebo eplerenonem) [1,2]. Při terapii nemocných se srdečním selháním inhibitory RAAS bychom měli respektovat několik jednoduchých zásad. 1) Správný výběr nemocných ‒ zvláštní pozornost si zasluhují nemocní s renálním selháním nebo s byť jen mírně zvýšenou kalemií. 2) Léčbu je nutno začínat malými dávkami inhibitorů RAAS, např. u MRA 25 mg spironolaktonu nebo eplerenonu denně, při GFR nižší než 50 ml/min obden. 3) Vyvarovat se kombinace inhibitoru ACE se sartanem (nebo ev. i s inhibitorem reninu aliskirenem). Takováto duální inhibice RAAS na různých etážích nepřináší další zlepšení prognózy nemocných se srdečním selháním, ale významně zvyšuje riziko výskytu nežádoucích účinků, především zhoršení renálních funkcí a hyperkalemie. 4) Do čtyř týdnů po zahájení léčby inhibitorem RAAS nebo při každé relevantní změně dávkování těchto léků zkontrolovat renální funkce a iontogram. Při stabilizovaném klinickém stavu je doporučeno monitorovat renální funkci a kalemii jedenkrát za 3‒4 měsíce.
Nemocní se srdečním selháním
obvykle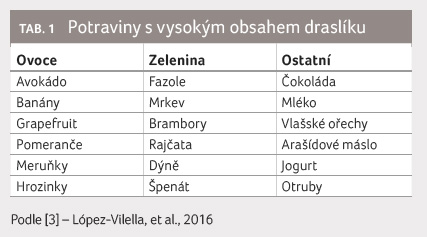 užívají diuretika a kvůli tomu u nich často
vzniká hypokalemie, která je také doprovázena vyšší
mortalitou. Proto jsou mnohým nemocným jako substituce ordinovány
draselné soli (např. KCl) nebo draslíkem obohacené potravinové
doplňky či na draslík bohaté potraviny (např. sušené
meruňky aj.). V okamžiku, kdy se zahajuje léčba inhibitory
RAAS, musí být podávání draselných solí, různých
potravinových doplňků a na draslík bohatých potravin
(tab. 1) přehodnoceno.
Zavedení MRA do terapie srdečního selhání výskyt
hypokalemie významně snížilo. Rovněž dávkování digoxinu musí
být při hypokalemii zkontrolováno a doporučuje se upravit
acidózu a ev. přidat malou dávku β1 selektivního
betablokátoru. Obecně má být kalemie zkontrolována vždy
po přidání jakéhokoliv léku, který ovlivňuje homeostázu
draslíku. U srdečního selhání to častěji mohou být např.
nesteroidní antirevmatika, vysoké dávky kličkových diuretik,
která mohou navodit hypovolemii, heparin, kotrimoxazol,
kalcineurinové inhibitory a další. Protože eplerenon se
metabolizuje na cytochromu P450 izoenzymu 3A4 (CYP3A4), může
současná léčba silnými inhibitory tohoto enzymatického systému
(např. ketokonazolem, flukonazolem, erytromycinem nebo verapamilem)
zvýšit kalemii, a tím pádem také riziko vzniku
hyperkalemie. Taková situace nevzniká při léčbě
spironolaktonem, který není metabolizován CYP3A4.
užívají diuretika a kvůli tomu u nich často
vzniká hypokalemie, která je také doprovázena vyšší
mortalitou. Proto jsou mnohým nemocným jako substituce ordinovány
draselné soli (např. KCl) nebo draslíkem obohacené potravinové
doplňky či na draslík bohaté potraviny (např. sušené
meruňky aj.). V okamžiku, kdy se zahajuje léčba inhibitory
RAAS, musí být podávání draselných solí, různých
potravinových doplňků a na draslík bohatých potravin
(tab. 1) přehodnoceno.
Zavedení MRA do terapie srdečního selhání výskyt
hypokalemie významně snížilo. Rovněž dávkování digoxinu musí
být při hypokalemii zkontrolováno a doporučuje se upravit
acidózu a ev. přidat malou dávku β1 selektivního
betablokátoru. Obecně má být kalemie zkontrolována vždy
po přidání jakéhokoliv léku, který ovlivňuje homeostázu
draslíku. U srdečního selhání to častěji mohou být např.
nesteroidní antirevmatika, vysoké dávky kličkových diuretik,
která mohou navodit hypovolemii, heparin, kotrimoxazol,
kalcineurinové inhibitory a další. Protože eplerenon se
metabolizuje na cytochromu P450 izoenzymu 3A4 (CYP3A4), může
současná léčba silnými inhibitory tohoto enzymatického systému
(např. ketokonazolem, flukonazolem, erytromycinem nebo verapamilem)
zvýšit kalemii, a tím pádem také riziko vzniku
hyperkalemie. Taková situace nevzniká při léčbě
spironolaktonem, který není metabolizován CYP3A4.
Jak můžeme hyperkalemii léčit?
Hyperkalemie musí být léčena jak
krátkodobě, tak i dlouhodobě. K tomuto účelu máme
k dispozici celou řadu terapeutických postupů (tab. 2). Zahájit léčbu hyperkalemie se doporučuje obvykle
při plazmatické koncentraci vyšší než 6,0–6,5 mmol/l
a vždy, když se na EKG objeví známky hyperkalemie
(zejména vysoké hrotnaté vlny T), kdy je vysoké riziko vzniku
maligních komorových arytmií. Při hyperkalemii s typickými
elektrokardiografickými změnami by měl být neodkladně podán
kalcium glukonát i.v. Tento lék okamžitě antagonizuje účinky
draslíku na 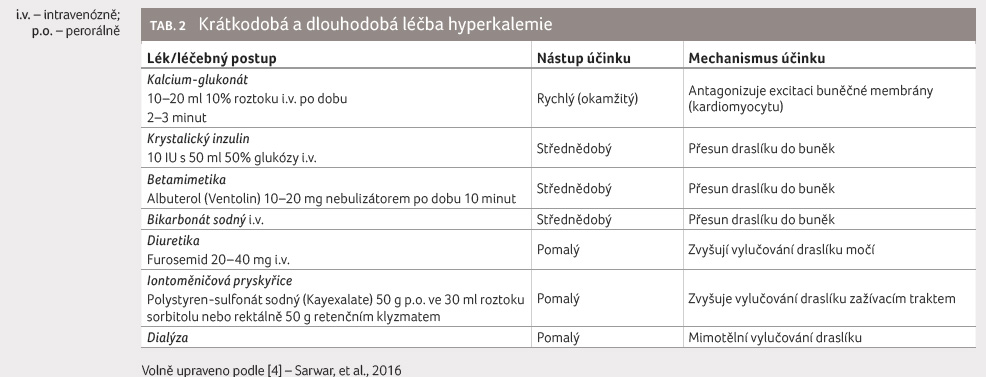 buněčnou membránu myocytů, aniž by ovlivňoval
plazmatickou koncentraci K+. Je důležité si
uvědomit, že biologický poločas kalcium glukonátu je
zhruba 60 minut, a proto trvá li hyperkalemie, musí být
dávka opakována. Současně by mělo být zahájeno podávání
inzulinu, přibližně 10 IU krystalického inzulinu spolu s 50 ml
50% glukózy k zabránění hypoglykemie. To je nejúčinnější
a přitom bezpečná léčba ke snížení kalemie [4].
Mechanismus účinku inzulinu je založen na stimulaci
Na+ K+ ATPázy, která přesunuje
K+ z extracelulárního do intracelulárního
prostoru. Podání 10 IU inzulinu dokáže snížit kalemii
o 0,5–1,5 mmol/l a tento účinek přetrvává
přibližně 4–6 hodin [12]. Za léky druhé volby jsou při
hyperkalemii považovány betamimetika a bikarbonát sodný.
Obojí mají podobné účinky i jejich nástup jako inzulin,
ale obojí také mají potenciální nežádoucí účinky ‒
betamimetika tachykardii a bikarbonát sodný solnou nálož.
Když tato emergentní léčebná opatření nestačí, měla by být
zahájena hemodialýza, zejména u nemocných s těžší
renální insuficiencí. Pro tento účel je hemodialýza účinnější
než peritoneální dialýza.
buněčnou membránu myocytů, aniž by ovlivňoval
plazmatickou koncentraci K+. Je důležité si
uvědomit, že biologický poločas kalcium glukonátu je
zhruba 60 minut, a proto trvá li hyperkalemie, musí být
dávka opakována. Současně by mělo být zahájeno podávání
inzulinu, přibližně 10 IU krystalického inzulinu spolu s 50 ml
50% glukózy k zabránění hypoglykemie. To je nejúčinnější
a přitom bezpečná léčba ke snížení kalemie [4].
Mechanismus účinku inzulinu je založen na stimulaci
Na+ K+ ATPázy, která přesunuje
K+ z extracelulárního do intracelulárního
prostoru. Podání 10 IU inzulinu dokáže snížit kalemii
o 0,5–1,5 mmol/l a tento účinek přetrvává
přibližně 4–6 hodin [12]. Za léky druhé volby jsou při
hyperkalemii považovány betamimetika a bikarbonát sodný.
Obojí mají podobné účinky i jejich nástup jako inzulin,
ale obojí také mají potenciální nežádoucí účinky ‒
betamimetika tachykardii a bikarbonát sodný solnou nálož.
Když tato emergentní léčebná opatření nestačí, měla by být
zahájena hemodialýza, zejména u nemocných s těžší
renální insuficiencí. Pro tento účel je hemodialýza účinnější
než peritoneální dialýza.
Současně s emergentními opatřeními, která vedou k přesunu K+ z plazmy do buněk, by měla začít dlouhodobá léčba vedoucí k vyloučení nadbytečného draslíku, a tou jsou diuretika. Pro dlouhodobou léčbu jsou diuretika léky první volby, protože výrazně zvyšují močovou exkreci draslíku a jsou přitom dobře tolerována. U nemocných se zachovanou vylučovací schopností ledvin dáváme přednost thiazidovým nebo thiazidům podobným diuretikům, zatímco u nemocných s GFR nižší než 30‒40 ml/min používáme diuretika kličková, u nás takřka výhradně furosemid. Při intenzivní diuretické terapii se však musíme vyvarovat vzniku hypovolemie, která by mohla vést k prerenálnímu ledvinovému selhání a ve svém důsledku pak ke zhoršení hyperkalemie.
A konečně, k dispozici máme také iontoměničovou pryskyřici. Jejím problémem ale je mechanismus účinku založený na gastrointestinálním vylučování draslíku výměnou za retenci sodíku s potenciální následnou intravaskulární retencí Na+ a se zhoršením srdečního selhání. Donedávna byl jedinou registrovanou iontoměničovou pryskyřicí polystyren sulfonát sodný (Kayexalate, Concordia Pharmaceuticals), který u nás není registrován. Tato látka je velmi špatně tolerována, často působí úpornou zácpu, a proto musí být alespoň první týdny užívána současně s projímadlem. Navíc může způsobit nekrózu tlustého střeva a další závažná intestinální poškození. Polystyren sulfonát sodný nikdy nebyl vyhodnocen ve větších randomizovaných klinických studiích. V jediné malé studii z jednoho centra byl tento lék podáván 33 ambulantním nemocným s chronickým onemocněním ledvin a s mírnou hyperkalemií (5,0‒5,9 mmol/l) v jedné denní dávce 30 g perorálně po dobu 7 dnů. Při aktivní léčbě dosáhlo 73 % nemocných normokalemie oproti 38 % nemocných při užívání placeba [13]. Pro závažné nežádoucí účinky včetně fatálních se však tento lék nikdy nedočkal většího klinického využití.
Nové léky v terapii hyperkalemie
Jak již bylo konstatováno výše, podávání inhibitorů RAAS, zejména MRA spironolaktonu a eplerenonu, je dost často doprovázeno hyperkalemií. Výzkum se proto v jednom směru zaměřil na hledání nových molekul, které blokují mineralokortikoidní receptory, ale méně interferují s plazmatickou koncentrací K+. Druhým směrem výzkumu je pak vývoj nových léků, jež jsou schopny nadbytečný draslík vázat a vylučovat z organismu.
První směr klinického výzkumu představuje finerenon. Jedná se o nesteroidní MRA, který má podobnou afinitu k mineralokortikoidním receptorům jako spironolakton a specificitu stejnou jako eplerenon. Jak se prokázalo v klinických studiích fáze II, je podávání finerenonu spojeno s nižším rizikem hyperkalemie, u nemocných s diabetickou nefropatií se navíc snižuje také mikroalbuminurie, aniž by se zhoršovaly renální funkce. Každá dávka finerenonu vedla po 30 dnech k menšímu vzestupu kalemie než spironolakton v dávce 50 mg/den (0,04 mmol/l vs. 0,45 mmol/l). Navíc finerenon vedl k menšímu poklesu GFR než spironolakton (0,38‒3,0 ml/min vs. 5,73 ml/min) [14]. Nedávno byly publikovány výsledky klinické studie ARTS HF, která porovnávala stoupající dávky finerenonu se standardní dávkou eplerenonu u pacientů, kteří jsou náchylní ke vzniku hyperkalemie (diabetici 2. typu, nediabetici s GFR 30‒60 ml/min). Nebyl sice pozorován rozdíl ve výskytu hlavního ukazatele účinnosti (pokles hodnoty NT proBNP [N terminální fragment natriuretického peptidu typu B] o 30 %) ani bezpečnosti (stejná incidence kalemie větší než 5,6 mmol/l), ale při vyšších dávkách finerenonu bylo pozorováno zlepšení většiny klinických ukazatelů [15]. Z tohoto důvodu byla zahájena mortalitně/morbiditní klinická studie u podobně rizikové populace nemocných se srdečním selháním s vyššími dávkami finerenonu (7,5 a 10 mg denně) pod kódovým označením BAY 94 8862.
V současnosti probíhá klinické zkoušení dvou nových léků, které jsou schopny vázat v tlustém střevě K+ a zvyšovat jeho vylučování. Oba tyto léky mají vyšší účinnost a jsou lépe tolerovány než polystyren sulfonát sodný.
První z nich je patiromer,
který schválil americký Úřad pro kontrolu potravin a léčiv
(FDA) v říjnu 2015 jako první nový lék k léčbě
hyperkalemie po 50 letech pod obchodním názvem Veltassa
(Relypsa, USA). V Evropské unii zatím tento lék ke klinickému
použití schválen není. Patiromer je nevstřebatelný polymer
(obr. 2), který se
podává ve formě orální suspenze jednou denně s jídlem.
Tento polymer váže ionty K+ v celém zažívacím
traktu, ale především v tlustém střevě, a vyměňuje
je za ionty Ca2+, Mg2+ a Na+.
Patiromer byl hodnocen ve třech klinických studiíc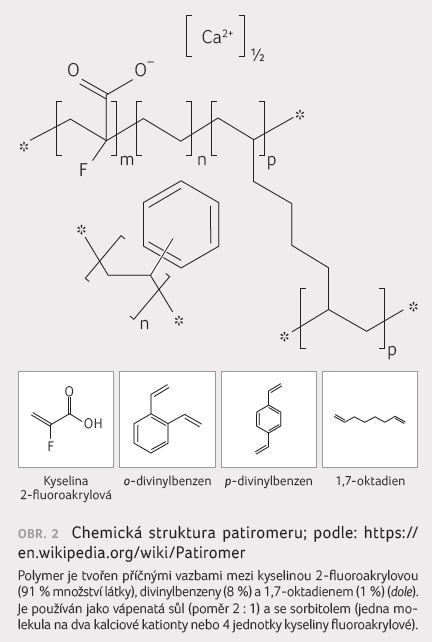 h.
Ve studii OPAL HK bylo sledováno 237 nemocných s kalemií
5,1–6,4 mmol/l, kteří byli léčeni inhibitory RAAS [16].
Hodnocení mělo dvě fáze ‒ v prvních 4 týdnech dostávali
nemocní patiromer dvakrát denně 4,2 g nebo 8,4 g,
v následujících 8 týdnech pak bylo podání léku
randomizovaně ukončeno nebo se pokračovalo v původní léčbě.
Po prvních 4 týdnech dosáhlo 76 % nemocných normokalemie;
v průběhu druhé, randomizované fáze se objevila
hyperkalemie u 15 % nemocných s aktivní terapií
patiromerem versus u 60 % nemocných při užívání placeba.
h.
Ve studii OPAL HK bylo sledováno 237 nemocných s kalemií
5,1–6,4 mmol/l, kteří byli léčeni inhibitory RAAS [16].
Hodnocení mělo dvě fáze ‒ v prvních 4 týdnech dostávali
nemocní patiromer dvakrát denně 4,2 g nebo 8,4 g,
v následujících 8 týdnech pak bylo podání léku
randomizovaně ukončeno nebo se pokračovalo v původní léčbě.
Po prvních 4 týdnech dosáhlo 76 % nemocných normokalemie;
v průběhu druhé, randomizované fáze se objevila
hyperkalemie u 15 % nemocných s aktivní terapií
patiromerem versus u 60 % nemocných při užívání placeba.
AMETHYST DN byla multicentrická randomizovaná, otevřená, dávku vyhledávající studie s 306 nemocnými s diabetes mellitus, s chronickým onemocněním ledvin (GFR 15‒60 ml/min) a s kalemií > 5 mmol/l. Všichni pacienti byli léčeni inhibitory RAAS. Jak při mírné, tak i při středně těžké hyperkalemii došlo po 4 týdnech léčby k významnému poklesu kalemie, který přetrvával po dobu 52 týdnů [17]. V obou těchto studiích, tedy OPAL HK i AMETHYST DN, mohli nemocní pokračovat v terapii inhibitory RAAS.
Třetí studie – PEARL HF – sledovala účinnost patiromeru u nemocných se srdečním selháním [18]. U celkem 155 pacientů s GFR nižší než 60 ml/min nebo s anamnézou ukončení podávání inhibitoru RAAS z důvodu hyperkalemie byla zahájena léčba 25 mg spironolaktonu denně a poté byli nemocní randomizováni ke dvojitě zaslepenému užívání buď 30 g patiromeru/den, nebo placeba po dobu 4 týdnů. Patiromer ve srovnání s placebem významně snížil kalemii, v průměru o 0,45 mmol/l, s nižší incidencí hyperkalemie (7,3 % vs. 24,5 %; p = 0,015) a s vyšším podílem nemocných, jimž bylo možno zvýšit denní dávku spironolaktonu na 50 mg/den (91 % vs. 74 %; p = 0,019) [18].
Nejčastějšími nežádoucími účinky byly hypomagnezemie (7,2 %), zácpa (6,3 %) a hypokalemie (5,6 %). Velmi pečlivě byly sledovány různé lékové interakce. Výsledky neukázaly, že by patiromer vedl ke klinicky významnému snížení absorpce celé řady léků. Přesto výrobce doporučuje, aby ostatní léky byly užity minimálně 6 hodin před podáním patiromeru nebo 6 hodin po něm.
Druhým novým lékem vázajícím
draslík je zirkonium cyklosilikát sodný (ZS 9).
Je to anorganická látka, která je v současnosti studována
v klinických studiích fáze II a III. Funguje jako
fyziologický iontový filtr, který selektivně filtruje ionty
na základě průměru iontových kanálů. Látka ZS 9 má
strukturu, která napodobuje fyziologický draslíkový kanál
a selektivně zachytává draslíkové kationty (obr. 3) [19]. Aby prošel kanálem, musí se K+ zbavit
svého hydratačního obalu. ZS 9 je dostupný jako nerozpustný
krystalický prášek bez chuti a bez zápachu, který se
nevstřebává ze zažívacího traktu. Specificky váže
monovalentní ionty K+, nikoliv bivalentní kationty, jako
jsou Ca2+ nebo Mg2+. Protože se
nevstřebává, je riziko systémové toxicity minimální.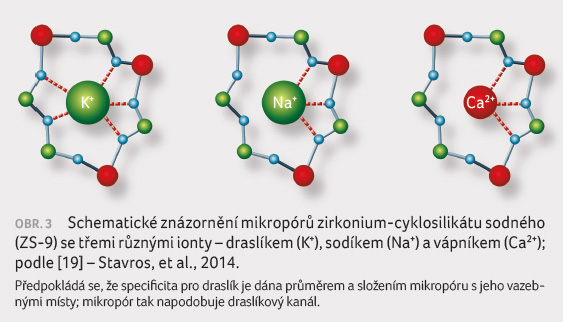
Zirkonium cyklosilikát sodný byl testován v několika klinických studiích. Studie HARMONIZE zahrnula 258 ambulantních nemocných s hyperkalemií vyšší než 5,1 mmol/l [20]. Po podání 10 g přípravku ZS 9 třikrát denně došlo po 48 hodinách ke snížení kalemie v průměru z 5,6 na 4,5 mmol/l. Průměrný čas k dosažení normokalemie byl 2,2 hodiny. Za 24 hodin dosáhlo normokalemie 84 % a za 48 hodin 98 % pacientů. V udržovací fázi studie byli nemocní randomizováni k podávání tří dávek ZS 9 (5, 10 a 15 g 1× denně) nebo k podávání placeba po dobu 28 dnů. Při aktivní léčbě se udržovala trvale normokalemie. Čím vyšší byla výchozí hodnota kalemie, tím vyšší byl její absolutní pokles. Podskupinová analýza nemocných se srdečním selháním (n = 94) ve studii HARMONIZE ukázala stejné výsledky [21]. Všechny tři dávky ZS 9 byly účinné v dosažení a udržení normokalemie, včetně nemocných užívajících inhibitory RAAS. Snášenlivost přípravku ZS 9 je velmi dobrá. Výskyt nežádoucích účinků byl podobný jako při užívání placeba. Nejčastějším nežádoucím účinkem byl průjem (v 1,77 % při léčbě ZS 9 vs. 2,2 % při podávání placeba!).
Závěrem
U nemocných se srdečním selháním je hyperkalemie častým a závažným problémem. Riziko hyperkalemie stoupá na jedné straně se zvyšujícím se věkem pacientů a s četnými komorbiditami, zejména častým renálním selháním, a na straně druhé vlivem léků inhibujících patologicky aktivované neurohumorální systémy, zejména RAAS. Inhibitory RAAS prokazatelně zlepšily prognózu nemocných se srdečním selháním, ale bohužel s sebou také přinášejí zvýšený výskyt nežádoucích účinků, především zhoršení renálních funkcí a hyperkalemie. Hned po několika liniích pokračuje klinický výzkum nových léků, které buď snižují riziko vzniku hyperkalemie (finerenon), nebo účinně redukují plazmatickou koncentraci draslíku tím, že výrazně zvyšují jeho vylučování z organismu (patiromer a zirkonium cyklosilikát sodný). U všech těchto nových léků je však zapotřebí provést další klinické studie.
Seznam použité literatury
- [1] Ponikowski P, Voors AA, Anker SD, et al., for the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37: 2129–2200.
- [2] Špinar J, Hradec J, Špinarová L, Vítovec J. Summary of the 2016 ESC Guidelines on the diagnosis and treatment of acute and chronic heart failure. Prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58: e530‒e568.
- [3] López‑Vilella R, Morillas‑Climent H, Plaza‑López D, et al. Hyperkalemia in heart failure patients: current chalenges and future prospects. Res Reports in Clin Cardiol 2016; 7: 1‒8.
- [4] Sarwar CMS, Papadimitriou L, Pitt B, et al. Hyperkalemia in heart failure. J Am Coll Cardiol 2016; 68: 1575‒1589.
- [5] Acker CG, Johnson JP, Palevsky PM, et al. Hyperkalemia in hospitalized patients: causes, adequacy of treatment, and results of an attempt to improve physician compliance with published therapy guidelines. Arch Intern Med 1998; 158: 917‒924.
- [6] Kovesdy CP. Management of hyperkalemia in chronic kidney disease. Nat Rev Nephrol 2014; 10: 653‒662.
- [7] Palmer BF. Managing hyperkalemia caused by inhibitors of the renin‑angiotensin‑aldosterone system. N Engl J Med 2004; 351: 585‒592.
- [8] Ponikowski P, Anker SD, Al Habib KF, et al. Heart failure: prevention, disease and death worldwide. ESC Heart Fail 2014; 1: 4‒25.
- [9] Vardeny O, Clattget B, Anand I, et al. Randomized Aldactone Evaluation Study (RALES) investigators. Incidence, predictors, and outcomes related to hypo‑ and hyperkalemia in patients with severe heart failure treated with a mineralocorticoid receptor antagonist. Circ Heart Fail 2014; 7: 573‒579.
- [10] Juurlink DN, Mamdani MM, Lee DS, et al. Rates of hyperkalemie after publication of the Randomized Aldactone Evaluation Study. N Engl J Med 2004; 351: 543‒551.
- [11] Luo J, Brunelli SM, Jensen DE, et al. Association between serum potassium and outcomes in patients with reduced kidney function. Clin J Am Soc Nephrol 2016; 11: 90‒100.
- [12] Allon M, Comkney C. Albuterol and insulin for treatment of hyperkalemia in hemodialysis patients. Kidney Int 1990; 38: 869‒872.
- [13] Lepage L, Dufour AC, Doiron J, et al. Randomized clinical trial of sodium polystyrene sulfonate for the treatment of mild hyperkalemia in CKD. Clin J Am Soc Nephrol 2015; 10: 2136‒2142.
- [14] Pitt B, Kober L, Ponikowski P, et al. Safety and tolerability of novel non‑steroidal mineralocorticoid antagonist Bay 94‑8862 in patients with chronic heart failure and mild or moderate chronic kidney disease: a randomized, double‑blind trial. Eur Heart J 2013; 34: 2453‒2463.
- [15] Pitt B, Anker SD, Böhm M, et al. Rationale and design of MinerAlocorticoid Receptor antagonist Tolerability Study‑Heart Failure (ARTS‑HF): a randomized study of finerenone vs eplerenone in patients who have worsening chronic heart failure with diabetes and/or chronic kidney disease. Eur J Heart Fail 2015; 17: 224‒232.
- [16] Weir MR, Bakris GL, Bushinsky DA, et al. Opal‑HK investigators. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med 2015; 372: 211‒221.
- [17] Bakris DL, Pitt B, Weir MR, et al. AMETHYST‑DN Investigators. Effect of patiromer on serum potassium level in patients with hyperkalemia and diabetic kidney disease: the AMETHYST‑DN randomized clinical trial. JAMA 2015; 314: 151‒161.
- [18] Pitt B, Anker SD, Bushinsky DA, et al. Evaluation of the efficacy and safety of RLZ5016, a polymeric potassium binder, in a double‑blind, placebo‑controlled study in patients with chronic heart failure (the PEARL‑HF) trial. Eur Heart J 2001; 32: 820‒828.
- [19] Stavros F, Yang A, Leon A, et al. Characterization of structure and function of ZS‑9, a K+ selective ion trap. Plos One 2014; 9: E114686.
- [20] Packham DK, Rasmussen HS, Lavin PT, et al. Sodium zirconium cyclosilicate in hyperkalemia. N Engl J Med 2015; 372: 222‒231.
- [21] Anker SD, Kosiborod M, Zannad F, et al. Maintenance of serum potassium with sodium zirconium cyclosilicate (ZS‑9) in heart failure patients: results from a phase 2 randomized, double‑blind, placebo‑controlled trial. Eur J Heart Fail 2015; 17: 1050‒1056.