Individuální přístup v léčbě dyslipidemií
Souhrn:
Porucha lipidového metabolismu neboli dyslipidemie je nejčastější metabolickou poruchou. Podle formulace Evropské asociace pro aterosklerózu (EAS, European Atherosclerosis Society) z roku 1992 se dyslipidemie dělí do tří skupin podle koncentrace základních lipoproteinů v plazmě na hypercholesterolemii, hypertriglyceridemii a kombinovanou (smíšenou) dyslipidemii. Léčba dyslipidemií by měla být specifikovaná pro každého jedince podle přítomných charakteristik – individualizovaná, tzv. ušitá na míru. V současné době vycházíme při výběru hypolipidemik z typu dyslipidemie a z účinnosti dostupných hypolipidemik. Hlavním smyslem farmakologické léčby dyslipidemií je snížení celkového kardiovaskulárního rizika. Bezprostředním primárním cílem je snížení koncentrací LDL cholesterolu na cílovou hodnotu podle celkového kardiovaskulárního rizika. Sekundárním cílem by mělo být ovlivnění zvýšené koncentrace triglyceridů nebo aterogenní dyslipidemie, pokud je u pacienta vyjádřena. Nová biologická léčba, která je ve fázi klinického hodnocení, jistě přispěje k větší individualizaci léčby, k lepší kontrole poruch metabolismu lipidů, a tím i k významnější redukci kardiovaskulární morbidity a mortality.
Key words: dyslipidemia, combined lipid modifying therapy, individualized therapy, atherogenic dyslipidemia, cardiovascular disease prevention.
Summary:
Lipid metabolism disorders (dyslipidemias) are considered the most frequent metabolic diseases. Dyslipidemias are divided into three groups: hypercholeste-rolemia, hypertriglyceridemia. and combined (mixed) dyslipidemia by European Atherosclerosis Society (1992). Dyslipidemia treatment should be specified for everybody according his (her) characteristics, i.e. individualized or tailored treatment. Today we make a choice of lipid modifying drugs according to their effects and the type of lipid disorder. The main aim of lipid disorder treatment is to reduce the total cardiovascular risk. Lowering of LDL cholesterol to the recommended level based on the total cardiovascular risk represents the immediate primary aim of dyslipidemia therapy. The secondary aim should be the treatment of high triglycerides or atherogenic dyslipidemia if they are expressed. New biological therapy of dyslipidemia, which is now in tested in a clinical experiment, should contribute to the more individualized therapy, better lipid metabolism control. and to better reduction of cardiovascular morbidity and mortality.
Porucha lipidového metabolismu neboli dyslipidemie (dyslipoproteinemie, dříve hyperlipoproteinemie) je nejčastější metabolickou poruchou. Její klinický význam je určen intenzitou poruchy a celkovým kardiovaskulárním (KV) rizikem. Původní složité dělení hyper-lipoproteinemií podle Fredricksona, které bylo založeno na elektroforéze lipoproteinů, ustoupilo jednoduchému rozdělení dyslipidemií podle Evropské asociace pro aterosklerózu (EAS, European Atherosclerosis Society) z roku 1992 do tří skupin podle koncentrace základních lipoproteinů v plazmě:
- hypercholesterolemie – zvýšení plazmatické koncentrace LDL (low density lipoprotein) cholesterolu,
- hypertriglyceridemie – zvýšení plazmatické koncentrace VLDL (very low density lipoprotein),
- kombinovaná (smíšená) dyslipidemie.
Kombinovaná dyslipidemie se může týkat zvýšené koncentrace triglyceridů a LDL cholesterolu nebo zvýšené koncentrace triglyceridů a snížené koncentrace protektivního HDL (high density lipoprotein) cholesterolu, tzv. aterogenní dyslipidemie.
Aterogenní dyslipidemie spolu s abdominální distribucí tukové tkáně a poruchami glukózového metabolismu patří k tzv. kardiome-tabolickým rizikovým faktorům, které jsou společné pro aterosklerotické cévní nemoci i pro diabetes mellitus 2. typu (DM2). V posledních třech dekádách se dostávají tyto rizikové faktory (emerging risk factors) do popředí zájmu preventivních kardiologů. Zvýšení koncentrace triglyceridů a snížení hodnot protektivního HDL cholesterolu je spojeno s výskytem malých denzních LDL částic, které jsou velmi aterogenní; mají nižší afinitu k receptorům pro LDL cholesterol, a proto déle přetrvávají v krevním oběhu a snadno podléhají modifikaci (glykaci nebo oxidaci). Malé denzní LDL částice se vyskytují v krvi při koncentraci triglyceridů 1,5 mmol/l a více, přičemž koncentrace LDL cholesterolu se může pohybovat v normálních mezích.
Na výskytu kardiometabolických rizikových faktorů se podílí na jedné straně životní styl, v němž dominuje sedavý způsob života a vysokoenergetická strava, která u osob s genetickou náchylností k inzulinové rezistenci vede k rozvoji kardiometabolického syndro-mu, eventuálně i k rozvoji DM2. Na rozvoji inzulinorezistence se však mohou podílet i jiné faktory, např. stále více znečišťované zevní prostředí (výroba plastických hmot a kontaminace bisfenolem A, průmyslové exhalace, kontaminace zemědělské půdy a pitné vody řadou toxických látek) anebo chronický stres, jemuž jsou nejvyspělejší lidské společnosti vystavovány stále více.
Terapie dyslipidemií
Základem terapie jakékoli dyslipidemie (kromě extrémně vysokých hodnot celkového cholesterolu > 8 mmol/l, LDL cholesterolu > 6 mmol/l a triglyceridů > 7 mmol/l, při nichž je třeba zahájit farmakoterapii okamžitě) je nefarmakologická léčba, tj. snaha motivovat nemocného ke zdravému životnímu stylu. Důkladně a opakovaně je třeba vysvětlovat, zdůvodňovat a doporučovat racionální dietu, nekouření a dostatek pravidelného pohybu podle individuálního stavu pacienta a jeho možností. Zvláště u nemocných s nadváhou nebo obezitou abdominálního typu, která je spojena s aterogenní dyslipidemií a progreduje při vysokoenergetické stravě bohaté na jednoduché cukry a živočišné tuky, je nezbytně důležitá modifikace stravy a zavedení pravidelného pohybového režimu. Redukce hmotnosti u těchto nemocných o 5–10 % původní hodnoty je velmi přínosná, neboť viscerální tuková tkáň se odbourává dříve a rychleji než subkutánní tuk a díky tomu se upravuje i řada dalších rizikových faktorů včetně zlepšení lipidového metabolismu.
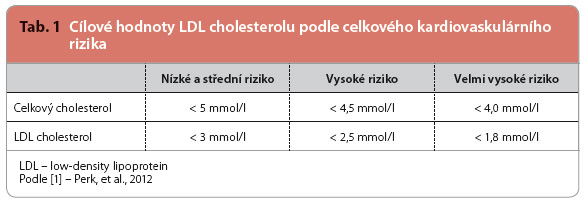 Hlavním smyslem farmakologické léčby dyslipidemií je snížení celkového KV rizika a následně snížení nemocnosti a úmrtnosti na KV onemocnění na podkladě aterosklerózy [1]. Primárním cílem léčby dyslipidemií je snížení koncentrace LDL cholesterolu na cílovou hodnotu podle celkového KV rizika (tab. 1).
Hlavním smyslem farmakologické léčby dyslipidemií je snížení celkového KV rizika a následně snížení nemocnosti a úmrtnosti na KV onemocnění na podkladě aterosklerózy [1]. Primárním cílem léčby dyslipidemií je snížení koncentrace LDL cholesterolu na cílovou hodnotu podle celkového KV rizika (tab. 1).
Statiny
Statiny jsou léky první volby v léčbě hypercholesterolemie; tyto léky, jak je známo, inhibují HMG CoA (3 hydroxy 3 methylglutaryl koenzym A) reduktázu a tak blokují začátek kaskády reakcí vedoucích ke vzniku cholesterolu v buňkách. Řada studií hodnotících jejich použití v primární i sekundární prevenci prokázala, že statiny snižují nejen koncentraci základního rizi-kového faktoru aterosklerózy, tj. LDL cholesterolu, ale i výskyt KV onemocnění na podkladě aterosklerózy a snižují KV i celkovou mortalitu.
Další studie z posledních let prokázaly, že statiny dokáží zpomalit progresi aterosklerózy, a dokonce i navodit její regresi. Tyto stu-die využívaly zobrazovací techniky, nejčastěji angiografii, sonografii, a dokonce intravaskulární ultrazvuk (IVUS); např. léčba rosuva-statinem ve studii ASTEROID vedla k významné regresi ateromu v koronárních tepnách zjištěné pomocí IVUS [2]. Tyto studie nahrá-valy teorii „čím níže, tím lépe“, tj. čím nižších hodnot LDL cholesterolu se dosáhne, tím větší regrese aterosklerózy a větší redukce KV rizika je docíleno.
Kromě lipidového účinku mají statiny řadu pleiotropních účinků, o kterých se zpočátku velmi pochybovalo. Z klinických studií ne-lze rozpoznat, zda zlepšení endotelové dysfunkce, stabilizace aterosklerotického plátu, zvýšení fibrinolýzy a jiné změny nastaly ovliv-něním dyslipidemie, snížením koncentrace LDL cholesterolu, anebo zda se uplatňují i jiné, nelipidové účinky léčby. Řada experimen-tálních studií však tyto pleiotropní účinky statinů dokazuje. Lze tedy předpokládat, že pleiotropní účinky statinů přispívají ke snížení KV rizika, k omezení výskytu KV onemocnění i KV mortality.
Pokud se nepodaří dosáhnout cílových hodnot LDL cholesterolu monoterapií statinem podávaným v nejvyšší tolerované dávce, je vhodné kombinovat statin s dalšími hypolipidemiky, v současné době nejlépe s ezetimibem.
Ezetimib
Ezetimib působí v kartáčovém lemu sliznice tenkého střeva a blokuje absorpci cholesterolu ze střeva přes receptor NPC1L1 (Nieman-nův Pickův C1 like 1). Zdrojem cholesterolu ve střevě je potrava a žluč. Kombinace statinu a ezetimibu, kterou máme k dispozici i ve fixní kombinaci, se vzájemně velmi dobře doplňuje. Při léčbě statiny dochází kompenzačně ke zvýšení absorpce cholesterolu ze střeva, kterou ezetimib snižuje. Stejně tak léčba ezetimibem může vést kompenzatorně ke zvýšení syntézy cholesterolu v játrech, což tlumí statiny. Duální inhibice cholesterolu touto kombinovanou terapií je proto velmi účinná.
Sledováním účinnosti kombinované terapie statin a ezetimib ve srovnání s monoterapií atorvastatinem se zabývala např. studie VYMET, která prokázala, že podávání kombinace je daleko účinnější než monoterapie [3]. Kombinace statinu a ezetimibu byla velmi účinná v prevenci KV chorob u nemocných s chronickým renálním onemocněním, jak ukázala studie SHARP [4]. Nedávno prezento-vaná studie IMPROVE IT konečně prokázala, že kombinace statinu s ezetimibem u nemocných s velmi vysokým KV rizikem (po akutním koronárním syndromu) významně snižuje KV riziko [5]. Pozoruhodné bylo, že kardioprotektivní účinek byl vyšší u diabetiků a trend byl patrný i u starších nemocných (65 let a více). Lze si to vysvětlit na jedné straně tím, že diabetes i věk představují závažné rizikové faktory spojené s velmi vysokým KV rizikem, a proto byla účinnost léčby větší u těchto nemocných. Na druhé straně lze uvažovat o dalších účincích této kombinace na non LDL dyslipidemii, konkrétně na aterogenní dyslipidemii, která se častěji vysky-tuje u diabetiků i starších pacientů (také v prediabetu, např. u nemocných s kardiometabolickým syndromem). Experimentální i menší klinické studie poukazují také na další účinky ezetimibu, jako je např. příznivé ovlivnění inzulinové rezistence a nealkoholové steatózy jater, stimulace inkretinového systému, a tím zlepšení glykemie, a jiné.
Individualizace léčby
Léčba dyslipidemií (ale i jiných chorob) by měla být specifikovaná pro každého jedince podle přítomných charakteristik, měla by to tedy být léčba individualizovaná, tzv. léčba ušitá na míru. Tento přístup v léčbě je do jisté míry reakcí na někdy trochu přílišné zobec-ňování výsledků velkých klinických studií, tj. evidence based medicine. Do těchto studií se zařazují přesně definovaní nemocní, aby výsledky léčby byly jasně interpretovatelné, aby měly význam prokázaných faktů, které budeme aplikovat na podobné nemocné. Je to jistě dosud zatím nejexaktnější způsob, jak potvrdit, že určitá terapie je účinná u určitých nemocných. Ale co ostatní nemocní, kteří nevyhovují přesně kritériím studií? A co ti, kteří vyhovují kritériím studií, ale přesto daná terapie jejich chorobu neovlivnila? Je prů-měrný statisticky významný výsledek dostatečný pro všechny pacienty? Výsledek hodnotící např. účinnost určité léčby vyjadřuje pouze míru pravděpodobnosti pro určitou skupinu nemocných.
Každý lékař ve své praxi aplikuje výsledky evidence based medicine u části svých pacientů, ale řada dalších pacientů je více či méně odlišná, tj. více či méně vyžaduje modifikaci prokázané léčby – individualizovaný přístup. Tento přístup je všem lékařům velmi vlastní a je založen na klinických zkušenostech nebo na výsledcích menších klinických studií. Abychom mohli zpřesnit léčbu jednotli-vých nemocných, budeme potřebovat řadu dalších genetických a klinických markerů, které nám upřesní charakteristiku daného pacien-ta a vymezí, jakou léčbu nebo jakou dávku léku máme pro daného pacienta zvolit. Využití obou přístupů, tj. výsledků velkých studií (evidence based medicine) i přesnější charakteristiky daného pacienta (personalizovaný přístup), bude užitečné pro správnou léčbu našich nemocných.
V současné době vycházíme při výběru hypolipidemik z typu dyslipidemie a z účinnosti dostupných hypolipidemik. Hypertriglyce-ridemie je příkladem takové dyslipidemie, kterou nelze ovlivnit statinem. Zde je indikován fibrát
Fibráty
Fibrát (u nás dostupný fenofibrát) svým působením na receptory PPAR α (peroxisome proliferator activated receptors alpha) v jádrech buněk dokáže měnit expresi různých enzymů a ovlivnit lipidový metabolismus. V důsledku toho dochází k redukci koncentrace trigly-ceridů v průměru o 30 % (a ke zvýšení koncentrace HDL cholesterolu v průměru o 15 %). Hypertriglyceridemie ≥ 7 mmol/l je v asociaci s rizikem akutní pankreatitidy a kromě zákazu konzumace alkoholu, úpravy terapie případného diabetu a vyřazení tučných komponent stravy je nutné zahájit léčbu fibráty ve vyšších dávkách. Mírná hypertriglyceridemie samostatně nebo jako součást atero-genní dyslipidemie je v přímé asociaci s rizikem pro aterosklerózu. Triglyceridy jsou obsaženy ve VLDL, v IDL (intermediate density lipoprotein), což jsou remnanty VLDL, i v chylomikronových remnantech.
Dlouho se pochybovalo o aterogenním účinku triglyceridů, ale později se prokázalo, že všechny částice bohaté na triglyceridy ob-sahují velké množství esterů cholesterolu, které mají úzký vztah k aterogenezi [6]. Mezi pleiotropní účinky fibrátů patří jejich protizá-nětlivé působení. Nežádoucí účinky fibrátů jsou velmi vzácné (gastrointestinální potíže, kožní léze, cholecystolitiáza, myopatie). Fibrá-ty zvyšují sérovou koncentraci kreatininu a homocysteinu, ale nebylo potvrzeno, že by zhoršovaly renální funkce nebo zvyšovaly KV riziko.
Aterogenní dyslipidemie
Ovlivnění koncentrace triglyceridů nebo aterogenní dyslipidemie by mělo být sekundárním cílem léčby dyslipidemií u nemocných, kde je již dosaženo primárního cíle, tj. požadovaných hodnot LDL cholesterolu (tab. 1). Cílové hodnoty non HDL cholesterolu (= celkového cholesterolu – HDL cholesterolu) nebo koncentrace apolipoproteinu B (apo B), jak je uvádějí současná doporučení, jsou uvedeny v tab. 2. Orientačně v klinické praxi často používáme ke zhodnocení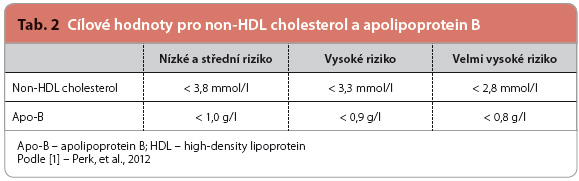 léčby aterogenní dyslipidemie dosažení optimálních hodnot triglyceridů (< 1,7 mmol/l) a HDL cholesterolu (> 1,0 mmol/l u mužů a > 1,2 mmol/l u žen).
léčby aterogenní dyslipidemie dosažení optimálních hodnot triglyceridů (< 1,7 mmol/l) a HDL cholesterolu (> 1,0 mmol/l u mužů a > 1,2 mmol/l u žen).
Aterogenní dyslipidemii je přisuzována velká část reziduálního rizika podle celosvětové iniciativy R3i (Residual Risk Reduction Initiative) [7]. Iniciativa vznikla před několika lety a je do ní zapojena řada zemí (včetně České republiky) a různí odborníci zaintere-sovaní do prevence KV nemocí, DM2 i prevence diabetických makro i mikrovaskulárních komplikací. Reziduální riziko přetrvává u každého nemocného, který je již standardně léčen podle stávajících Doporučení pro primární a sekundární prevenci KV nemocí, tj. je již léčen např. statiny nebo antihypertenzivy. U tohoto nemocného přesto přetrvává určitá pravděpodobnost vzniku KV příhody; toto reziduální riziko je dáno individuálně podle přítomnosti dalších „nestandardních” novějších rizikových faktorů (v anglickém názvoslo-ví „emerging risk factors“), mezi něž patří i aterogenní dyslipidemie. Celosvětová iniciativa R3i upozorňuje právě na tuto dyslipidemii a doporučuje její léčbu ke snížení reziduálního rizika našich nemocných.
Aterogenní dyslipidemie je ovlivnitelná více léčbou fibráty, eventuálně kombinací statinu a fibrátu. Dosud nemáme k dispozici nej-vyšší úroveň důkazů pro léčbu aterogenní dyslipidemie u všech pacientů. Výsledek studie ACCORD ukázal, že pouze pacienti s DM2 a s aterogenní dyslipidemií (triglyceridy ≥ 2,3 mmol/l a HDL cholesterol < 0,9 mmol/l) měli přínos z kombinované léčby simvastati-nem a fenofibrátem; došlo u nich k významnému relativnímu snížení výskytu primárního cílového ukazatele, tj. KV morbidity a mortality o 30 % [8]. Pacienti s DM2 a s vyjádřenou aterogenní dyslipidemií měli ve studii ACCORD významně vyšší relativní KV riziko (o 70 %) ve srovnání s diabetiky bez aterogenní dyslipidemie. Poslední analýza ze studie ACCORD prokázala, že fenofibrát snižuje především postprandiální koncentraci triglyceridů a omezuje tvorbu apolipoproteinu B 48, čímž dochází k redukci počtu rem-nantních částic bohatých na cholesterol střevního původu [9]. Léčba fibráty je účinná i při snižování výskytu mikrovaskulárních kom-plikací, jakými jsou především oční změny u diabetiků (diabetická retinopatie), jak prokázala podstudie ACCORD Eye [10]. Je zají-mavé, že protektivní vliv fenofibrátu na redukci mikrovaskulárních komplikací u DM2 je zcela nezávislý na přítomnosti aterogenní dyslidemie.
Metaanalýza fibrátových studií z roku 2010 potvrdila, že fibráty snižují KV riziko v průměru o 35 % u pacientů s manifestní atero-genní dyslipidemiií definovanou podle studie ACCORD (viz výše). Předpokládá se, že léčba aterogenní dyslipidemie by mohla být prospěšná nejen u diabetiků, ale i u osob v prediabetu, které mají vysoké KV riziko i riziko vzniku DM2 [11].
U pacientů s kombinovanou (smíšenou) dyslipidemií (zvýšené koncentrace triglyceridů a LDL cholesterolu) bychom měli upřed-nostnit kombinaci statinů s fenofibrátem. Tato kombinace byla opakovaně zkoumána a zhodnocena jako dobře tolerovaná kombinova-ná hypolipidemická léčba, která upravuje lipidový profil tak, že snižuje aterogenitu plazmy; například ve studii SAFARI (Effectiveness and tolerability of simvastatin plus fenofibrate for combined hyperlipidemia), v níž bylo randomizováno více než 600 pacientů se smí-šenou dyslipidemií k monoterapii simvastatinem nebo ke kombinované léčbě simvastatinem a fenofibrátem. Při podávání kombinované léčby došlo k výraznějšímu snížení sérové koncentrace triglyceridů (o 24 %) a LDL cholesterolu (o 6 %) a k jejímu většímu zvýšení u HDL cholesterolu (o 9 %) ve srovnání s monoterapií simvastatinem [12]. Ve skupině léčené kombinací statinu a fibrátu byla také prokázána významná redukce počtu malých denzních LDL částic, které jsou více aterogenní než velké, méně denzní částice LDL cho-lesterolu.
Také v naší nedávné studii léčby smíšené dyslipidemie jsme prokázali nejen změnu koncentrací a počtu lipidových částic podobně jako ve studii SAFARI, ale i změnu aterogenního indexu plazmy (AIP) [13]. Tento index AIP = log (triglyceridy/HDL cholesterol), který vytvořila RNDr. Milada Dobiášová, DrSc., z Fyziologického ústavu AV ČR, nejenže vyjadřuje poměr lipidových frakcí, které tvoří aterogenní dyslipidemii, ale souvisí i s esterifikační rychlostí cholesterolu v HDL cholesterolu a tím i s velikostí částic lipoprotei-nů. Regulace velikosti lipoproteinových subpopulací je spojena především s triglyceridy, kdy působením lipoproteinové a hepatické lipázy jsou remodelovány HDL částice a poměr malých a velkých HDL makromolekul zpomaluje nebo zrychluje esterifikační rychlost v HDL cholesterolu, která je tak biochemickým a funkčním indikátorem jejich velikosti [14]. Na webových stránkách České společnos-ti pro aterosklerózu (www.athero.cz) nebo Českého institutu metabolického syndromu (www.cimp ops.cz) lze najít kalkulátor k výpočtu AIP i nomogram k odečtení aterogenního rizika. V současné době máme na českém farmaceutickém trhu k dispozici fixní kombinaci statinu a fenofibrátu.
Vývoj léčby dyslipidemií
Novým trendem v léčbě dyslipidemií je biologická léčba, která se ubírá třemi směry:
- antisense mRNA – terapie zaměřená proti apo B (např. mipomersen), proti PCSK9 (proprotein konvertáza subtilisin/kexin typu 9), který se váže na LDL receptory a tak brání navázání LDL cholesterolu, proti CETP (cholesterylester transfer protein) a jiným části-cím lipidového metabolismu;
- monoklonální protilátky anti PCSK9;
- vakcinace (vakcína anti PCSK9 indukuje protilátkovou odpověď zabraňující interakci PCSK9 s LDL receptory).
U všech těchto látek je nutno posoudit jejich účinnost i bezpečnost, k čemuž slouží právě probíhající i plánované klinické studie. První klinické hodnocení léčby evolocumabem ukázalo, že tato monoklonální protilátka proti PCSK9 je ve snižování hodnoty LDL choleste-rolu velmi účinná (redukuje koncentrace LDL cholesterolu o více než 50 %), dobře tolerovaná (látka se aplikuje 1–2krát měsíčně sub-kutánně) a vede ke snížení výskytu KV příhod během prvního roku aplikace [15]. Tato léčba bude indikována především u pacientů s těžkou hypercholesterolemií (např. u pacientů s familiární hypercholesterolemií), ale také u nemocných s vysokým KV rizikem a intolerancí léčby vysokými dávkami statinů.
Tato nová hypolipidemika jistě přispějí k větší individualizaci léčby dislipidemií, k lepší kontrole poruch metabolismu lipidů, a tím i k účinnějšímu snížení KV rizika.
Podpořeno výzkumným grantem Univerzity Kalovy Praha Lékařská fakulta v Plzni P36.
Seznam použité literatury
- [1] Perk J, De Backer G, Gohlke H, et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012); The Fifth Joint Task Force of the ESC and other Societies on Cardiovascular Disese Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33: 1635–1701.
- [2] Nissen SE, Nicholls SJ, Spahi I, et al. Effect of very high intensity statin therapy on regression of coronary atherosclerosis.The ASTEROID trial. JAMA 2006; 295: 1556–1565.
- [3] Robinson JG, Ballantyne CM, Grundy SM, et al. Lipid Altering Efficacy and Safety of Ezetimibe/Simvastatin Versus Atorvastatin in Patients With Hypercholesterole-mia and the Metabolic Syndrome (from the VYMET Study). Am J Cardiol 2009; 103: 1694–1702.
- [4] Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart And Renal Protection): a randomised, placebo controlled trial. Lancet 2011; 377: 2181–2192.
- [5] Braunwald E, Califf R, Cannon C, et al. Improved reductions of outcomes: Vytorin efficacy international trial. American Heart Association´s Scientific Sessions 2014, 17. listopadu 2014, Chicago, USA (ústní prezentace).
- [6] VarboA ‚ Benn M, Tybjaerg Hansen A, et al. Remnant cholesterol as a causal risk factor for ischemic heart disease. J Am Coll Cardiol 2013; 61: 427–436.
- [7] Fruchart JCh, Sacks FM, Hermans MP, et al. The Residual Risk Reduction Initiative: a call to action to reduce residual vascular risk in dyslipidaemic patients. A condenset position paper by the Residual Risk Reduction Initiative (R3i). Diab Vasc Dis Res 2008; 5: 319–335.
- [8] The ACCORD Study Group: Effects of Combination Lipid Therapy in Type 2 Diabetes Mellitus. N Engl J Med 2010; 362: 1563–1574.
- [9] Reyes Soffer G, Ngai CI, Lovato L, et al. Effect of combination therapy with fenofibrate and simvastatin on postprandial lipemia in the ACCORD lipid trial. Diabetes Care 2013; 36: 422–428.
- [10] The ACCORD Study Group and ACCORD Eye Study Group: Effects of Medical Therapies on Retinopathy Progression in Type 2 Diabetes. N Engl J Med 2010; 363: 233–244.
- [11] Sacks FM, Carey VJ, Fruchart JC, et al. Combination lipid therapy in type 2 diabetes. N Engl J Med 2010; 363: 684–692.
- [12] Grundy S, Vega GL, Juan Z, et al. Effectiveness and tolerability of Simvastatin plus Fenofibrate for combined hyperlipidemia (The SAFARI Trial). Am J Cardiol 2005; 95: 462–468.
- [13] Rosolova H, Ceska R, Soska V, et al. Concomitant administration of statin and fenofibrate in patients with mixed dyslipidemia. Abstract No145, Atherosclerosis Supplements: Abstract of the 77th Congress of the European Atherosclerosis Society, April 26–29 2008, Istanbul, Turkey: p. 249.
- [14] Dobiášová M. AIP aterogenní index plazmy jako významný prediktor kardiovaskulárního rizika: od výzkumu do praxe. Vnitř Lék 2006; 52: 64–71.
- [15] Sabatine MS, Giugliano RP, Wiviott SD, et al. Open Label Study of Long Term Evaluation against LDL Cholesterol (OSLER) Investigators: Efficacy and safety of Evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; DOI: 10.1056/NEJMoa1500858.