Inhibitory dipeptidylpeptidázy-4: přehled a porovnání základních údajů
Článek formou tabelárního přehledu uvádí základní chemické, farmakodynamické a farmakokinetické vlastnosti relativně nové skupiny perorálních antidiabetik – inhibitorů enzymu dipeptidylpeptidázy-4 (tzv. gliptinů). V textu jsou zmíněny odlišnosti, které mohou hrát roli při rozhodování o výběru konkrétní účinné látky pro konkrétního pacienta v klinické praxi.
Diabetes mellitus 2. typu (DM2) je chronické progresivní onemocnění, jehož incidence celosvětově narůstá [1, 2]. Cílem léčby pacientů s DM2 je snížení rizika akutních a chronických komplikací diabetu, prodloužení života a zlepšení jeho kvality. Základem farmakoterapie DM2 je léčba perorálními antidiabetiky, která jsou často podávána v kombinacích, a teprve pokud tato léčba není dostatečně účinná (nebo ve speciálních případech), přistupuje se k aplikaci inzulinu.
Inhibitory enzymu dipeptidylpeptidázy-4 (DPP-4) nazývané též gliptiny jsou relativně novou skupinou perorálních antidiabetik. Vývoj této skupiny léčiv je založen na bližším pochopení principu tzv. inkretinového efektu (perorální podání glukózy stimuluje sekreci inzulinu mnohem více než intravenózně aplikované množství, které vede ke shodnému vzestupu glykemie) [3]. Za tento jev jsou zodpovědné gastrointestinální hormony – inkretiny. Jedná se o polypeptidy, jež jsou secernovány do krve endokrinními buňkami trávicího ústrojí po požití potravy. Z hlediska terapeutického využití pro léčbu diabetu je nejdůležitějším inkretinem glucagon-like peptide-1 (glukagonu podobný peptid-1, GLP-1). Dalším významným inkretinovým hormonem je glucose-dependent insulinotropic polypeptide/gastric inhibitory polypeptide (na glukóze závislý inzulinotropní peptid, GIP). Koncentrace GLP-1 je u pacientů s DM2 snížená, jeho účinek ale zůstává zachován [4, 5].
Inkretiny ovlivňují různými způsoby homeostázu glukózy. Hlavními mechanismy jsou: ovlivnění sekrece inzulinu závislé na glykemii, postprandiální suprese sekrece glukagonu, ovlivnění evakuace žaludku či navození pocitu sytosti. Účinek na sekreci inzulinu je tzv. glukózodependentní. To znamená, že se neprojevuje při normální nebo snížené glykemii, taktéž ustává při poklesu postprandiální glykemie na normální hodnotu [6, 7].
Plazmatický poločas inkretinů je velmi krátký (2–7 minut), neboť jsou velmi rychle degradovány ubikviterně přítomným enzymem DPP-4 [7]. Inhibitory DPP-4 (gliptiny) vedou k zablokování aktivity tohoto enzymu, čímž se zastaví odbourávání GLP-1, zvýší se jeho plazmatická koncentrace a prodlouží se jeho plazmatický poločas.
V současné době je v klinickém použití celkem 5 zástupců inhibitorů DPP-4: sita-gliptin, vildagliptin, saxagliptin, alogliptin a linagliptin. Alogliptin je registrován pouze v Japonsku (od roku 2010). Cílem tohoto sdělení je porovnat chemické, farmakodyna-mické a farmakokinetické vlastnosti gliptinů registrovaných v České republice a zhodnotit rozdíly, které mohou být významné pro klinickou praxi.
Z hlediska chemické struktury je možné rozdělit inhibitory DPP-4 na dvě základní skupiny. První tvoří molekuly, jejichž struktura je podobná dipeptidovým substrátům DPP-4 (sitagliptin, vildagliptin, saxagliptin), druhou pak tvoří molekuly, jež jsou označovány jako non-peptidomimetika (alogliptin, linagliptin) [8].
S výjimkou vildagliptinu jsou inhibitory DPP-4 podávány jednou denně [9–12].
Vildagliptin se podává 2krát denně.
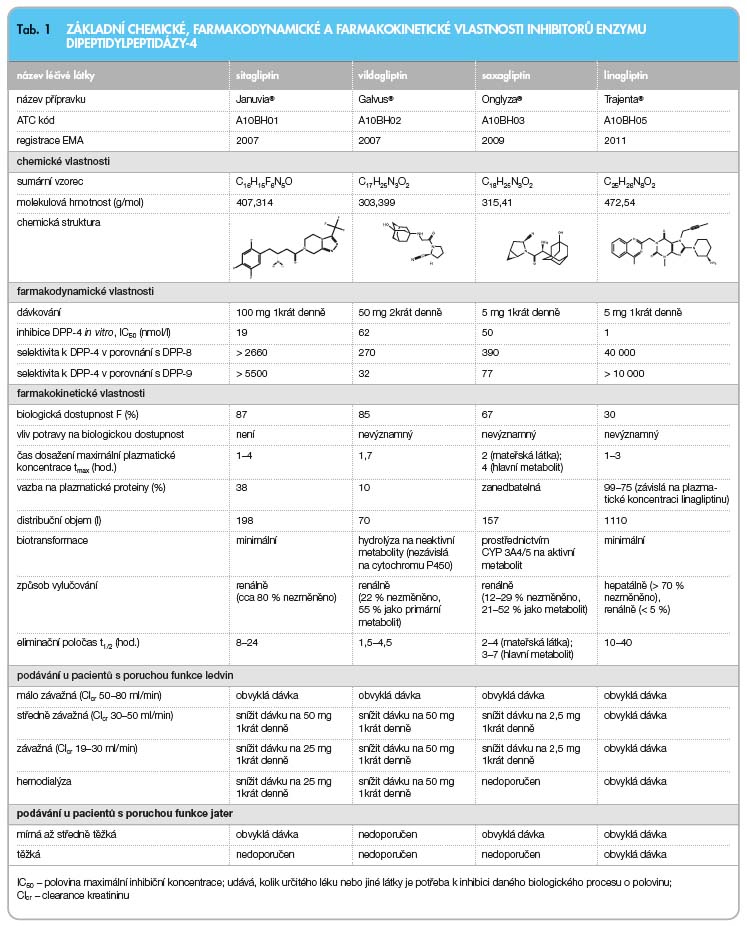 Všechny gliptiny jsou kompetitivními reverzibilními inhibitory DPP-4 vykazujícími vysokou selektivitu vůči tomuto enzymu. Nejvyšší je u linagliptinu, který vykazuje více než 104násobnou selektivitu oproti jiným dipeptidylpeptidázám (DPP-8 nebo DPP-9), viz tab. 1 [8, 13]. DPP-8 a DPP-9 byly identifikovány v některých preklinických studiích v souvislosti se supresí aktivace a proliferace T-lymfocytů. Klinický význam potenciální inhibice těchto enzymů in vivo je nejasný. In vitro mají všechny gliptiny podobnou účinnost (tj. maximální účinek) z hlediska inhibice DPP-4, nicméně jsou zde rozdíly v potenci (tj. potřebné množství účinné látky). Při podání terapeutických dávek inhibito-rů DPP-4 dochází k 70–90% redukci aktivity plazmatické dipeptidylpeptidázy-4 [8].
Všechny gliptiny jsou kompetitivními reverzibilními inhibitory DPP-4 vykazujícími vysokou selektivitu vůči tomuto enzymu. Nejvyšší je u linagliptinu, který vykazuje více než 104násobnou selektivitu oproti jiným dipeptidylpeptidázám (DPP-8 nebo DPP-9), viz tab. 1 [8, 13]. DPP-8 a DPP-9 byly identifikovány v některých preklinických studiích v souvislosti se supresí aktivace a proliferace T-lymfocytů. Klinický význam potenciální inhibice těchto enzymů in vivo je nejasný. In vitro mají všechny gliptiny podobnou účinnost (tj. maximální účinek) z hlediska inhibice DPP-4, nicméně jsou zde rozdíly v potenci (tj. potřebné množství účinné látky). Při podání terapeutických dávek inhibito-rů DPP-4 dochází k 70–90% redukci aktivity plazmatické dipeptidylpeptidázy-4 [8].
Inhibitory DPP-4 vykazují některé od-lišnosti ve farmakokinetických vlastnos-tech [14, 15]. Všechny zástupce inhibitorů DPP-4 charakterizuje rychlá absorpce, k signifikantní inhibici plazmatické DPP-4 dochází již 5 minut po podání. Biologická dostupnost je obecně vysoká. Distribuční objem je nereálně vysoký, což svědčí pro extenzivní distribuci do tkání. S výjimkou linagliptinu se inhibitory DPP-4 vážou velmi málo na plazmatické proteiny. Vazba linagliptinu na plazmatické bílkoviny je extenzivní (99–75 %) a je závislá na koncentraci léčiva [9–12]. Tato vazba pravděpodobně alespoň z části přispívá k tomu, že linagliptin není vylučován ledvinami.
Sitagliptin a linagliptin téměř nepodléhají biotransformaci, zhruba 80 % léčiva je vyloučeno v nezměněné formě. Naproti tomu vildagliptin a saxagliptin jsou extenzivně biotransformovány. Vildagliptin je biotransformován hydrolýzou a jeho bio-transformace je nezávislá na cytochromu P450. Saxagliptin je biotransformován prostřednictvím CYP 3A4/5 na účinný metabolit, který vykazuje přibližně 50% inhibiční aktivitu mateřské látky [9–12].
Sitagliptin, vildagliptin a saxagliptin jsou eliminovány z organismu převážně renální cestou. Výjimkou je linagliptin, jenž je eli-minován hepatálně. Této vlastnosti linagliptinu může být s výhodou využito při podávání u nemocných s poruchou funkce ledvin. Při podávání ostatních inhibitorů DPP-4 (sitagliptin, vildagliptin, saxagliptin) u pacientů s poruchou funkce ledvin je třeba úprava dávkování nebo se podávání nedoporučuje. Podíl vylučování ledvinami u jednotlivých inhibitorů DPP-4 ukazuje tab. 1.
Dávkování linagliptinu však není nutné upravovat dle stupně poruchy funkce ledvin a může být podáván nemocným ve všech stadiích renální nedostatečnosti [8, 16]. Tato vlastnost linagliptinu může být velmi významná pro klinickou praxi, protože obecně platí, že u pacientů s těžší poruchou funkce ledvin je řada perorálních antidiabetik kontraindikována nebo nedoporučena výrobcem (pro nedostatek zkušeností). Prevalence chronického onemocnění ledvin je přitom u pacientů s diabetem 2. typu vysoká (kolem 40 %) a dá se předpokládat, že bude nadále stoupat s prodlužujícím se dožitím diabetiků [16].
Sitagliptin, vildagliptin ani linagliptin nejsou substráty jednotlivých izoenzymů cytochromu P450. Saxagliptin je substrátem CYP3A4, dle SPC saxagliptinu platného v ČR vede současné podání ketokonazolu a saxagliptinu ke zvýšení expozice saxagliptinu. Současné podání s jinými silnými inhibitory CYP3A4 není zmíněno. Sitagliptin a linagliptin jsou rovněž substráty P-glykoproteinu (P-gp). Na základě současných znalostí a studií in vitro byly lékové interakce na úrovni P-gp hodnoceny jako klinicky nevýznamné [17]. Dle SPC lina-gliptinu by nicméně v kombinaci se silnými induktory P-gp (rifampicin) nemuselo být dosaženo plného účinku.
Linaglipin může být použit bez omezení také u pacientů s jaterním poškozením, což může být klinicky významné.
Léčba inhibitory DPP-4 je obecně velmi dobře snášena, frekvence výskytu nežádoucích účinků v klinických studiích byla nízká a nelišila se od placeba [8].
Jak již bylo uvedeno výše, z hlediska inhibice DPP-4 jsou všechny gliptiny srovnatelné, a proto se dá usuzovat, že rovněž jejich potenciál snižovat hladiny glykova-ného hemoglobinu (HbA1c) je srovnatelný. Jak vyplývá z jejich mechanismu účinku, který je tzv. glukózodependentní, není třeba se při jejich podávání obávat rizika hypoglykemie. V klinických studiích rov-něž nebyl po podání inhibitorů DPP-4 prokázán přírůstek hmotnosti a hovoříme o nich jako o váhově neutrálních antidiabetikách [18].
![Graf 1 Inhibitory DPP-4 a vztah ke kardiovaskulárnímu riziku; podle [19–22] – Frederich, et al., 2010; Johansen, et al., 2012; Schweizer, et al., 2010; Williams-Herman, et al., 2010. AKS – akutní koronární syndrom; TIA – tranzitorní ischemická ataka; KV – kardiovaskulární; CMP – cévní mozková příhoda; IM – infarkt myokardu; AP – angina pectoris; RR – relativní riziko; MACE – major adverse cardiovascular events, závažné kardiovaskulární příhody; MedDRA – Medical Dictionary for Regulatory Activities Pozn. Jedná se o předběžné výsledky, které byly získány metaanalýzami klinických studií, jejichž primárním cílem nebylo hodnocení kardiovaskulárních rizik (v případě sitagliptinu se dokonce jednalo o post-hoc analýzu a nikoli o metaanalýzu). Rozdílné výsledky získané těmito metaanalýzami mohou být způsobeny tím, že jednotlivé metaanalýzy hodnotily odlišné primární end-pointy. Uvedené výsledky je třeba posuzovat jako první signál, jenž je třeba dále potvrdit. V současnosti probíhá několik prospektivních randomizovaných kontrolovaných studií, jejichž primárním cílem je zhodnotit vliv gliptinů na kardiovaskulární riziko.](https://www.remedia.cz/photo-a-28794---.jpg) Velmi slibná data přinesly metaanalýzy studií jednotlivých inhibitorů DPP-4 ve vztahu k možnému kardiovaskulárnímu riziku, viz graf 1 [19–22].
Velmi slibná data přinesly metaanalýzy studií jednotlivých inhibitorů DPP-4 ve vztahu k možnému kardiovaskulárnímu riziku, viz graf 1 [19–22].
Ukazuje se, že inhibitory DPP-4 by mohly snižovat kardiovaskulární riziko, což by mohlo upřednostnit tuto skupinu léků oproti jiným perorálním antidiabetikům zejména ze skupiny derivátů sulfonylurey. Potvrzením těchto dat budou již probíhající studie s primárním cílem zaměřeným na kardiovaskulární rizika.
Z výše uvedeného rovněž vyplývá, že dostupné inhibitory DPP-4 vykazují důležité rozdíly ve farmakokinetických vlastnostech zahrnujících biologický poločas, vazbu na plazmatické bílkoviny, biotransformaci, přítomnost aktivních metabolitů a způsob vylučování. Z hlediska klinické praxe mohou být tyto rozdíly u jednotlivých pacientů s DM2 významné, zvláště pokud jsou přítomny komorbidity, jako je porucha funkce ledvin či jater, nebo pokud jsou gliptiny zařazeny do kombinační léčby [15].
Seznam použité literatury
- [1] American Diabetes Association. Diabetes statistics. Accessed 26. 1. 2012. http://www.diabetes.org/diabetes-basics/diabetes-statistics/
- [2] World Health Organization. 10 facts about diabe-tes. Accessed 26. 1. 2012. http://www.who.int/ features/factfiles/diabetes/en/
- [3] Perley MJ, Kipnis DM. Plasma insulin responses to oral and intravenous glucose: studies in normal and diabetic subjects. J Clin Invest 1967; 46: 1954–1962.
- [4] Nauck MA, Stöckmann F, Ebert R, et al. Reduced incretin effect in Type 2 (non-insulin-dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [5] Čáp J. Inkretinové hormony. Vnitř Lék 2011; 57: 405–410.
- [6] Ahrén B. Gut peptides and type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3: 365–372.
- [7] Drucker DJ. The biology of incretin hormones. Cell Metabolism 2006; 3: 153–165.
- [8] Deacon CF. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes: a comparative review. Diabetes Obes Metab 2011; 13: 7–18.
- [9] European Medicines Agency. Januvia. Souhrn údajů o přípravku. Accessed 18. 3. 2012 http:// www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000722/ WC500039054.pdf
- [10] European Medicines Agency. Galvus. Souhrn údajů o přípravku. Accessed 18. 3. 2012 http:// www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000771/ WC500020327.pdf
- [11] European Medicines Agency. Onglyza. Souhrn údajů o přípravku. Accessed 18. 3. 2012 http:// www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/001039 /WC500044316.pdf
- [12] European Medicines Agency. Trajenta. Souhrn údajů o přípravku. Accessed 18. 3. 2012 http:// www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human /002110/ WC500115745.pdf
- [13] Thomas L, Eckhardt M, Langkopf E, et al. (R)-8-(3-Amino-piperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methylquinazolin-2-ylmethyl)-3,7-dihydropurine-2,6-dione (BI 1356), a novel xanthine-based dipeptidyl peptidase 4 inhibitor, has a superior potency and longer duration of action compared with other dipeptidyl peptidase-4 inhibitors. J Pharmacol Experimental Therapeut 2008; 325: 175–182.
- [14] Scheen AJ. Pharmacokinetics of dipeptidylpeptidase-4 inhibitors. Diabetes Obes Metab 2010; 12: 648–658.
- [15] Baetta R, Corsini A. Pharmacology of dipeptidyl peptidase-4 inhibitors: similarities and differences. Drugs 2011; 71: 1441–1467.
- [16] Haluzík M, Suchopár J, Šťastná Koblihová H. Linagliptin. Remedia 2011; 21: 356–363.
- [17] Scheen AJ. Dipeptidylpeptidase-4 inhibitors (gliptins): focus on drug-drug interactions. Clin Pharmacokinet 2010; 49: 573–588.
- [18] Campbell IW. Comparing the actions of older and newer therapies on body weight: to what extent should these effects guide the selection of antidiabetic therapy? Int J Clin Pract 2010; 64: 791–801.
- [19] Frederich R, Alexander JH, Fiedorek FT, et al. A systematic assessment of cardiovascular outcomes in the saxagliptin drug development program for type 2 diabetes. Postgrad Med 2010; 122: 16–27.
- [20] Johansen OE, Neubacher D, von Eynatten M, et al. Cardiovascular safety with linagliptin in pa-tients with type 2 diabetes mellitus: a pre-specified, prospective, and adjudicated meta-analysis of a phase 3 programme. Cardiovasc Diabetol 2012; 11: 3.
- [21] Schweizer A, Dejager S, Foley JE, et al. Assessing the cardio-cerebrovascular safety of vilda-gliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab 2010; 12: 485–494.
- [22] Williams-Herman D, Engel SS, Round E, et al. Safety and tolerability of sitagliptin in clinical studies: a pooled analysis of data from 10,246 patients with type 2 diabetes. BMC Endocr Disord 2010; 10: 7.