Inhibitory protonové pumpy: přehled a porovnání základních údajů
Uvedené sdělení podává přehled farmakokinetických a farmakodynamických charakteristik léčivých látek ze skupiny inhibitorů protonové pumpy (PPI), které jsou dostupné v České republice. Rovněž jsou zmíněny indikace jednotlivých PPI spolu s hodnocením síly důkazů o jejich klinické účinnosti.
Úvod
Za produkci žaludeční kyseliny v parietálních buňkách je zodpovědný vysoce specializovaný transportní systém, H+/K+ adenozin trifosfatáza (ATPáza) neboli protonová pumpa. Ta je lokalizovaná v kanalikulu parietální buňky a výměnou za K+ vydává H+. Výsledkem je sekrece kyseliny chlorovodíkové. Výzkum v oblasti látek potenciálně inhibujících tento systém vedl k vývoji sloučenin zvaných substituované benzimidazoly. Tyto látky se koncentrují v parietálních buňkách, ireverzibilně se vážou na H+/K+ ATPázu a inhibují tvorbu žaludeční kyseliny. Prvním substituovaným benzimidazolem schváleným pro použití v klinické praxi byl v roce 1989 omeprazol (Losec®, AstraZeneca). Omeprazol stál na počátku vývoje nové skupiny léčiv nazvaných inhibitory protonové pumpy (proton pump inhibitors, PPI), v současné době nejúčinnějších antisekretoricky působících látek. Omeprazol byl následován lansoprazolem (Prevacid®, TAP Pharmaceuticals), pantoprazolem (Protonix®, Wyeth Pharmaceuticals), rabeprazolem (Aciphex®, Eisai Company) a (S)-enantiomerem omeprazolu esomeprazolem (Nexium®, AstraZeneca) [1,2]. Rabeprazol, stejně jako v letošním roce v USA registrovaný dexlansoprazol, není v České republice registrován, proto v tomto sdělení nebudou tyto sloučeniny zmiňovány.
Inhibitory protonové pumpy (PPI) jsou substituované 2-pyridyl methyl sulfinyl benzimidazoly. Liší se navzájem strukturami navázanými na pyridin a benzimidazolovou komponentu molekuly. Jsou to slabé báze, jejich pKa1 se pohybuje v rozmezí 3,8–4,9, jsou minimálně ionizovány v neutrálním prostředí, ale maximálně ve vysoce kyselém prostředí. To je za fyziologických podmínek přítomno lidském v organismu pouze intracelulárně v parietálních buňkách a v lumen žaludku. Po přestupu neaktivní látky do kyselého prostředí parietální buňky (kde je pH ~1 a koncentrace PPI zde může být 1000násobně vyšší než v plazmě) spouští ionizace dusíku pyridinové skupiny sled reakcí, na jehož konci je po druhé ionizaci stabilní cyklický sulfonamidový kation, aktivní forma PPI. Inhibitory protonové pumpy jsou tedy proléčiva přeměňovaná na vlastní účinné látky působením vysoce kyselého prostředí. Aktivní léčivo se následně permanentně váže na cysteinovou skupinu na luminálním povrchu H+/K+ ATPázy a zabraňuje tvorbě kyseliny chlorovodíkové. Jedná se o vazbu kovalentní, nevratně postihující aktivitu H+/K+ ATPázy, a sekreční aktivita parietální buňky může být obnovena pouze syntézou H+/K+ ATPázového systému de novo. PPI potlačují sekreci žaludeční kyseliny nezávisle na původu podnětu [1–4]. Kovalentní vazba PPI na H+/K+ ATPázu způsobuje, že účinek PPI přetrvává déle, než by se dalo usuzovat na základě jejich plazmatických koncentrací [1–4].
Farmakologické a farmakokinetické vlastnosti
Inhibitory protonové pumpy se vstřebávají po perorálním podání v horní části tenkého střeva. Aby se zabránilo předčasné přeměně neaktivní látky na látku aktivní v kyselém prostředí žaludku, má perorální léková forma acidorezistentní úpravu. Vstřebávání pak začíná až při vyšších hodnotách pH v duodenu a téměř kompletně dojde ke vstřebání v tenkém střevě [1, 2].
U zdravých dobrovolníků se biologický poločas inhibitorů protonové pumpy pohybuje kolem 1 hodiny, nicméně inhibice H+/K+ ATPázy přetrvává z důvodu kovalentní vazby až 48 hodin. Maximální plazmatické koncentrace (cmax) a míra suprese sekrece žaludeční kyseliny spolu nekorelují, zatímco plocha pod křivkou (AUC) koreluje se supresí žaludeční kyseliny poměrně dobře. Inhibitory protonové pumpy neinhibují po perorálním podání všechny gastrické H+/K+ ATPázy, neboť tyto nejsou všechny aktivní během maximálně 1,5hodinového biologického poločasu PPI. Udává se, že vždy je inhibováno pouze 70 % gastrických H+/K+ ATPáz. K dosažení steady state inhibice gastrické sekrece je zapotřebí 2–3 dnů. Pokusy na potkanech prokázaly poločas biosyntézy H+/K+ ATP-ázy 54 hodin a stejná doba se předpokládá i u lidské H+/K+ ATPázy. Za 24 hodin je tedy nově vytvořeno přibližně 20 % H+/K+ ATPáz, přičemž se předpokládá, že novotvorba je pravděpodobně vyšší v noci [2, 3]. Maximálně stimulovány jsou pak parietální buňky v ranních hodinách. Podání léčiva v tuto denní dobu se proto jeví jako maximálně výhodné a umožňuje inaktivovat maximální počet gastrických H+/K+ ATPáz [2, 3].
V procesu znovuobnovy sekrece žaludeční kyseliny se pravděpodobně uplatňují i jiné mechanismy než jen tvorba gastrických H+/K+ ATPáz de novo. Poločas znovuobnovy sekrece žaludeční kyseliny byl v experimentech na lidech 24 hodin, měřeno od ukončení podávání omeprazolu, a 46 hodin od ukončení podávání pantoprazolu. Uvažuje se o možné reverzibilitě vazby PPI na H+/K+ ATPázu [2].
Všechny PPI jsou dostupné v perorálních lékových formách, omeprazol, esomeprazol a pantoprazol i ve formě parenterální. Souhrnný přehled farmakologických vlastností PPI 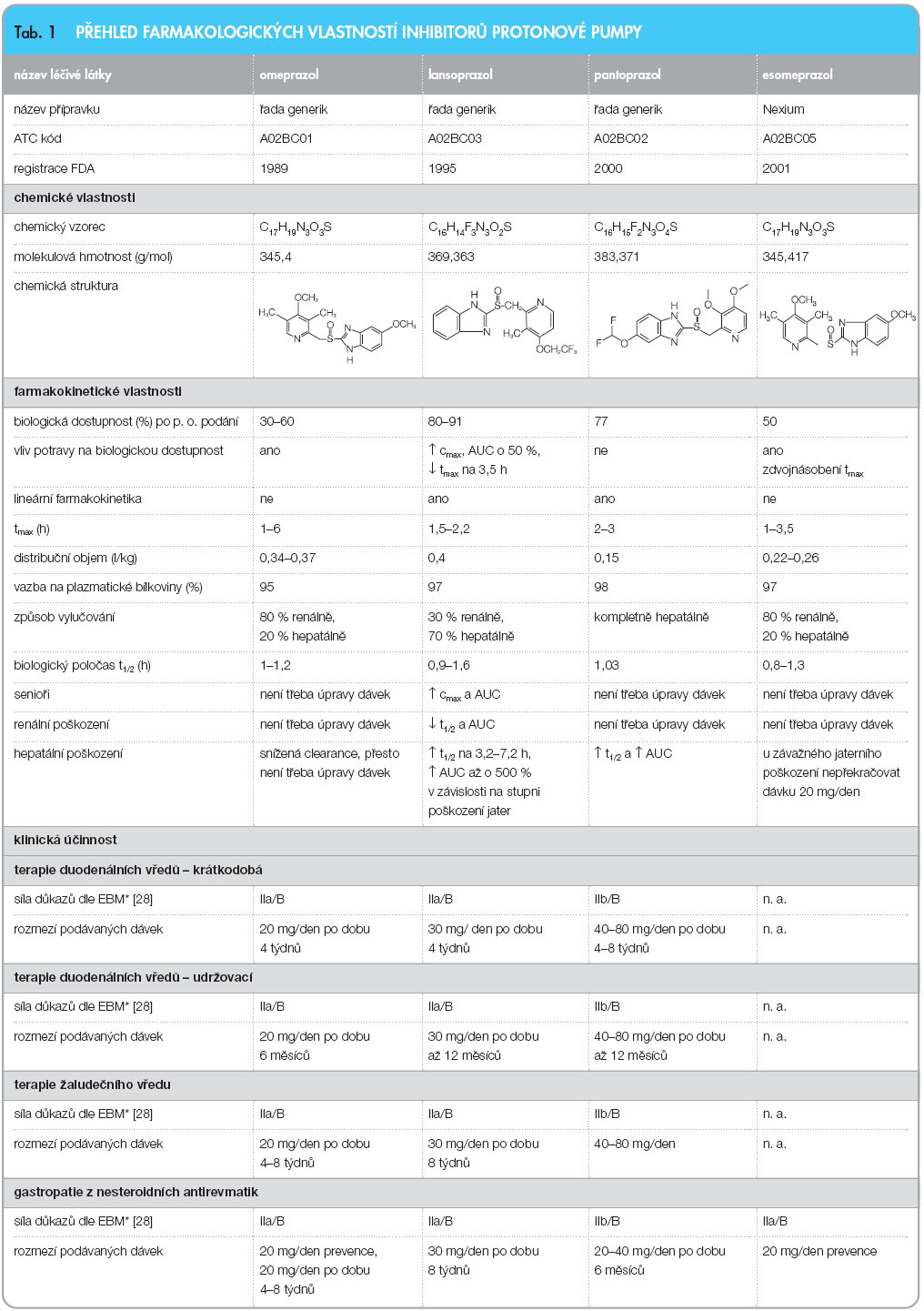 dostupných v České republice zobrazuje tab. 1 [5–8, 28]. Výsledky farmakokinetických studií prokázaly pouze malé rozdíly mezi jednotlivými PPI. Hodnoty jejich biologických poločasů (t1/2) a času do dosažení maximální koncentrace (tmax) jsou obdobné. Větší rozdíly se vyskytují mezi jednotlivými PPI v cmax a AUC (tab. 1). Všechny PPI podstupují extenzivní biotransformaci v játrech. Ta zahrnuje oxidativní hepatální metabolismus a částečně
dostupných v České republice zobrazuje tab. 1 [5–8, 28]. Výsledky farmakokinetických studií prokázaly pouze malé rozdíly mezi jednotlivými PPI. Hodnoty jejich biologických poločasů (t1/2) a času do dosažení maximální koncentrace (tmax) jsou obdobné. Větší rozdíly se vyskytují mezi jednotlivými PPI v cmax a AUC (tab. 1). Všechny PPI podstupují extenzivní biotransformaci v játrech. Ta zahrnuje oxidativní hepatální metabolismus a částečně 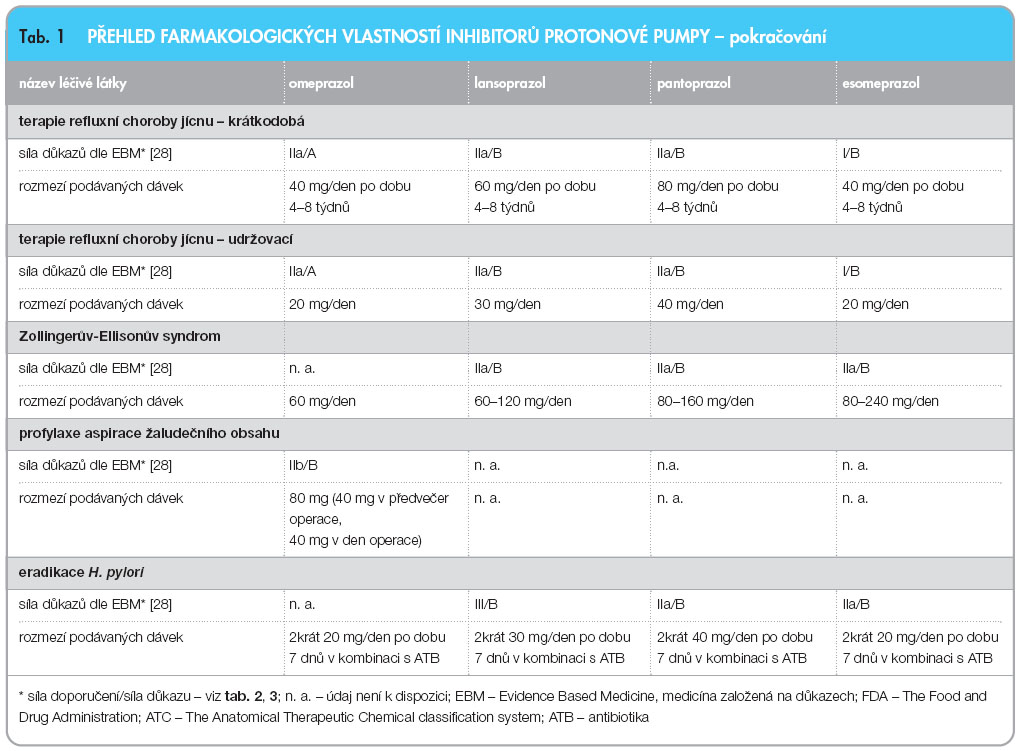 metabolizaci izoenzymy CYP2C19 a CYP3A4. Jednotlivé látky se liší v rozsahu, v jakém se na jejich metabolizaci podílejí jednotlivé izoenzymy. Všechny PPI (kromě u nás neregistrovaného rabeprazolu) jsou primárně metabolizovány CYP2C19. Omeprazol a esomeprazol vykazují inhibiční aktivitu vůči tomuto izoenzymu, což způsobuje kumulaci jak vlastní látky, tak metabolitu po 5 dnech podávání [1–3].
metabolizaci izoenzymy CYP2C19 a CYP3A4. Jednotlivé látky se liší v rozsahu, v jakém se na jejich metabolizaci podílejí jednotlivé izoenzymy. Všechny PPI (kromě u nás neregistrovaného rabeprazolu) jsou primárně metabolizovány CYP2C19. Omeprazol a esomeprazol vykazují inhibiční aktivitu vůči tomuto izoenzymu, což způsobuje kumulaci jak vlastní látky, tak metabolitu po 5 dnech podávání [1–3].
Genetický polymorfismus
 Pro izoenzym CYP2C19 je charakteristický genetický polymorfismus, kde byly identifikovány 2 fenotypy: rychlí metabolizátoři (extensive metabolizers, EMs) a pomalí metabolizátoři (poor metabolizers, PMs). Podíl slabých metabolizátorů v populaci se liší podle etnika. Pomalí metabolizátoři tvoří dle dostupných údajů 2–6 % kavkazské populace, 1 % Afroameričanů a až 23 % Japonců. Farmakokinetické a farmakodynamické studie s PPI u dospělých jedinců, kteří jsou pomalými metabolizátory, v porovnání s rychlými metabolizátory vykazovaly signifikantní nárůst v hodnotách t1/2, AUC a silnější potlačení sekrece žaludeční kyseliny. U pomalých metabolizátorů dochází tedy ke zvýšení biodostupnosti PPI. Naopak rychlí metabolizátoři nemusí odpovídat na terapii PPI a možností může být zvýšit dávku PPI [1–3]. Toto bylo prokázáno u omeprazolu, lansoprazolu a pantoprazolu [3].
Pro izoenzym CYP2C19 je charakteristický genetický polymorfismus, kde byly identifikovány 2 fenotypy: rychlí metabolizátoři (extensive metabolizers, EMs) a pomalí metabolizátoři (poor metabolizers, PMs). Podíl slabých metabolizátorů v populaci se liší podle etnika. Pomalí metabolizátoři tvoří dle dostupných údajů 2–6 % kavkazské populace, 1 % Afroameričanů a až 23 % Japonců. Farmakokinetické a farmakodynamické studie s PPI u dospělých jedinců, kteří jsou pomalými metabolizátory, v porovnání s rychlými metabolizátory vykazovaly signifikantní nárůst v hodnotách t1/2, AUC a silnější potlačení sekrece žaludeční kyseliny. U pomalých metabolizátorů dochází tedy ke zvýšení biodostupnosti PPI. Naopak rychlí metabolizátoři nemusí odpovídat na terapii PPI a možností může být zvýšit dávku PPI [1–3]. Toto bylo prokázáno u omeprazolu, lansoprazolu a pantoprazolu [3].
 Dalším důležitým poznatkem je, že (R)- a (S)-izomery inhibitorů protonové pumpy jsou cytochromovým systémem metabolizovány různou měrou. (S)-enantiomer omeprazolu esomeprazol je metabolizován s menší efektivitou, proto vykazuje v porovnání s omeprazolem (směs (R)- a (S)-enantiomerů) vyšší hodnoty t1/2 a AUC [1]. Esomeprazol dosahuje u rychlých metabolizátorů vyšších hodnot t1/2 a AUC, u pomalých metabolizátorů dosahuje vyšších hodnot naopak omeprazol [3].
Dalším důležitým poznatkem je, že (R)- a (S)-izomery inhibitorů protonové pumpy jsou cytochromovým systémem metabolizovány různou měrou. (S)-enantiomer omeprazolu esomeprazol je metabolizován s menší efektivitou, proto vykazuje v porovnání s omeprazolem (směs (R)- a (S)-enantiomerů) vyšší hodnoty t1/2 a AUC [1]. Esomeprazol dosahuje u rychlých metabolizátorů vyšších hodnot t1/2 a AUC, u pomalých metabolizátorů dosahuje vyšších hodnot naopak omeprazol [3].
Lékové interakce inhibitorů protonové pumpy
Onemocnění, jejichž patogeneze souvisí s působením kyseliny chlorovodíkové, většinou vyžadují dlouhodobou léčbu. Pacienti užívající PPI proto mohou být během této doby vystaveni působení ostatních léčiv. Velká část léčiv je metabolizována jaterním cytochromovým systémem, proto zde vzniká prostor pro potenciálně klinicky závažné lékové interakce. PPI mohou navíc primárně ovlivňovat vstřebávání některých léčiv snížením kyselosti žaludečního prostředí. Klinicky významné může být snížení vstřebávání preparátů obsahujících železo, ketokonazol a itrakonazol [4–9].
Interakční potenciál omeprazolu byl poměrně extenzivně studován, může dojít k ovlivnění absorpce bismutu, kofeinu, karbamazepinu, diazepamu, digoxinu, methotrexátu, nifedipinu, fenytoinu a warfarinu. Naopak lékové interakce nebyly popsány u theofylinu, metoprololu, ethanolu a cyklosporinu. Již zmiňovaná inhibice CYP2C19 esmeprazolem a esomeprazolem může ovlivnit metabolismus léčiv zprostředkovaný tímto izoenzymem [3]. Některá léčiva mohou naopak ovlivnit metabolismus omeprazolu. Ketokonazol inhibuje jeho přeměnu na metabolit pravděpodobně inhibicí izoenzymu CYP3A4, který se též podílí na metabolismu omeprazolu [3, 5]. Lansoprazol má méně zdokumentovaných lékových interakcí v porovnání s omeprazolem. Nebyly popsány klinicky významné lékové interakce s warfarinem, fenytoinem, prednisonem, diazepamem a perorálními kontraceptivy. Klarithromycin zvyšuje plazmatické koncentrace lansoprazolu inhibicí CYP3A4 [6]. V případě pantoprazolu nebyly prokázány klinicky významné lékové interakce s theofylinem, warfarinem, diazepamem, metoprololem, ethanolem a karbamazepinem [7]. Podobně jako omeprazol inhibuje také esomeprazol metabolismus diazepamu a v menším rozsahu fenytoinu a warfarinu. Současné podání klarithromycinu zvyšuje plazmatické koncentrace esomeprazolu dvojnásobně [8]. V průběhu terapie omeprazolem bylo popsáno snížení absorpce současně podávaných přípravků s obsahem železa. Sama nízká biologická dostupnost přípravků s obsahem železa je ještě více ovlivněna pravděpodobně zvýšením pH žaludečního prostředí [9].
Je třeba mít na paměti, že genetický polymorfismus CYP2C19 ovlivňující metabolismus PPI může stejně tak ovlivnit i riziko lékových interakcí a komplikovat posuzování jejich klinické závažnosti [3]. Nedávno publikované studie [10, 11] upozorňují na snížení účinnosti protidestičkového léčiva klopidogrelu u pacientů užívajích PPI. Klopidogrel je proléčivo, pro jehož aktivaci je klíčový cytochrom P-450 2C19, který je pravděpodobně inhibován současným podáním PPI. Snížení metabolismu klopidogrelu na jeho aktivní formu může vést ke zvýšenému výskytu trombotických příhod včetně infarktu myokardu. Studie naznačují, že riziko je nejvyšší pro omeprazol a esomeprazol, jež jsou inhibitory CYP2C19 [3], z dostupných dat je však nemožné vytvořit konkrétnější závěr. Evropská léková agentura (EMEA) vydala 29. 5. 2009 vyjádření k této problematice, kde doporučuje přehodnotit započetí či podávání PPI u pacientů užívajích klopidogrel.
Postavení inhibitorů protonové pumpy v klinické praxi
V ČR jsou k dispozici preparáty s obsahem omeprazolu, pantoprazolu a esomeprazolu i pro intravenózní podání. Intravenózní podání je řešením v případě, že pacient nemůže přijímat léčivé přípravky per os nebo v případě akutního krvácení do horní části trávicího traktu, kdy je třeba terapie vysokou dávkou. Intravenózní podání PPI představuje rychlou cestu, jak dosáhnout útlumu gastrické sekrece, v porovnání s perorálním podáním. Maximální intenzita antisekrečního účinku nastává v řádu hodin v porovnání se dny po podávání perorálních forem v doporučeném dávkování. Farmakokinetické studie prokázaly dvojnásobnou cmax a o 66–83 % větší AUC v porovnání s p.o. formami ve stejných dávkách. U pacientů s akutním krvácením do horní části trávicí trubice bylo studováno podání omeprazolu intermitentně injekčně nebo kontinuální infuzí (20 mg bolus třikrát denně vs. 80 mg bolus + 8 mg/h infuze). V prvním případě bylo možno udržet intragastrické pH na hodnotě vyšší než 4 po dobu 24 hodin, což je pravděpodobně dostatečné pro udržení hemostázy. V druhém případě hodnota intragastrického pH přesahovala 6, což umožňuje lepší ochranu žaludeční sliznice [20].
Hlavními indikacemi PPI jsou: refluxní choroba jícnu, vředová Helicobacter pylori (H. pylori) pozitivní choroba, gastropatie z nesteroidních antiflogistik, sekundární peptické vředy (stresem způsobené a jiné endokrinně podmíněné vředy), prevence a léčba krvácení do horní části trávicího traktu, poporodní a pooperační aspirace žaludečního sekretu (Mendelsohnův syndrom). Hlavní indikace a dávkování jsou uvedeny v tab. 1 u jednotlivých zástupců PPI. PPI mají nezastupitelnou roli v eradikační léčbě H. pylori, protože snížení kyselosti žaludečního obsahu je nezbytné pro účinek podávaných antibiotik. Obvyklým postupem v první linii je perorálně podávaná trojkombinace amoxicilinu (2x denně 1000 mg) a klarithromycinu (2x denně 500 mg) společně s PPI podaným též 2krát denně, kterou je pacient léčen po dobu minimálně 7 dní. Náhradou za klarithromycin z důvodu rezistence je možné použít metronidazol (2x denně 500 mg). Rezistence na amoxicilin je popisována jako vzácná, proto je tato látka fixní v kombinační eradikační léčbě [3, 4].
Porovnání jednotlivých inhibitorů protonové pumpy
Studie porovnávající denní podání 30 mg lansoprazolu a 20 mg omeprazolu na základě monitorování žaludečního pH prokázala, že lansoprazol signifikantně prodlouží dobu, kdy je žaludeční pH > 3, v porovnání s omeprazolem. Několik jiných studií neprokázalo na druhou stranu rozdíl mezi 20 mg omeprazolu a 30 mg lansoprazolu. Pantoprazol 40 mg v porovnání s omeprazolem 20 mg zabezpečil signifikantně vyšší 24hodinové pH žaludku [2]. řada studií porovnávala účinnost jednotlivých PPI v léčbě refluxní choroby jícnu. Na základě endoskopického vyšetření nebyl zjištěn signifikantní rozdíl mezi podáváním 20 mg omeprazolu a 30 mg lansoprazolu denně po dobu 4 a 8 týdnů. Dávka 40 mg esomeprazolu vykazovala po 8 týdnech podávání signifikantně lepší výsledky v porovnání s 20 mg omeprazolu, v porovnání se 40 mg pantoprazolu bylo dosaženo stejných výsledků [2].
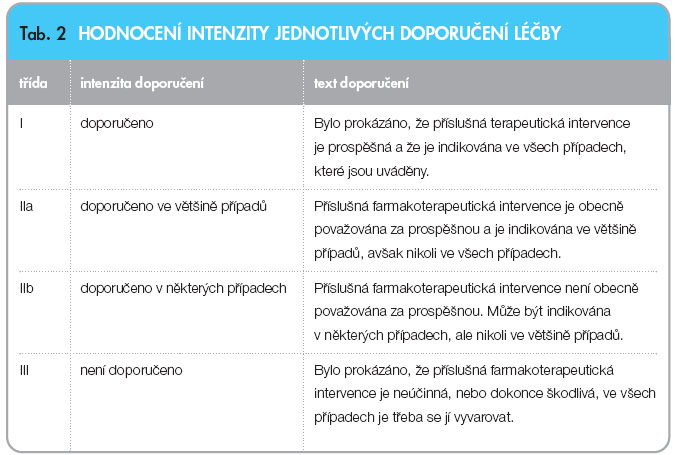
Existuje řada mezinárodních i národních doporučení pro dávkování PPI. Světová zdravotnická organizace pokládá denní dávku 20 mg omeprazolu, 30 mg esomeprazolu, 30 mg lansoprazolu a 40 mg pantoprazolu za ekvivalentní pro léčbu refluxní choroby jícnu. Kanadská asociace gastroenterologů považuje dávku 20 mg omeprazolu ekvivalentní 40 mg esomeprazolu, 30 mg lansoprazolu a 40 mg pantoprazolu v léčbě refluxní choroby jícnu. Nicméně nedávno publikované review zpochybňuje porovnávání omeprazolu a esomeprazolu a dávku 20 mg esomeprazolu pokládá za ekvivalentní 30 mg omeprazolu [25]. Metaanalýza založená na endoskopicky ověřovaném hojení erozivní ezofagitidy během 8 týdnů pokládá za ekvivalentní dávku 20 mg omeprazolu, 30 mg lansoprazolu a 40 mg pantoprazolu [26]. V případě eradikační terapie H. pylori nebyly mezi použitými PPI prokázány rozdíly v účinnosti [2, 26]. Většina publikovaných prací zaměřených na srovnání účinnosti jednotlivých PPI se shoduje na tom, že všechny PPI jsou v účinnosti srovnatelné a výběr konkrétního přípravku závisí i na jiných faktorech, např. ekonomických [2, 25–28].
Inhibitory protonové pumpy v graviditě, u dětí a seniorů
PPI jsou považovány za bezpečné pro použití v těhotenství v léčbě refluxní choroby jícnu, infekce H. pylori, peptického vředu, Zollingerova-Ellisonova syndromu a také v prevenci těhotenské nevolnosti a zvracení, jež postihují až 80 % těhotných žen. To bylo potvrzeno nedávno publikovanou metaanalýzou [24]. Stejně jako u dospělých jedinců byla účinnost a bezpečnost podávání PPI prokázána i u dětí. Několik experimentálních studií z poslední doby naznačilo, že v případě kojenců a malých dětí může být k účinnému potlačení žaludeční sekrece potřeba vyšších dávek PPI na kilogram tělesné hmotnosti než u dospělých. Je tomu tak pravděpodobně z důvodu vyšší metabolické aktivity CYP2C19 a CYP3A4 v tomto vývojovém období [1]. Podání PPI je bezpečné a účinné bez nutnosti měnit dávky i v populaci seniorů, pouze s přihlédnutím ke zvýšenému riziku lékových interakcí vyplývajících z polymorbidity a polypragmazie pacientů této věkové skupiny. Téměř jedinou kontraindikací PPI je přecitlivělost na účinnou látku a další složky léčivého přípravku [5–8].
Nežádoucí účinky a možná rizika inhibitorů protonové pumpy
PPI jsou v praxi používány relativně dlouho a během této doby prokázaly svoji dobrou snášenlivost v léčbě dospělých i dětí. Jsou popisovány pouze mírné nežádoucí účinky jako bolest hlavy, nevolnost a průjem. Jejich výskyt se významněji neliší od placeba. Obecně se uvádí, že hypersekrece HCl se po ukončení podávání PPI, na rozdíl od antagonistů H2-receptorů, nevyskytuje. Tento poznatek však byl zpochybněn nedávno publikovanou dvojitě zaslepenou studií, která prokázala opětovnou hypersekreci s klinicky významnými příznaky po ukončení podávání esomeprazolu [12].
Bylo publikováno několik klinických studií popisujících zvýšený výskyt atrofické gastritidy, histopatologického prekurzoru rakoviny žaludku, při dlouhodobém užívání PPI. Její výskyt byl zvláště zvýšen při podávání PPI u H. pylori pozitivních pacientů. Předpokladem je přesun maximálního výskytu H. pylori z antra z důvodu intenzivní antisekreční léčby proximálním směrem do žaludku, kde následně zánětlivá odpověď na přítomnost H. pylori spouští atrofickou gastritidu. Mnozí autoři se shodují, že před dlouhodobým podáváním inhibitorů protonové pumpy by měla být zvážena eradikace H. pylori [1].
Dlouhodobé podávání PPI a jimi způsobená hypochlorhydrie v prostředí žaludku může dle některých autorů způsobovat snížením účinku kyselého prostředí přirozené ochranné bariéry bakteriální přerůstání v žaludku a duodenu. Klinické důsledky jsou ale nepříliš jasné [1]. Studie u pacientů se Zollingerovým-Ellisonovým syndromem léčených vysokými dávkami PPI prokázala u těchto nemocných vývin plazmatického deficitu cyanokobalaminu (vitamin B12). Klíčovým pro predispozici k tomuto deficitu může být genotyp CYP-450 2C19 [1].
Vztah mezi dlouhodobým užíváním PPI a rizikem zlomeniny stehenní kosti byl zkoumán ve třech velkých retrospektivních studiích případů a kontrol. Dvě z nich přinesly statisticky signifikantní důkaz o tomto vztahu [13, 14], třetí z nich souvislost mezi dlouhodobým podáváním PPI a rizikem zlomeniny stehenní kosti nepotvrdila [15]. Pravděpodobnou příčinou by mohlo být ovlivnění vstřebávání vápníku ve střevě inhibitory protonové pumpy, metaanalýza studií však nepřináší jednoznačný názor [16]. Z dostupných literárních údajů vyplývá, že není nutno přijímat při terapii PPI ohledně možného rizika zlomenin jakákoli zvláštní opatření [17]. Metaanalýza studií rovněž nepotvrdila riziko vzniku deficitu železa v organismu v důsledku sníženého vstřebávání železa přijímaného z potravy [18]. Podání PPI je spojováno s vyšším rizikem výskytu pneumonie. Naposled bylo toto zdokumentováno v rozsáhlé epidemiologické studii pacientů přijatých k hospitalizaci. Ve skupině pacientů léčených PPI došlo k 30% nárůstu případů nozokomiální pneumonie v porovnání s pacienty léčenými antagonisty H2-receptorů [19]. Pravděpodobnou příčinou je v těchto případech regurgitace a aspirace žaludečního obsahu postiženého bakteriálním přerůstáním [20].
Po zavedení PPI do klinické praxe bylo publikováno několik studií upozorňujících na možné riziko výskytu kolorektálního karcinomu (CRC) v souvislosti s jejich dlouhodobým užíváním. Jako pravděpodobná příčina je uvažována zvýšená koncentrace sérového gastrinu způsobená PPI. Gastrin stimuluje k růstu mnoho typů epiteliálních buněk, včetně těch, které jsou lokalizovány v žaludeční, pankreatické a střevní mukóze. Svůj podíl může mít i bakteriální přerůstání v trávicím traktu. Touto problematikou se zabývalo i několik nedávno publikovaných studií. Analýza kohorty téměř 900 000 pacientů z databáze praktických lékařů v USA neprokázala zpětně během pětiletého období souvislost mezi podáváním PPI a výskytem CRC. Nicméně připouští možnost zvýšeného rizika při terapii PPI trvající delší dobu než analyzované období [21]. Ani studie provedená na základě registru pacientů v Dánsku neprokázala spojitost mezi léčbou PPI a výskytem CRC, a to ani při dlouhodobém konstantním podávání PPI [22]. Ke stejnému výsledku dospěla i další studie provedená v Dánsku [23].
Shrnutí
Seznam použité literatury
- [1] Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep 2008; 10: 528–534.
- [2] Gibbons TE, Gold BD. The use of proton pump inhibitors in children: a comprehensive review. Paediatr Drugs 2003; 5: 25–40.
- [3] Robinson M, Horn J. Clinical pharmacology of proton pump inhibitors: what the practising physician needs to know. Drugs 2003; 63: 2739–2754.
- [4] Robinson M. Review article: the pharmacodynamics and pharmacokinetics of proton pump inhibitors-overview and clinical implications. Aliment Pharmacol Ther 2004; 20 (Suppl. 6): 1–10.
- [5] Wilde MI, McTavish D. Omeprazole. An update of its pharmacology and therapeutic use in acid-related disorders. Drugs 1994; 48: 91–132.
- [6] Matheson AJ, Jarvis B. Lansoprazole: an update of its place in the management of acid-related disorders. Drugs 2001; 61: 1801–1833.
- [7] Cheer SM, Prakash A, Faulds D, Lamb HM. Pantoprazole: an update of its pharmacological properties and therapeutic use in the management of acid-related disorders. Drugs 2003; 63: 101–133.
- [8] Scott LJ, Dunn CJ, Mallarkey G, Sharpe M. Esomeprazole: a review of its use in the management of acid-related disorders. Drugs 2002; 62: 1503–1538.
- [9] Sharma VR, Brannon MA, Carloss EA. Case report: effect of omeprazole on oral iron replacement in patients with iron deficiency anemia. South Med J 2004; 97: 887–889.
- [10] Juurlink DN, Gomes T, Ko DT, et al. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ 2009; 180: 713–718.
- [11] Ho PM, Maddox TM, Wang L, et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA 2009; 301: 937–944.
- [12] Reimer C, So/ndergaard B, Hilsted L, Bytzer P. Proton-pump inhibitor therapy induces acid-related symptoms in healthy volunteers after with-drawal of therapy. Gastroenterology 2009; 137: 80–87.
- [13] Yang YX, Lewis JD, Epstein S, Metz DC. Long-term proton pump inhibitor therapy and risk of hip fracture. JAMA 2006; 296: 2947–2953.
- [14] Vestergaard P, Rejnmark L, Mosekilde L. Proton pump inhibitors, histamine H2 receptor antagonists, and other antacid medications and the risk of fracture. Calcif Tissue Int 2006; 79: 76–83.
- [15] Kaye JA, Jick H. Proton pump inhibitor use and risk of hip fractures in patients without major risk factors. Pharmacotherapy 2008; 28: 951–959.
- [16] Insogna KL. The effect of proton pump-inhibiting drugs on mineral metabolism. Am J Gastroenterol 2009; 104: S2–S4.
- [17] Laine L. Proton pump inhibitors and bone fractures? Am J Gastroenterol 2009; 104 (Suppl. 2): S21–S26.
- [18] McColl KE. Effect of proton pump inhibitors on vitamins and iron. Am J Gastroenterol 2009; (Suppl. 2): S5–9.
- [19] Herzig SJ, Howell MD, Ngo LH, Marcantonio ER. Acid-suppressive medication use and the risk for hospital-acquired pneumonia. JAMA 2009; 301: 2120–2128.
- [20] Bardou M, Martin J, Barkun A. Intravenous proton pump inhibitors: an evidence-based review of their use in gastrointestinal disorders. Drugs 2009; 69: 435–448.
- [21] Yang YX, Hennessy S, Propert K, et al. Chronic proton pump inhibitor therapy and the risk of colorectal cancer. Gastroenterology 2007; 133: 748–754.
- [22] Robertson DJ, Larsson H, Friis S, et al. Proton pump inhibitor use and risk of colorectal cancer: a population-based, case-control study. Gastroenterology 2007; 133: 755–760.
- [23] van Soest EM, van Rossum LG, Dieleman JP, et al. Proton pump inhibitors and the risk of colorectal cancer. Am J Gastroenterol 2008; 103: 966–973.
- [24] Gill SK, O'Brien L, Einarson TR, Koren G. The safety of proton pump inhibitors (PPIs) in pregnancy: a meta-analysis. Am J Gastroenterol 2009; 104: 1541–1545.
- [25] Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65: 19–31.
- [26] Klok RM, Postma MJ, van Hout BA, Brouwers JR. Meta-analysis: comparing the efficacy of proton pump inhibitors in short-term use. Aliment Pharmacol Ther 2003 15; 17: 1237–1245.
- [27] Vakil N, Fennerty MB. Direct comparative trials of the efficacy of proton pump inhibitors in the management of gastro-oesophageal reflux disease and peptic ulcer. Pharmacol Ther 2003; 18: 559–568.
- [28] Micromedex® Healthcare Series [intranet database]. Version 5.1.