Inkretinové hormony a úloha inkretin-mimetik v léčbě diabetes mellitus 2. typu
Inkretinové hormony a peptidy uvolňované z gastrointestinálního traktu napomáhají dosažení glukózové homeostázy. Hlavními inkretinovými hormony jsou glukagon-like peptid-1 (GLP-1) a glukózo-dependentní inzulinotropní polypeptid (GIP). GLP-1 stimuluje sekreci inzulinu jako odpověď po příjmu potravy, inhibuje sekreci glukagonu z -buněk pankreatických ostrůvků, zpomaluje vyprazdňování žaludku, urychluje dosažení pocitu sytosti, stimuluje také replikaci a neogenezi -buněk pankreatických ostrůvků. Vede tím k výraznému snížení výkyvů glykémie po jídle. Léčebné použití nativního GLP-1 je limitováno, proto byla vyvinuta řada peptidových analog GLP-1. Nejdůležitějším z nich je exenatid.
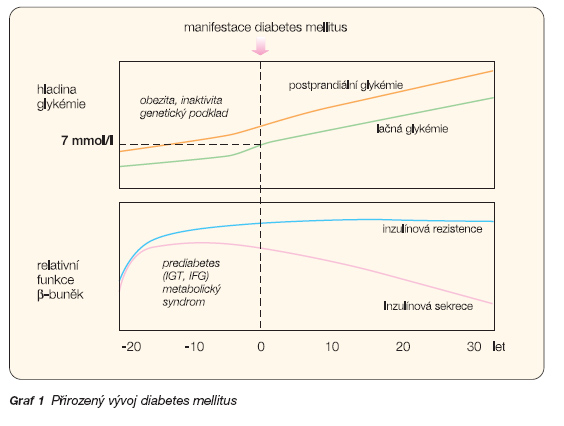
Diabetes mellitus 2. typu (DM2) je charakterizován přítomností lačné a postprandiální hyperglykémie. Je všeobecně akceptováno, že hyperglykémie u DM2 roste jako důsledek klíčových metabolických abnormalit. Neadekvátní sekrece inzulinu a porucha inzulinové odpovědi (inzulinová rezistence) jsou stanoveny jako hlavní patofyziologický defekt. Teprve nedávno byla včleněna mezi patofyziologické defekty u DM2 role kontraregulačních hormonů, glukagonu, amylinu a inkretinových hormonů. Postprandiální glykémie se zvyšuje již v časných stadiích DM2, často ještě i před nárůstem lačné glykémie (jež však bývá mnohdy použita ke stanovení diagnózy diabetu) (graf 1) [6].
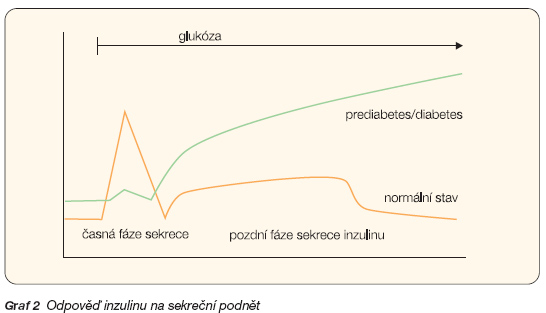
Jednou z příčin metabolických poruch u DM2 je dysfunkce b-buněk. Již v době stanovení diagnózy DM je ztraceno určité množství b-buněk a zbylé buňky jsou dysfunkční. Dochází k depleci granulí obsahujících inzulin, takže buňky špatně odpovídají na stimulaci glukózou. Zcela nedostatečná je časná fáze sekrece, která zodpovídá za „otupení" postprandiálních glykemických výkyvů, a normální pulsatilní sekrece inzulinu je těžce porušena (viz graf 2).
U nediabetických jedinců je cca 50 % celkové denní dávky inzulinu secernováno rovnoměrně během celého dne, suprimují lipolýzu, proteolýzu a glykogenolýzu. Zbytek inzulinu je secernován postprandiálně. V odpovědi na příjem potravy je rychle uvolněn inzulin ze zásobních sekrečních granulí b-buněk. Tato „časná fáze" inzulinové sekrece umožňuje periferní utilizaci glukózy, suprimuje produkci glukózy v játrech, a limituje tím postprandiální zvýšení glykémie. Časná fáze inzulinové sekrece začíná během 2 minut po požití potravy a pokračuje zhruba dalších 10–15 minut. Následuje ji pozdní fáze sekrece inzulinu, která přetrvává, dokud není nastolena normoglykémie.
Je dobře zmapováno, že porušená časná fáze sekrece je markerem dysfunkce b-buněk objevujícím se dlouho předtím, než jsou patrné signifikantní změny v hladinách glykémie. Již u osob s porušenou glukózovou tolerancí jsou přítomny mnohočetné defekty v kvalitě i kvantitě inzulinové sekrece. Porucha časné fáze sekrece je dokumentována také u žen s anamnézou gestačního diabetes mellitus a normální tolerancí glukózy po porodu. Tyto ženy, které mají velmi vysoké riziko vzniku diabetu v dalším průběhu života, vykazují porušenou časnou fázi sekrece inzulinu v odpovědi na podání glukózy p.o. nebo i.v., zatímco další markery funkce b-buněk jsou normální. Rovněž osoby, blízcí příbuzní pacientů s DM2, vykazují nižší sekreci inzulinu v časné fázi sekrece jako reakci na p.o. podání glukózy [3].
Postprandiální hyperglykémie, která vychází z porušené časné fáze sekrece inzulinu, není jen následkem nedostatku inzulinu na zpracování glukózy přijaté potravou. Intaktní časná fáze sekrece inzulinu je totiž kritická také pro restrikci jaterní glukoneogeneze, takže postprandiální zvýšení glykémie je také důsledkem vystupňované endogenní produkce glukózy.
Dysfunkce b-buněk je způsobena jednak snížením jejich absolutního počtu, jednak jejich poškozením dlouhodobě přetrvávající hyperglykémií (glukotoxicita) a zvýšenou hladinou volných mastných kyselin (lipotoxicita). Svoji roli hraje také vyčerpání b-buněk z kontinuální hyperinzulinémie a depozice amyloidu do ostrůvků. Snížení počtu b-buněk je pravděpodobně následkem dysbalance v regulaci jejich replikace/neogeneze a apoptózy. Rovnováhu těchto dějů zajišťují růstové faktory, cytokiny a hormony, včetně rodiny inkretinových hormonů. Předpokládá se, že pokud budou identifikovány faktory mající proproliferativní a antiapoptotický efekt na b-buňky, mohlo by jejich použití vést k normalizaci dysfunkce b-buněk, a zvrátit tak nepříznivý vývoj diabetu [3].
Inkretinové hormony
Inkretinové hormony a peptidy uvolňované z gastrointestinálního traktu odpovídají na požití potravy a pomáhají dosažení glukózové homeostázy. Účinek inkretinů byl zaznamenán po pozorování, že enterální podání glukózy způsobí rychlejší uvolnění inzulinu než odpovídající množství glukózy podané intravenózně.
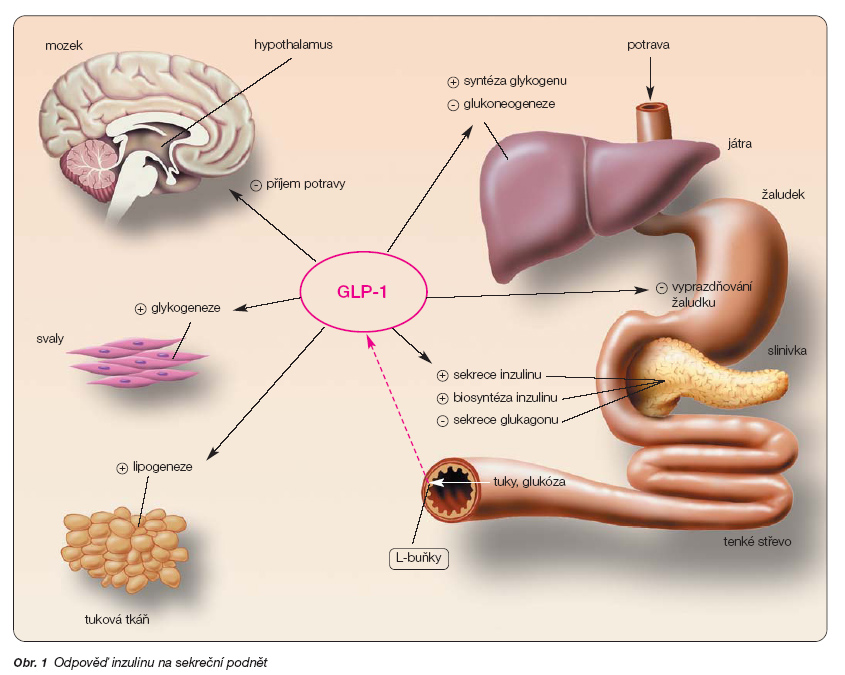
Hlavními inkretinovými hormony jsou glukagon-like peptid-1 (GLP-1) a glukózo-dependentní inzulinotropní polypeptid (GIP). GLP-1 a GIP jsou malé peptidy obsahující 30 a 42 aminokyselin. GLP-1 je peptid odštěpený z proglukagonu a secernovaný střevními L-buňkami po požití sacharidů a tuků. Jeho účinek je zprostředkován receptorem GLP-1, který je exprimován na pankreatických ostrůvcích, v žaludku, plicích a nervové tkáni. Nejdůležitějším fyziologickým účinkem GLP-1 je regulace postprandiální glukózové homeostázy, ke které GLP-1 přispívá několika mechanismy (obr. 1) [4, 12, 14]:
– ‑zřejmě hlavním účinkem GLP-1 je stimulace uvolnění inzulinu po příjmu potravy (působí jen minimálně nalačno, k manifestaci účinku je nezbytná elevace glykémie). Za normálních okolností však nezpůsobuje hypoglykémii;
– ‑‑GLP-1 stimuluje nejen sekreci inzulinu, ale také jeho biosyntézu;
– ‑stimuluje transkripci genů pro glukokinázu a glukózové transportéry GLUT2;
– ‑‑GLP-1 inhibuje rovněž sekreci glukagonu z a-buněk pankreatických ostrůvků. Zdá se, že kontroluje sekreci glukagonu ve stavu nalačno – vede tedy také ke zlepšení lačné glykémie;
– ‑‑dalším účinkem, který zlepšuje kontrolu glykémie, je zpomalení vyprazdňování žaludku. Tento efekt je zprostředkován vagovými aferentními nervy. Prodloužená doba vyprazdňování žaludku vede u pacientů s DM2, ale také i u pacientů s diabetes mellitus 1. typu (DM1) k oploštění glykemické odpovědi. Pozorování, že GLP-1 zlepšuje glykemickou kontrolu i u pacientů bez endogenní sekrece inzulinu, vede k názoru, že spektrum fyziologických účinků GLP-1 na jiných místech než na pankreatických b-buňkách hraje důležitou úlohu v regulaci glykémie;
– ‑‑GLP-1 je aktivní rovněž v mozku a vede k urychlení pocitu sytosti a následnému snížení příjmu potravy;
– ‑mnohé studie rovněž podporují důležitou funkci tohoto hormonu v regulaci množství b-buněk, aktivace GLP-1-receptoru přímo stimuluje jejich replikaci a neogenezi.
Ústřední úloha GLP-1 v glukózové homeostáze vede k otázce, zda není pravděpodobná také jeho účast v patogenezi diabetes mellitus 2. typu [10].
Inkretin-mimetika
Široká škála navzájem souvisejících účinků, kterými GLP-1 ovlivňuje homeostázu glukózy, spustila novou vlnu vývoje léků směřujících k tomuto peptidu.
Použití nativního GLP-1 k léčbě diabetických pacientů je limitováno. Peptid není možné užívat perorálně, navíc je rychle inaktivován enzymem dipeptidylpeptidázou IV (DPP-IV) [1], a má proto velmi krátký poločas v cirkulaci (cca 1,5 min.). Z tohoto důvodu byly vyvinuty molekuly stimulující GLP-1-receptor, ale mající kvůli změně molekuly delší biologický poločas nebo nepodléhající inaktivaci DPP-IV. Jedná se o peptidová analoga GLP-1.
Exenatid
Exenatid je biosyntetická podoba exendinu-4, peptidu sestávajícího z 39 aminokyselin, který byl poprvé izolován ze slin ještěrky Heloderma suspectum žijící na jihozápadě USA. Tyto ještěrky přijímají potravu jen 4x ročně a v mezidobí jsou schopné „vypnout" slinivku a zastavit sekreci inzulinu. Nastane-li čas k příjmu potravy, inkretiny „zapnou" slinivku a obnoví inzulinovou sekreci. Vědci zkoumající tento úkaz vyslovili domněnku, že jeho znalost by mohla být prospěšná pro pacienty s DM2 [7].
Exenatid je polypeptidový hormon se sekvencí homologní k lidskému GLP-1, ale nepodléhající rychlé degradaci DPP-IV. Z tohoto důvodu má exenatid prodloužený biologický poločas zhruba na 4 hodiny a vysokou afinitu vazby k receptoru GLP-1.
Mechanismus účinku
Zlepšuje glykemickou kontrolu několika mechanismy:
– ‑zvyšuje glukózo-dependentní sekreci inzulinu z pankreatických b-buněk;
– ‑restauruje časnou fázi inzulinové sekrece;
– ‑suprimuje sekreci glukagonu z pankreatických a-buněk za podmínek hyperglykémie, což vede k redukci výdeje glukózy z jater;
– snižuje následný příjem potravy;
– zpomaluje vyprazdňování žaludku [8].
Exenatid obdržel v dubnu 2005 v USA schválení FDA pro užití v léčbě pacientů s DM2 v kombinaci s metforminem a/nebo sulfonylureovými preparáty [13]. Je aplikován 2x denně injekčně, rychle se vstřebává a aktivně se váže na receptor GLP-1. Zlepšuje glykemickou kontrolu a vede k mírnému poklesu hmotnosti (pravděpodobně jako následek rychleji nastupujícího pocitu sytosti). Exenatid pravděpodobně nezpůsobuje hypoglykémie, pokud není podáván v kombinaci se sekretagogy inzulinu.
Dávkování a skladování
Preparát je k dispozici v předplněných „perech" pro 30denní léčbu (5 nebo 10 mg). Podává se 1 hodinu před ranním a večerním jídlem. Neměl by být podáván až po jídle. Startovací dávka je 5 mg 2x denně, po 1 měsíci je možno dávku zvýšit na 10 mg 2x denně podle hladiny glykémií a tolerance preparátu. Doporučená dávka je fixní pro všechny pacienty a nemění se ani s velikostí jídla a fyzickou aktivitou. Přípravek by měl být skladován v chladničce obdobně jako inzulin (při teplotě 2–8 °C), neměl by zmrznout.
Kontraindikace
Exenatid není náhradou inzulinu u pacientů, kteří léčbu inzulinem potřebují. Neměl by být také podáván pacientům s DM 1. typu (k plnému účinku exenatidu jsou zapotřebí funkční b-buňky), pacientům s terminálním postižením ledvin a s těžkými gastrointestinálními chorobami.
Nežádoucí účinky
Při současném užívání sulfonylureových preparátů je zvýšené riziko hypoglykémie. Jinak byly pozorovány bolesti hlavy, závratě, lehké gastrointestinální příznaky (nauzea, zvracení, průjem, dyspepsie).
Lékové interakce
Zpomalené vyprazdňování žaludku může redukovat absorpci léků podávaných perorálně (zejména těch, jejichž účinek závisí na dosažené koncentraci, tj. hlavně antibiotik a kontraceptiv). Z tohoto důvodu by takové léky měly být podávány nejpozději 1 hodinu před aplikací exenatidu.
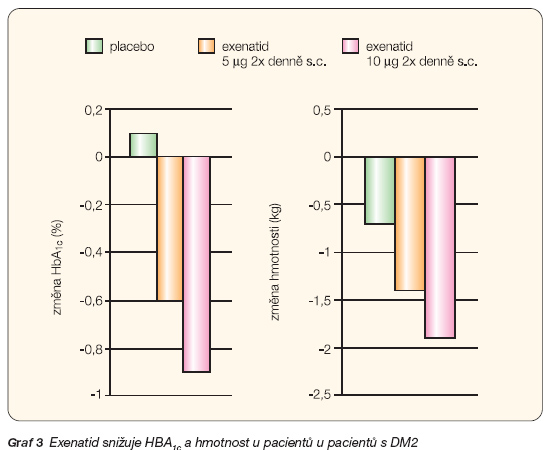
Účinek exenatidu byl ověřen v řadě studií. V sérii 3 studií (randomizovaných dvojitě slepých, placebem kontrolovaných) byl exenatid přidán k léčbě sulfonylureovým preparátem, metforminem a oběma dohromady – v každé studii bylo zhruba 480 obézních pacientů s kratší dobou (6–8 let) trvání DM2. Ve všech 3 skupinách došlo k signifikantnímu snížení hodnoty glykovaného hemoglobinu HbA1c průměrně o 0,9 %. Došlo rovněž ke snížení hmotnosti průměrně o 1,9 kg oproti placebové větvi – nejvíce zřetelný pokles váhy byl ve studii, kdy byl exenatid přidán pacientům s monoterapií metforminem (graf 3) [2, 5, 7, 11].
Liraglutid
Liraglutid je GLP-1 vázaný kovalentní vazbou na mastnou kyselinu. Tato modifikace umožňuje navázání celé molekuly na sérový albumin, což má za následek blokádu štěpení pomocí DPP-IV, prodloužení absorpce z místa aplikace a redukci vylučování ledvinami, takže biologický poločas molekuly je 12 hodin. Jednotlivá denní dávka pokryje tedy biologicky aktivní množství GLP-1 na 24 hodin. U pacientů s DM2 jedna denní aplikace liraglutidu před spaním signifikantně snižuje hodnoty glykémie přes noc, vydatně zmenšuje glykemické výkyvy v době jídla a zvyšuje jídlem stimulovanou sekreci inzulinu. Byla též pozorována suprese jídlem stimulované sekrece glukagonu a prodloužení vyprazdňování žaludku. Ale stejně jako při použití nativního GLP-1 nebo exendinu-4 byla při použití liraglutidu jako vedlejší nežádoucí účinek pozorována nauzea a zvracení. Liraglutid je podáván 1x denně injekčně, probíhají klinické studie 3. fáze [13].
CJC-1131
CJC-1131 je syntetický analog GLP-1 s prodlouženým biologickým poločasem až na 10 dnů.
Inhibitory dipeptidylpeptidázy IV
Alternativou pro zvýšení účinku endogenně secernovaného GLP-1 je blokování jeho degradace. Proto jsou vyvíjeny inhibitory dipeptidylpeptidázy IV (DPP-IV), enzymu štěpícího GLP-1 v cirkulaci. Tyto látky mají výhodu perorálního podání a mají jen minimální nežádoucí gastrointestinální účinky. Teoretickým problémem inhibice DPP-IV je široké pole účinnosti tohoto enzymu – metabolizuje totiž celou řadu dalších regulačních peptidů. Inhibitory DPP-IV byly použity v několika klinických studiích u diabetických pacientů. Zvýšením funkčnosti endogenních inkretinových hormonů jsou inhibitory DPP-IV schopny snížit postprandiální glykémii, zvýšit masu b-buněk podpořením jejich přežívání, proliferace a neogeneze, urychlit dosažení pocitu sytosti (čímž se sníží následný příjem potravy) a s příjmem potravy bezprostředně související snížení tělesné hmotnosti [1, 9].
Reprezentanty této skupiny jsou sitagliptin (MK-0431) a vildagliptin (LAF-237), které nyní podstupují 2. fázi testování.
Postavení inkretin-mimetik v léčbě diabetes mellitus 2. typu
U pacientů léčených metforminem a glitazony jsou menší postprandiální výkyvy glykémie dosaženy sníženým výdejem glukózy z jater a snížením periferní inzulinové rezistence, nedochází však k obnovení časné fáze sekrece inzulinu.
Inzulinová sekretagoga zlepšují, ale nenormalizují časnou fázi sekrece inzulinu. Sulfonylureové preparáty zvyšují časnou i pozdní fázi sekrece inzulinu, zvýšený výdej inzulinu pak vede ke zlepšení, ale ne k normalizaci glukózové tolerance. Účinek novějších inzulinových sekretagog repaglinidu a nateglinidu na časnou fázi sekrece je mnohem brisknější a kratší než účinek sulfonylureových preparátů, vede ke zlepšení postprandiální kontroly glykémie a má menší vliv na pozdní fázi sekrece inzulinu.
Exenatid a liraglutid výrazně zmenšují postprandiální výkyvy glykémie. Unikátní (v kontrastu s ostatní antidiabetickou medikací, která vede spíše k přibývání na váze) je efekt exenatidu na ztrátu hmotnosti, která se zdá být progresivní po celou dobu léčby (studie prokázala 2 roky trvající stálý pokles hmotnosti).
DM 2. typu je charakterizován chronickou hyperglykémií jak lačnou, tak i postprandiální. Způsoby léčby, které ovlivňují především lačnou glykémii (jako metformin, thiazolidindiony a bazální inzulin) a způsoby ovlivňující především postprandiální glykémii (acarbosa, inzulinová sekretagoga, krátký inzulin a jeho analoga, nově tuto skupinu doplňují také inkretin-mimetika), jsou nástroji k optimální kontrole glykémie. Inkretin-mimetika zasahující na více hladinách regulace glykémie jsou kvalitativně novou složkou v antidiabetické medikaci. Budou velmi užitečnými preparáty v léčbě diabetes mellitus 2. typu, umožní zlepšit metabolickou kompenzaci a vést k redukci nadváhy. Tím budou pomáhat pacientům dosáhnout cílů, které pro ně byly ještě nedávno obtížně uskutečnitelné [6].
Seznam použité literatury
- [1] Ahren B, Simonsson E, et al. Inhibition of dipeptidyl peptidase IV improves metabolic control over a 4-week study period in type 2 diabetes. Diab Car 2002; 25: 869–875.
- [2] Buse JB, Henry RR, Han J, et al. Effects of exenatide on glycemic control and weight over 30 weeks in sulfonylurea treated patients with type 2 diabetes. Diab Car 2004; 27: 2628–2635.
- [3] Cavaghan MK. The Beta Cell and First-Phase Inzulin Secretion. Med Diab Endocrinol 2004; 6: http: //www.medscape.com/viewarticle/483307
- [4] D´Alessio DA, Vahl TP. Glucagon-like peptide 1: Evolution of an incretin to model therapeutic for diabetes. Am J Physiol Endocrinol Metab 2004; 286: E882–E890.
- [5] DeFronzo RA, Ratner RE, Han K, et al. Effects of exenatide on glycemic control and weight over 30 weeks in metformin treated patients with type 2 diabetes. Diabetes Care 2005; 28: 1092–1100.
- [6] Kendall DM. Postprandial Blood Glucose in the Management of Type 2 Diabetes: The Emerging Role of Incretin Mimetics. Med Diab Endocrinol 2005; 7: http://www.medscape.com/viewarticle/515693
- [7] Kendall DM, Riddle MC, Rosenstock J, et al. Effects of exenatide on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea. Diab Car 2005; 28: 1083–1091.
- [8] Kruger DF. Exenatide: A Novel Therapy for the Treatment od Type 2 Diabetes. Med Diab Endo-crinol 2005; 7: http: //www.medscape.com/viewarticle/511270
- [9] Lankas GR, Leiting B, et al. Dipeptidyl Peptidase IV Inhibition for the treatment of Type 2 Diabetes. Diab 2005; 54: 2988–2994.
- [10] Nauck MA, Baller B, Meier JJ. Gastric inhibitory polypeptide and glucagon-like peptide 1 in the pathogenesis of type 2 diabetes. Diab 2004; 53 (suppl.3): S190–196.
- [11] Peters A. Incretin Mimetics: Clinical Use in Combination Therapy. Med Diab Endocrinol 2005; 7: http: //www.medscape.com/viewarticle/519727
- [12] Prigeon RL, Quddusi S, Paty B, D´Alessio DA. Suppression of glucose production by GLP1 independent of islet hormones: a novel extrapancreatic effect. Am J Physiol Endocrinol Metab 2003; 285: E701– E70.
- [13] Ratner RE. Therapeutic Role of Incretin Mimetics. Med Diab Endocrinol 2005; 7: http://www.medscape.com/viewarticle/506476
- [14] Vahl TP, D´Alessio, DA. Gut peptides in the treatment of diabetes mellitus. Expert Opin Investig Drug 2004; 13: 177–188.