Inzulinová analoga
V roce 2006 je tomu 85 let, co byl objeven inzulin. Když v létě roku 1921 publikoval rumunský badatel působící v Paříži Nicolae Paulescu první zkušenosti s látkou, která zachránila psa po pankreatektomii před neodvratnou smrtí, nikdo nepomyslel, že se schyluje k epochálnímu objevu inzulinu. V té době ortoped Frederic Banting se studentem Charlesem Bestem zaznamenávali v torontském fyziologickém ústavu výdej cukru močí u psů, jimž nejdříve odebrali slinivku a pak jim zpětně podávali její extrakt. Zvířata přežila, neboť dostala inzulin. O několik měsíců později, v lednu 1922, byl zachráněn první diabetik, čtrnáctiletý Thompson – dostal inzulin. Žil pak dalších 35 let.
Poté následovalo nejdříve období opakovaného podávání krátce působícího inzulinu, než se podařilo připravit kolem roku 1930 první preparáty inzulinu s prodlouženým účinkem (protamin Zn inzulin). Inzulin se začal podávat už ne čtyřikrát denně, ale jen dvakrát, nebo později dokonce jednou denně. Od padesátých let dvacátého století se používá tzv. NPH inzulin (neutral protamin Hagedorn). Podle délky účinku vzniklo několik preparátů, později i mixované inzuliny. Postupné vylepšování technologie vedlo k získávání stále čistšího inzulinu z vepřových a hovězích slinivek. Preparáty byly zbaveny balastních látek, které alergizovaly nebo se významně podílely na lipoatrofických změnách v podkoží. Monokomponentní inzuliny zvířecího, ponejvíce vepřového původu tak znamenaly v sedmdesátých letech další pokrok v léčbě diabetu.
To je však zároveň doba, kdy se opakovaně začalo dokladovat, že přes všechen technický pokrok s čistými preparáty inzulinu není léčba dostatečná. První studie ukázaly, že zvýšený výskyt cévních komplikací, které byly do té doby považovány za nezbytný průvodní jev u dlouhodobě žijících diabetiků, je podmíněn nedostatečnou kompenzací diabetu. Bylo to zejména u pacientů, kteří si aplikovali inzulin jednou nebo dvakrát denně. Poznatky z fyziologie syntézy a sekrece inzulinu včetně regulačních mechanismů ukázaly, že taková léčba je zcela nefyziologická, a nemůže tudíž dovést diabetika k normálním hodnotám glykémie. Intenzivní léčba inzulinem, která podmínila lepší dlouhodobou kompenzaci diabetu, přinesla nižší výskyt pozdních komplikací jak u diabetiků 1. typu (studie DCCT), tak u diabetiků 2. typu (studie UKPDS či Kumamoto), jak dokládaly výsledky v devadesátých letech.
To se však již běžně používal lidský inzulin vyráběný biotechnologií pomocí Escherichia coli nebo kvasinek. Dlouhodobé výsledky však jednoznačně spočívaly v kompenzaci diabetu, nikoli v původu inzulinu. Léčba inzulinovou pumpou, která se zaváděla od druhé poloviny sedmdesátých let, byla dalším důkazem, že výborná kompenzace může oddálit rozvoj angiopatie, nebo dokonce zamezit jejímu předčasnému vzniku u některých pacientů.
Porozumění bazální a prandiální sekreci, a zejména pak odhalení několika typů pulsní sekrece inzulinu podmínily další kroky ke zdokonalování léčby. Je proto pochopitelné, že krátce působící inzulin nahradil chybějící prandiální sekreci, tedy reakci endogenního inzulinu na příjem jídla, kdežto bazální sekrece mohla být léčebně napodobena podáním dlouhodobě působícího inzulinu. Tato intenzivní léčba diabetu, při níž se aplikovaly jednotlivé dávky menší než při použití tzv. konvenční léčby s jednou až dvěma dávkami déle působícího inzulinu, vedla k dosahování lepší dlouhodobé kompenzace. Snižování průměrné hodnoty glykémie však bylo provázeno častějším výskytem hypoglykémií (ve studii DCCT asi třikrát častěji než při konvenční léčbě).
Léčba humánními inzuliny vyvolává zejména při použití vyšších dávek dlouhodobou hyper-inzulinémii, která ovlivňuje i samotné působení inzulinu v cílové tkáni. Také krátce působící humánní inzulin, jehož účinek přetrvává až 6 hodin po aplikaci, působí v porovnání s fyziologicky uvolněným inzulinem v rámci prandiální sekrece příliš dlouze. To se pak může podílet na vzniku hypoglykémie. Navíc i nástup jeho účinku není bezprostřední, ale postupně narůstá, neboť jednotlivá molekula se musí uvolnit z hexamerního uspořádání v místě podkožního depa.
Inzuliny s prodlouženým působením podmiňují kolísání hladiny inzulinu v séru s postupným nárůstem po aplikaci, následně pak s vrcholem a konečně s poklesem hladiny. Fyziologicky nízké interprandiální hladiny inzulinu není při léčbě humánními inzuliny dosaženo.
Zavedení inzulinových analog
Poznatky získané z mnohaletých výsledků léčby inzulinem ukázaly, že využití humánních inzulinů, přestože vychází z nejmodernějších poznatků o mechanismech a účincích tohoto hormonu, nevede k požadovaným výsledkům. Nedaří se dosáhnout dlouhodobé výborné kompenzace diabetu, opakovaně se vyskytují hypoglykémie vedoucí k rozkolísání (destabilizaci) glykemického profilu, farmakokinetika i farmakodynamika podávaných preparátů se liší od tělu vlastního inzulinu, podání krátce působícího inzulinu nemusí zabránit postprandiálnímu vzestupu glykémie, dlouhodobě působící inzuliny nevytvářejí vyrovnanou hladinu. Již v osmdesátých letech byla proto řada důvodů, aby se začalo pracovat na obměnách molekuly inzulinu, která by poskytla nové vlastnosti a umožnila odstranit některé z výše uvedených nevýhod.
Obecný princip analog spočívá vesměs v záměně aminokyseliny v primární struktuře inzulinu podmíněné bodovou mutací inzulinového genu, která vede k uplatnění nových vlastností. Modifikovanou molekulu inzulinu lze připravit biotechnologicky.
Inzulin působí prostřednictvím receptorů a spouští dvě signalizační kaskády nitrobuněčných dějů. Jedna významně ovlivňuje metabolické děje a současně transport glukózy (aktivací fosfatidylinositol-3-kinázy), druhá přes mitogenem aktivovanou proteinkinázu má růstové a mitogenní účinky. Zatímco první kaskáda usměrňuje metabolismus, v němž inzulin vykazuje unikátní efekty v porovnání s několika kontraregulačními hormony, jako je glukagon, katecholaminy, kortizol či růstový hormon, druhá kaskáda se může projevovat zvýšenou proliferační aktivitou stimulující i neoplastické procesy. Může to být podmíněno vazbou inzulinového analoga s inzulinovým receptorem a rychlostí jeho disociace, ale i aktivací receptoru pro IGF-1 (insulin-like growth factor-1), na nějž se může analog inzulinu zvýšeně vázat.
Není proto překvapením, že některé z prvních derivátů inzulinu jako inzulin Asp(B10) vedly ke zpomalené disociaci z inzulinového receptoru, prodloužené defosforylaci substrátů a ke zvýšené mitogenní aktivitě, na níž se zřejmě podílela i jeho zvýšená afinita k receptoru pro IGF-1 [1]. U tohoto analoga byla popsána zvýšená tvorba tumorů prsní žlázy u potkanů [2].
V současné době se však předpokládá, že zvýšená mitogenní aktivita určitého inzulinového analoga je podmíněna více jeho přímým efektem na inzulinový receptor než vazbou na receptor pro IGF-1 [3]. Každý nově zaváděný analog inzulinu musí být proto podrobně testován z hlediska vazby na inzulinový receptor a aktivace postreceptorových dějů. Teprve nepřítomnost negativních účinků podmíněných především změněnou mitogenní potencí může vést k jeho dalšímu klinickému zkoušení.
Nedávno byla publikována přehledná sdělení zabývající se inzulinovými analogy, která shrnula dosavadní poznatky i klinické využití těchto látek [4, 5] včetně publikace v naší literatuře týkající se rychle působících analog [6].
Rychle působící analoga
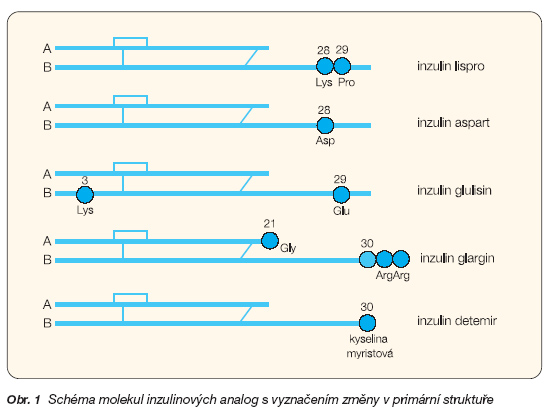
Farmakokinetické a farmakodynamické účinky rychle působícího humánního inzulinu, způsobující jednak opožděný nárůst plazmatické koncentrace a tím i zpožděný nástup účinku, jednak několik hodin přetrvávající účinek a konečně i výskyt hypoglykémií, vedly k hledání analoga, které by tyto vlastnosti nemělo. V současné době se vyskytují pro klinické použití tři analoga, inzulin lispro, insulin aspart a nejmladší inzulin glulisin. Schéma jejich primární struktury viz obr. 1.
U nejdéle používaného inzulinu lispro je v molekule provedena záměna pořadí aminokyselin prolinu a lysinu na pozicích B28 a B29, v inzulinu aspart je nahrazen prolin v poloze B28 kyselinou asparagovou, kdežto v inzulinu glulisinu jsou umístěny lysin v poloze B3 a kyselina glutamová v poloze B29. Dosud jsou větší klinické zkušenosti s prvními dvěma. Vyznačují se rychlým nástupem účinku, dosažením vrcholu, který má téměř dvojnásobnou koncentraci, a to za poloviční čas v porovnání s rychlým humánním inzulinem [7, 8]. Rychlý nástup účinku je způsoben vstřebáním monomeru analoga, které nepodléhá polymeraci na hexamery. To je způsobeno změnou aminokyseliny v poloze B28/B29, na níž je tvorba hexamerů závislá.
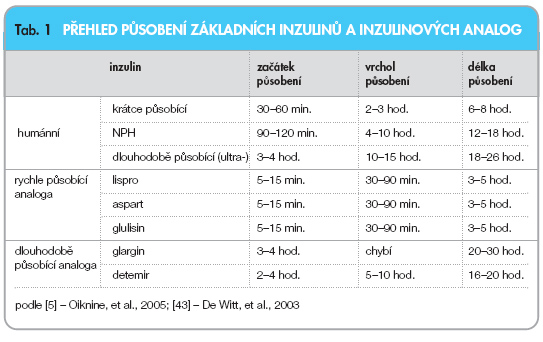
Přehled působení základních inzulinů a inzulinových analog je uveden v tab. 1.
Mezi rychle působícími analogy byly shledány zcela nepatrné rozdíly, které se zřejmě promítají do klinické praxe jen minimálně. Inzulin glulisin způsobuje přednostní aktivaci substrátu inzulinového receptoru-2 (IRS-2), který ovlivňuje růstové vlastnosti b-buňky, a mohl by tudíž působit antiapoptoticky [9, 10]. Jeho klinický význam bude teprve zhodnocen na základě dlouhodobých zkušeností.
Při hodnocení mitogenních účinků byla posuzována vazba k IGF-1 receptoru u rychlých analog. Inzulin lispro má asi 1,5krát vyšší vazbu než humánní inzulin, kdežto u aspartu i glulisinu byla tato vazba srovnatelná s humánním inzulinem a podobně i mitogenní potenciál, který je u glulisinu dokonce nižší než u humánního inzulinu [3, 5].
Z délky působení rychlých analog vyplývají některá opatření potřebná pro náhradu rychlého humánního inzulinu analogem. Je třeba respektovat, že délka působení analoga je asi poloviční, a tedy po třech hodinách od aplikace jeho účinek mizí, na rozdíl od šestihodinového působení rychlého humánního inzulinu. Vzniklá „mezera" musí být kryta bazálním inzulinem u pacientů s inzulinovým deficitem, někdy to může vyžadovat dokonce i další dávku (např. v poledne) NPH inzulinu. Účinnost analoga i uvedený efekt podmiňuje, že poměr celkové denní dávky analoga k NPH inzulinu je menší než poměr celkové dávky rychlého humánního inzulinu k NPH inzulinu. Pro praxi ze zmíněného vyplývá, že analog by měl tvořit asi 40 % celkové denní dávky inzulinu (na rozdíl od obvyklých cca 50–60 % rychlého humánního inzulinu) a v případě vzestupu glykémií pozdě odpoledne je třeba uvážit i malou dávku NPH inzulinu v poledne. Přechod z humánního inzulinu na analog proto obvykle podmiňuje úpravu dávkování prandiálního i bazálního inzulinu.
U diabetiků 1. typu byl pozorován snížený výskyt postprandiálních hyperglykémií, kdežto celková kompenzace zůstala u pacientů při kombinaci rychlého analoga s NPH inzulinem většinou nezměněna [11–13]. Pokud se podaří zlepšit i působení bazálního inzulinu, lze očekávat zlepšení hodnot glykovaného hemoglobinu [14]. Naproti tomu u diabetiků léčených inzulinovou pumpou vede použití inzulinového analoga k lepší kompenzaci než při podávání humánního inzulinu [15]. Je však třeba pamatovat, že porucha pumpy s přerušením dodávky inzulinu lispro nebo aspart vede k rychlejšímu rozvoji ketoacidózy než při použití krátce působícího lidského inzulinu [16]. Správné dávkování krátce působícího analoga redukuje výskyt postprandiálních hypoglykémií, jak ukázala metaanalýza několika studií [17]. Samozřejmě rozvoj hypoglykémie závisí i na fyzické aktivitě, která, začne-li brzy po jídle, může hypoglykémii vyvolat mnohem snadněji než aktivita za 4–5 hodin po jídle u diabetika aplikujícího rychlý analog inzulinu.
U diabetiků 2. typu je podání krátce působícího analoga zdůvodněno především potřebou snížit dlouhodobě hyper-inzulinémii, k níž může poměrně snadno docházet při použití zejména NPH inzulinů. U pacientů s inzulinovou rezistencí je dlouhodobá expozice hyper-inzulinémii nežádoucí, a proto krátce působící analog inzulinu může nahradit časnou fázi sekrece inzulinu, která je u těchto pacientů pravidelně postižena.
Ačkoli se předpokládalo, že nižší antigenita rychle působících analog vyvolá nižší alergii, než byla pozorována po humánních inzulinech, popsané případy nasvědčují tomu, že analoga nejsou lékem volby při alergiích [18].
Rychle působící inzulinová analoga se používají i ve fixních poměrech s NPH inzulinem v premixovaných inzulinech označovaných též jako bifázické inzuliny. Zatím se používá inzulin lispro (25 %) s NPH (75 %) nebo inzulin aspart (30 %) s NPH (70 %). Tyto premixované inzuliny se využívají především u diabetiků 2. typu, u nichž byl pak pozorován pokles výskytu jak postprandiálních hyperglykémií, tak hypoglykémií, kdežto hodnoty glykovaného hemoglobinu podstatně ovlivněny nebyly [19–21]. Tato léčba byla shledána bezpečnou a nejméně stejně účinnou jako léčba humánními mixovanými preparáty. Může být proto vhodnou indikací zejména u starších diabetiků.
Konečně je třeba uvést informaci o možném „kumulativním efektu inzulinu", který se vztahuje i na analoga. Tento jev je podmíněn dozníváním účinku aplikované dávky inzulinu v postprandiálním období, kdy si diabetik může aplikovat další malou dávku interprandiálně pro přetrvávající zvýšenou glykémii. Pak může dojít k zesílení doznívajícího efektu předchozí dávky a možnosti vzniku hypoglykémie. Právě u krátkých analog, jejichž normální působení je kratší než u humánních inzulinů, může vést aplikace další dávky např. v odpoledních hodinách k hypoglykémii před večeří.
Dlouze působící analoga
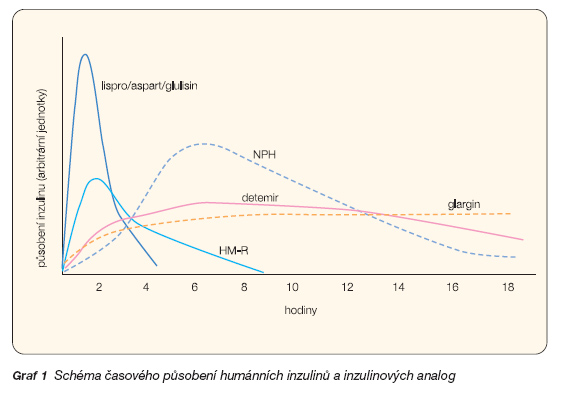
Vedle ovlivnění prandiálních exkurzí glykémií zůstal při terapii klasickými humánními inzuliny další problém, totiž zajištění bazální inzulinémie, která by se blížila fyziologickému stavu. Humánní NPH inzuliny i ultradlouze působící inzuliny jsou totiž „vrcholové", což znamená, že postupně narůstá jejich účinek a po dosažení vrcholu jejich účinnost v udržení glykémie slábne. Vrcholu je dosaženo obvykle po 5–6 hodinách, kdežto po 12 hodinách může být jejich efekt poměrně malý (graf 1). Zejména v situacích, kdy se uplatňuje „dawn fenomén", přináší použití NPH inzulinu problémy, neboť se nedaří dosáhnout ráno nalačno uspokojivé nebo dokonce normální glykémie. Ani dvě dávky NPH inzulinu neřeší tuto situaci, a navíc je třeba zvažovat důsledky kombinace inzulinů v průběhu dne.
Tato skutečnost podmínila i výzkum dlouhodobě působících analog inzulinu. V současné době jsou k dispozici inzulin glargin a inzulin detemir. V prvním případě se jedná o inzulin s náhradou asparaginu glycinem v pozici A21 a přidání dvou molekul argininu na konci molekuly v poloze B30 (obr. 1). Tato úprava způsobuje, že se původně čirý roztok inzulinu glarginu s pH 4,0 po aplikaci do podkoží stává méně rozpustným a ze vzniklého precipitátu se pak inzulin uvolňuje pomalu. Inzulin glargin se proto aplikuje samostatně a nemíchá se s ostatními inzuliny, což by změnilo farmakokinetiku obou inzulinů. Je třeba pamatovat, že otevřená ampule s glarginem by se měla používat jen 4 týdny, kdežto neotevřená vydrží bez problémů podle vyznačené exspirace. Dodržováním tohoto doporučení se může předejít neočekávanému snížení účinku glarginu a tím i nevysvětlitelnému rozkolísání glykémií [22, 23]. Účinek glarginu je vyrovnaný, inzulin je označován jako bezvrcholový a jeho farmakokinetika se tudíž liší od NPH inzulinu [24]. Po opakovaném podání jednou denně nebyla pozorována kumulace, přestože jeho účinek trvá až 30 hodin [25]. Má poměrně silnou afinitu k inzulinovým receptorům a k receptorům pro IGF-1, více než 6krát větší než humánní inzulin [26].
Druhým analogem je inzulin detemir, který má v molekule nahrazen threonin v poloze B30 kyselinou myristovou (obr. 1) a z toho byl odvozen i jeho název [27]. Kyselina myristová podmiňuje reverzibilní vazbu s albuminem, který zpomaluje účinek tohoto inzulinu. Po aplikaci detemiru dochází k pomalejšímu uvolňování molekul z hexamerů do oběhu v porovnání s NPH inzulinem. Biologický poločas je prodloužen asi o 40 % v porovnání s NPH inzulinem. V oběhu se detemir váže na albumin, a tím dochází k prodloužení jeho působení, které přetrvává až 20 hodin, což je kratší doba než u glarginu. Proto se doporučuje aplikovat detemir dvakrát denně. Detemir má zřetelně nižší intraindividuální variabilitu plazmatických koncentrací než NPH inzulin nebo glargin. Naproti tomu jeho vazba s inzulinovými receptory je slabší (až čtyřikrát) v porovnání s NPH inzulinem a též je slabší i jeho hypoglykemizující efekt [28]. Jeho afinita k receptorům pro IGF-1 je asi 5krát nižší než u NPH inzulinu [26].
Studie provedené u diabetiků 1. typu ukázaly, že použití glarginu vede ke sníženému výskytu zejména nočních hypoglykémií, a to při podání tohoto inzulinu před večeří i před spaním [29]. Současně byl pozorován pokles koncentrace glykovaného hemoglobinu v porovnání s léčbou používající NPH inzulin. Naproti tomu jiné studie zlepšení kompenzace diabetu nepopsaly, ale frekvence hypoglykémií byla při podávání glarginu nižší [30, 31]. Podobně byl popsán nižší výskyt nočních hypoglykémií po inzulinu glarginu v porovnání s NPH inzulinem u diabetiků 2. typu [32]. Přesto se mohou noční hypoglykémie vyskytovat, i když je inzulin glargin podáván před spaním. V tom případě je vhodné zkusit aplikovat glargin ráno, kdy se hypoglykémie vyskytují vzácněji [33]. Ráno podávaný inzulin glargin vedl u diabetiků 2. typu k většímu poklesu glykovaného hemoglobinu než při aplikaci před spaním [34]. Vzhledem k poklesu účinku glarginu pozorovanému u některých pacientů již po 15 hodinách je zapotřebí podávat glargin i dvakrát denně [35]. Z praktického hlediska je vhodné uvést, že při převodu NPH inzulinu aplikovaného ve dvou dávkách denně na inzulin glargin se doporučuje použít při zahájení dávku glarginu asi o 20 % nižší, než je součet obou dávek NPH inzulinu, a v následujících dnech pak dávkování postupně upravit. Také po podání glarginu se může vyskytnout alergie [36].
Kombinace inzulinu lispro s inzulinem glarginem aplikovaná inzulinovými pery vedla u diabetiků 1. typu ke srovnatelné kompenzaci diabetu jako při použití inzulinové pumpy [37]. Inzulinová pumpa však přesto podmiňuje menší amplitudy glykémií a nižší spotřebu inzulinu [38, 39].
Také podávání detemiru u diabetiků 1. typu vedlo k poklesu výskytu nočních hypoglykémií a menšímu vlivu na hmotnost pacienta ve srovnání s NPH inzulinem [39, 40]. Determir byl na rozdíl od glarginu aplikován dvakrát denně. Kombinace detemiru s inzulinem aspart vedla k lepší kompenzaci diabetu, nižšímu výskytu hypoglykémií a menšímu hmotnostnímu přírůstku než použití kombinace klasických humánních inzulinů (krátce působícího a NPH inzulinu) [41].Tento neutrální efekt inzulinového analoga na hmotnost může být vítanou vlastností pro mnoho diabetiků [42].
Inzulinová analoga u dětí a v těhotenství
Při použití inzulinových analog v dětství a v těhotenství je vždy zapotřebí zhodnotit nejen jejich pozitivní přínos v léčbě diabetu, ale i případné nežádoucí účinky vyplývající ze zvýšeného mitogenního potenciálu analoga.
Studie u dětí nejsou zatím tak četné jako u dospělých diabetiků. Podání rychle působícího inzulinu lispro nebo aspart poskytuje u dětí podobné výhody jako u dospělých a jejich využití je tudíž perspektivní [44, 45]. Studie ukázaly, že podání rychlého analoga po jídle je stejně účinné jako podání před jídlem. To může být významné zejména u diabetiků s gastroparézou, u nichž právě aplikace analoga po jídle vychází z množství konzumované potravy.
Také inzulin glargin byl podáván dětským diabetikům, u nichž snížil výskyt těžších hypoglykemických příhod v porovnání s NPH inzulinem, kdežto hodnoty glykovaného hemoglobinu se významněji nelišily [46]. V jiné studii bylo pozorováno též zlepšení kompenzace diabetu při léčbě glarginem [47]. Jiní autoři však poukazují na významně vyšší vazbu inzulinu glarginu na receptor pro IGF-1 a případně i vyšší mitogenní potenciál a doporučují přehodnotit použití tohoto analoga u dětí [48].
Použití inzulinu lispro v těhotenství ukázalo podobné výsledky jako u ostatních diabetiků. Nižší výskyt hypoglykémií a lepší kompenzace jsou jistě důležitými ukazateli v průběhu těhotenství u diabetiček [49, 50]. V současné době je inzulin lispro považován v těhotenství za bezpečný [51, 52]. Inzuliny aspart a glulisin zatím postrádají údaje o využití v těhotenství, ale dá se očekávat, že stanovisko u nich bude podobné.
Naproti tomu u inzulinu glarginu se zvažuje vyšší vazba na receptor IGF-1 a možnost zvýšeného mitogenního potenciálu, a proto se tento analog v těhotenství nedoporučuje [53].
Závěr
Inzulinová analoga v důsledku odlišných vlastností od humánních inzulinů přinášejí do léčby diabetu nové prvky. Je jimi možno v porovnání s humánními inzuliny více ovlivnit postprandiální hyperglykémii i hypoglykémii včetně frekvence hypoglykemických příhod, ale také kolísání dlouhodobé inzulinémie a tím i interprandiální glykémie. Vedle jednoznačně popisovaných výsledků dokládajících zlepšení různých parametrů se vyskytují studie vycházející z metaanalýz, jejichž stanovisko je více kritické [54–56]. Tyto analýzy svědčí spíše o vlivu na stabilitu glykémií než o ovlivnění kompenzace diabetu hodnocené koncentrací glykovaného hemoglobinu. Některé dokonce zpochybňují dlouhodobý benefit léčby analogy u diabetu 2. typu [55].
Při hodnocení efektu léčby inzulinovým analogem volené u konkrétního diabetika v klinické praxi je tudíž potřeba porovnat výsledky s předchozí léčbou, a to se zřetelem na výskyt hypoglykémií, nestability (rozkolísanosti) glykémií i hodnot glykovaného hemoglobinu. Tento rozbor pak umožní rozhodnout, nakolik je alternativní léčba analogem pro diabetika prospěšná. Správně vedená léčba vychází z farmakokinetických i farmakodynamických účinků použitého inzulinu. Jejich respektování spolu s posouzením individuálních terapeutických požadavků u diabetika pak může využít specifických vlastností zvolené léčby a dosáhnout pak zlepšení stavu pacienta.
Lze očekávat, že z dlouhodobých studií využívajících kombinace inzulinových analog vyplyne, nakolik je tato léčba přínosem pro další vývoj diabetu a jeho komplikací.
Seznam použité literatury
- [1] Hamel FG, Siford GL, Fawcett J, et al. Differences in the cellular processing of AspB10 human insulin compared with human insulin and LysB28ProB29 human insulin. Metabolism 1999; 48: 611–617.
- [2] Milazzo G, Sciacca L, Papa V, et al. AspB10 insulin induction of increased mitogenic responses and phenotypic changes in human breast epithelial cells: evidence for enhanced interactions with the insulin-like growth factor-I receptor. Molec Carcinog 1997; 18: 19–25.
- [3] Hennige AM, Strack V, Metzinger E, et al. Effects of new insulin analogues HMR1964 (insulin glulisine) and HMR1423 on insulin receptors. Diabetologia 2005; 48: 1891–1897.
- [4] Hirsch IB. Insulin analogues. New Engl J Med 2005; 352: 174–183.
- [5] Oiknine R, Bernbaum M, Mooradian AD. A critical appraisal of the role of insulin analogues in the management of diabetes mellitus. Drugs 2005; 65: 325–340.
- [6] Perušičová J. Krátce působící inzulinová analoga. Diabetologie, metabolismus, endokrinologie, výživa 2004; 7: 181–186.
- [7] Howey DC, Bowsher RR, Brunelle Rl, Woodworth JR. [Lys(B28), Pro(B29)]-human insulin: a rapidly absorbed analogue of human insulin. Diabetes 1994; 43: 396–402.
- [8] Mudaliar S, Lindberg FA, Joyce M, et al. Insulin aspart (B28 Asp-Insulin): a fast-acting analog of human insulin: absorption kinetics and action profile compared with regular human insulin in healthy nondiabetic subjects. Diabetes Care 1999; 22: 1501–1506.
- [9] Rakatzi I, Ramrath S, Ledwig D, et al. A novel insulin analog with unique properties, LysB3, GluB29 insulin induces prominent activation of insulin receptor substrate 2 but marginal phosphorylation of insulin receptor substrate 1. Diabetes 2003; 52: 2227–2238.
- [10] Rakatzi I, Seipke G, Eckel J. [LysB3, GluB29] insulin: a novel insulin analog with enhanced -cell protective action. Biochem Biophys Res Commun 2003; 310: 852–859.
- [11] Anderson JH, Brunelle RL, Koivisto VA, et al. Reduction of postprandial hyper-glycemia and frequency of hypoglycemia in IDDM patients on insulin-analog treatment. Diabetes 1997; 46: 265–270.
- [12] Home PD, Lindholm A, Hylleberg B, Round P. Improved glycemic control with insulin aspart: a multicenter randomised double-blind cross over trial in type 1 diabetic patients. Diabetes Care 1998; 21: 1904–1909.
- [13] Gale EA. A randomized, controlled trial comparing insulin lispro with human soluble insulin in patients with Type 1 diabetes on intensified insulin therapy. Diabet Med 2000; 17: 209–214.
- [14] Lalli C, Ciofetta M, Del Sindaco P, et al. Long-term intensive treatment of type 1 diabetes with the short-acting insulin analog lispro in variable combination with NPH insulin at mealtime. Diabetes Care 1999; 22: 468–477.
- [15] Raskin P, Holcombe JH, Tamborlane WV, et al. A comparison of insulin lispro and buffered regular human insulin administered via continuous subcutaneous insulin infusion pump. J Diabet Complications 2001; 15: 295–300.
- [16] Guerci B, Meyer L, Salle A, et al. Comparison of metabolic deterioration between insulin analog and regular insulin after a 5-hour interruption of a continuous subcutaneous insulin infusion in type 1 diabetic patients. J Clin Endocrinol Metab 1999; 84: 2673–2678.
- [17] Brunelle BL, Llewelyn J, Anderson JH, et al. Meta-analysis of the effect of insulin lispro on sever hypoglycemia in patients with type 1 diabetes. Diabetes Care 1998; 21: 1726–1731.
- [18] Takata H, Kumon Y, Osaki F, et al. The human insulin analogue Aspart is not the almighty solution for insulin allergy. Diabetes Care 2003; 26: 253–254.
- [19] Koivisto VA, Tuominen JA, Ebeling P. Lispro Mix25 insulin as premeal therapy in type 2 diabetic patients. Diabetes Care 1999; 22: 459–462.
- [20] Kilo C, Mezitis N, Jain R, et al. Starting patients with type 2 diabetes on insulin therapy using oncedaily injections of biphasic insulin aspart 70/30, biphasic human insulin 70/30, or NPH insulin in combination with metformin. J Diabet Complications 2003; 17: 307–313.
- [21] Boehm BO, Vaz JA, Brondsted L, Home PD. Long-term efficacy and safety of biphasic insulin aspart in patients with type 2 diabetes. Eur J Intern Med 2004; 5: 496–502.
- [22] Grajower MM, Fraser CG, Holcombe JH, et al. How long should insulin be used once a vial is started. Diabetes Care 2003; 26: 2665–2669.
- [23] Gallo M, Comoglio M, De Micheli A, et al. Insulin storage in Europe. Diabetes Care 2004; 27: 1225–1226.
- [24] Owens DR, Ciates PA, Luzio SD, et al. Pharmacokinetics of 125I-labeled insulin glargine (HOE 901) in healthy men: comparison with NPG insulin and the influence of different subcutaneous injection sites. Diabetes Care 2000; 23: 813–819.
- [25] Heise T, Bott S, Rave K, et al. No evidence for accumulation of insulin glargine (Lantus): a multiple injection study in patients with Type 1 diabetes. Diabet Med 2002; 19: 490–495.
- [26] Kurtzhals P, Schäffer L, Sorensen A, et al. Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogues designed for clinical use. Diabetes 2000; 49: 999–1005.
- [27] Chapman TM, Perry CM. Insulin detemir. A review of its use in the management of type 1 and type 2 diabetes mellitus. Drugs 2004; 64: 2577–2595.
- [28] Kurtzhals P. Engineering predictability and protraction in a basal insulin analogue: the pharmacology of insulin detemir. Int J Obes Relat Metab Disord 2004; 28 (Suppl. 2): S23–S28.
- [29] Rossetti P, Pamparelli S, Fanelli C, et al. Intensive replacement of basal insulin in patients with type 1 diabetes given rapid-acting insulin analog at mealtime: a 3-month comparison between administration of NPH insulin four times daily and glargine insulin at dinner or bedtime. Diabetes Care 2003; 26: 1490–1496.
- [30] Rattner RE, Hirsch IB, Neifing JL, et al. Less hypoglycemia with insulin glargine in intensive insulin therapy for type 1 diabetes. Diabetes Care 2000; 23: 639–643.
- [31] Raskin P, Klaf L, Bergenstal R, et al. A 16-week comparison of the novel insulin analog insulin glargine (HOE 901) and NPH human insulin used with insulin lispro in patients with type 1 diabetes. Diabetes Care 2000; 23: 1666–1671.
- [32] Yki-Järvinen H, Dressler A, Ziemen M. Less nocturnal hypoglycemia and better post-dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin during insulin combination therapy in type 2 diabetes. Diabetes Care 2000; 23: 1130–1136.
- [33] Hamann A, Matthaei S, Rosak C, et al. A randomised clinical trial comparing breakfast, dinner or bedtime administration of insulin glargine in patients with type 1 diabetes. Diabetes Care 2003; 26: 1738–1744.
- [34] Fritsche A, Schweitzer MA, Haring HU. Glimepiride combined with morning insulin glargine, bedtime neutral protamine hagedorn insulin, or bedtime insulin glargine in patients with type 2 diabetes: a randomised, controlled trial. Ann Intern Med 2003; 138: 952–959.
- [35] McKeage K, Gou KL. Insulin glargine: a review of its therapeutic use as a long-acting agent for the management of type 1 and type 2 diabetes mellitus. Drugs 2001; 61: 1599–1624.
- [36] Durand-Gonzales KN, Guillausseau N, Pecquet C, et al. Glargine insulin is not an alternative in insulin allergy (letter). Diabetes Care 2003; 26: 2216.
- [37] Lepore G, Dodesini AR, Nosari I, et al. Effect of continuous subcutaneous insulin infusion vs multiple daily insulin injection with glargine as basal insulin: an open parallel long-term study. Diabetes Nutr Metab 2004; 17: 84–89.
- [38] Harmel AP, Mathur R. Similar A1c outcomes in type 1 diabetic patients undergoing intensive diabetes management with preprandial rapid-acting insulin and either CSII or glargine. Diabetes Care 2004; 27: 272–273.
- [39] De Leeuw I, Vaugue P, Selam JL, et al. Insulin detemir used in basal-bolus therapy in people with type 1 diabetes is associated with a lower risk of nocturnal hypoglycemia and less weight gain over 12 months in comparison to NPH insulin. Diabetes Obes Metab 2005; 7: 73–82.
- [40] Standl E, Lang H, Roberts A. The 12-months efficacy and safety of insulin detemir and NPH insulin in basal-bolus therapy for the treatment of type 1 diabetes. Diab Tech Ter 2004; 6: 579–588.
- [41] Hermansen K, Fontaine P, Kukolja KK, et al. Insulin analogues (insulin detemir and insulin aspart) versus traditional human insulins (NPH insulin and regular human insulin) in basal-bolus therapy for patients with Type 1 diabetes. Diabetologia 2004; 47: 622–629.
- [42] Fritsche A, Haring H, et al. At last, a weight neutral insulin? Int J Obes 2004; 28 (Suppl. 2): S41–S46.
- [43] De Witt DE, Hirsch IB. Outpatient insulin therapy in type 1 and type 2 diabetes mellitus: scientific review. JAMA 2003; 289: 2254–2264.
- [44] Rami B, Schnober E. Postprandial glycemia after regular and lispro insulin in children and adolescents with diabetes. Eur J Pediatr 1997; 156: 838–840.
- [45] Dunne T, Aman J, Schober E, et al. A comparison of postprandial and preprandial administration of insulin aspart in children and adolescents with type 1 diabetes. Diabetes Care 2003; 26: 2359–2364.
- [46] Schober E, Schoenle E, Van Dyk J, Wernicke-Panten K. Comparative trial between insulin glargine and NPH insulin in children and adolescents with type 1 diabetes mellitus. J Pediatr Endocrinol Metab 2002; 15: 369–376.
- [47] Chase HP, Dixon B, Pearson J, et al. Reduced hypoglycemic episodes and improved glycemic control in children with type 1 diabetes using insulin glargine and neutral protamine Hagedorn insulin. J Pediatr 2003; 143: 737–740.
- [48] Haffner MC, Kufner MP. Insulin analogues. N Engl J Med 2005; 352: 1823.
- [49] Masson EA, Patmolre JE, Brash PD, et al. Pregnancy outcome in Type 1 diabetes mellitus treated with insulin lispro (Humalog). Diabet Med 2003; 20: 46–50.
- [50] Garg SK, Frias JP, Anil S, et al. Insulin lispro therapy in pregnancies complicated by type 1 diabetes: glycemic control and maternal and fetal outcomes. Endocr Pract 2003; 9: 187–193.
- [51] Gabbe SG, Graves CR. Management of diabetes mellitus complicating pregnancy. Obstet Gynecol 2003; 102: 857–868.
- [52] Gonzales C, Santoro S, Salzberg S, et al. Insulin analogue therapy in pregnancies complicated by diabetes mellitus. Exp Opin Pharmacother 2005; 6: 735–742.
- [53] Kurtzhals P, Schäffer L, Sorensen A, et al. Correlation of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use. Diabetes 2000; 49: 999–1005.
- [54] Siebenhofer A, Planck J, Berghold A, et al. Meta-analysis of short-acting insulin analogues in adult patients with type 1 diabetes: continuous subcutaneous insulin infusion versus injection therapy. Diabetologia 2004; 47: 1895–1905.
- [55] Planck J, Siebenhofer A, Berghold A, et al. Systematic review and meta-analysis of short-acting insulin analogues in patients with diabetes mellitus. Arch Intern Med 2005; 165: 1337–1344.
- [56] Schooff M, Ehlers K. Short-acting insulin analogues vs. human insulin for diabetes. Am Family Physician 2005; 72: 805–807.