Ixekizumab v léčbě axiální spondyloartritidy
Souhrn:
Suchý D. Ixekizumab v léčbě axiální spondyloartritidy. Remedia 2021; 31: 406–412.
Axiální spondyloartritida (axSpA) je zastřešující termín, který zahrnuje ankylozující spondylitidu a neradiografickou axSpA. Přítomnost nebo absence definitivní sakroiliitidy na rentgenových snímcích odlišuje ankylozující spondylitidu (také nazývanou radiografická axSpA) od neradiografické axSpA. Dlouholeté trvání choroby je spojeno s rizikem obtížně ovlivnitelných strukturálních změn, které mají negativní dopady na běžný život pacientů. Proto časné stanovení diagnózy skýtá lepší šanci nejen na úspěch léčby, ale zejména na snížení rizika vzniku ireverzibilního poškození. Existuje stále více důkazů, které naznačují, že dráha IL‑17 je klíčovou v patogenezi axSpA. Ixekizumab působí jako inhibitor IL‑17A, jeho účinnost již byla potvrzena v léčbě psoriázy, psoriatické artritidy a recentně i radiografické a neradiografické formy axSpA. Registrace ixekizumabu pro léčbu axSpA se opírá o výsledky dvou klinických hodnocení fáze III radiografické formy axSpA u pacientů dosud neléčených inhibitorem TNF, u pacientů se selháním léčby inhibitory TNF nebo s intolerancí této léčby a o klinické studie u neradiografické formy axSpA.
Summary:
Suchy D. Ixekizumab in the treatment of axial spondyloarthritis. Remedia 2021; 31: 406–412.
Axial spondyloarthritis (axSpA) is an umbrella term that includes ankylosing spondylitis and non‑radiographic axSpA. The presence or absence of a definitive sacroiliitis on X‑ray images differentiates ankylosing spondylitis (also known as radiographic axSpA) from non‑radiographic axSpA. Long‑term disease activity is associated with a risk of hardly manageable structural changes that have negative impact on the everyday life of patients. Therefore, early diagnosis not only offers a better chance of treatment success, but especially of a lower risk of irreversible damage. More and more evidence about the key role of IL‑17 pathway in the pathogenesis of axSpA gathers. Ixekizumab is an IL‑17A inhibitor with confirmed efficacy in the treatment of psoriasis, psoriatic arthritis and recently also radiographic and non‑radiographic forms of axSpA. The registration of ixekizumab for the treatment of axSpA is supported by evidence from two phase III clinical trials of radiographic axSpA in TNF inhibitor‑naive patients, in patients with failure or intolerance of TNF inhibitors and a clinical study of non‑radiographic form of axSpA.
Key words: axial spondyloarthritis, non‑radiographic axial spondyloarthritis, sacroiliitis, biologic treatment, ixekizumab
Úvod
Axiální spondyloartritidy (axSpA) jsou chronická zánětlivá onemocnění, která typicky postihují axiální skelet (spondylitida), sakroiliakální (SI) klouby (sakroiliitida) a dále periferní klouby (artritida) a další struktury – enteze (entezitida) a prsty (daktylitida). Extraskeletální manifestace zahrnují akutní přední uveitidy, psoriázu a idiopatické střevní záněty. Závažnost onemocnění je dána aktivitou, kvalitou života a úrovní bolesti. Dlouhodobě aktivní onemocnění je asociováno s progredujícím strukturálním postižením páteře. Tradiční biomarker aktivity onemocnění představuje C reaktivní protein (CRP), který je i prediktorem strukturální progrese a odpovědi na léčbu. V rámci zobrazovacích metod lze aktivitu onemocnění nejlépe sledovat pomocí magnetické rezonance (MRI). Nález na MRI koreluje s CRP, jehož hodnota predikuje rozvoj sakroiliitidy a osteoproduktivních změn – syndesmofytů. Nová klasifikační kritéria axSpA podle skupiny Assessment of SpondyloArthritis International Society (ASAS) umožňují časnou diagnostiku onemocnění. Kritéria jsou založena na přítomnosti chronické bolesti zad trvající déle než tři měsíce a mají klinickou a zobrazovací větev.
Konvenční léčbu lze rozdělit na nefarmakologickou, farmakologickou a chirurgickou. Cílem léčby u ankylozující spondylitidy (AS) je snížit bolest, ztuhlost a únavnost, udržet či zlepšit funkci a pokusit se zpomalit strukturální progresi nemoci [1–4].
Dle recentních Doporučení České revmatologické společnosti pro léčbu axiálních spondyloartritid má být terapeutická strategie navržena individuálně podle přítomných symptomů onemocnění [3]. Léčba by měla být směrována k cíli (koncept „treat to target“), jímž má být remise či stav nízké aktivity onemocnění, přičemž jako vhodný nástroj ke zhodnocení aktivity se jeví index ASDAS (Ankylosing Spondylitis Disease Activity Score) [3].
Základem léčby každého pacienta je celoživotní cvičení, které pomáhá udržovat pohyblivost páteře, rehabilitace a lázeňská péče. Z farmakologické léčby představují první volbu nesteroidní antirevmatika (NSA). Tlumí zánět i bolest, přičemž dobrá odpověď na NSA je u pacientů se zánětlivou bolestí zad v rámci symptomatologie axSpA udávána až v 70 %. U aktivního onemocnění se doporučuje kontinuální užívání NSA v plné terapeutické dávce, u stabilizovaných pacientů pouze při obtížích [1,3,5]. NSA s dlouhým biologickým poločasem se jeví jako výhodnější, zejména pro efekt na noční bolesti a ranní ztuhlost [1–3]. U pacientů se zvýšeným rizikem NSA indukované gastropatie využíváme kombinace NSA s inhibitorem protonové pumpy, ev. NSA ze skupiny koxibů (celekoxib). NSA rovněž nejsou vhodná u pacientů s idiopatickými střevními záněty. Možný strukturální efekt NSA, tj. ovlivnění progrese onemocnění, je stále otevřenou otázkou, tento efekt byl prokázán pro celekoxib (pouze u pacientů s vysokými hodnotami reaktantů akutní fáze), naopak nebyl prokázán pro diklofenak [3]. Data z kohortové studie (GESPIC), jež byla publikována v roce 2012, prokázala zpomalení rentgenové progrese u pacientů s častým užíváním NSA oproti pacientům s méně frekventním užíváním [6].
Účinnost konvenčních syntetických chorobu modifikujících antirevmatických léků (csDMARDs) u čistě axiálních forem axSpA nebyla doložena. V léčbě periferních forem onemocnění je běžně používán sulfasalazin, jehož efektivita u periferních projevů spondyloartritidy byla prokázána v několika klinických hodnoceních [7]. Maximální dávka je 3 g/den. Použití metotrexátu v léčbě axSpA není vhodné, klinických hodnocení v této indikaci je málo a většinou s negativními výsledky. Systémové glukokortikoidy u AS indikovány nejsou.
Biologická
léčba axSpA
Pokud je terapie dvěma NSA v plných dávkách podávaná po dobu čtyř týdnů bez efektu a přetrvává li klinická aktivita onemocnění, je indikováno zahájení biologické léčby. Z biologických léků jsou využívány inhibitory tumor nekrotizujícího faktoru alfa (TNFα) a blokátory interleukinu 17 (IL 17). K dispozici jsou četné důkazy o účinnosti anti TNF léčby v terapii axSpA. O účinnosti svědčí celá řada randomizovaných klinických hodnocení, která byla u těchto pacientů provedena. Léčba inhibitorem TNF vede k poklesu hodnot reaktantů akutní fáze, k ústupu zánětlivých změn na MRI páteře a SI kloubů. Inhibitory TNF ovlivňují všechny projevy SpA, jak axiální, tak i periferní (artritida, entezitida, daktylitida) a řadu extraskeletálních manifestací [8]. Ač je k léčbě axSpA registrováno pět inhbitorů TNF, chybějí přímé srovnávací studie, nicméně výsledky nepřímých srovnání svědčí pro podobnou účinnost. Anti TNF léčba je účinnější u pacientů s kratším trváním onemocnění, nicméně efekt je popisován i u pokročilých změn s postižením celé páteře. Novější studie prokázaly stejně dobrou účinnost anti TNF přípravků u forem radiografických (AS) a tzv. non radiografických [3,8].
U části pacientů (kolem 30 %) léčba selhává a není dosaženo cíle, proto se hledaly i biologické léky s jiným mechanismem účinku. Výsledky klinických hodnocení s přípravky, které se osvědčily v terapii revmatoidní artritidy, byly vesměs negativní a žádný z těchto léků se v terapii neuplatnil. Pozitivní výsledky přinesla až klinická hodnocení zaměřená na blokádu IL 17. Interleukin 17 je přirozeně se vyskytující cytokin, který se účastní normální imunitní odpovědi, ale hraje i klíčovou roli v patogenezi AS. IL 17A je produkován celou řadou buněk imunitního systému, včetně Th17 lymfocytů, a ovlivňuje funkci dalších buněčných populací (neutrofily, keratinocyty, endoteliální buňky, chondrocyty a osteoblasty); podněcuje další aktivaci a produkci zánětlivých cytokinů a chemokinů, které kromě akcelerace zánětlivé odpovědi vedou i k buněčné proliferaci, vzniku kostních erozí a poškození chrupavky. U pacientů s axSpA byla prokázána zvýšená koncentrace IL 17 v subchondrální kostní dřeni intervertebrálních kloubů nemocných s AS a souvislost mezi chronickou expresí IL 17 a vznikem zánětu a destrukcí kosti i chrupavčité tkáně [10].
Ixekizumab
v léčbě axSpA
Ixekizumab je monoklonální protilátka
IgG4, která se váže s vysokou afinitou (< 3
pM) a specificitou k IL 17A i IL 17A/F.
Inhibice IL 17 ixekizumabem vede k blokádě zánětu
u artritidy, entezitidy, potlačení degradace chrupavky
a subchondrální kosti a rovněž k inhibici
ektopické kostní formace [8], obrázek 1.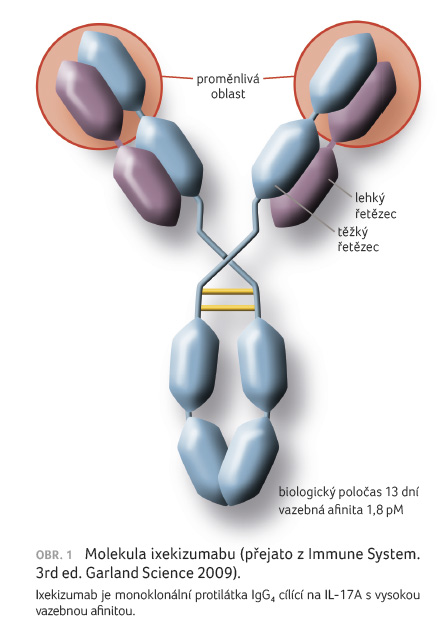
Klinické hodnocení ixekizumabu u axSpA zahrnuje tři zásadní studie, jejichž výsledky byly podkladem pro registrační řízení. Dvě z nich (COAST V, COAST W) byly provedeny u pacientů s radiografickou axSpA a studie COAST X pak sledovala pacienty s non radiografickou axSpA. Pacienti, kteří dokončili 52 týdnů hodnocení v těchto registračních studiích, mohli být posléze zařazeni do dlouhodobé otevřené studie COAST Y [10].
Ixekizumab
u radiografické SpA
Bezpečnost a účinnost ixekizumabu v léčbě radiografické SpA byly zkoumány u celkem 657 pacientů ve dvou randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III (studie COAST V a studie COAST W). Zařazeni byli dospělí pacienti (≥ 18 let) s axSpA. Do studie COAST V byli zahrnuti pacienti naivní k biologické léčbě, studie COAST W zahrnula nemocné, u nichž došlo k selhání biologické terapie [10].
Do obou studií byli zařazeni
pacienti s aktivní axSpA (BASDAI ≥ 4) starší
18 let, s celkovým stupněm bolesti zad ≥ 4
na numerické hodnoticí škále i přes léčbu NSA,
medián trvání onemocnění byl 17 let. RTG snímky SI skloubení
byly centrálně hodnoceny, aby byla skutečně splněna upravená
newyorská klasifikační kritéria AS. Primárním cílovým
ukazatelem v obou studiích byl procentuální podíl pacientů,
u nichž bylo v týdnu 16 dosaženo odpovědi ASAS 40 (40%
zlepšení dle ASAS). Hlavními sekundárními cílovými ukazateli
hodnocenými v 16. týdnu byly ASAS 20 (20% zlepšení dle
kritérií ASAS), dosažení skóre aktivity AS (ASDAS) < 2,1
(neaktivní nebo nízká aktivita onemocnění) a změny oproti
výchozím hodnotám ASDAS, BASDAI (Bath Ankylosing Spondylitis
Disease Activity Index), funkčního indexu BASFI (Bath Ankylosing
Spondylitis Functional Index), fyzikální komponenty SF‐36 skóre
(Physical Component Summary, PCS), ASAS HI (ASAS Health Index)
a indexu SPARCC MRI (Spondyloarthritis Research Consortium of
Canada Magnetic Resonance Imaging) pro páteř [10–12], tabulka 1.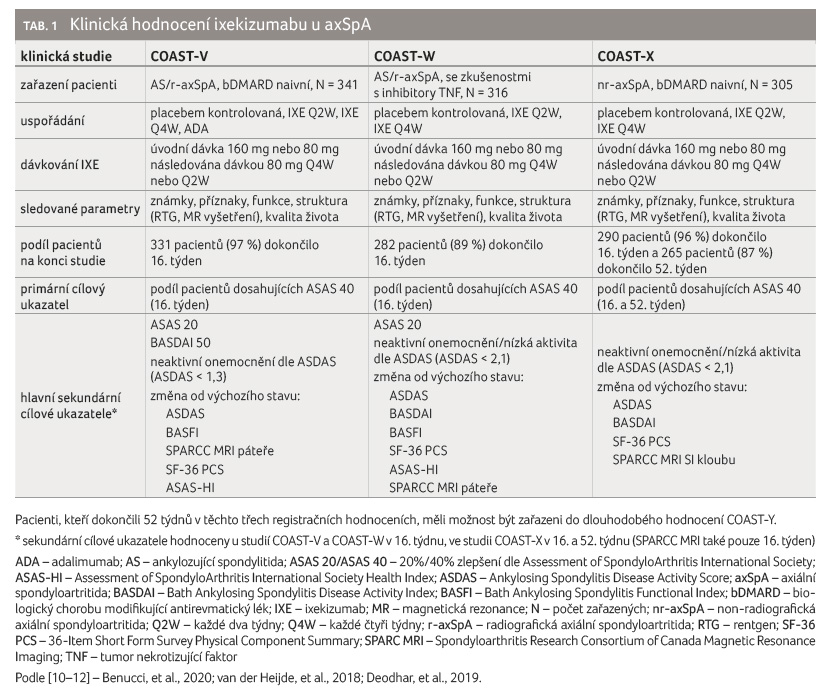
Studie COAST V
Studie COAST V zahrnula 341 biologicky naivních pacientů, kteří byli randomizováni do čtyř skupin. Pacienti byli léčeni ixekizumabem v dávce 80 mg nebo 160 mg podané v týdnu 0 a poté dávkou 80 mg každé 2 nebo 4 týdny, adalimumabem 40 mg každé 2 týdny nebo placebem. Pacienti, kteří užívali placebo, byli v týdnu 16 znovu randomizováni k užívání ixekizumabu (160 mg úvodní dávka, poté 80 mg každé 2 nebo 4 týdny). Pacienti, kteří užívali adalimumab, byli v týdnu 16 znovu randomizováni k užívání ixekizumabu (80 mg každé 2 nebo 4 týdny). Průměrný věk pacientů byl 42 let, trvání obtíží v průměru 16 let a čas od stanovení diagnózy 7 let.
Ve studii COAST V byla v týdnu 16 u pacientů léčených ixekizumabem podávaným v dávce 80 mg každé 2 nebo 4 týdny prokázána signifikantně významnější zlepšení v odpovědích ASAS 40 a ASAS 20 v porovnání s placebem, a to nezávisle na konkomitantní terapii (část pacientů užívala sulfasalazin nebo metotrexát).
Odpovědi ASAS 40 v 16. týdnu,
primárního cílového parametru, bylo dosaženo u přibližně
poloviny pacientů v obou skupinách s ixekizumabem:
ve skupině s ixekizumabem podávaným jednou za 2
týdny v 52 % (p < 0,0001),
ve skupině s podáváním jednou za 4 týdny ve 48 %
(p < 0,0001)
oproti placebové větvi (18 %), graf 1.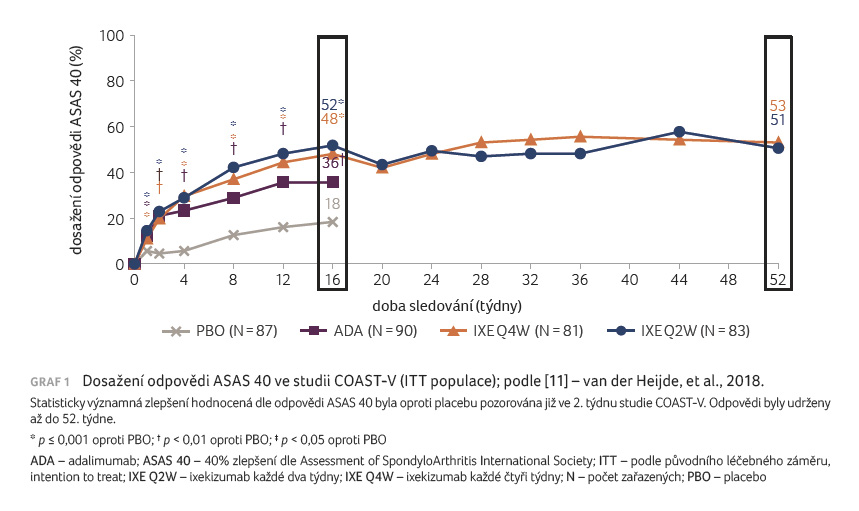
Výrazné zlepšení oproti placebu bylo pozorováno pro každý režim ixekizumabu, pro všechny hlavní sekundární cílové ukazatele v 16. týdnu, včetně klinické aktivity onemocnění, funkce a kvality života. Kromě výše uvedených výsledků byl zaznamenán významný léčebný účinek na zánět (pokles hodnot CRP a ústup zánětu na MRI páteře a SI kloubů). Odpovědi ASAS 20 bylo v 16. týdnu dosaženo v ramenech s ixekizumabem u 69 %, resp. 64 % vs. 40 % pacientů dostávajících placebo. Pacienti léčení adalimumabem rovněž vykázali v 16. týdnu signifikantně vyšší odpověď oproti placebu v primárním cílovém ukazateli: ASAS 40 (36 %, p = 0,0053) a ASAS 20 (59 %, p = 0,0075) [10,11].
Studie COAST W
Studie COAST W hodnotila 316 pacientů, kteří měli předchozí zkušenosti s jedním nebo dvěma inhibitory TNF při trvání terapie nejméně 12 týdnů (90 % pacientů mělo nedostatečnou odpověď a 10 % pacientů inhibitory TNF nesnášelo). Průměrný věk pacientů byl 46 let, trvání onemocnění od stanovení diagnózy 13 let, pacienti trpěli radiografickou axSpA dle modifikovaných newyorských kritérií pro sakroiliitidu a zároveň splňovali kritéria ASAS pro axSpA [8,11]. Podmínkou zařazení bylo aktivní onemocnění: BASDAI > 4, bolest na vizuální škále (0–10) > 4, průměrný ASDAS 4,1 a CRP 16–20 mg/l. Primárním cílovým ukazatelem byla odpověď ASAS 40 v týdnu 16. Všichni pacienti byli léčeni ixekizumabem v dávce 80 mg nebo 160 mg v týdnu 0 a poté 80 mg každé 2 nebo 4 týdny nebo placebem. Pacienti, kteří užívali placebo, byli v týdnu 16 znovu randomizováni k užívání ixekizumabu (úvodní dávka 160 mg, poté 80 mg každé 2 nebo 4 týdny).
Primárního cílového ukazatele bylo dosaženo ve 30 % případů při režimu podávání ixekizumabu každé 2 týdny a v 25 % případů v režimu každé 4 týdny, při podávání placeba dosáhlo odpovědi ASAS 40 pouze 12,5 % pacientů (obě skupiny ixekizumabu vs. placebo p = 0,03, resp. 0,17).
Ixekizumab byl účinnější než placebo také ve všech sekundárních ukazatelích účinnosti, včetně aktivity onemocnění, funkce, kvality života. Statisticky signifikantní zlepšení oproti placebu bylo zaznamenáno časně pro všechny cílové ukazatele. Byl zjištěn statisticky signifikantní pokles výskytu zánětlivých změn na MRI páteře (SPARCC MRI) rovněž s paralelním poklesem hodnot CRP.
I přes výraznější expozici
ixekizumabu ve skupině s režimem podávání jednou za 2
týdny nebyla účinnost významně vyšší oproti podávání
jednou za 4 týdny. Podobně nebyl zaznamenán významnější
efekt vyšší iniciální dávky ixekizumabu (160 mg) vs. 80 mg
[10,12], graf 2.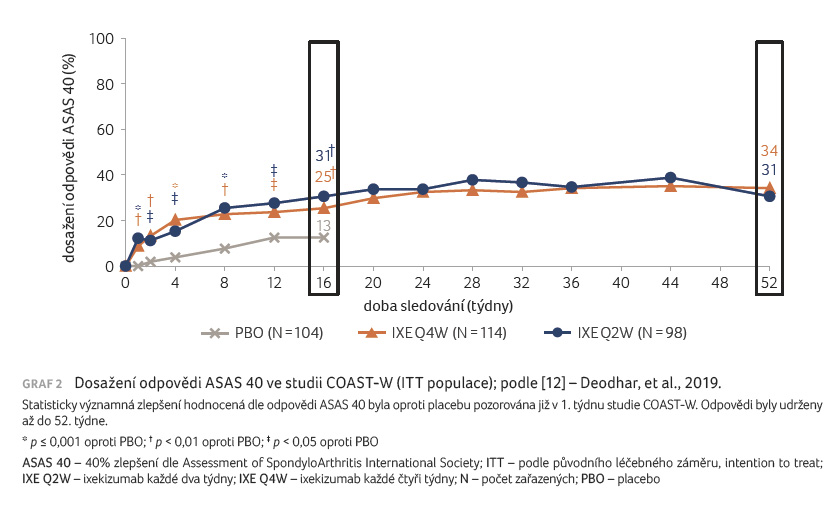
Prodloužení obou studií (COAST V, COAST W) do týdne 52 prokázalo dlouhodobou účinnost léčby ixekizumabem, graf 3A, B. U pacientů ze studie COAST V iniciálně randomizovaných k léčbě adalimumabem bylo doloženo další numerické zlepšení po přechodu na léčbu ixekizumabem [13].
Ixekizumab
u non radiografické axSpA
Do randomizované, placebem
kontrolované studie fáze III COAST X bylo zařazeno celkem 303
dospělých pacientů s aktivní non radiografickou axSpA,
kteří dostávali ixekizumab 80 mg subkutánně každé 4 týdny
nebo každé 2 týdny (po počáteční dávce 80 mg nebo
160 mg v týdnu 0) nebo placebo. Podmínkou zařazení bylo
splnění klasifikačních kritérií pro non radiografickou
axSpA dle ASAS a vyloučení rentgenové sakroiliitidy. Kromě
aktivity onemocnění vyjádřené podobně jako v předchozích
studiích hodnotou BASDAI > 4 a bolestí
na vizuální analogové škále > 4 byl dalším
vstupním kritériem objektivní průkaz zánětu (elevace
CRP > 5 mg/l nebo pozitivní nález sakroiliitidy
na MRI, případně obojí). Průměrná hodnota ASDAS
představovala 3,9, CRP 12–14 mg/l, BASDAI 78,2. Průměrný věk
činil 40 let, trvání symptomů 10 let, pozitivita
HLA B27 v 75 % [8,14]. Primárním cílovým ukazatelem
byla opět odpověď ASAS 40 ve dvou časových intervalech –
v týdnu 16 a 52.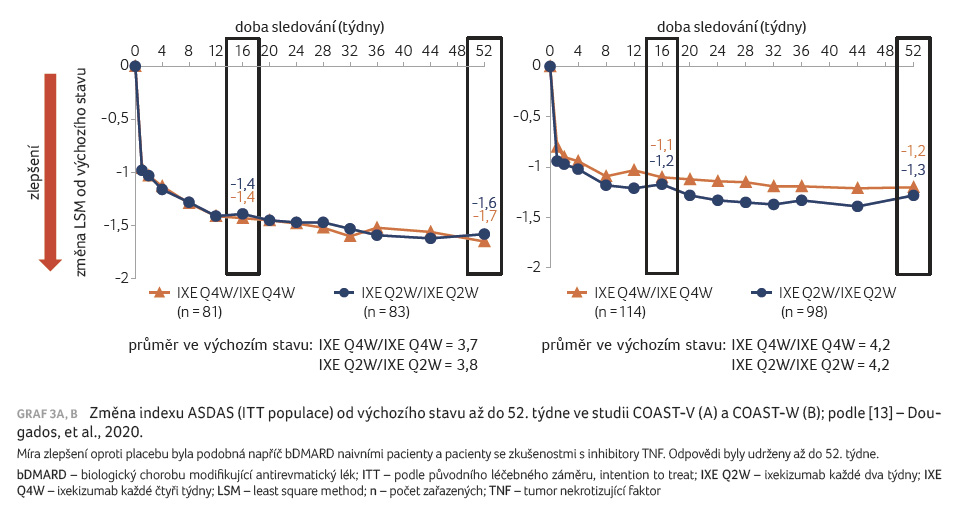
Podíl pacientů, kteří dosáhli primárního cílového ukazatele zmírnění známek a příznaků non radiografické axSpA, měřeno odpovědí ASAS 40, byl vyšší ve skupině pacientů s ixekizumabem ve srovnání s placebem se statisticky významným rozdílem (p < 0,01). V 16. týdnu dosáhlo odpovědi ASAS 40 celkem 35 % pacientů s léčbou ixekizumabem podávaným každé 4 týdny a 41 % pacientů při podávání ixekizumabu každé 2 týdny, zatímco ve skupině s placebem to bylo jen 19 % pacientů.
V 52. týdnu bylo odpovědi ASAS 40 dosaženo u 30 % pacientů s léčbou ixekizumabem každé 4 týdny a u 31 % pacientů v léčebném režimu každé 2 týdny, při podávání placeba pak pouze u 13 % pacientů.
Signifikantní zlepšení oproti placebu nastalo již v prvním týdnu léčby. Ixekizumab rovněž splnil hlavní sekundární cílové ukazatele v 16. a 52. týdnu, včetně významného zlepšení skóre aktivity AS (ASDAS, BASDAI), zvýšení podílu pacientů dosahujících nízké aktivity onemocnění (ASDAS < 2,1), významného zmírnění zánětlivých změn sakroiliakálního kloubu dle MRI (16. týden) a významného zlepšení fyzických složek skóre SF 36 [14].
Dlouhodobá léčba ixekizumabem
Pacienti, kteří úspěšně zakončili některou z těchto tří registračních studií, měli možnost být zařazeni do dlouhodobé studie COAST Y. V této studii dosáhla více než polovina pacientů (56,7 %) léčených kontinuálně ixekizumabem (80 mg každé 4 týdny, n = 157) po dobu dvou let odpovědi ASAS 40. Při léčbě ixekizumabem nepřetržitě každé 4 týdny po dobu dvou let dosáhlo nízkého stavu aktivity onemocnění 43,9 % pacientů, měřeno podle skóre aktivity ASDAS (< 2,1). Průměrná změna skóre ASDAS oproti výchozí hodnotě (3,9) byla −1,6. Stavu částečné remise dosáhlo 19,7 % sledovaných. Průměrná změna ve srovnání s výchozí hodnotou (6,6) BASFI činila −2,8.
Průměrná změna sledované fyzické komponenty oproti výchozí hodnotě (33,9) v dotazníku SF 36 (SF 36 PCS) byla 8,4.
Ve studii COAST Y tedy ixekizumab prokázal konzistentní a dlouhodobé zmírňování známek a příznaků axSpA, funkčních parametrů a kvality života u pacientů s radiografickou a non radiografickou axSpA [15].
Bezpečnost
léčby ixekizumabem
Mezinárodní tým autorů provedl analýzu údajů o dlouhodobé bezpečnosti ixekizumabu na základě dat z 21 klinických hodnocení z programů UNCOVER (léčba psoriázy), SPIRIT (léčba psoriatické artritidy, PsA) a COAST (léčba axSpA). Celkem byla vyhodnocena data 8 228 pacientů, jimž byl podáván ixekizumab po dobu až pěti let (5 898 pacientů s psoriázou, 1 401 s PsA a 929 s axSpA; úhrnem 20 896 pacientoroků).
Mezi nejčastěji reportované nežádoucí příhody vzniklé během léčby (treatment emergent adverse effects, TEAEs) patřily nazofaryngitida, infekce horních cest dýchacích a reakce v místě aplikace (injection site reactions, ISR). Ojediněle se vyskytly případy střevních zánětů, malignit a významných kardiovaskulárních příhod. Během prvního roku léčby patřily mezi nejčastější TEAEs především infekce, ISR a hypersenzitivita. Frekvence těchto TEAEs v průběhu pěti let sledování vykazovala spíše snižující se trend. Infekce byly nejčastější nežádoucí příhodou po celou dobu sledování. Častější byly během prvního roku léčby, dále se jejich výskyt nezvyšoval. Míra incidence závažných infekcí byla nízká a dlouhodobě stabilní. Nejčastějšími infekcemi vyskytujícími se během léčby byly infekce horních cest dýchacích, bronchitidy, a dále oportunní infekce jako kandidózy dutiny ústní a jícnu nebo herpes zoster. Nebyly zaznamenány žádné systémové ani invazivní kandidózy, jen vzácně bylo reportováno herpetické postižení oka.
Nebyly potvrzeny žádné případy reaktivace tuberkulózy (TBC) ve spojení s podáváním ixekizumabu, a to ani u nemocných s latentní TBC nebo anamnézou infekce Mycobacterium tuberculosis [16]. Nejnovější analýza bezpečnosti ixekizumabu byla publikována na letošní konferenci Evropské ligy proti revmatismu (EULAR) a vyznívá velmi podobně [17]. Do této bezpečnostní analýzy bylo zahrnuto celkem 1 401 pacientů. Nejběžnějšími TEAEs byly opět nazofaryngitida, infekce horních cest dýchacích a reakce v místě vpichu. Závažné nežádoucí účinky byly hlášeny u 134 pacientů, 8,2 % pacientů přerušilo léčbu kvůli nežádoucím účinkům. Byly zdokumentovány tři případy zánětlivého onemocnění střev vzniklého de novo, jedna ulcerózní kolitida a dva případy Crohnovy choroby; výskyt oportunních infekcí byl zjištěn u 40 (2,9 %) pacientů.
Nebyly hlášeny žádné případy TBC. Mezi další infekce patřily hepatitida B, herpes simplex a herpes zoster. Závěrem lze říci, že bezpečnostní profil ixekizumabu byl v souladu s dříve publikovanými bezpečnostními údaji a že nebyly pozorovány žádné nové bezpečnostní signály [17].
Závěr
Ixekizumab prokázal výbornou a dlouhodobou účinnost u radiografické i non radiografické formy axSpA. Ve všech studiích fáze III bylo dosaženo odpovědí ASAS 40 oproti placebu. Při podávání ixekizumabu jednou za 4 týdny bylo dosaženo hlavních sekundárních cílových ukazatelů. Statisticky významné odpovědi byly pozorovány již v 1.–2. týdnu a byly celkově udrženy až do 52. týdne. Odpovědi na léčbu byly podobné bez ohledu na výchozí hodnoty CRP a vyšetření pomocí MRI.
Schválené terapeutické indikace ixekizumabu u axSpA zahrnují obě formy onemocnění. Ixekizumab (Taltz) je indikován k léčbě dospělých pacientů s aktivní ankylozující spondylitidou, kteří nereagovali dostatečně na konvenční léčbu. V terapii neradiografické axiální spondyloartritidy je indikován k léčbě dospělých pacientů s aktivní neradiografickou axSpA s objektivními známkami zánětu na základě zvýšené hodnoty CRP a/nebo vyšetření MR, kteří nereagovali dostatečně na léčbu nesteroidními protizánětlivými léky. Doporučená dávka je 160 mg (tj dvě s.c. injekce à 80 mg) v týdnu 0 následovaných 80 mg každé 4 týdny.
Seznam použité literatury
- [1] Procházková L, Červeňák V, Souček M. Axiální spondylartritida. Vnitř Lék 2018; 64: 108–111.
- [2] Pavelka K. Doporučení České revmatologické společnosti pro léčbu ankylozující spondylitidy. Czech Rheumatology/Ces Revmatol 2012; 20: 4–11.
- [3] Pavelka K. Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartritid. Strategie léčby a farmakoterapie. Čes Revmatol 2021; 29: 5‑19.
- [4] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS/ EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978–991.
- [5] Wang R, Dasgupta A, Ward MM. Comparative efficacy of non‑steroidal anti‑inflammatory drugs in ankylosing spondylitis: a Bayeysian network meta‑analysis of clinical trials. Ann Rheum Dis 2016; 75: 1152–1160.
- [6] Poddubnyy D, Rudwaleit M, Haibel H, et al. Effect of non‑steroidal anti‑inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: results from the German spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71: 1616–1622.
- [7] Database Syst Rev 2014; 11: CD004800; doi: 10.1002/14651858.
- [8] Pavelka K. Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění. Vnitř Lék 2021; 67: 195–200.
- [9] Inhibitory IL‑17 v léčbě spondyloartritid. In Pavelka K, Šenolt L, Šedová L, Hušáková M, Heissigerová J. Spondyloartritidy. Praha: Maxdorf, [2020]. Jessenius, s. 123–129.
- [10] Benucci M, Damiani A, Li Gobbi F, et al. Therapeutic Potential of Ixekizumab in the Treatment of Ankylosing Spondylitis: A Review on the Emerging Clinical Data. Ther Clin Risk Manag 2020; 16: 287–297.
- [11] van der Heijde D, Wei JC, Dougados M, et al. Ixekizumab, an interleukin‑17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease‑modifying anti‑rheumatic drugs (COAST‑V): 16 week results of a Phase III randomised, double‑blind, active‑controlled and placebo‑controlled trial. Lancet 2018; 392: 2441–2451.
- [12] Deodhar A, Poddubnyy D, Pacheao‑Tena C, et al. Efficacy and safety of ixekizumab in the treatment of radiographic axial spondyloarthritis: sixteen‑week results from a Phase III randomized, double‑blind, placebo‑controlled trial in patients with prior inadequate response to or intolerance of tumor necrosis factor inhibitors. Arthritis Rheumatol 2019; 71: 599–611.
- [13] Dougados M, Wei JC, Landewé R, et al.; COAST‑V and COAST‑W Study Groups. Efficacy and safety of ixekizumab through 52 weeks in two Phase 3, randomised, controlled clinical trials in patients with active radiographic axial spondyloarthritis (COAST‑V and COAST‑W). Ann Rheum Dis 2020; 79: 176–185.
- [14] Gensler LS, et al.; COAST‑X Study Group. Ixekizumab for patients with non‑radiographic axial spondyloarthritis (COAST‑X): a randomised, placebo‑controlled trial. Lancet 2020; 395: 53–64.
- [15] Landewé RB, Gensler LS, Poddubnyy D, et al.; COAST‑Y study group. Continuing versus withdrawing ixekizumab treatment in patients with axial spondyloarthritis who achieved remission: efficacy and safety results from a placebo‑controlled, randomised withdrawal study (COAST‑Y). Ann Rheum Dis 2021 May 6: doi: 10.1136/annrheumdis‑2020‑219717.
- [16] Genovese MC, Mysler E, Tomita T, et al. Safety of ixekizumab in adult patients with plaque psoriasis, psoriatic arthritis and axial spondyloarthritis: data from 21 clinical trials. Rheumatology (Oxford, England) 2020; 59: 3834–3844.
- [17] Sesin C, Gallo G, Gellett A, et al. Safety of ixekizumab in patients with psoriatic arthritis: an integrated analysis of 4 clinical trials. Ann Rheum Dis 2021; 80: 789.
- [18] Dougados M, Sieper J, Baraliakos X, et al. Ixekizumab: 52‑Week Efficacy and Safety in Radiographic Axial Spondyloarthritis Patients with Prior Inadequate Response/Intolerance to Tumor Necrosis Factor Inhibitors. Arthritis Rheumatol 2019; 71(suppl 10): Abstr 1501.