Jak je to s dostupností léků v České republice?
Souhrn:
Česká republika je malý, vysoce regulovaný trh v rámci zemí Evropské unie. Nedávno se začaly objevovat obavy ohledně dostupnosti některých nepostradatelných léčiv. V České republice je registrováno celkem 58 217 variant léčivých přípravků, z nichž 8 157 (14 %) je v současné době aktivně obchodováno. Důvody neochoty zavést přípravky po registraci na trh jsou mimo jiné komplikovaná národní legislativa, netransparentní a nekonzistentní vymáhání práva, nepředvídatelnost administrativních postihů, nejednoznačná pravidla pro vyjednávání cen a posuny v postupech v závislosti na politických změnách. Ačkoliv je současná situace dávána za vinu reexportům, žádná vyčerpávající studie o rozsahu a původu nedostatku léků neexistuje. Analýza Arete‑Zoe srovnává počty registrovaných a obchodovaných léčivých přípravků dle indikačních skupin a poskytuje vhled do dostupnosti léčiv v České republice ze seznamu nepostradatelných léčiv Světové zdravotnické organizace (WHO). Údaje pocházejí z databáze Státního ústavu pro kontrolu léčiv. Vizualizace dat ukazují vysoké zastoupení v některých terapeutických oblastech (neurologie a psychiatrie, kardiovaskulární léky), zatímco jiné skupiny jsou zastoupeny jen stěží. Z celkového počtu 427 nepostradatelných léčiv ze seznamu WHO je jich v současné době v České republice nedostupných 135. Nejhůře jsou na tom antiinfektiva, antiparazitika a dermatologika. Nedostatek některých nepostradatelných léčiv, specificky injekčních přípravků a starších léčiv, jimž vypršela patentová ochrana, je globálním problémem. Příčiny jsou komplexní, mj. konsolidace průmyslu, potíže při výrobě, zadávání výroby do produkce výrobcům v Číně a Indii, administrativní postihy vůči výrobcům pro nedodržení zásad Správné výrobní praxe, nedostupnost zdrojových materiálů, obchodní bariéry, případně ukončení výroby z ryze obchodních důvodů. Zpráva Úřadu pro odpovědnost vlády (GAO) z července 2016 podrobně zkoumá příčiny nedostatku léčiv ve Spojených státech amerických a navrhuje řešení na národní úrovni. Zdravotnické systémy mají často potíže definovat, jaké jsou potřeby jejich populace. Zároveň nemocnice jsou velmi omezeny v možnostech volby a musejí nakupovat pouze s ohledem na cenu. Světová zdravotnická organizace ve své zprávě (2016) navrhuje minimální garantované ceny pro určité nepostradatelné léky, aby byla zaručena jejich dostupnost v přijatelné kvalitě.
Key words: drug shortages – WHO essential medicines – pharmaceutical market analysis.
Summary:
Czech Republic is a small, highly regulated EU market. Recently, concerns emerged regarding availability of certain essential medicines. There are 58,217 variants of medicinal products registered in the Czech Republic, of which 8,157 (14%) are currently actively marketed. Reasons for reluctance to launch products after approval include complex national regulations, lack of transparency and inconsistent enforcement, unpredictability of administrative actions, ambiguity in price negotiations, and policy shifts in response to political changes. Although the current situation is mainly blamed on re‑exports, there is no comprehensive study of the extent and nature of the shortages. Arte‑Zoe analysis compares numbers of approvals and marketed drugs by indication groups, and provides insight into the availability of World Health Organization (WHO) essential medicines in the Czech Republic. The dataset was obtained from the Czech State Institute of Drug Control. Data visualizations show high representation in some therapeutic areas (neurology and psychiatry, cardiovascular drugs), whilst other groups are hardly present at all. Of the 427 WHO essential medicines, 135 are currently unavailable in the Czech Republic. The worst affected groups are anti‑infectives, anti‑parasitics and dermatologicals. Shortage of certain essential medicines, especially injectables and old off‑patent medicines is a global problem. Its causes are complex and include consolidation of the industry, production issues, outsourcing of manufacturing to India and China, administrative actions against manufacturers for good manufacture practice (GMP) non‑compliance, unavailability of raw materials, trade barriers, as well as discontinuation of production for purely business reasons. Government Accountability Office report from July 2016 scrutinizes in detail causes of shortages in the U.S. and suggests solutions at national level. Health systems have often difficulty defining their populations’ needs. At the same time, hospitals are highly restricted in their choices beyond the sole criterion of price. WHO report (2016) suggested guaranteed minimum prices for certain essential drugs to ensure their availability in appropriate quality.
Konzultační společnost Arete Zoe, LLC, poskytuje celé spektrum služeb v oblasti řízení rizika a optimalizace procesů v oboru zdravotnictví a farmaceutického průmyslu. Tato činnost zahrnuje analýzu procesů, sběr a zpracování informací, produkci zpráv k podpoře rozhodování s cílem snížit riziko a optimalizovat vnitřní fungování organizací. Publikace, kurzy a prezentace na stránkách společnosti poskytují představu o rozsahu a kvalitě projektů, na nichž jsme se měli možnost podílet.
V České republice je aktuálně registrováno 58 217 variant léčivých přípravků, tj. včetně všech lékových forem, sil a velikostí balení. Z těchto více než 58 000 lékových variant jich bylo v posledním čtvrtletí roku 2016 aktivně obchodováno pouze 8 157 (14 %). O registrace léčiv na českém trhu je dle vyjádření Státního ústavu pro kontrolu léčiv (SÚKL) značný zájem, avšak rozhodnutí o tom, zda bude registrovaný léčivý přípravek pacientům skutečně dostupný, je na držiteli rozhodnutí o registraci.
Počet registrovaných léčiv v České republice, která ovšem nejsou na trhu, nyní dosahuje 50 000. Vzhledem k tomu, že v případě nutnosti je možno převzít registraci z jiné země EU [4], není prosté neuvedení na trh po registraci a následná nedostupnost ještě důvodem k panice. Otázkou ovšem je, zda takový postup pro případ krize je tím nejlepším a nejekonomičtějším řešením.
Česká republika je malý trh, navíc s komplikovanými pravidly, často odlišnými od zemí Evropské unie (EU). Pravidla pro vymáhání předpisů nejsou vždy vnímána jako transparentní. Jedním z nejdůležitějších vodítek pro manažery rizika v oboru je historie vymáhání práva, konzistence administrativních postihů vůči různým subjektům, předvídatelnost chování státní správy a pravděpodobnost ovlivnění státní administrativy politickými změnami a náladami v zemi. Zářným příkladem je matoucí používání standardní terminologie „qualified person“ (kvalifikovaná osoba) a „responsible person“ (odpovědná osoba) a definice jejich kompetencí, rolí v oblasti distribuce léčivých přípravků a postavení v organizační struktuře společnosti [5].
Dalším příkladem je inspekce ve skladu léčiv v Rudné v lednu 2017, jejíž výsledek je k dispozici k nahlédnutí v databázi EudraGMDP. Tento nález pouze odkazuje na článek 84 směrnice 2001/83/EC, který pouze přikazuje implementaci Pokynu pro správnou distribuční praxi. Dokument je navíc na internetu označen stále jako důvěrný [6].
Transparentnost v oblasti postihů je jednou ze základních podmínek fungování státní správy. Například americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) na svých stránkách publikuje dopisy kontrolovaným subjektům [7]. Odborná veřejnost má možnost si všechny tyto dopisy stáhnout a podrobně je prozkoumat. Pro farmaceutický průmysl, ale i pro investory je důležité vědět, jakým způsobem úřady řeší standardní situace, zda měří všem stejně a zdali a jakým způsobem je možno se bránit nekalým obchodním praktikám, včetně korupce [8]. Právně administrativní nejistota, nejasná forma tvorby cen a netransparentní prostředí může řadu farmaceutických společností od uvedení léčiv na český trh odradit.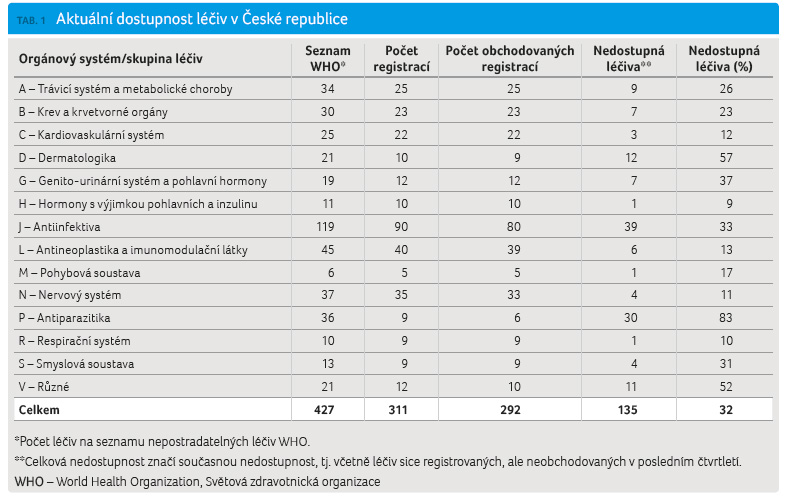
Problematice dostupnosti léčiv věnují česká média pozornost již velmi dlouho [9]. Současná situace je kladena za vinu zpětnému vývozu, ale i nastavení cen léčivých přípravků v ČR ve srovnání se zbytkem Evropy. Studii o aktuální situaci, analýzu příčin současného stavu, srovnání se situací ve světě a návrhy řešení jsem ovšem nenašla. Podrobná studie by měla sloužit jako jeden z podkladů pro přípravu novely zákona o léčivech.
Prvním krokem k usměrnění debaty na dané téma je upřesnění toho, která léčiva na českém trhu jsou a která chybějí a z jakého důvodu tomu tak je.
Analýza dat provedená naší společností [10] porovnává celkový počet registrací a počet ob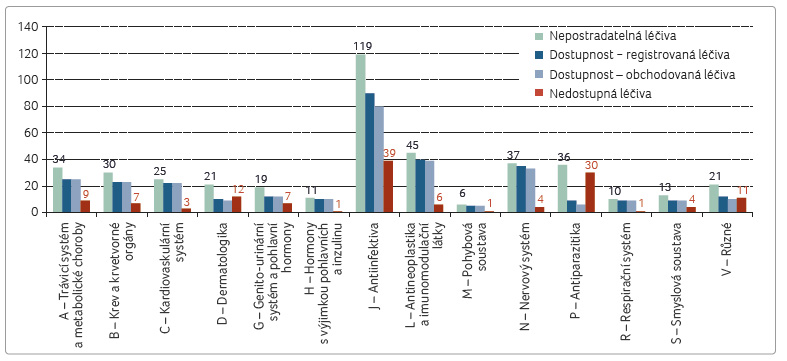 chodovaných registrací na českém trhu, a rovněž dostupnost léčiv na českém trhu se seznamem nezbytných léčiv Světové zdravotnické organizace (World Health Organization, WHO), tab. 1, graf 1−3 [11]. Z vizualizací je zřejmé, že některým léčivým látkám se dostává nebývalé pozornosti: vítězem s nejvyšším počtem 1 190 registrací (48 obchodovaných) se stal pregabalin, lék určený k léčbě úzkostných stavů, neuropatické bolesti a záchvatů. O tento lék je taktéž značný zájem na černém trhu. Nejpočetněji zastoupenými lékovými skupinami jsou přípravky pro nervový systém a dále pak léky pro onemocnění srdce a cév (graf 2). V jiných oborech je výběr a dostupnost léčiv nepoměrně chudší. Příkladem jsou dermatologika, antimikrobiální léčiva – obzvláště pro léčbu mykobakterií, antivirové přípravky, séra, imunoglobuliny a vakcíny, některé skupiny onkologických léčiv, imunos
chodovaných registrací na českém trhu, a rovněž dostupnost léčiv na českém trhu se seznamem nezbytných léčiv Světové zdravotnické organizace (World Health Organization, WHO), tab. 1, graf 1−3 [11]. Z vizualizací je zřejmé, že některým léčivým látkám se dostává nebývalé pozornosti: vítězem s nejvyšším počtem 1 190 registrací (48 obchodovaných) se stal pregabalin, lék určený k léčbě úzkostných stavů, neuropatické bolesti a záchvatů. O tento lék je taktéž značný zájem na černém trhu. Nejpočetněji zastoupenými lékovými skupinami jsou přípravky pro nervový systém a dále pak léky pro onemocnění srdce a cév (graf 2). V jiných oborech je výběr a dostupnost léčiv nepoměrně chudší. Příkladem jsou dermatologika, antimikrobiální léčiva – obzvláště pro léčbu mykobakterií, antivirové přípravky, séra, imunoglobuliny a vakcíny, některé skupiny onkologických léčiv, imunos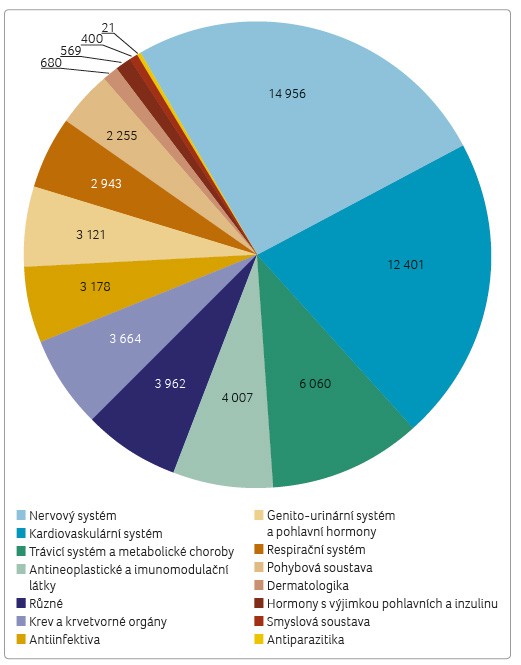 upresiva, anestetika a další. Nejméně jsou na českém trhu zastoupena antiparazitika: z celkem 21 registrací pro celou indikační skupinu jich v posledním čtvrtletí loňského roku bylo obchodovaných jen sedm.
upresiva, anestetika a další. Nejméně jsou na českém trhu zastoupena antiparazitika: z celkem 21 registrací pro celou indikační skupinu jich v posledním čtvrtletí loňského roku bylo obchodovaných jen sedm.
Seznam všech 427 nepostradatelných léčiv je možno nalézt v příloze 3 technické zprávy WHO [12]. Z těchto nenahraditelných léčiv jich v současné chvíli v České republice chybí 135 (tj. 32 %). Nejhůře jsou dotčena antiinfektiva (ze 119 nepostradatelných jich chybí 39), dermatologika (z celkem 21 nepostradatelných chybí 12) a již zmíněná antiparazitika (z 36 nepostradatelných chybí 30). Podrobný rozbor dle orgánových systémů je k dispozici k nahlédnutí a ke stažení na stránkách Arete Zoe.![Jak je to s dostupností léků v České republice? 101 aktuálně Léky a pr ávo nenašla. Podrobná studie by měla sloužit jako jeden z podkladů pro přípravu novely zákona o léčivech. Prvním krokem k usměrnění debaty na dané téma je upřesnění toho, která léčiva na českém trhu jsou a která chybějí a z jakého důvodu tomu tak je. Analýza dat provedená naší společností [10] porovnává celkový počet registrací a počet obchodovaných registrací na českém trhu, a rovněž dostupnost léčiv na českém trhu se seznamem nezbytných léčiv Světové zdravotnické organizace (World Health Organization, WHO), tab. 1, graf 1−3 [11]. Z vizualizací je zřejmé, že některým léčivým látkám se dostává nebývalé pozornosti: vítězem s nejvyšším počtem 1 190 registrací (48 obchodovaných) se stal pregabalin, lék určený k léčbě úzkostných stavů, neuropatické bolesti a záchvatů. O tento lék je taktéž značný zájem na černém trhu. Nejpočetněji zastoupenými lékovými skupinami jsou přípravky pro nervový systém a dále pak léky pro onemocnění srdce a cév (graf 2). V jiných oborech je výběr a dostupnost léčiv nepoměrně chudší. Příkladem jsou dermatologika, antimikrobiální léčiva – obzvláště pro léčbu mykobakterií, antivirové přípravky, séra, imunoglobuliny a vakcíny, některé skupiny onkologických léčiv, imunosupresiva, anestetika a další. Nejméně jsou na českém trhu zastoupena antiparazitika: z celkem 21 registrací pro celou indikační skupinu jich v posledním čtvrtletí loňského roku bylo obchodovaných jen sedm. Seznam všech 427 nepostradatelných léčiv je možno nalézt v příloze 3 technické zprávy WHO [12]. Z těchto nenahraditelných léčiv jich v současné chvíli v České republice chybí 135 (tj. 32 %). Nejhůře jsou dotčena antiinfektiva (ze 119 nepostradatelných jich chybí 39), dermatologika (z celkem 21 nepostradatelných chybí 12) a již zmíněná antiparazitika (z 36 nepostradatelných chybí 30). Podrobný rozbor dle orgánových systémů je k dispozici k nahlédnutí a ke stažení na stránkách Arete‑Zoe. Nedostatek základních léčiv, a především infuzních a injekčních látek, není problémem pouze v České republice. Farmaceutický průmysl se od osmdesátých let dvacátého století podstatně změnil: farmaceutické společnosti se v důsledku vzájemného slučování rozrůstají [13] a řada funkcí je zadávána subdodavatelům v levnějších regionech převážně v Asii [14]. Globalizace s sebou přináší řadu změn, od možnosti získat levné zboží z druhého konce světa po nutnost toto zboží z druhého konce světa dovézt a taktéž dohlédnout na jeho přijatelnou kvalitu [15]. V tomto směru je nejvíce aktivní FDA, který aktivně kontroluje indické a čínské výrobce léčiv, než se jejich produkty dostanou na americký trh [16]; FDA také vede databázi léčiv, která na trhu chybějí [17], a každoročně připravuje zprávu pro Kongres [18]. V červenci 2016 pak Úřad pro zodpovědnou vládu (GAO) vydal rozsáhlou zprávu o příčinách nedostatku léčiv a způsobech dosažení nápravy [19]. V lednu 2016 vydala WHO zprávu [20], jakým způsobem je možno řešit nedostatek některých léků, a to jak ve vyspělých, tak v rozvojových zemích. Nedostatek postihuje především léčiva starší, s prošlými patenty, ovšem s náročným výrobním postupem. Příčiny jsou různé: zejména potíže se získáním chemických materiálů pro výrobu a problémy ve výrobě, omezený počet výrobců některých zdrojových chemikálií, administrativní opatření proti výrobci, a to především ze strany FDA proti výrobcům v Indii a Číně, a obchodní překážky bránící přístupu na trh. Řada starších léčiv je výrobci opuštěna z ryze obchodních důvodů. Novější léčiva ve stejné indikační skupině jsou výnosnější, byť ne vždy opodstatněná pro všechny skupiny pacientů. Studie z různých zemí jmenují nové technologie jako jednu z důležitých příčin nedostatku některých léčiv [21]. Bohužel, zdravotnické systémy ve vyspělých zemích, a tím spíše ne v zemích chudších, mají potíže definovat, jaká léčiva a v jakém množství jejich populace potřebují. V mnoha zemích nemocnice nakupují na základě nejnižší možné nabídky, bez možnosti výběru zdroje, distributora, cesty a způsobu dodání, kvality zabezpečení dodavatelského řetězce a bez přihlédnutí k dalším kritériím. Relativně nízký objem dodávek objednávaných na poslední chvíli v relativně malých množstvích v kombinaci s neustálým tlakem na cenu činí z některých nepostradatelných léčiv ztrátové produkty. Kromě notifikačních systémů a globální databáze léčiv ohrožených nedostatkem doporučuje WHO taktéž dohodu minimálních cen pro určité produkty, aby byla zajištěna jejich dostupnost v přiměřené kvalitě. GRAF 3 Podíl obchodovaných léčiv na českém trhu dle AT C skupin. AT C – Anatomicko-terapeuticko-chemická klasifikace léčiv](https://www.remedia.cz/photo-a-31060---.jpg)
Nedostatek základních léčiv, a především infuzních a injekčních látek, není problémem pouze v České republice. Farmaceutický průmysl se od osmdesátých let dvacátého století podstatně změnil: farmaceutické společnosti se v důsledku vzájemného slučování rozrůstají [13] a řada funkcí je zadávána subdodavatelům v levnějších regionech převážně v Asii [14]. Globalizace s sebou přináší řadu změn, od možnosti získat levné zboží z druhého konce světa po nutnost toto zboží z druhého konce světa dovézt a taktéž dohlédnout na jeho přijatelnou kvalitu [15]. V tomto směru je nejvíce aktivní FDA, který aktivně kontroluje indické a čínské výrobce léčiv, než se jejich produkty dostanou na americký trh [16]; FDA také vede databázi léčiv, která na trhu chybějí [17], a každoročně připravuje zprávu pro Kongres [18]. V červenci 2016 pak Úřad pro zodpovědnou vládu (GAO) vydal rozsáhlou zprávu o příčinách nedostatku léčiv a způsobech dosažení nápravy [19].
V lednu 2016 vydala WHO zprávu [20], jakým způsobem je možno řešit nedostatek některých léků, a to jak ve vyspělých, tak v rozvojových zemích. Nedostatek postihuje především léčiva starší, s prošlými patenty, ovšem s náročným výrobním postupem. Příčiny jsou různé: zejména potíže se získáním chemických materiálů pro výrobu a problémy ve výrobě, omezený počet výrobců některých zdrojových chemikálií, administrativní opatření proti výrobci, a to především ze strany FDA proti výrobcům v Indii a Číně, a obchodní překážky bránící přístupu na trh. Řada starších léčiv je výrobci opuštěna z ryze obchodních důvodů. Novější léčiva ve stejné indikační skupině jsou výnosnější, byť ne vždy opodstatněná pro všechny skupiny pacientů. Studie z různých zemí jmenují nové technologie jako jednu z důležitých příčin nedostatku některých léčiv [21].
Bohužel, zdravotnické systémy ve vyspělých zemích, a tím spíše ne v zemích chudších, mají potíže definovat, jaká léčiva a v jakém množství jejich populace potřebují. V mnoha zemích nemocnice nakupují na základě nejnižší možné nabídky, bez možnosti výběru zdroje, distributora, cesty a způsobu dodání, kvality zabezpečení dodavatelského řetězce a bez přihlédnutí k dalším kritériím. Relativně nízký objem dodávek objednávaných na poslední chvíli v relativně malých množstvích v kombinaci s neustálým tlakem na cenu činí z některých nepostradatelných léčiv ztrátové produkty. Kromě notifikačních systémů a globální databáze léčiv ohrožených nedostatkem doporučuje WHO taktéž dohodu minimálních cen pro určité produkty, aby byla zajištěna jejich dostupnost v přiměřené kvalitě.
Seznam použité literatury
- [2] Zákon 378/2007 Sb., o léčivech, § 33.
- [3] Zákon 378/2007 Sb., o léčivech, § 34a.
- [4] Zákon 378/2007 Sb., o léčivech, § 44.
- [5] MacDonald G. Three drug wholesalers have failed GDP checks according to Czech regulator. In‑Pharma Technologist, 22‑Jun‑2016, http://www.in‑pharmatechnologist.com/Regulatory‑Safety/Three‑drug‑wholesalers‑have‑failed‑GDP‑checks‑according‑to‑Czech‑regulator (navštíveno 24. ledna 2017)
- [6] EudraGMDP database: Good Distribution Practice – non‑compliance reports http://eudragmdp.ema.europa.eu/inspections/view/gdp/viewGDPCertificate.xhtml (navštíveno 24. ledna 2017)
- [7] Food and Drug Administration: Inspections, Compliance, Enforcement, and Criminal Investigations. Warning letters http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/ucm2005393.htm (navštíveno 24. ledna 2017)
- [8] Securities and Exchange Commission: SEC Enforcement Actions: Foreign Corrupt Practices Act (FCPA) Cases https://www.sec.gov/spotlight/fcpa/fcpa‑cases.shtml (navštíveno 24. ledna 2017)
- [9] Česká televize: Máte slovo s Michaelou Jílkovou na téma: Co vás trápí ohledně léků? 27. října 2016. http://www.ceskatelevize.cz/porady/
- [10] Arete‑Zoe, LLC: http://www.aretezoe.com/czech
- [11] World Health Organization: ATC/DDD Index 2017: https://www.whocc.no/atc_ddd_index/ (navštíveno 24. ledna 2017)
- [12] Report of the WHO Expert Committee: The Selection and Use of Essential Medicines 2015. (WHO, 2015). http://apps.who.int/iris/bitstream/10665/189763
- [13] Vij R. Pharma Industry Mergers and Acquisitions Analysis 1995 to 2015. Revenues and Profits, 17. února 2017. http://revenuesandprofits.com/pharma‑industry‑merger‑and‑acquisition‑analysis‑1995‑2015/ (navštíveno 24. ledna 2017)
- [14] Walker N. Nice Insight Outsourcing Trends in 2016 http://www.americanpharmaceuticalreview.com/Featured‑Articles/184362‑Nice‑Insight‑Outsourcing‑Trends‑in‑2016/ (navštíveno 24. ledna 2017)
- [15] Arete‑Zoe. Pharmaceutical Supply Chain Integrity and Security, květen 2016. http://www.aretezoe.com/supply‑chain‑integrity‑security (navštíveno 24. ledna 2017)
- [16] Government Accountability Office: FDA Has Improved Its Foreign Drug Inspection Program, but Needs to Assess the Effectiveness and Staffing of Its Foreign Offices GAO‑17‑143: Publikováno 16. prosince 2016, zveřejněno 17. ledna 2017. http://gao.gov/products/GAO‑17‑143 (navštíveno 24. ledna 2017)
- [17] Food and Drug Administration: Drug shortages. http://www.fda.gov/Drugs/DrugSafety/DrugShortages/ (navštíveno 24. ledna 2017)
- [18] Food and Drug Administration: Third Annual Report on Drug Shortages for Calendar Year 2015 Required by Section 1002 of the Food and Drug Administration Safety and Innovation Act. http://www.fda.gov/downloads/Drugs/DrugSafety/DrugShortages/UCM488353.pdf (navštíveno 24. ledna 2017)
- [19] Government Accountability Office: Certain Factors Are Strongly Associated with This Persistent Public Health Challenge GAO‑16‑595: Publikováno 7. července 2016, zveřejněno 7. července 2016. http://www.gao.gov/products/GAO‑16‑595 (navštíveno 24. ledna 2017)
- [20] WHO: Medicines shortages Global approaches to addressing shortages of essential medicines in health systems WHO Drug Information Vol. 30, No. 2, 2016 http://www.who.int/medicines/publications/druginformation/WHO_DI_30‑2_Medicines.pdf (navštíveno 24. ledna 2017)