Jak máme postupovat u pacientů s fibrilací síní podle nových evropských doporučení?
V srpnu 2010 byla zveřejněna nová doporučení pro vyšetřování a léčbu pacientů s fibrilací síní. Hlavními součástmi léčby jsou prevence a ovlivnění základního srdečního onemocnění, tzv. upstream léčba, prevence tromboembolických příhod, kontrola srdeční frekvence a kontrola rytmu. Perorální antikoagulační léčba je indikována častěji než dříve, jsou zavedeny nové systémy rizikové stratifikace tromboembolie, tzv. CHA2DS2-VASc skóre, i rizika krvácivých komplikací, tzv. HAS-BLED skóre. Primárním cílem antiarytmické léčby je ovlivnění symptomů. Kontrolou srdeční frekvence se zpočátku snažíme dosáhnout hodnot pod 110 tepů/min („lenient control“), při trvání obtíží či vzniku dysfunkce levé komory používáme intenzivnější („strict control“) léčbu. Ke kontrole rytmu je vhodný dronedaron, propafenon, flekainid, sotalol nebo amiodaron. Jednotlivá antiarytmika volíme podle přítomnosti srdečního onemocnění, hlavní důraz klademe na bezpečnost léčby.
Úvod
Koncem srpna 2010 byla zveřejněna nová doporučení pro vyšetřování a léčbu pacientů s fibrilací síní (FS) Evropské kardiologické společnosti [1]. Jaké jsou změny oproti předchozím doporučením z roku 2006 [2]?
Nová doporučení mají trochu odlišný název. Změna se týká formulace pro management pacientů s FS, která je nyní nahrazena výrazem pro management FS. Původní znění bylo patrně výstižnější, protože zdůrazňovalo, že léčíme pacienta, nikoliv jen samotnou arytmii. Na rozdíl od předchozích doporučení, jež byla společná pro evropskou (ECS) i americké kardiologické společnosti (AHA, ACC), je jejich současná verze publikována jen Evropskou kardiologickou společností. Odůvodněním jsou některé odlišné postupy (a patrně i názory autorů) na obou kontinentech. Rozdílné je také používání některých antiarytmik. Např dofetilid se v Evropě nepoužívá, ale v USA ano.
Epidemiologie a mechanismy vzniku
Výskyt FS narůstá, v současné době tato arytmie postihuje 1–2 % populace. Protože většina atak FS proběhne asymptomaticky, bude se výskyt onemocnění blížit spíše horní hranici. FS je spojena se zvýšenou mortalitou, s rizikem iktu, s častějšími hospitalizacemi, se sníženou kvalitou života a často také se srdečním selháním. Nejčastější příčinou FS jsou změny srdce probíhající se stárnutím, hypertenze, srdeční selhání, onemocnění chlopní, kardiomyopatie a další kardiovaskulární onemocnění. Kromě klasických rizikových faktorů pro vznik FS jsou uvedena nová rizika. Více než 20 % pacientů s FS trpí ICHS, 25 % je obézních, 20 % je léčeno pro diabetes mellitus, 10–15 % má chronickou renální insuficienci, často se také vyskytuje spánková apnoe. Byl popsán rovněž familiární výskyt FS, svědčící pro genetické predispozice k onemocnění. Hlavním patogenetickým mechanismem vzniku FS je strukturální remodelace síní spojená s nehomogenitou vedení impulzu. Změny postihují jak samotné myocyty, tak extracelulární matrix. Také u pacientů s tzv. izolovanou („lone“) FS byly pozorovány zánětlivé změny a fibróza. Při FS jsou změněny i elektrofyziologické vlastnosti síní. K jejich poznání přispělo hlavně provádění ablací. U paroxysmální FS je dominujícím mechanismem fokální spouštěcí ektopie v plicních žilách, u perzistující FS nabývá na důležitosti rovněž mechanismus mnohočetných reentry.
Diagnóza a klasifikace
Základem diagnózy FS je dokumentace FS v EKG, pokud možno 12svodovém. Svědčí-li obtíže pacienta pro možnost FS, lze provést některý ze způsobů monitorace EKG až po diagnózu stanovenou pomocí holterovských funkcí implantovaných kardiostimulátorů, ![Obr. 1 Klasifikace fibrilace síní; podle [1] – Camm, et al., 2010.](https://www.remedia.cz/photo-a-28400---.jpg) defibrilátorů či implantabilních monitorů. FS obvykle progreduje od asymptomatických atak přes paroxysmy FS po perzistující FS. V klasifikaci FS (obr. 1) rozeznáváme první zachycenou ataku, která může přecházet v paroxysmální FS (ataky končí spontánně, obvykle do 48 hodin), dále perzistující FS (ataky trvající déle než 7 dní či ataky vyžadující kardioverzi), dlouhodobě perzistující FS (trvání déle než 1 rok, ale je stále zvažována obnova sinusového rytmu, nejčastěji ablací) a permanentní FS (trvale akceptovanou, bez zvažování intervencí). Nově přibyla kategorie dlouhodobě perzistující FS.
defibrilátorů či implantabilních monitorů. FS obvykle progreduje od asymptomatických atak přes paroxysmy FS po perzistující FS. V klasifikaci FS (obr. 1) rozeznáváme první zachycenou ataku, která může přecházet v paroxysmální FS (ataky končí spontánně, obvykle do 48 hodin), dále perzistující FS (ataky trvající déle než 7 dní či ataky vyžadující kardioverzi), dlouhodobě perzistující FS (trvání déle než 1 rok, ale je stále zvažována obnova sinusového rytmu, nejčastěji ablací) a permanentní FS (trvale akceptovanou, bez zvažování intervencí). Nově přibyla kategorie dlouhodobě perzistující FS.
Léčba pacienta s FS
Základem léčby pacienta s FS je léčba základního onemocnění (pokud je přítomno), dále prevence tromboembolických příhod a kontrola srdeční frekvence nebo srdečního rytmu.
Prevence tromboembolických příhod
Oproti starší verzi prodělala největší změny doporučení k prevenci tromboembolických příhod (TE). Stávající a pro svou jednoduchost široce rozšířená riziková stratifikace pomocí CHADS2 skóre je vhodná pro základní posouzení a při vyšším riziku TE. Pacienti s CHADS2 skóre 1 však mají stále výrazně vyšší riziko TE a je u nich přínosnější 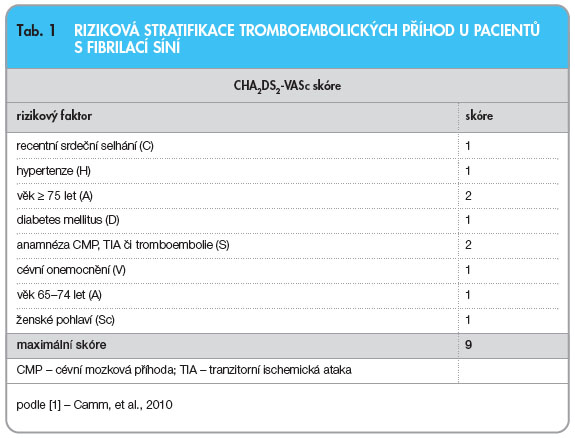 antikoagulační léčba než léčba antiagregační. Nově se proto doporučuje podrobnější CHA2DS2-VASc skóre (tab. 1): nejvyšší riziko představuje věk (A2) nad 75 let a předchozí anamnéza iktu (S2), jež jsou ohodnoceny dvěma body. Za každý další rizikový faktor (srdeční selhání s ejekční frakcí levé komory ≤ 40 %, hypertenze, diabetes, cévní onemocnění, věk nad 65 let, ženské pohlaví) se skóre zvyšuje o jeden bod. Riziko TE je kumulativní, největší při maximálním počtu 9 bodů. U pacientů s rizikovým skóre ≥ 2 je indikována perorální antikoagulační léčba, u pacientů s rizikem 1 je antikoagulační léčba vhodnější, u pacientů bez rizikových faktorů není
antikoagulační léčba než léčba antiagregační. Nově se proto doporučuje podrobnější CHA2DS2-VASc skóre (tab. 1): nejvyšší riziko představuje věk (A2) nad 75 let a předchozí anamnéza iktu (S2), jež jsou ohodnoceny dvěma body. Za každý další rizikový faktor (srdeční selhání s ejekční frakcí levé komory ≤ 40 %, hypertenze, diabetes, cévní onemocnění, věk nad 65 let, ženské pohlaví) se skóre zvyšuje o jeden bod. Riziko TE je kumulativní, největší při maximálním počtu 9 bodů. U pacientů s rizikovým skóre ≥ 2 je indikována perorální antikoagulační léčba, u pacientů s rizikem 1 je antikoagulační léčba vhodnější, u pacientů bez rizikových faktorů není 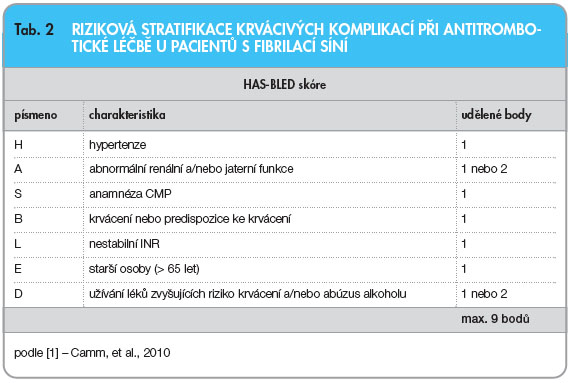 doporučena léčba žádná či se podává léčba antiagregační (ASA – kyselina acetylsalicylová). Podle CHA2DS2-VASc stratifikace TE má více než 90 % pacientů s FS skóre ≥ 1. Skórovací systémy lze prakticky shrnout tak, že v současné době je antikoagulační léčba vhodná pro naprostou většinu pacientů s FS s výjimkou mužů mladších 65 let bez dalších rizikových faktorů. Se stoupajícím rizikem TE se při terapii zvyšuje také riziko krvácivých komplikací. Toto riziko lze odhadnout pomocí HAS-BLED skóre (tab. 2), kde se za každý rizikový faktor počítá také jeden bod, maximální počet je 9 bodů. Jako rizika krvácení jsou zde uvedena hypertenze, abnormální funkce jater a/nebo ledvin, iktus, anamnéza krvácení, nestabilní hodnoty INR při léčbě, věk nad 65 let, konzumace vyšších dávek alkoholu a/nebo léků zvyšujících riziko krvácení. Při HAS-BLED skóre≥ ≥ 3 je během antikoagulační léčby nutná zvýšená opatrnost, neznamená to však, že bychom tuto léčbu neměli podávat.
doporučena léčba žádná či se podává léčba antiagregační (ASA – kyselina acetylsalicylová). Podle CHA2DS2-VASc stratifikace TE má více než 90 % pacientů s FS skóre ≥ 1. Skórovací systémy lze prakticky shrnout tak, že v současné době je antikoagulační léčba vhodná pro naprostou většinu pacientů s FS s výjimkou mužů mladších 65 let bez dalších rizikových faktorů. Se stoupajícím rizikem TE se při terapii zvyšuje také riziko krvácivých komplikací. Toto riziko lze odhadnout pomocí HAS-BLED skóre (tab. 2), kde se za každý rizikový faktor počítá také jeden bod, maximální počet je 9 bodů. Jako rizika krvácení jsou zde uvedena hypertenze, abnormální funkce jater a/nebo ledvin, iktus, anamnéza krvácení, nestabilní hodnoty INR při léčbě, věk nad 65 let, konzumace vyšších dávek alkoholu a/nebo léků zvyšujících riziko krvácení. Při HAS-BLED skóre≥ ≥ 3 je během antikoagulační léčby nutná zvýšená opatrnost, neznamená to však, že bychom tuto léčbu neměli podávat.
Perorální antikoagulační léčbou se v „guidelines“ rozumí léčba antagonisty vitaminu K (VKA) v terapeutickém rozmezí INR 2,0–3,0 (cílová hodnota 2,5). Počet naměřených hodnot v tomto intervalu by při sledování měl být co nejvyšší.
Pokud je doba s hodnotami INR v terapeutickém rozmezí (time in therapeutic range, TTR) < 60 %, není léčba VKA přínosnější než podávání ASA. U některých skupin nemocných, např. se srdečním selháním, je obtížné hodnot TTR < 60 % dosáhnout.
Pro pacienty s akutním koronárním syndromem a perkutánní koronární intervencí platí zvláštní doporučení. V těchto případech je vhodné použití trojkombinace klopidogrel + ASA + VKA. Zvyšuje se sice riziko výraznějšího krvácení, avšak kombinace ASA + klopidogrel není v prevenci TE u FS dostatečná. Trojkombinace by měla být podávána po dobu 2 týdnů až 6 měsíců v závislosti na použitém stentu a riziku krvácení určeném podle HAS-BLED skóre. Cílová hodnota INR dosažená při trojkombinaci by měla být v rozmezí 2,0–2,5. Klopidogrel je indikován v závislosti na typu intervence až po dobu 12 měsíců, poté následuje trvalá antikoagulační léčba bez ASA. U pacientů, kteří z různých důvodů nemohou v současnosti užívat perorální antikoagulancia, je možné zvážit léčbu kombinací klopidogrelu s ASA, která je účinnější než monoterapie ASA, ale je spojena s vyšším rizikem krvácení. V blízké budoucnosti však tuto indikaci nahradí nová antitrombotika.
V době tvorby nových „guidelines“ nebyla v Evropě schválena pro použití u pacientů s FS jiná antitrombotika než VKA, i když byla již dříve v praxi užívána v dalších indikacích (prevence TE po kloubních náhradách). Byly však již publikovány výsledky studie RE-LY [3]. Dabigatran prokázal v prevenci TE u pacientů s FS v dávce 2krát denně 110 mg stejnou účinnost jako warfarin, ale vyskytlo se méně nežádoucích účinků, v dávce 2krát denně 150 mg byl dabigatran účinnější než warfarin se stejným počtem nežádoucích účinků. Evropská doporučení proto předpokládají použití dabigatranu jako alternativu léčby VKA. U pacientů s nižším rizikem krvácení (HAS-BLED skóre 0–2) bude vhodná vyšší a účinnější dávka 150 mg 2krát denně, při vyšším riziku krvácení (HAS-BLED skóre ≥ 3) pak bezpečnější nižší dávka 110 mg 2krát denně. U pacientů s jedním méně závažným rizikem TE bude možné zvážit podávání dabigatranu v dávce 110 mg. V USA byl dabigatran pro prevenci TE u FS již schválen, ovšem jen v dávce 2krát 150 mg, případně v dávce 2krát denně 75 mg pro pacienty se selháváním ledvin [4]. V Evropě se schválení očekává 23. 6. 2011.
Studie ROCKET AF ukázala, že rivaroxaban je srovnatelně účinný jako warfarin (non-inferiorita při „intention-to-treatment“ analýze), případně účinnější než warfarin (superiorita při „on-treatment“ analýze). Uvedení rivaroxabanu na trh pro použití v prevenci TE u FS se očekává patrně na podzim 2011. U apixabanu se zjistila vyšší účinnost ve srovnání s ASA, výsledky studie porovnávající apixaban s warfarinem budou prezentovány v létě 2011. V současnosti probíhá další studie porovnávající účinek edoxabanu versus VKA. V horizontu dvou let bychom tedy mohli mít k dispozici až čtyři nová antitrombotika pro prevenci TE u FS. Tato oblast léčby FS se tedy velmi rychle vyvíjí a je pravděpodobné, že i nová „guidelines“ budou brzy potřebovat úpravy či doplňky.
Kontrola srdeční frekvence a kontrola rytmu
Studie porovnávající kontrolu srdečního rytmu a kontrolu srdeční frekvence nenalezly mezi oběma způsoby léčby rozdíl v morbiditě a mortalitě. Podobná data jsou také u FS při srdečním selhání. Analýzy studie AFFIRM ukázaly, že sinusový rytmus je sice spojen s nižší mortalitou (-53 %), podávání současných antiarytmik ke kontrole rytmu však výhodu udržení sinusového rytmu neutralizuje, protože je spojeno se vzestupem mortality (+49 %).
Základní možností k ovlivnění symptomů při FS je kontrola frekvence, jíž léčbu začínáme (obr. 2). Pokud obtíže trvají ne![Obr. 2 Doporučení ke kontrole srdeční frekvence, případně ke kontrole srdečního rytmu u pacientů s různými formami fibrilace síní; podle [1] – Camm, et al., 2010.](https://www.remedia.cz/photo-a-28401---.jpg) bo je kontrola nedostatečná, lze zvážit kontrolu rytmu. V každém individuálním případě je možné zvážit kontrolu rytmu jako počáteční léčbu. Studie RACE II [5] nenalezla rozdíl mezi méně intenzivní („lenient“, klidová frekvence < 110 tepů /min) a intenzivní („strict“, klidová frekvence < 80 tepů/min) kontrolou frekvence. Intenzivní kontroly bylo přitom možné dosáhnout jen obtížně a s nutností častějších hospitalizací. Proto jako výchozí postačuje frekvence < 110 tepů/min. Při trvání obtíží či zhoršování funkce srdce lze pak zkusit intenzivnější kontrolu frekvence, ověřovanou pomocí holterovské monitorace EKG, případně sledovat reakci na zátěž pomocí ergometrie.
bo je kontrola nedostatečná, lze zvážit kontrolu rytmu. V každém individuálním případě je možné zvážit kontrolu rytmu jako počáteční léčbu. Studie RACE II [5] nenalezla rozdíl mezi méně intenzivní („lenient“, klidová frekvence < 110 tepů /min) a intenzivní („strict“, klidová frekvence < 80 tepů/min) kontrolou frekvence. Intenzivní kontroly bylo přitom možné dosáhnout jen obtížně a s nutností častějších hospitalizací. Proto jako výchozí postačuje frekvence < 110 tepů/min. Při trvání obtíží či zhoršování funkce srdce lze pak zkusit intenzivnější kontrolu frekvence, ověřovanou pomocí holterovské monitorace EKG, případně sledovat reakci na zátěž pomocí ergometrie.
Americká „update guidelines“ [6] také považují za dostačující dosažení klidové frekvence < 110 tepů/min. Současně však upozorňují, že rozsah studie RACE II (pouhých 614 pacientů s dosažením 81 kardiovaskulárních příhod) nemůže být dostatečný pro definitivní rozhodnutí. Dosažení klidové frekvence < 80 tepů/min je obtížné, na druhou stranu hodnota 110 tepů/min je možná příliš vysoká. V léčbě ICHS a srdečního selhání platí, že nižší srdeční frekvence jsou výhodnější.
Základním cílem léčby FS antiarytmiky je ovlivnění symptomů. Účinnost antiarytmik při kontrole rytmu je jen průměrná. Úspěchem léčby je proto spíše snížení recidiv FS než jejich vymizení. Je-li jedna léčivá látka neúčinná, lze zkusit látku jinou. Je třeba pamatovat na možné nežádoucí účinky antiarytmik, a to hlavně proarytmické a nekardiální. Důležitějším ukazatelem při volbě antiarytmika je bezpečnost léčby než její účinnost.
K prevenci recidiv FS používáme propafenon, sotalol, amiodaron, případně flekainid. Nově se v doporučeních objevuje další antiarytmikum, dronedaron. Ve studii ATHENA [7] u 4628 pacientů s FS a kardiovaskulárním rizikovým faktorem (hypertenze, diabetes, anamnéza iktu, TIA nebo embolizace, dilatace levé síně, ejekční frakce levé komory < 40 % nebo věk ≥ 70 let) dronedaron významně ovlivnil hlavní kombinovaný ukazatel – počet hospitalizací a úmrtí. Ve zpětné analýze dat byl zjištěn i pokles výskytu iktů, a to nezávisle na antitrombotické léčbě.
Volba antiarytmika záleží na přítomnosti strukturálního postižení srdce (obr. 3). Pokud není postižení přítomno nebo je mírné, lze použít dronedaron, propafenon, flekainid, sotalol. U hypertoniků s hypertrofií levé komory a při mírné srdeční insuficienci (NYHA I–II) se doporučuje dronedaron. U těžší srdeční insuficience je možné použít amiodaron, naopak dronedaron není v tomto případě vhodný. U ICHS je doporučen dronedaron nebo sotalol. Účinnost amiodaronu v prevenci FS je vyšší než účinnost ostatních antiarytmik, u nichž je účinnost obdobná. Pro nežádoucí účinky je však amiodaron indikován až při selhání nebo nevhodnosti bezpečnější medikace. Betablokátory ovlivňují výskyt FS při zvýšeném tonu sympatiku, jsou vhodné také ke kontrole frekvence a k léčbě vyvolávajících onemocnění, jako je hypertenze.
![Obr. 3 Kontrola srdečního rytmu u pacientů s fibrilací síní. Použití antiarytmik se řídí přítomností srdečního onemocnění. Při neúspěchu medikace lze zvážit katetrizační ablaci, u pacientů s paroxysmální arytmií v individuálních případech jako léčbu první volby; podle [1] – Camm, et al., 2010.](https://www.remedia.cz/photo-a-28379---.jpg) Pokud trvají obtíže pacienta i při farmakologické kontrole srdeční frekvence a rytmu, lze zvážit katetrizační ablaci (obr. 3). Paliativní výkon v podobě ablace AV uzlu a implantace kardiostimulátoru indikujeme v případech, kdy neuvažujeme o selektivní ablaci, nebo v případech, kdy tato léčba selhala nebo byla odmítnuta. Kromě toho ablaci AV uzlu provádíme u pacientů s resynchronizační léčbou srdečního selhání, abychom umožnili maximální uplatnění biventrikulární stimulace.
Pokud trvají obtíže pacienta i při farmakologické kontrole srdeční frekvence a rytmu, lze zvážit katetrizační ablaci (obr. 3). Paliativní výkon v podobě ablace AV uzlu a implantace kardiostimulátoru indikujeme v případech, kdy neuvažujeme o selektivní ablaci, nebo v případech, kdy tato léčba selhala nebo byla odmítnuta. Kromě toho ablaci AV uzlu provádíme u pacientů s resynchronizační léčbou srdečního selhání, abychom umožnili maximální uplatnění biventrikulární stimulace.
O indikaci ke kurativní selektivní ablaci rozhoduje kromě symptomů také doba trvání FS, velikost levé síně, přítomnost a závažnost kardiálního onemocnění a také preference pacienta. V „guidelines“ se nezdůrazňuje vliv věku pacienta, v praxi je však věk důležitý z hlediska tolerance výkonu, jeho úspěšnosti a rizika komplikací. Vzhledem k náročnosti a možným komplikacím by měly být výkony soustředěny do zkušených center. Studie, které porovnávaly úspěšnost ablací s medikací, většinou prokázaly výrazně vyšší úspěšnost ablací. Doba sledování po výkonu však byla většinou krátká a pacienti byli již primárně rezistentní na antiarytmika. K ablaci jsou indikováni hlavně pacienti s paroxysmální FS, u nichž je úspěšnost vysoká. U vybraných pacientů lze zvážit ablaci i jako léčbu první volby. U pacientů s perzistující a zejména dlouhodobě perzistující FS je úspěšnost zákroku nižší, často jsou nutné opakované výkony. Technologie používané k ablacím jsou velmi rozdílné, pro nedostatek porovnávacích studií však nelze určit, která je nejvhodnější.
U pacientů se symptomatickou FS podstupujících kardiochirurgický výkon je indikována chirurgická perioperační ablace. Vzhledem k malým rizikům výkonu lze perioperační ablaci zvážit i u asymptomatických nemocných. Ablace je schůdná i bez současné kardiochirurgické operace jako thorakoskopický nebo minimálně invazivní výkon, ve srovnání s katetrizačními ablacemi je pro tento postup zatím málo dat.
Upstream léčba
U FS by měla být jako primární léčba a prevence onemocnění, která arytmii způsobují. Sama FS pak způsobuje další remodelační změny. Tak zvaná upstream léčba má za cíl ovlivnit či zabránit remodelaci síní spojené s hypertenzí, srdečním selháním či se zánětlivými onemocněními. Primárně preventivní použití upstream léčby může zabránit novým atakám FS, sekundární prevencí pak můžeme předejít dalším recidivám arytmie. Nejvíce dostupných údajů je u ACE-inhibitorů (ACE-I) a blokátorů receptorů pro aldosteron (ARB). V meta-analýzách byl většinou prokázán příznivý efekt v prevenci FS u hypertenze a srdečního selhání, v největší analýze 25 studií byl zaznamenán pokles FS o 35 % [8]. V prospektivních sekundárně preventivních studiích (GISSI, ANTIPAF) však ARB výskyt FS nesnížily, ve studii ACTIVE I neovlivnily tyto blokátory výskyt kardiovaskulárních příhod. ACE-I a ARB jsou proto doporučeny v primární prevenci FS u pacientů se srdečním selháním a s hypertenzí (a zejména s hypertrofií levé komory). U pacientů po kardiochirurgických operacích lze zvážit terapii statiny. Upstream léčba s využitím ACE-I, ARB či statinů není indikována v primární prevenci FS u pacientů bez kardiovaskulárního onemocnění. V sekundární prevenci FS a u pacientů bez výraznějšího kardiovaskulárního onemocnění jsou data pro upstream léčbu méně prokazatelná. Pro ostatní up-stream léčbu s výjimkou ACE-I, ARB a statinů, případně ještě betablokátorů, nejsou data dostatečná vůbec (např. pro podávání vícenenasycených mastných kyselin).
Závěr
Celkově jsou nová „guidelines“ přehlednější než ta předchozí. V prevenci TE příhod jsou striktnější, antikoagulační léčba je doporučována častěji než dříve, v současnosti u naprosté většiny pacientů s FS. Kontrola srdečního rytmu a kontrola frekvence je zaměřena hlavně na ovlivnění symptomatologie. Byly rozšířeny indikace pro provádění katetrizačních ablací. Nová evropská „guidelines“ budou v květnu 2011 následovat také nová česká doporučení, vycházející více z konkrétních podmínek a možností v ČR.
Seznam použité literatury
- [1] Camm AJ, Kirchhof P, Lipp YH, et al. Guidelines for the management of atrial fibrillation: The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31: 2369–2429. Epub 2010 Aug 29.
- [2] Fuster V, Rydén LE, Cannom DS, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: full text: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for practice Guidelines (Writing Committee to Revise the 2001 guidelines for the management of patients with atrial fibrillation) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace 2006, 8: 651–745.
- [3] Connolly SJ, Ezekowitz MD, Yusuf S, et al. RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009, 361: 1139–1151.
- [4] Wann LS, Curtis AB, Ellenbogen KA. ACCF/AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Updating on Dabigatran). J Am Coll Cardiol 2011; March 15 [Epub ahead of print].
- [5] Van Gelder IC, Groenveld HF, Crijns HJ, et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362: 1363–1373.
- [6] VWann LS, Curtis AB, January CT et al. ACCF/ AHA/HRS focused update on the management of patients with atrial fibrillation (updating the 2006 guideline): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 123: 104–123.
- [7] Hohnloser SH, Crijns HJ, van Eickels M, et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009, 360: 668–678.
- [8] Zhang Y, Zhang P, Mu Y, et al. The role of renin-angiotensin system blockade therapy in the prevention of atrial fibrillation: a meta-analysis of randomized controlled trials. Clin Pharmacol Ther 2010, 88: 521–531. Epub 2010 Sep 1.