Jaké jsou naše znalosti o jaterních enzymech
Při příležitosti XLIX. májových hepatologických dnů konaných 11.–13. května 2022 v Olomouci proběhlo mimo jiné sympozium společnosti PRO.MED.CS Praha. Přednášející – MUDr. Václav Šmíd, Ph.D., ze IV. interní kliniky gastroenterologie a hepatologie 1. LF UK a VFN v Praze a profesor MUDr. Libor Vítek, Ph.D., ze IV. interní kliniky a Ústavu lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze – se v něm zabývali tím, co vše víme a nevíme o jaterních enzymech.
Při příležitosti XLIX. májových hepatologických dnů konaných 11.–13. května 2022 v Olomouci proběhlo mimo jiné sympozium společnosti PRO.MED.CS Praha. Přednášející – MUDr. Václav Šmíd, Ph.D., ze IV. interní kliniky gastroenterologie a hepatologie 1. LF UK a VFN v Praze a profesor MUDr. Libor Vítek, Ph.D., ze IV. interní kliniky a Ústavu lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze – se v něm zabývali tím, co vše víme a nevíme o jaterních enzymech.
Jaterní enzymy, jak je pravděpodobně známe
„Téměř třetina dospělých mužů a 10 % dospělých žen má zvýšené hodnoty jaterních testů minimálně v jednom parametru, a je tedy namístě, aby interpretace jejich výsledků byla precizní a správná a aby toto téma bylo diskutováno nejen mezi hepatology, ale i mezi lékaři jiných oborů,“ uvedl svůj příspěvek MUDr. Šmíd.
Jaterní testy se dělí na funkční (liver function test), kam patří základní panel vyšetření, která slouží především k vyloučení hepatocelulárního poškození a cholestázy, k posouzení syntetické funkce jater bychom měli rutinně stanovovat hodnotu albuminu a protrombinový čas (tzv. Quick test). K přesné diagnostice příčiny jaterního poškození je často nutné využít další analyty (tzv. rozšířený panel), mezi něž patří hodnota autoprotilátek, sérologie a ev. provádíme genetické testování. V poslední době se zvýšením incidence nealkoholového postižení jater při steatóze (non alcoholic fatty liver disease, NAFLD) vzrůstá potřeba neinvazivní diagnostiky histopatologických změn, které se odehrávají v jaterním parenchymu – zejména steatózy a fibrózy. Ukázalo se, že velmi účinné jsou tzv. skórovací indexy, které kombinují několik laboratorních a klinických parametrů a mají velmi dobrou výpovědní hodnotu [1].
Základní panel jaterních testů
K základnímu panelu jaterních testů patří stanovení hodnoty bilirubinu, která vypovídá o funkční kapacitě jater. Pokud máme pacienta s izolovanou hyperbilirubinemií, musíme pomýšlet na Gilbertův syndrom (nekonjugovaná hyperbilirubinemie). Běžné rozmezí celkového bilirubinu se pohybuje mezi 3–17 μmol/l. Kdybychom měli vyloučit hemolýzu u pacientů, kteří nemají chronické jaterní onemocnění, nepřesahují většinou koncentrace bilirubinu 70 μmol/l. Na výsledky jaterních testů je nutné pohlížet odděleně, nelze je hodnotit jako soubor. Aspartátaminotransferáza (AST) a alaninaminotransferáza (ALT) představují markery hepatocelulárního poškození. Alaninaminotransferáza je oproti AST specifičtější, uvolňuje se z cytosolu při poškození membrány, vyskytuje se také v kosterním svalstvu. Aspartátaminotransferáza má mitochondriální a cytoplazmatickou formu. Je třeba mít na paměti, že AST je výrazně přítomna rovněž v kosterním svalstvu, myokardu, ledvinách a dalších orgánech, a reflektovat to při diferenciální diagnostice [2].
Dále vyšetřujeme hodnotu gamaglutamyltransferázy (GGT), která není jen markerem pro cholestázu, její aktivita je zvýšená i při nadměrné konzumaci alkoholu, při NAFLD, někteří autoři zdůrazňují, že je to marker oxidačního stresu v organismu. Syntézu GGT indukují obezita, alkohol a některé léky, je velmi dobrým prediktorem „jaterní mortality“. Gamaglutamyltransferáza není přítomna v kostech, ale je přítomna v membránách buněk s vysokou sekreční nebo absorpční kapacitou: biliární epitel, proximální tubuly ledvin, střevo, pankreas, prostata [3].
Dalším parametrem základního panelu je alkalická fosfatáza (ALP), která se vyskytuje v biliárním epitelu, kostech, placentě, méně ve střevě a leukocytech. V dětství bývá hodnota ALP zvýšena fyziologicky (zejména v období rychlého růstu), a rovněž v těhotenství. Dále bývá zvýšena u kuřáků a obézních jedinců. Při izolované elevaci je nutno pomýšlet na deficit vitaminu D, Pagetovu chorobu nebo metapostižení skeletu [4].
Komplexní panel jaterních testů
Pokud mluvíme o jaterních testech, nikdy bychom neměli zůstat jen u výše jmenovaných pěti parametrů, ale měli bychom se vždy v rámci diagnostiky jaterního onemocnění opírat o komplexní panel, kam patří ukazatele proteosyntetické funkce.
Albumin představuje hlavní plazmatický protein a je produkován pouze játry. Má řadu funkcí (onkotický tlak, transport, antioxidační funkce atd.) a je markerem syntetické funkce jater. Jeho koncentrace mohou být zvýšené při sepsi/šoku (únik do třetího prostoru), při systémovém onemocnění, nefrotickém syndromu, malabsorpci atd. Prealbumin je také produkován pouze játry, je markerem syntetické funkce jater a jeho krátký biologický poločas umožňuje monitorovat úspěšnost nutriční intervence. Zároveň je negativním reaktantem akutní fáze – cytokiny suprimují jeho produkci při zánětu bez ohledu na nutriční stav pacienta.
Markerem syntetické funkce jater je rovněž protrombinový čas, který je nezastupitelným parametrem v diagnostice akutního jaterního selhání. K jeho prodloužení dochází v situacích, kdy klesá množství koagulačních faktorů pod 70 %. Prodloužení protrombinového času nastává také v případě deficitu vitaminu K, malabsorpce tuků nebo chronické cholestázy.
Pacienti s chronickým nebo velmi pokročilým jaterním onemocněním mají často trombocytopenii. Příčinou poklesu počtu trombocytů může být snížená produkce trombopoetinu, suprese kostní dřeně při užívání alkoholu, při přetížení železem nebo vlivem léků či působením virů. U cirhotiků dochází ke slezinné sekvestraci (hypersplenismus/portální hypertenze) a k poškození trombocytů nespecificky vlivem střižných sil, fibrinolýzy a bakteriální translokace. U autoimunitních chorob se může objevit imunologicky mediovaná destrukce tzv. protidestičkovými imunoglobuliny.
Další parametry
Mezi další parametry patří
5’nukleotidáza, jež je nespecifická, je přítomna v mnoha
tkáních a její zvýšená hodnota ukazuje
na hepatobiliární/cholestatické onemocnění zejména při
současné elevaci ALP a/nebo GGT. Dále je možné sledovat
laktátdehydrogenázu (LDH), karbohydrát deficientní
transferin (CDT) či etylglukuronid v moči pro průkaz abúzu
alkoholu, gamaglobuliny a močové kyseliny.
Pokud máme u pacienta podezření na nějakou specifickou jaterní chorobu, opíráme se o rozšířený panel pro screening jaterních chorob (tab. 1), přičemž postupujeme od levnějších metod po ty dražší a náročnější. Diferenciální diagnostika jaterních chorob představuje relativně komplikovaný proces.
Doporučené postupy
Jak již bylo uvedeno, vždy se opíráme o pět základních parametrů: bilirubin, AST, ALT, GGT a ALP. Dále bychom měli stanovit hodnotu albuminu a krevní obraz. Jednotlivé analyty vyhodnocujeme odděleně. Například poměr AST/ALT má řadu konsekvencí: je to nejen marker alkoholové choroby jater (více než 96% specificita při poměru > 3), ale poměr AST/ALT > 1 i při fyziologických hodnotách upozorňuje na možnou přítomnost jaterní fibrózy, či dokonce cirhózy [5].
Pokud pátráme po specifické jaterní chorobě (virové hepatitidy atp.), je třeba se opírat také o osobní a rodinnou anamnézu a zjistit, zda pacient nepochází z rizikové skupiny (migrace, abúzus drog v minulosti, pobyt ve výkonu trestu apod.). Rozšířený panel testů tedy provádíme na základě klinické úvahy.
Management abnormálních jaterních testů aneb Co je třeba zdůrazňovat kolegům
- Vždy je třeba nabírat kompletní panel v rámci standardního testování.
- V případě hodnot jaterních testů zvýšených mimo referenční mez je třeba vyšetřovat opakovaně kvůli dynamice.
- Jak správně reagovat na zvýšené hodnoty jaterních testů.
- Výše a trvání abnormálních hodnot jaterních testů neimplikují následná vyšetření – ta mají být provedena ihned [5].
Jaterní testy jsou dobrými prediktory jaterních komplikací. Zvýšené aktivity AST a ALT jsou spojeny se zvýšenou mortalitou v budoucnosti [6]. Hodnota GGT > 0,68 μkat/l ukazuje na vyšší incidenci kardiovaskulárního onemocnění (KVO) a diabetes mellitus 2. typu (DM2), GGT v rozmezí 0,417–0,68 μkat/l signalizuje zvýšené riziko rozvoje DM2; AST > 0,68 μkat/l ukazuje na zvýšenou incidenci KVO, ale nikoliv DM2 [7]. Zvýšené aktivity GGT a ALT jsou spojeny s rizikem vzniku KVO, asociace aktivity ALT vyžaduje další zkoumání [7]. Velké epidemiologické studie silně naznačují, že zvýšená aktivita GGT koreluje se vznikem KVO, ischemické choroby srdeční, arteriální hypertenze, srdečního selhání, arytmií a s mortalitou související s KVO [3]. Zvýšená aktivita GGT a ALT predikuje rozvoj metabolického syndromu v budoucnosti [3].
Jaterní testy zasahují i do oblasti neurologie – zvýšená aktivita GGT je významně spojena se zvýšeným rizikem rozvoje cévní mozkové příhody (nezávisle na příjmu alkoholu) [8]. Zvýšená aktivita i kolísání GGT jsou nezávislým rizikovým faktorem pro rozvoj vaskulární demence i Alzheimerovy choroby; diabetici s polyneuropatií mají signifikantně vyšší GGT (oproti diabetikům bez polyneuropatie) [9].
Důležité poznatky přinášejí
recentní práce o jaterních testech a genetickém pozadí,
které odhalují 300 genetických variant asociovaných
s cirkulujícími jaterními enzymy [10]. Genetické pozadí má
vliv na průběh léčby (léčebnou odpověď), má význam pro
lepší pochopení patogeneze jaterních onemocnění a identifikaci
nejrizikovějších pacientů mimo referenční meze.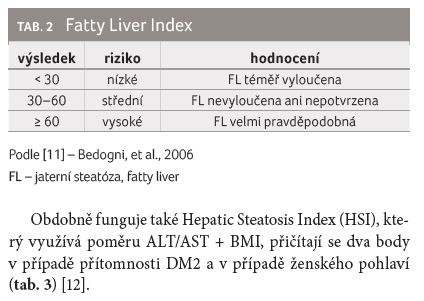
Indexy a skórovací systémy
K nejdůležitějším indexům a skórovacím systémům patří Fatty Liver Index (FLI) využívající snadno dostupné parametry: obvod pasu, index tělesné hmotnosti (BMI), triacylglyceroly, GGT; kde výsledek ≥ 60 upozorňuje na velmi pravděpodobnou přítomnost jaterní steatózy (fatty liver, FL), tabulka 2 [11].
Obdobně funguje také Hepatic Steatosis Index (HSI), který využívá poměru ALT/AST + BMI, přičítají se dva body v případě přítomnosti DM2 a v případě ženského pohlaví (tab. 3) [12].
Španělská práce, v níž autoři pět let sledovali téměř 17 000 osob, doložila, že skóre FLI u pacientů s prediabetem nezávisle predikuje konverzi do DM2 [13]. Nepříznivý výsledek tohoto indexu může tedy být jednoznačným výstupem pro pacienta
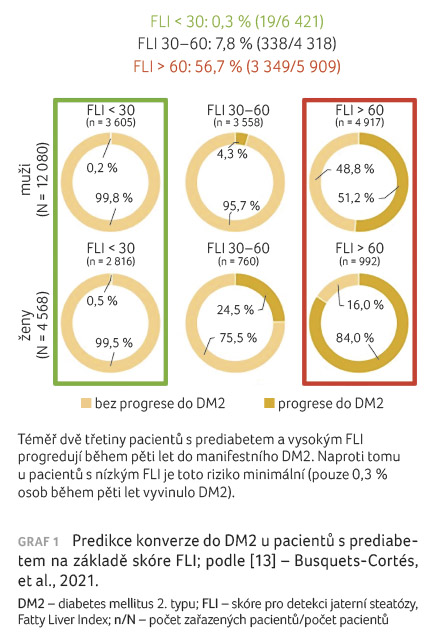
v podobě varování před riziky vzniku DM2 a motivace ke změně životního stylu (graf 1).
Skóre FLI je rovněž nezávisle
asociováno s jaterní mortalitou, KVO a onkologickými
onemocněními [14,15]. Podle výsledků sledování s přibližně
50 000 pacienty každý decil FLI zvyšuje riziko vzniku infarktu
myokardu a ischemické cévní mozkové příhody [16].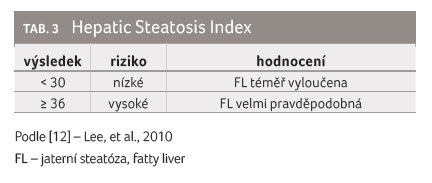
V případě diagnostiky jaterní fibrózy lze použít FIB 4 Score (věk, ALT, AST, trombocyty), kde výsledek > 2,67 znamená pravděpodobnou přítomnost významné fibrózy (F3–F4). Hodnota < 1,3 naopak absenci významné fibrózy (F0–F2), rozmezí 1,3–2,67 představuje neurčité skóre s požadavkem dalších vyšetření [17,18].
Dalším indexem je NAFLD Fibrosis Score (NFS; věk, hmotnost, DM2, ALT, AST, trombocyty, albumin), prediktorem přítomnosti významné fibrózy je v tomto případě výsledek > 0,675. Hodnota nižší než –1,455 je prediktorem absence významné fibrózy (F0–F2), rozmezí –1,455 až 0,675 znamená neurčitý výsledek [19]. NFS lze dnes již rovněž stáhnout jako aplikaci do telefonu či počítače, skórovací systémy jsou zde registrovány jako zdravotnický prostředek. Výsledek je možno uchovat v kartě pacienta v tištěné nebo elektronické podobě.
Doporučené postupy Americké diabetologické asociace (ADA) z roku 2020 v této souvislosti nově upozorňují na to, že diabetolog by se u svých pacientů měl zaměřit i na jaterní testy a zvážit možnou přítomnost NAFLD, a uvádějí kroky pro postup při zjišťování dané diagnózy [20].
Kontroverze výsledků jaterních testů
Závěrem doktor Šmíd upozornil na některé kontroverze a často opomíjená fakta spojená s výsledky jaterních testů. Podle literatury má zhruba 8–20 % dospělých zvýšenou hodnotu alespoň jednoho parametru jaterních testů. Je třeba si uvědomit, že normální výsledky jaterních testů nevylučují pokročilé jaterní onemocnění (kompenzovaní cirhotici mívají nezřídka téměř normální jaterní testy!). Skórovací systémy nezahrnují většinu jaterních testů. Důležité je proto neopomínat stanovení hodnot albuminu, mezinárodního normalizovaného poměru (INR) a počtu trombocytů, které tyto indexy zahrnují. U cirhotiků prodloužený INR nevypovídá o skutečném stavu koagulace, neboť je u nich přítomen defekt prokoagulačních i antikoagulačních drah [21]. Jednotlivé analyty je nutné hodnotit vždy odděleně (hepatocelulární vs. cholestatická jaterní léze). V případě zvýšených hodnot jaterních testů provádíme ihned další vyšetření (ultrasonografie, elastografie atp.), klíčové je včas intervenovat, abychom předešli rozvoji pokročilé jaterní choroby a zahájili vhodnou léčbu. Neinvazivní skórovací systémy (FIB 4, NFS) by měly být podle přednášejícího implementovány do výsledkového listu a/nebo do zdravotnického IT systému.
Jaterní enzymy, jak je zřejmě neznáme
Přednáška profesora Vítka byla soustředěna na parametry GGT a ALP. Oba dva tyto obstrukční enzymy si zaslouží větší pozornost, neboť nám mohou pomoci v diferenciální diagnostice.
Alkalická fosfatáza
Alkalická fosfatáza má řadu izoenzymů, z nichž praktický význam mají izoenzymy kostní, jaterní, střevní a placentární. Ovšem vyšetření izoenzymů ALP v běžné klinické praxi využíváme jen velmi málo. Ze souboru 165 000 pacientů ve Všeobecné fakultní nemocnici v Praze v roce 2019 byla pouze u 232 osob vyšetřena ALP elektroforeticky. Jaterní ALP představuje izoformu lokalizovanou na kanalikulárním pólu hepatocytu a ve výstelce žlučových cest, funguje tedy jako marker cholestázy. Izoelektrickou fokusací lze detekovat až 12 izoenzymů zastoupených v nejrůznějších orgánech, jako jsou plíce, cévy, ledviny, slezina, slinné žlázy, svaly, štítná žláza, pankreas, ovaria atd., a dokonce existují tři jaterní izoenzymy (kanalikulární, hepatocelulární, z Kupfferových buněk). V této souvislosti se např. v Jižní Karolíně v devadesátých letech minulého století pokoušeli provádět tzv. biochemickou biopsii jater, jakkoliv nedošlo k širšímu využití v klinické praxi [22].
Referenční meze ALP se v jednotlivých zdravotnických zařízeních liší, což značně komplikuje hodnocení (např. ve VFN jsou hodnoty pro muže 0,67–2,15 μkat/l a pro ženy 0,58–1,74 μkat/l). Intestinální ALP má rovněž protektivní účinky: deaktivuje bakteriální lipopolysacharid, ovlivňuje střevní mikrobiom, inaktivuje protizánětlivé působky (lipopolysacharidy, nukleotidy atd.) a prezervuje bariérové funkce střeva. ALP je ovlivňována přijímanou potravou. Pokud přijímáme příliš mnoho mastných kyselin s dlouhým řetězcem, dochází ke zvyšování hodnoty intestinální ALP [23]. Terapeuticky lze používat ALP pro její protektivní účinky. Většina sledování na toto téma je zatím experimentálních na zvířatech, ale lze zmínit práci profesora Lukáše, která hodnotila malý soubor 20 pacientů s ulcerózní kolitidou, jimž byla aplikována telecí ALP a bylo prokázáno snížení aktivity tohoto střevního onemocnění [24]. Ačkoliv to v literatuře nebývá často zmiňováno, ALP ovlivňuje i celkovou mortalitu, včetně kardiovaskulární, pro což dnes již existuje řada přesvědčivých dat publikovaných v prestižních časopisech [25,26].
Gamaglutamyltransferáza
Gamaglutamyltransferáza (GGT) je přítomna v tkáních s exkretorickou nebo absorpční funkcí a také v prostatě (o 50 % vyšší referenční meze u mužů) a v placentě (vyšší aktivita u novorozenců). Nachází se v játrech v mikrosomální frakci, na kanalikulárním pólu hepatocytů a v membránách buněk výstelky žlučových cest. Je markerem cholestázy, abúzu alkoholu a zvýšeného oxidačního stresu (NAFLD/nealkoholová steatohepatitida, NASH).
Existuje nejméně sedm genů kódujících GGT. Enzym se vyskytuje v játrech, ledvinách, pankreatu, krevních destičkách, leukocytech (monocyty/makrofágy), mléčné žláze, prostatě, mozku, placentě, tlustém střevě, štítné žláze ad. [27]. Heritabilita GGT (do značné míry sdílená s ALT/AST) se udává 50–77 %. Aktivita závisí na BMI (marker viscerální adipozity), etnicitě, kouření, užívání alkoholu atd.
Referenční meze jsou pro GGT ve VFN nastaveny na intervaly u mužů 0,14–0,84 μkat/l a u žen 0,14–0,68 μkat/l a vycházejí z práce Ceriottiho a kol. [28]. Co se týče prevalence elevace jaterních enzymů v české populaci, má hodnoty GGT zvýšeny téměř třetina mužů (28,9 %) a skoro 9 % žen. Hodnoty ALT má zvýšeny 9,7 % mužů a 1,8 % žen. Hodnoty tří hlavních jaterních enzymů – ALT/AST/GGT – jsou zvýšeny u 32,6 % mužů a 9,7 % žen [29,30]. GGT ovlivňuje celkovou mortalitu, jak dokládá např. práce z roku 1997, kde byla u osob s hodnotou GGT > 0,83 μkat/l zaznamenána asi 2,5krát vyšší mortalita [31]. I pokud je aktivita GGT vyšší v mezích normy, je celková mortalita zvýšena [32]. Zároveň je elevace GGT asociována s vyšším rizikem vzniku vaskulárních příhod, nezávisle na abúzu alkoholu [3,33]. Je zde také vyšší relativní riziko rozvoje DM2. V jedné klinické studii měli jedinci s nejvyšší aktivitou GGT o 34 % vyšší riziko rozvoje DM2 v porovnání s osobami ve spodním tercilu [34].
Izoforma GGT v trombocytech ovlivňuje konverzi leukotrienu C4 na D4 a moduluje dostupnost oxidu dusnatého v trombocytech. Aktivita GGT se zvyšuje u nemocí spojených s hyperaktivací a konzumpcí trombocytů (akutní infarkt myokardu, diabetes mellitus, hyperlipoproteinemie, ischemická choroba dolních končetin aj.), existuje tedy pozitivní korelace mezi počtem trombocytů a aktivitou GGT [35].
GGT je přítomna rovněž v ateromatózních plátech, částečně vlivem akumulovaných trombocytů, ale i pěnových buněk, pochází tedy i z makrofágů. Enzym zde oxiduje LDL hydrolýzou glutathion na cysteinylglycin, který redukuje trojmocné železo na dvojmocné a spouští reakce spojené s oxidací, což akceleruje proces aterosklerózy [36–38].
Dalšími nemocemi asociovanými s elevací GGT jsou arteriální hypertenze, atriální fibrilace, chronické srdeční selhání, dyslipidemie, chronická obstrukční plicní nemoc, chronické renální selhání, kostní nemoc (riziko fraktur), demence, Alzheimerova choroba, epilepsie, intrakraniální tumory [39]. Zvýšená aktivita GGT je též spojována se zvýšeným rizikem rozvoje nádorových onemocnění [40], s chronickou pankreatitidou a rizikem vzniku karcinomu pankreatu [41].
Jak snížit aktivitu jaterních enzymů?
K redukci aktivity jaterních enzymů přispívají kromě terapeutických opatření především režimová opatření, tedy zdravá dieta. Některé potraviny mohou ovlivňovat aktivitu jaterních enzymů [42,43]. „V osmdesátých letech byla za škodlivou označena káva společně s cigaretami, dnes však víme, že káva působí velmi významně protektivně a aktivitu GGT redukuje,“ zdůraznil profesor Vítek [44,45]. U zeleného čaje zaznamenáváme částečnou kontroverzi, protože působí i hepatotoxicky v případě některých obsažených látek [46,47]. Průběh NAFLD zlepšují listová zelenina, luštěniny, vláknina, rybí tuk, omega 3 mastné kyseliny [48–51]. Také například práce kolektivu VFN publikovaná v lednu letošního roku prokázala prospěch z užívání omega 3 mastných kyselin u pacientů s NAFLD [52]. S omega 3 mastnými kyselinami souvisí konzumace ořechů, které jsou bohatým zdrojem těchto kyselin a opět pomáhají snižovat aktivitu jaterních enzymů [53]. Kurkumin působí na zmírňování oxidačního stresu [54], slunečnicová semínka jsou opět bohatým zdrojem omega 3 mastných kyselin [55], důležitou potravinou je i česnek [56].
Farmakologických látek, které snižují aktivitu jaterních enzymů, je řada. Můžeme jmenovat přímá antivirotika u hepatitidy C, k látkám používaným v běžné klinické praxi patří kyselina ursodeoxycholová (UDCA), která redukuje aktivitu ALT a GGT [57]. Metaanalýza 20 klinických studií prokázala, že UDCA snižuje aktivitu ALT/GGT u NAFLD, autoimunitní hepatitidy i hepatitidy B a C [58]. Uvedené možnosti máme k dispozici, pokud nepostačují režimová opatření.
Závěr
„Jaterní enzymy nemusejí být vždy úplně jaterní,“ podotkl závěrem přednášející a vysvětlil, že distribuce těchto enzymů v organismu je ubikvitérní a dochází k ní téměř v celém organismu. Aktivity těchto enzymů v běžné populaci jsou významnými markery NAFLD/NASH a současně i signifikantními prediktory kardiovaskulární i celkové morbidity a mortality.
Prevalence elevace jaterních enzymů je v české populaci vysoká. Je velice žádoucí snižovat aktivity jaterních enzymů – režimovými opatřeními i farmakoterapií.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Boyer TD, Manns MP, Sanyal AJ (eds.). Zakim and Boyer’s Hepatology (Sixth Edition), W.B. Saunders, 2012.
- [2] Gazzin S, Vitek L, Watchko J, et al. A Novel Perspective on the Biology of Bilirubin in Health and Disease. Trends Mol Med 2016; 22: 758–768.
- [3] Ndrepepa G, Kastrati A. Gamma‑glutamyl transferase and cardiovascular disease. Ann Transl Med 2016; 4: 481.
- [4] Pratt DS, Kaplan MM. Evaluation of Abnormal Liver‑Enzyme Results in Asymptomatic Patients. N Engl J Med 2000; 342: 1266–1271.
- [5] Newsome PN, Cramb R, Davison SM, et al. Guidelines on the management of abnormal liver blood tests. Gut 2018; 67: 6–19.
- [6] Lee WM, Squires RH Jr, Nyberg SL, et al. Acute liver failure: Summary of a workshop. Hepatology 2008; 47: 1401–1415.
- [7] Monami M, Bardini G, Lamanna C, et al. Liver enzymes and risk of diabetes and cardiovascular disease: results of the Firenze Bagno a Ripoli (FIBAR) study. Metabolism 2008; 57: 387–392.
- [8] Zhang W, Tang Z, Shi Y, et al. Association Between Gamma‑Glutamyl Transferase, Total Bilirubin and Systemic Lupus Erythematosus in Chinese Women. Front Immunol 2021; 12: 682400.
- [9] Gasecka A, Siwik D, Gajewska M, et al. Early Biomarkers of Neurodegenerative and Neurovascular Disorders in Diabetes. J Clin Med 2020; 9: 2807.
- [10] Chen VL, Du X, Chen Y, et al. Genome‑wide association study of serum liver enzymes implicates diverse metabolic and liver pathology. Nat Commun 2021; 12: 816.
- [11] Bedogni G, Bellentani S, Miglioli L, et al. The Fatty Liver Index: a simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol 2006; 6: 33.
- [12] Lee J‑H, Kim D, Kim HJ, et al. Hepatic steatosis index: a simple screening tool reflecting nonalcoholic fatty liver disease. Dig Liver Dis 2010; 42: 503–508.
- [13] Busquets‑Cortés C, Bennasar‑Veny M, López‑González A, et al. Fatty liver index and progression to type 2 diabetes: a 5‑year longitudinal study in Spanish workers with pre‑diabetes. BMJ Open 2021; 11: e045498.
- [14] Bonnet F, Gastaldelli A, Pihan‑Le Bars F, et al. Gamma‑glutamyltransferase, fatty liver index and hepatic insulin resistance are associated with incident hypertension in two longitudinal studies. J Hypertens 2017; 35: 493–500.
- [15] Calori G, Lattuada G, Ragogna F, et al. Fatty liver index and mortality: the Cremona study in the 15th year of follow‑up. Hepatology 2011; 54: 145–152.
- [16] Kim JH, Moon JS, Byun SJ, et al. Fatty liver index and development of cardiovascular disease in Koreans without pre‑existing myocardial infarction and ischemic stroke: a large population‑based study. Cardiovasc Diabetol 2020; 19: 51.
- [17] Sterling RK, Lissen E, Clumeck N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006; 43: 1317–1325.
- [18] Vallet‑Pichard A, Mallet V, Nalpas B, et al. FIB‑4: An inexpensive and accurate marker of fibrosis in HCV infection. comparison with liver biopsy and fibrotest. Hepatology 2007; 46: 32–36.
- [19] Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45: 846–854.
- [20] American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes – 2020. Diabetes Care 2020; 43(Suppl 1): S14–S31.
- [21] Thachil J. Relevance of clotting tests in liver disease. Postgrad Med J 2008; 84: 177–181.
- [22] Griffiths J, Black J. Separation and identification of alkaline phosphatase isoenzymes and isoforms in serum of healthy persons by isoelectric focusing. Clin Chem 1987; 33: 2171–2177.
- [23] Lallès J‑P. Intestinal alkaline phosphatase: multiple biological roles in maintenance of intestinal homeostasis and modulation by diet. Nutrition Reviews 2010; 68: 323–332.
- [24] Lukas M. Inflammatory Bowel Disease as a Risk Factor for Colorectal Cancer. Dig Dis 2010; 28: 619–624.
- [25] Wannamethee SG, Sattar N, Papcosta O, et al. Alkaline phosphatase, serum phosphate, and incident cardiovascular disease and total mortality in older men. Arterioscler Thromb Vasc Biol 2013; 33: 1070–1076.
- [26] Tonelli M, Curhan G, Pfeffer M, et al. Relation between alkaline phosphatase, serum phosphate, and all‑cause or cardiovascular mortality. Circulation 2009; 120: 1784–1792.
- [27] Courtay C, Heisterkamp N, Siest G, Groffen J. Expression of multiple gamma‑glutamyltransferase genes in man. Biochem J 1994; 297(Pt 3): 503–508.
- [28] Ceriotti F, Henny J, Queraltó J, et al. Common reference intervals for aspartate aminotransferase (AST), alanine aminotransferase (ALT) and g‑glutamyl transferase (GGT) in serum: results from an IFCC multicenter study. Clin Chem Lab Med 2010; 48: 1593–1601.
- [29] Cífková R, Bruthans J, Wohlfahrt P, et al. The prevalence of major cardiovascular risk factors in the Czech population in 2015–2018. The Czech post‑MONICA study. Cor Vasa 2020; 62: 6–16.
- [30] Eremiasova L, Hubacek JA, Danzig V, et al. Serum Bilirubin in the Czech Population – Relationship to the Risk of Myocardial Infarction in Males. Circ J 2020; 84: 1779–1785.
- [31] Brenner H, Rothenbacher D, Arndt V, et al. Distribution, Determinants, and Prognostic Value of γ‑Glutamyltransferase for All‑Cause Mortality in a Cohort of Construction Workers from Southern Germany. Prev Med 1997; 26: 305–310.
- [32] Kazemi‑Shirazi L, Endler G, Winkler S, et al. Gamma Glutamyltransferase and Long‑Term Survival: Is It Just the Liver? Clin Chem 2007; 53: 940–946.
- [33] Fraser A, Harris R, Sattar N, et al. Gamma‑glutamyltransferase is associated with incident vascular events independently of alcohol intake: analysis of the British Women's Heart and Health Study and Meta‑Analysis. Arterioscler Thromb Vasc Biol 2007; 27: 2729–2735.
- [34] Kunutsor SK, Abbasi A, Adler AI. Gamma‑glutamyl transferase and risk of type II diabetes: an updated systematic review and dose‑response meta‑analysis. Ann Epidemiol 2014; 24: 809–816.
- [35] Gürdöl F, Nwose OM, Mikhailidis DP. Gamma‑glutamyl Transferase Activity in Human Platelets: Quantification of Activity, Isoenzyme Characterization and Potential Clinical Relevance. Platelets 1995; 6: 200–203.
- [36] Whitfield JB, Zhu G, Nestler JE, et al. Genetic Covariation between Serum γ‑Glutamyltransferase Activity and Cardiovascular Risk Factors. Clin Chem 2002; 48: 1426–1431.
- [37] Franzini M, Corti A, Martinelli B, et al. γ‑Glutamyltransferase activity in human atherosclerotic plaques – Biochemical similarities with the circulating enzyme. Atherosclerosis 2009; 202: 119–127.
- [38] Emdin M, Pompella A, Paolicchi A. Gamma‑Glutamyltransferase, Atherosclerosis, and Cardiovascular Disease. Circulation 2005; 112: 2078–2080.
- [39] Kunutsor SK. Gamma‑glutamyltransferase – friend or foe within? Liver Int 2016; 36: 1723–1734.
- [40] Kunutsor SK, Apekey TA, Van Hemelrijck M, et al. Gamma glutamyltransferase, alanine aminotransferase and risk of cancer: Systematic review and meta‑analysis. Int J Cancer 2015; 136: 1162–1170.
- [41] Brand H, Diergaarde B, O’Connell MR, et al. Variation in the Gamma‑Glutamyltransferase 1 (GGT1) Gene and Risk of Chronic Pancreatitis. Pancreas 2013; 42: 836–840.
- [42] Mega A, Marzi L, Kob M, et al. Food and Nutrition in the Pathogenesis of Liver Damage. Nutrients 2021; 13: 1326.
- [43] Rosqvist F, Rydell A, Iggman D. The Effects of Foods on Blood Lipids in Non‑alcoholic Fatty Liver Disease (NAFLD) – A Systematic Review and Meta‑Analysis. Front Nutr 2020; 7: 613221.
- [44] Heath RD, Brahmbhatt M, Tahan AC, et al. Coffee: The magical bean for liver diseases. World J Hepatol 2017; 9: 689–696.
- [45] Nakanishi N, Nakamura K, Nakajima K, et al. Coffee consumption and decreased serum γ‑glutamyltransferase: a study of middle‑aged Japanese men. Eur J Epidemiol 2000; 16: 419–423.
- [46] Pezeshki A, Safi S, Feizi A, et al. The Effect of Green Tea Extract Supplementation on Liver Enzymes in Patients with Nonalcoholic Fatty Liver Diseas. Int J Prev Med 2016; 7: 28.
- [47] Palacio Sánchez E, Ribero Vargas ME, Restrepo Gutiérrez. Hepatotoxicity due to green tea consumption (Camellia Sinensis): A review. Rev Col Gastroenterol 2013; 28: 43–49.
- [48] Mokhtari E, Farhadnejad H, Salehi‑Sahlabadi A, et al. Spinach consumption and nonalcoholic fatty liver disease among adults: a case‑control study. BMC Gastroenterol 2021; 21: 196.
- [49] Bahrami A, Teymoori F, Eslamparast T, et al. Legume intake and risk of nonalcoholic fatty liver disease. Indian J Gastroenterol 2019; 38: 55–60.
- [50] Ross AB, Godin J‑P, Minehira K, Kirwan JP. Increasing whole grain intake as part of prevention and treatment of nonalcoholic Fatty liver disease. Int J Endocrinol 2013; 2013: 585876.
- [51] Lu W, Li S, Li J, et al. Effects of Omega‑3 Fatty Acid in Nonalcoholic Fatty Liver Disease: A Meta‑Analysis. Gastroenterol Res Pract 2016; 2016: 1459790.
- [52] Šmíd V, Dvořák K, Šedivý P, et al. Effect of Omega‑3 Polyunsaturated Fatty Acids on Lipid Metabolism in Patients With Metabolic Syndrome and NAFLD. Hepatol Comm 2022; 6: 1336–1349.
- [53] Zhang S, Fu J, Zhang Q, et al. Association between nut consumption and non‑alcoholic fatty liver disease in adults. Liver Int 2019; 39: 1732–1741.
- [54] Goodarzi R, Sabzian K, Shishehbor F, Mansoori A. Does turmeric/curcumin supplementation improve serum alanine aminotransferase and aspartate aminotransferase levels in patients with nonalcoholic fatty liver disease? A systematic review and meta‑analysis of randomized controlled trials. Phytother Res 2019; 33: 561–570.
- [55] Cheenam B, Leena P. Effects of sunflower seeds on LFT levels of patients with fatty liver (grade 1). J Innov Pharm Biol Sci 2017; 4.
- [56] Soleimani D, Paknahad Z, Hossein Rouhani M. Therapeutic Effects of Garlic on Hepatic Steatosis in Nonalcoholic Fatty Liver Disease Patients: A Randomized Clinical Trial. Diabetes Metab Syndr Obes 2020; 13: 2389–2397.
- [57] Bellentani S, Tiribelli C, Saccoccio G, et al. Prevalence of chronic liver disease in the general population of northern Italy: The dionysos Study. Hepatol 1994; 20: 1442–1449.
- [58] Reardon J, Hussaini T, Alsahafi M, et al. Ursodeoxycholic Acid in Treatment of Non‑cholestatic Liver Diseases: A Systematic Review. J Clin Transl Hepatol 2016; 4: 192–205.