Úvod
Léčebné postupy se u nemocných s diabetem mellitem 2. typu (DM2)
v posledních letech mění. Ukázalo se, že pouhé snížení hyperglykémie je pro snížení rizika chronických cévních komplikací nedostačující.
Nadějnou skupinou léčiv, která působí komplexně na metabolickou poruchu nemocných s DM2, jsou thiazolidindiony (TZD), zlepšující metabolickou kompenzaci diabetiků snižováním inzulinové rezistence. TZD jsou agonisty jaderných receptorů aktivovaných proliferátory peroxizomů (PPAR, Peroxisome Proliferator-Activated Receptor). Aktivací PPAR-
g
se podílejí na regulaci homeostázy jak lipidového, tak i sacharidového metabolismu [1].
V posledním roce zaujaly TZD přední místo na mezinárodním lékařském diskus
ním fóru. Základním problémem bylo objas
nit vyšší kardiovaskulární (KV) riziko
při terapii rosiglitazonem (RSG). Cílem toho
to příspěvku je vysvětlit mechanismus působení TZD na KV systém a nastínit terapeutické uplatnění této skupiny léčiv.
Vliv na kardiovaskulární systém
Působení PPAR-
g
na srdce
Vliv PPAR-
g
na srdce je méně jasný než efekt PPAR-
a
. Exprese PPAR-
g
buňkami myokardu je všeobecně nízká. Významnou vlastností PPAR-
g
je ochrana myokardu před ischémií. Je známo, že při ischémii myokardu dochází k aktivaci proapoptotických signálních drah, což je provázeno signifikantním zvýšením hladiny kaspázy 3 a inhibicí drah antiapoptotických. Aplikace RSG vedla ke zvýšení poměru anti- a proapoptotických kináz a ke snížení hladiny kaspázy 3 provázenému snížením postischemické apoptózy myokardu a obnovením srdeční funkce [2]. Potenciální příznivý vliv RSG se vysvětluje protizánětlivými a antioxidačními účinky, jednak redukcí interleukinu 1
b
(IL-1
b
), interleukinu 6 (IL-6), faktoru X-2 i syntézy oxidu dusnatého (NOS), nukleárního faktoru
k
B (NF-
k
B), dále zvýšením hladin antioxidačních enzymů – katalázy a Cu/Zn superoxiddismutázy [3, 4].
Výsledky některých výzkumů ukazují, že agonisté PPAR-
g
inhibují hypertrofii myokardu. Mechanismy nejsou doposud plně objasněny. Je prokázáno, že TZD snižují expresi natriuretického peptidu, zlepšují diastolickou funkci komor a snižují akumulaci kolagenu.
Na druhé straně je nutné zmínit, že vliv TZD na myokard může být i negativní. TZD mohou naopak hypertrofii myokardu způsobit, jak bylo zjištěno u psů [5]. Autoři předkládají vysvětlující hypotézu, že příčinou vzniku hypertrofie kardiomyocytů může být trofický efekt SB-271256, který je hlavním metabolitem TZD u psů, naopak u krys a lidí bývá přítomen pouze v nízkých koncentracích.
Agonisté PPAR-
g
mohou způsobit nebo zhoršit srdeční selhání. Předpokládá se, že spíše než negativní ionotropní vliv se zde uplatňuje retence tekutin jako následek inzulinomimetického působení PPAR-
g
na
ledviny, vzestup tělesné hmotnosti, akti
vace neurohormonální osy nebo zvýšení tonu sympatiku.
TZD ovlivňují metabolismus lipoproteinů a působí změny koncentrací sérových lipidů a lipoproteinů. Rozdílná struktura molekul má za následek, že skupina TZD nepůsobí jednotně, nýbrž mezi působením jednotlivých léčiv jsou popsány výrazné rozdíly. Jak RSG, tak pioglitazon (PIO)
zvyšují hladiny HDL cholesterolu, PIO sni
žuje navíc koncentrace triglyceridů a celkového cholesterolu, zatímco při podávání RSG je popsáno jejich zvýšení. Naopak všechny TZD (nejméně PIO) zvyšují hladiny LDL cholesterolu, zároveň však způsobují i zvýšení velikosti částic LDL, což činí tyto částice méně náchylnými k oxidaci, a tím i méně aterogenními [6, 7]. K zajímavým zjištěním patří i možná aktivace odlišných regulačních mechanismů u lidí a zvířecích modelů, kdy například u králíků léčených RSG bylo jednoznačně popsáno signifikantní snížení hladiny celkového cholesterolu i LDL cholesterolu [8].
Je prokázáno, že PPAR-
g
jsou exprimovány makrofágy, endoteliálními buňkami a cévní hladkou svalovinou [9, 10], kde regulují kromě proteinů řídících lipidový metabolismus i expresi klíčových genů ovlivňujících vaskulární zánětlivé změny a proliferaci buněk. Ukazuje se, že fyziologická exprese PPAR-
g
v cévním systému u jedince není konstantní, zvyšování hladin PPAR-
g
tak může sloužit jako jeden z kompenzatorních mechanismů, kterými organismus reaguje na změny. Na krysích
modelech byla například popsána zvyšu
jící se exprese PPAR-
g
buňkami cévní hladké svaloviny v závislosti na věku. Otázkou zůstává, zda existuje podobná analogie i u lidí.
Většina studií předpokládá potenciální prospěšný vliv TZD na KV riziko, spojený se zmírněním tvorby aterosklerotických plátů a/nebo se zvýšením jejich stability. Protektivní efekt agonistů PPAR-
g
na cévní stěnu zahrnuje celou řadu faktorů. K nejvýznamnějším z nich patří zejména jejich lokální i celkový protizánětlivý efekt. Je prokázáno, že dochází k redukci zánětlivého infiltrátu, zejména makrofágů, CD4 lymfocytů a exprese HLA-DR v cévní stěně a k poklesu exprese faktorů TNF-
a
a INF-
g
ve sklerotických ložiscích [11, 12].
Bylo zaznamenáno i snížení hladin významných sérových proaterogenních markerů – C-reaktivního proteinu, IL-6 a IL-1, sérového amyloidu A (SAA) [13], selektinu E, von Willebrandova faktoru, fibrinogenu [14], inhibitoru aktivátoru plazminogenu 1,
cyklooxygenázy 2 a endotelinu 1 [15].
Pozorovány jsou změny hladin metaloproteináz, zvláště MMP 9 (matrix metaloproteináza 9). Tato proteináza podstatně potencuje vznik a růst nestabilních plátů a přispívá k jejich ruptuře [16, 17]. K prokázaným antiaterogenním mechanismům, které jsou rovněž regulovány TZD, patří inhibice migrace hladkých svalových buněk cévní stěny, snížení degradace bazální membrány a komponent extracelulární matrix arterií [18].
Agonisté PPAR-
g
ovlivňují i mezibuněčnou komunikaci. Prokazatelně snižují expresi VCAM (vaskulární celulární adhezní molekula), ICAM (intercelulární adhezní molekula), PECAM (destičková a endoteliální celulární adhezní molekula), AP (proteinový aktivátor) a MCP (monocytový chemotaktický protein).
Aktivace PPAR-
g
inhibuje proliferaci buněk hladké svaloviny cév a tvorbu neointimy. Objevují se důkazy, že jedním z podstatných regulátorů proliferace a diferenciace těchto buněk je telomeráza.
Výrazným aterogenním faktorem ovlivňujícím vaskulární fibrózu, remodelaci cév a zvýšení endoteliální dysfunkce a zánětu, který takto nezanedbatelně přispívá ke vzniku a progresi vážných komplikací hypertenze a diabetu, je angiotenzin (AT). Podání aktivátorů PPAR-
g
(RSG a PIO)
ztlumilo produkci CTGF (růstového fakto
ru pojivové tkáně) stimulovanou ATII, tvorbu extracelulární matrix, proliferaci hladkých svalových buněk cév, expresi kolagenu III a fibronektinu [19]. K novějším poznatkům ovlivňujícím proces aterosklerózy patří funkce osteopontinu (OPN). Některé experimentální práce poukazují na významné proaterogenní vlastnosti tohoto proteinu, který je rovněž stimulován angiotenzinem. Osteopontin je exprimován hladkou cévní svalovinou, endoteliemi a makrofágy; chybění tohoto proteinu bylo provázeno redukcí
aterosklerotických lézí až o 65 %, sníže
ním akumulace makrofágů v cévní stěně, poklesem migrace leukocytů a zvýšením pro
dukce interleukinu 10 (IL-10), který inhi
buje adhezi monocytů.
Proaterogenní efekt PPAR-
g
Některá experimentální data naznačují i možný proaterogenní vliv agonistů PPAR-
g
, nebo přinejmenším jejich žádný nebo velmi slabý antiaterogenní efekt zejména u ženské populace [20]. U zvířecích modelů vedlo podávání RSG k nárůstu počtu tukových proužků. I když je známo, že tyto změny, které jsou nejpravděpodobněji způsobeny pozorovaným zvýšením hladiny LDL cholesterolu, bývají reverzibilní, nelze vyloučit, že zejména v delším časovém horizontu mohou vést k prohloubení skle
rotických změn. TZD dále zvyšují expresi
proaterogenních faktorů CD36 a adipofilinu, přičemž hladiny těchto proteinů jsou asi 10krát vyšší po terapii RSG ve srovnání s terapií PIO [21].
Dále je prokázáno, že ligandy PPAR-
g
zvyšují sekreci lipoproteinové lipázy (LPL), jednak zvyšováním exprese mRNA a dále snížením degradace proteinu [22]. LPL je klíčovým enzymem metabolismu lipoproteinů bohatých na triglyceridy. Je exprimována zejména makrofágy a buňkami hladké svaloviny, přičemž při vysokých koncentracích ovlivňuje biologii těchto buněk v procesu aterosklerózy. Kromě metabolismu LDL a VLDL cholesterolu se na aterogenním působení tohoto enzymu podílí také aktivace makrofágů, provázená zvýšenou tvorbou INF, NOS a proteinkinázy C [23].
RSG navíc zvyšuje hladiny hormon senzitivní lipázy (HSL), která mobilizuje mastné kyseliny ze zásobních triglyceridů [24]. Nejsou však popsány změny hladin syntázy mastných kyselin (FAS) [25].
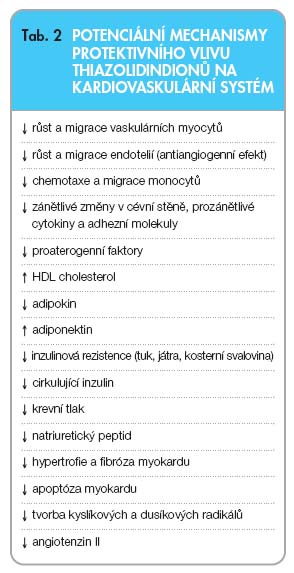
Potenciální mechanismy vlivu TZD na KV systém jsou shrnuty v
tab. 1
a
2
.
Přímé srovnání účinku pioglitazonu a rosiglitazonu
V porovnání s výchozím stavem byly po léčbě TZD zjištěny [26]:
– �snížené hladiny triglyceridů při léčbě PIO, ale ne při léčbě RSG;
– �zvýšené hladiny HDL cholesterolu při užívání obou látek, zvýšení však bylo větší při podávání PIO;
– �zvýšené hladiny LDL cholesterolu při užívání obou látek, zvýšení však bylo větší při podávání RSG;
– �zvýšené hladiny non-HDL cholesterolu při podávání RSG, bez významných změn při podávání PIO;
– �zvýšená velikost částic LDL při užívání obou látek, zvýšení však bylo větší při podávání PIO;
– �zvýšená koncentrace LDL částic a hladina apo B při podávání RSG;
– �snížená koncentrace LDL částic a hladi
na apo B bez významných změn při podávání PIO;
– �nebyl nalezen rozdíl v účinku obou látek na snížení hladin glykovaného hemoglobinu HbA
1c
.
PPAR-
g
jsou ligand-dependentní transkripční faktory patřící do rodiny jaderných receptorů, které regulují transkripci nebo supresi celé řady genů. Z tohoto důvodu je biologický efekt agonistů PPAR-
g
velmi komplexní. Funkčně se mezi sebou jednotliví agonisté PPAR-
g
liší, a to často podstatně, i přes svou strukturální podobnost (odlišují se strukturou postranního řetězce, který se váže na thiazolidinové jádro). Vzhledem k tomu, že může dojít k syntéze funkčně zcela odlišných proteinů, zůstává biologický efekt těchto molekul z velké části neznámý. Závěry experimentů musí zohledňovat, že při podávání TZD mohou rozdílně reagovat jednotlivé živočišné druhy, lze předpokládat i odlišné reakce v rámci jednoho druhu například v závislosti na stáří a pohlaví jedinců nebo v závislosti na typu
t
káně, ve které jsou receptory exprimová
ny. Z tohoto hlediska je nutné posuzovat často i protichůdné výsledky experimentálních a klinických studií. Můžeme tak vysvětlit, proč při podávání RSG nebyl potvrzen očekávaný protektivní efekt na KV systém pozorovaný ve studiích
in vitro
a v kratších studiích
in vivo
. Je potřeba dalších výzkumů, které nám pomohou detailněji poznat souvislosti a odpovědět na otázky vyvstávající při řešení tohoto problému.
Překvapivá metaanalýza
Rozruch v široké lékařské veřejnosti vyvolala zpráva Nissena a Wolského publikovaná v časopisu NEJM [27], která uvádí, že RSG signifikantně zvyšuje riziko
infarktu myokardu (IM) a že riziko KV úmr
tí
je při podávání RSG rovněž na hranici sig
nifikance. Autoři ve své práci retrospektiv
ně analyzovali výsledky 40 malých a 2 velkých klinických studií DREAM a ADOPT ve srovnání s kontrolní skupinou léčenou léky jinými než RSG. V rosiglitazonové skupině bylo popsáno 86 případů IM ve srovnání se 72 případy u kontrolní skupiny, dále 39 úmrtí z KV příčin ve srovnání s 22 úmrtími v kontrolní skupině. Míra pravděpodobnosti příhod po terapii RSG byla stanovena takto: 1,43 (1,03–1,98; p = 0,03) pro IM a 1,64 (0,98–2,74; p = 0,06) pro KV úmrtí. Autoři dále zdůrazňují závažnost své analýzy vzhledem ke skutečnosti, že uvedené nežádoucí komplikace byly pozorovány již v krátkodobých studiích, u nichž byl RSG
aplikován pouze několik týdnů. Nežádou
cí účinky jsou vysvětlovány zvýšením hladin LDL lipoproteinů, i když je zároveň poznamenáno, že rychlost vzniku rizika nelze
vysvětlit pouze změnou li
pidového spektra. K dalším přispívajícím mechanismům se řadí zhoršení kardiálního selhávání. Autoři dále vyzdvihují výsledky studie PROACTIVE, která zjistila jednoznačné protek
tivní účinky PIO na KV systém, včetně sní
žení koronárních i periferních vaskulárních příhod, a preferují tuto molekulu ve skupině agonistů PPAR-
g
.
Uvedená metaanalýza Nissena a Wolského má ovšem svá omezení, která snižují hodnotu jejích výsledků. Jednotlivé studie byly značně heterogenní, pokud jde o počty probandů, vstupní a výstupní kritéria i dávkování léčiv. Do analýzy bylo zahrnuto mnoho krátkodobých studií menšího rozsahu s různou dobou sledování v rozmezí 12 týdnů až dva roky. Chybějí údaje
o stadiu KV onemocnění. Nežádoucí účin
ky nebyly posuzovány standardním přístupem, protože záměrem většiny studií
byl jiný cíl než hodnocení KV rizika. Hod
nocení dat pacientů nezahrnovalo posuzování nežádoucích komplikací v časovém horizontu. Data byla shromážděna na základě nedostatečné statistické heterogenity.
Všechny tyto skutečnosti mohly podstatně ovlivnit výsledek metaanalýzy, který může spíše odrážet selekci nemocných než vliv léčiva. Otázkou zůstává i způsob statistického zhodnocení dat, kdy analýza jednotlivých podskupin zjišťuje signifikantní rozdíly pouze u malých studií a jen pro KV úmrtí, přičemž rozdíly ve výskytu úmr
tí a IM v rámci velkých studií ADOPT
a DREAM signifikantní nejsou.
Vzhledem k výrazným nedostatkům metaanalýzy byla provedena reanalýza dat, která použila jinou statistickou metodu, a byly začleněny i studie s nulovým výskytem komplikací. Vztah mezi podáváním RSG a výskytem IM nebo výskytem KV úmrtí potvrzen nebyl. Nebylo zjištěno snížení ani zvýšení KV rizika. Reanalýza má však podobná omezení: krátká doba sledování, nízký počet událostí, variabilní a neúplné hodnocení komplikací, které je důsledkem zejména nedostatečných údajů o pacientech, a chybějící posouzení výskytu komplikací v čase.
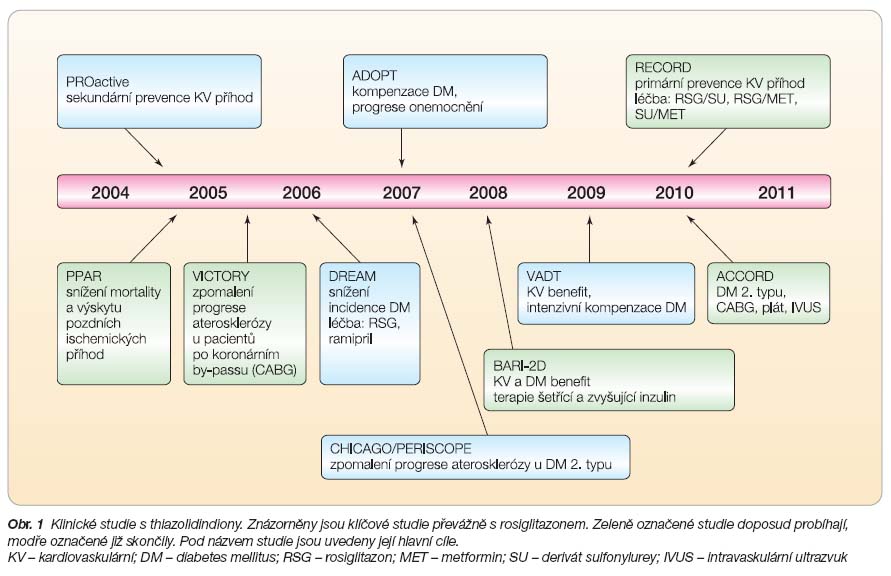
Klinické studie s thiazolidindiony
Klíčové studie s thiazolidindiony jsou shrnuty na
obr. 1
. Dále budou prezentovány pouze ukončené zásadní klinické studie.
Dlouhodobá studie společnosti GSK
ADOPT (A Diabetes Outcome Progressi
on Trial) porovnávala bezpečnost a účinnost
RSG s jinými perorálními antidiabetiky u více
než 4300 pacientů po dobu až 6 let. Získaná data ukazují, že celkové riziko závažných KV příhod (KV úmrtí, IM a cévní mozková příhoda) bylo u pacientů
léčených RSG srovnatelné s pacienty léče
nými metforminem a derivátem sulfonylurey. Výsledky prokázaly srovnatelné
procento KV úmrtí: RSG – 5 případů/1456 pacientů (0,34 %); metformin – 4/1454 (0,28 %); derivát sulfonylurey – 8/1441 (0,56 %). Přestože bylo zjištěno více pří
pa
dů IM ve skupině léčené RSG (RSG –
24 případů/1456 pacientů, 1,65 %; metformin – 20/1454, 1,38 %; derivát sulfony
lurey – 14/1411, 0,97 %), je tento počet
příliš nízký na to, aby bylo možno vyvodit
spolehlivé závěry o vlivu jednotlivých léčiv.
Studie ADOPT také prokázala, že RSG udrží na rozdíl od metforminu a glibenklamidu kompenzaci diabetu až po dobu pěti
let.
Další dlouhodobá studie DREAM (Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication), která sledovala 5200 pacientů vysoce rizikových pro vznik DM2 po dobu 3–5 let léčených
RSG v porovnání s placebem, neprokáza
la signifikantní nárůst KV rizika (IM: RSG –
15 případů, tj. 0,6 % vs. placebo – 9 pří
pa
dů, tj. 0,3 %; KV úmrtí: RSG – 12 přípa
dů,
tj. 0,5 % vs. placebo – 10 případů, tj. 0,4 %).
Cochrane review diabetických pacientů naznačuje tendenci k vyššímu riziku IM u nemocných léčených RSG, avšak statisticky významné rozdíly míry rizika mezi léčenými RSG a kontrolní skupinou zjištěny nebyly. Souhrnná data o RSG svědčí tedy pro to, že RSG má KV profil srovnatelný s ostatními perorálními antidiabetiky.
Z důvodu nejasných a často protichůdných výsledků klinických studií byla zveřejněna předběžná analýza probíhající studie RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycemia in Diabetes) [27]. Jedná se o velkou dlouhodobou randomizovanou studii, jejímž cílem je zjistit bezpečnost léčby RSG v kombinaci s derivátem sulfonylurey
nebo s metforminem. Předběžná zpráva zahrnuje data 4447 účastníků sledovaných průměrně 3,75 roku, přičemž zjištěné riziko KV úmrtí je vyjádřeno hodnotou 0,83 (0,5–1,36; p = 0,46), riziko IM 1,17
(0,75–1,82; p = 0,5) a riziko srdečního selhání 2,24 (1,27–3,97; p = 0,006). Analýza prokazuje signifikantně vyšší riziko srdečního selhání po léčbě RSG, není prokázána zvýšená mortalita z KV příčin ve srovnání s kontrolní skupinou. Co se týká rizika IM, získaná data neumožňují posoudit, zda je léčba RSG spojena s jeho zvýšeným výskytem v porovnání s metforminem nebo s derivátem sulfonylurey.
Studie Proactive prokázala, že PIO snižuje riziko KV příhod. Studie PERISCOPE [28] (Pioglitazone Effect on Regression of Intravascular Sonographic Coronary Obstruction Prospective Evaluation), jejíž výsledky byly prezentovány 31. 3. 2008 na vědeckém kongresu Americké kardiologické společnosti (American College of Cardiology 2008 Scientific Sessions), ukázaly, že PIO ve srovnání s glimepiridem může přispět významně k prevenci progrese aterosklerózy a ke snížení KV rizika. Podle expertů je tato studie první, v níž u diabetiků došlo vlivem perorálního antidiabetika ke zpomalení progrese aterosklerózy [29].
K detailnějšímu hodnocení KV rizika TZD je potřeba vyčkat dokončení studií speciálně zaměřených na sledování KV komplikací – RECORD, BARI-2D, APPROACH.
Zhodnocení pozice TZD v terapii DM 2. typu (volně upraveno dle [30])
V době medicíny založené na důkazech má být klinická praxe podpořena skutečnými daty, která vyžadují použití výsledků správně navržených studií. Bohužel, nedávné události ukázaly, že medicínský management může být ovlivněn jednoduchou metaanalýzou i přes všeobecně známé nedostatky a slabosti. Taková metaanalýza může negativně ovlivnit jednotlivé lékaře či celé skupiny terapeutů ke změně klinické praxe ve vztahu k použití RSG.
Na základě této metaanalýzy se zrodily návrhy, krátkodobě akceptovatelné velkým počtem diabetologů, jak se vyhnout problémům s RSG. Bylo navrženo rovnou předepsat PIO, a to na tak dlouho, dokud nebudou známa další data o bezpečnosti použití RSG. Navíc ve sledu těchto událostí i někteří klinici doporučili převedení pacientů, kteří jsou léčeni RSG, na léčbu PIO, i když chybějí podpůrné důkazy pro
takovou praxi [30]. Zmatek a nejistota
obklopující tato rozhodnutí vedly k nekonzistentnímu přístupu, který se lišil napříč světovými oblastmi. To ovšem může vést k rozdílu v kvalitě péče o pacienta.
Na základě přístupu založeného na důkazech bychom mohli učinit závěr, že ze stávajících dat nelze s konečnou platností potvrdit nárůst KV rizika při terapii RSG. Data, která máme k dispozici, však skutečně naznačují možnost jeho zvýšení, a to především v průběhu krátkodobé terapie. Naopak kumulující se důkazy indikují,
že léčba PIO je spojena s redukcí KV příhod.
Přestože mají oba zástupci TZD stejné hypoglykemizující účinky, pouze podávání RSG je doloženo důkazy dlouhodobého pozitivního ovlivnění glykémie, což je nesporně důležité z pohledu léčebných cílů u diabetiků. Zvážíme-li stávající důkazy, pak by měl být RSG vhodným léčivem pro pacienty, u nichž je léčebnou prioritou pokles glykémie; tento závěr podporují i data ze studie ADOPT. Na druhé straně, jestliže pacienti mají již KV chorobu a/nebo je prevence KV příhod základním zájmem terapeuta, pak je třeba použít PIO, což je ve shodě s výsledky studie PROACTIVE.
V posledních letech nastala nová éra léčby diabetu vedoucí ke zvýšení citlivosti k inzulinu a tím k potlačení inzulinové rezistence, kterou započal nástup TZD do klinické praxe. Vývoj této éry byl v počátcích zbrzděn použitím troglitazonu, jehož podávání vedlo u některých pacientů k selhání jater. PIO ani RSG nejsou hepatotoxické a je zjevné, že obě léčiva snižují glykémii alespoň na úroveň dosaženou podáváním dřívějších perorálních antidiabetik (PAD), navíc snižují inzulinovou rezistenci a redukují (PIO) výskyt aterotrombotických příhod u vysoce rizikové skupiny diabetiků.
Vnímání pozitiv této léčebné skupiny se v povědomí lékařů změnilo po publikování Nissenovy metaanalýzy. Byla navrhována opatření od terapeutických omezení až ke stažení léku z trhu. Mezi těmito názory je důležité si uvědomit, že i když byla metaanalýza publikována v prestižním lékařském časopise, bylo v ní podáno jen málo informací, a ty byly provázeny spoustou drobných chyb a nedostatků. Takový důkaz je třeba považovat za slabý, protože ve skutečnosti pokus o implikaci metaanalýzy do praxe ukázal četné nedostatky. Lékaři jsou pak postaveni před nelehký úkol porozumět těmto problémům v celku a udělat si sami svobodné a odpovědné rozhodnutí při terapii pacientů s ohledem na známá fakta. Základním problémem léčby diabetu zůstává kontrola glykémie a ovlivnění KV rizika, které je však spolehlivě snižováno také použitím statinů, inhibitorů ACE a antiagregancií.
KV působení RSG je zatím nejasné a celkově se může ukázat, že RSG bude kardioneutrální. Skutečné důkazy ze studie ADOPT dokumentují trvalé výrazné zlepšení v kontrole glykémie, ve srovnání s použitím tradičních PAD v průběhu 4leté terapie. Důkazy dokládají, že zlepšená glykemická kontrola by mohla snížit výskyt mikrovaskulárních komplikací a snad i oddálit nutnost zahájení inzulinové terapie. Tento potenciální prospěch bychom neměli podceňovat. Očekáváme s napětím konečné výsledky studie RECORD, prozatím bychom měli terapii RSG zvažovat, pokud chceme dosáhnout trvalého snížení glykémie. Pozornost musí být věnována pacientům s ICHS a se srdečním selháním, kde je použití RSG kontraindikováno, v případě absence těchto onemocnění zůstává PIO i RSG důležitým nástrojem při terapii komplexu metabolických poruch doprovázejících DM2 (
tab. 3
). Doposud u žádného PAD nebylo přesvědčivě prokázáno, že snižuje KV riziko.

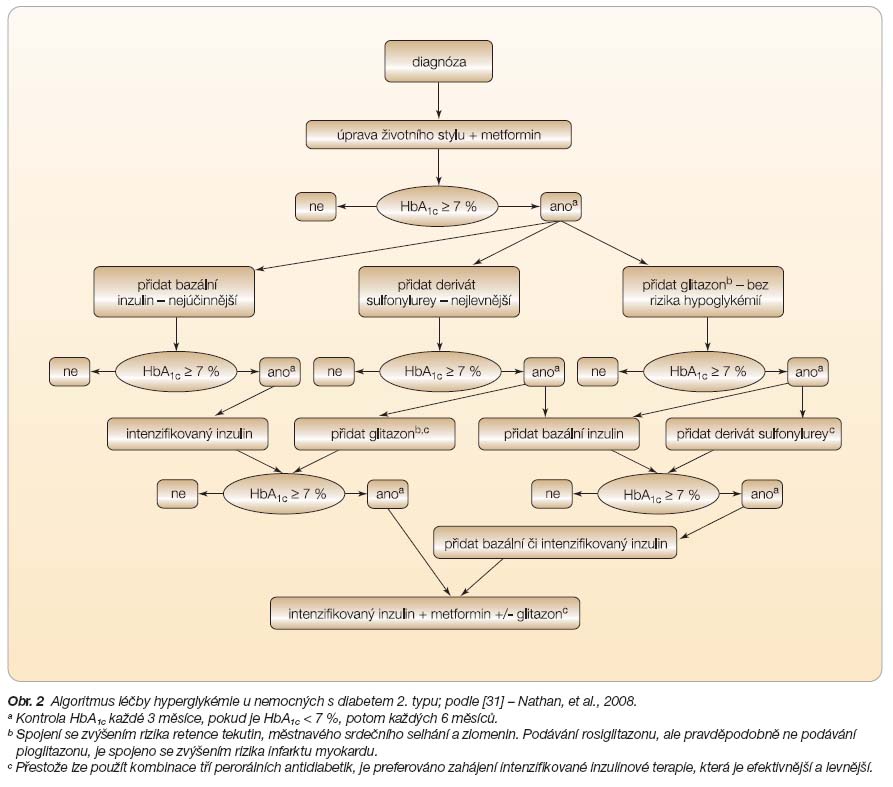
Pozici TZD v moderní terapii diabetu jasně ukazuje Nathanovo schéma algoritmu léčby DM2 (
obr. 2
) [31]. TZD jsou řazeny hned do druhé volby v kombinaci s metforminem.
• �TZD jsou účinná PAD, a to díky svému pozitivnímu vlivu na inzulinovou senzitivitu a funkci
b
-buněk.
• �TZD zůstávají lékem druhé volby do včas podávané kombinace s metforminem u pacienta s DM2 a obezitou (BMI > 30 kg/m2), s vyjádřenou inzulinovou rezistencí a s HbA
1c
≥ 5,5 % (IFCC).
• �Počáteční monoterapie RSG zpomaluje progresi hyperglykémie ve srovnání s metforminem a glibenklamidem.
•
�Pacienti s DM2 mají všeobecně zvýšené riziko KV komplikací, proto je třeba při rozhodování o léčbě a při dlouhodobém sledování léčených pacientů brát na vědomí možné KV nežádoucí účinky RSG.
• �Nedoporučuje se kombinovat RSG s inzulinem, protože hrozí zvýšené riziko retence tekutin.
Závěr
Považujeme za přínosné, že se široce diskutuje o nežádoucích účincích TZD, zejména RSG. Nebylo by však správné zapomínat na jejich převažující prospěch a měli bychom dále pro tuto skupinu dodržovat indikace, ve kterých převáží prospěch nad případným rizikem. A to na pozadí skutečnosti, že dosud neexistuje léčba bez nežádoucích účinků. Není zatím závažných důvodů měnit postup v terapii DM2, kde jsou TZD lékem 2. volby. Hlavní výhodou použití TZD zůstává jejich schopnost účinně zasáhnout do nepříznivého progresivního vývoje DM2 a možnost pozitivního ovlivnění hlavních sekundárních komplikací diabetu.
Článek byl podpořen VZ 6198959221.