Kardiovaskulární rizika léčby antipsychotiky
Kardiovaskulární komorbidita je u nemocných se schizofrenií podceňována. Nemocní trpící schizofrenií mají vyšší riziko rozvoje kardiovaskulárních onemocnění, je proto nutné vyšetřovat u těchto pacientů stav kardiovaskulárního systému a monitorovat jejich tělesné zdraví. Nemocní se schizofrenií jsou ohroženi častější přítomností faktorů rizikových pro rozvoj kardiovaskulárních chorob. Patří mezi ně obezita, kouření, hypertenze, dyslipidémie a diabetes mellitus 2. typu. V poslední době se pozornost soustředila na skutečnost, že některá antipsychotika mohou prodlužovat QT interval s rizikem vzniku arytmií torsades de pointes a náhlé smrti. Mezi faktory zvyšující riziko torsades de pointes patří bradykardie, minerálová dysbalance, ženské pohlaví a polyfarmakoterapie. Antipsychotiky způsobené torsades de pointes mohou mít letální následky. Myokarditidy a kardiomyopatie jsou vzácně popisované komplikace léčby antipsychotiky. Přestože se obě tyto komplikace vyskytují sporadicky, je důležité na ně myslet vzhledem k jejich potenciálně fatálnímu průběhu. Tento přehled zdůrazňuje roli psychiatra při monitorování suspektních kardiovaskulárních nežádoucích účinků antipsychotik.
Úvod
Onemocnění schizofrenií je spojeno se zvýšením rizika kardiovaskulárních onemocnění. Riziko předčasné smrti je u nemocných se schizofrenií 2–4krát vyšší než v běžné populaci. Nemocní trpící schizofrenií umírají v průměru o 10 let dříve než jejich duševně zdraví vrstevníci [1, 2]. Riziko kardiovaskulární poruchy zvyšují rizikové faktory, jejichž výskyt je mezi nemocnými se schizofrenií častější než v běžné populaci. Patří mezi ně kouření, obezita, arteriální hypertenze, dyslipidémie a diabetes mellitus 2. typu. Významným rizikovým faktorem je inaktivita, která souvisí s negativní symptomatikou schizofrenie, může k ní však přispívat také tlumivý efekt antipsychotik. Výskyt elektrokardiografických a metabolických abnormit při podávání antipsychotik první i druhé generace vyvolal v posledních letech intenzivní výzkum bezpečnosti při antipsychotické léčbě. Posouzení rizik výskytu nežádoucích účinků je jedním z nejdůležitějších aspektů při zvažování preskripce antipsychotik. Monitorování kardiovaskulárních a metabolických nežádoucích účinků při dlouhodobém podávání antipsychotik patří k dobré klinické praxi.
Cílem tohoto přehledu je zvýšit povědomí o kardiovaskulárních nežádoucích účincích při léčbě antipsychotiky. Některé se vyskytují vzácně, jsou však klinicky závažné, mohou ohrozit život nemocného.
Prodloužení QT intervalu, riziko komorových arytmíí typu torsades de pointes a náhlé srdeční smrti
Léčba antipsychotiky je často provázena vedlejšími kardiovaskulárními účinky [3]. Kromě relativně časté a méně závažné posturální hypotenze a sinusové tachykardie je tato léčba spojena také s prodloužením QT intervalu na povrchovém EKG se zvýšeným rizikem vzniku polymorfní komorové tachykardie typu torsades de pointes (TdP), které vede k synkopě nebo k oběhové zástavě a nebo k náhlé smrti.
Patofyziologie změn QT intervalu a torsades de pointes (TdP)
Změny QT intervalu korelují se změnou akčního potenciálu. Akční potenciál je tvořen křehkou rovnováhou mezi iontovými proudy oboustranně procházejícími buněčnou membránou srdečních myocytů. Poškození kteréhokoliv z nich může vést k narušení rovnováhy a ke změně trvání akčního potenciálu. Prodloužení QT intervalu na základě prodloužení akčního potenciálu je teoreticky dáno jak zesílením nebo prodloužením depolarizačních proudů (proud sodíku do buňky a kalciový kanál typu L), tak i oslabením nebo zkrácením repolarizačních proudů.
Prodloužení trvání repolarizace (prodloužení QT intervalu) umožňuje vznik arytmií na podkladě tzv. časných následných depolarizací. Vzniká nepravidelný sled rychle po sobě se opakujících depolarizací, jejichž obrazem na povrchovém EKG jsou polymorfní komorové tachykardie typu torsades de pointes [4]. Komorové tachykardie se na povrchovém EKG zobrazují komplexy QRS s měnlivou amplitudou a měnlivým sklonem osy ve frontální rovině, který osciluje kolem izoelektrické linie. Obvyklá frekvence TdP je 200–250 tepů/ min. Typickým nálezem, který TdP doprovází, je prodloužení QT (resp. QTc – korigovaný QT interval) na povrchovém EKG.
Stanovení QT (QTc) intervalu
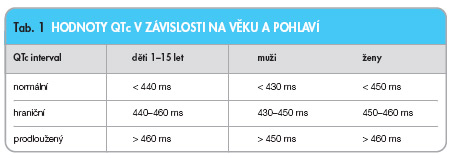
Interval QTc vztažený k základní tepové frekvenci se tradičně určuje podle Bazettova vzorce: QTc = QT (aktuální QT interval na EKG)/druhá odmocnina z R–R intervalu (R–R je délka srdečního cyklu vyjádřená v sekundách). Ačkoliv má tato Bazettova formule výpočtu QTc určité limitace (velmi pomalá a velmi rychlá tepová frekvence), je pro orientační posouzení uvedeného intervalu dostačující a široce akceptovaná [5]. Normální hodnoty QT intervalu jsou závislé na věku a pohlaví (tab. 1) [6].
Faktory ovlivňující prodloužení QT intervalu a vznik torsades de pointes
Etiologie lékového prodloužení QT intervalu a vznik TdP je kombinací několika faktorů potřebných k tomu, aby se arytmie objevila (tab. 2) [7, 8].
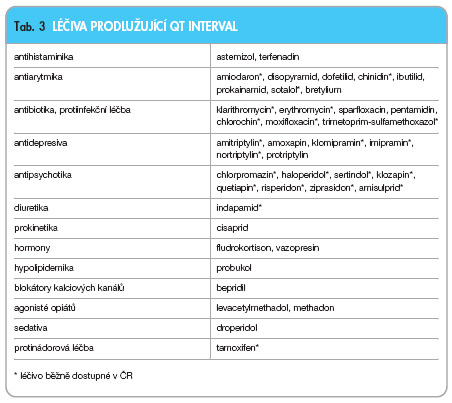
Polékovému prodlužování QT intervalu a riziku TdP, které se netýká jen antipsychotik, je v poslední době věnována pozornost řady kontrolních a regulačních úřadů a existují i odborné skupiny, které se touto problematikou cíleně zabývají. Následující přehled v tab. 3, který není konečný a vychází ze seznamu vědeckého poradního výboru AZCERT (Arizona Centre for Education and Research on Therapeutics), uvádí léčiva, jejichž podávání bylo nejčastěji spojeno s prodloužením QT intervalu a/nebo se vznikem TdP [7, 9].
Prevence prodloužení QT intervalu navozeného léčivy
Jako účinná praxe se ukazuje stratifikace rizika a individuální přístup k nemocnému při zahajování terapie léčivy s možným proarytmogenním působením. V první řadě je nezbytné prostudovat informace o léčivu poskytované výrobcem. Podrobnou anamnézou se snažíme identifikovat jedince s výskytem náhlých úmrtí v rodině, v osobní anamnéze cíleně pátráme po výskytu palpitací, synkop a presynkop, zjišťujeme přítomnost organického onemocnění srdce. Rizikovější skupinou jsou ženy a starší lidé, nemocní, kterým je podávána kombinace léčiv, zejména léčiv metabolizovaných stejnou cestou. Posuzujeme možný výskyt minerálových dysbalancí, převážně pokud jsou nemocní léčeni diuretiky s hypokalemickými účinky (např. thiazidová diuretika) nebo pokud se vyskytují onemocnění gastrointestinálního (zvracení nebo průjem) a močového systému (polyurie), která jsou doprovázena deplecí kalia. U těchto nemocných by měla být rutinně stanovována hladina sérového draslíku.
Velmi účinná, ale ne stoprocentní je monitorace QT intervalu na 12svodovém povrchovém EKG před zahájením léčby antipsychotiky a v jejím průběhu. Jedinci s patologickými hodnotami QTc by měli být kardiologicky vyšetřeni [4]. V klinické praxi lze snížit riziko prodloužení QT intervalu nepřekračováním doporučených dávek léků.
Terapie TdP navozené podáváním léčiv
Při prokázané arytmii TdP navozené farmakoterapií je prvním krokem hospitalizace nemocného na nepřetržitě monitorovaném lůžku (nejčastěji kardiologická jednotka intenzivní péče) a ukončení terapie příslušným léčivem. Stanovíme, popřípadě doplňujeme hladinu sérového draslíku na hodnoty mezi 4,5 až 5,0 mmol/l a nitrožilně podáváme magnesium (1–2 g). V rezistentních případech podáváme k urychlení komorové frekvence (90–100 tepů/min), které způsobí zkrácení QT intervalu, isoprenalin kontinuálně nitrožilně, popř. je indikována dočasná kardiostimulace (stimulace pravé síně nebo pravé komory).
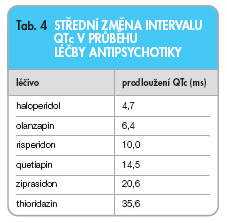
TdP se nejčastěji manifestuje jako synkopální stav. V případě setrvalé arytmie TdP přecházející do fibrilace komor dochází k oběhové zástavě a k náhlé srdeční smrti (NSS). NSS je jedním z největších problémů současné akutní medicíny. Roční výskyt NSS se v průmyslově vyspělých zemích pohybuje kolem 2–2,5 tisíc případů na 1 milion obyvatel [5]. NSS je definována jako oběhová zástava, která vznikla okamžitě nebo nejdéle do 1 hodiny po vzniku symptomů [10]. V 84 % případů byla fatální arytmií komorová tachykardie nebo fibrilace komor a jen v 16 % to byly bradyarytmie [11]. První případy náhlého úmrtí a změn EKG v závislosti na vysokých dávkách thioridazinu popsal Kelly a kol. v roce 1963 [12]. Spojitost mezi léčbou antipsychotiky a TdP je nejlépe dokumentována v případě léčby thioridazinem [7, 13], který významně prodlužuje QT interval (tab. 4) [14]. Také ostatní antipsychotika mohou potenciálně vyvolat TdP a lékaři jsou na toto nebezpečí upozorňováni výrobcem.
Zvláštní pozornost si zaslouží sertindol, který významně prodlužuje QT interval (o 22–30 ms). Výrobce doporučuje provádět EKG vyšetření před zahájením léčby, po 3 týdnech a dále po 3 měsících. Léčba sertindolem nesmí být kombinována s léčivy, která prodlužují QT interval.
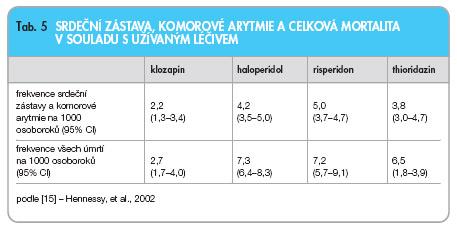
Hennessy a kol. [15] prokázal ve skupině více než 90 000 nemocných se schizofrenií léčených klozapinem (9 %), haloperidolem (43 %), risperidonem (23 %) a thioridazinem (25 %) 2–3násobně vyšší riziko srdeční zástavy a komorové arytmie v porovnání s nemocnými psoriázou (7541) nebo glaukomem (21 545). Celková mortalita byla u nemocných léčených antipsychotiky 2–5násobně vyšší. Autoři prokázali vyšší výskyt srdeční zástavy a komorové arytmie při terapii risperidonem ve srovnání s léčbou haloperidolem (tab. 5) a současně potvrdili závislost mezi stoupající dávkou thioridazinu a arytmickými příhodami.
Podobné výsledky publikoval Ray a kol. [16], který sledoval výskyt náhlé srdeční smrti u 480 000 nemocných léčených antipsychotiky. V této práci byla rovněž prokázána závislost výskytu náhlé smrti při stoupající dávce léků a zároveň zjištěno vyšší riziko (3,53násobné) v přítomnosti kardiovaskulárního onemocnění.
V populační studii případů a kontrol Strausové [17], vycházející z observační databáze dobře definované komunity pacientů 150 praktických lékařů, byla léčba antipsychotiky spojena s trojnásobně vyšším výskytem NSS. Toto riziko bylo nejvyšší při podávání butyrofenonů (haloperidol, pipamperon, bromperidol a benperidol) a thioxantinů (flupentixol a zuklopentixol) s poměry šancí (95% CI) 6,1 (2,6–14,1), resp. 3,4 (0,5–32,6). Přizpůsobením analýzy pro přítomnost diabetu mellitu, arytmií a léčbě diuretiky se riziko NSS u terapie butyrofenony zvýšilo na 7,3 (2,8–18,8). Překvapivě nejnižší riziko NSS bylo prokázáno při terapii fenothiaziny (chlorpromazin, levopromazin, perfenazin, thioridazin, prochlorperazin, trifluoperazin, perazin a periciazin), a to 1,7násobné, resp. 0,8násobné, pokud byla zohledněna přítomnost diabetu, arytmií a užívání diuretik.
Kazuistika
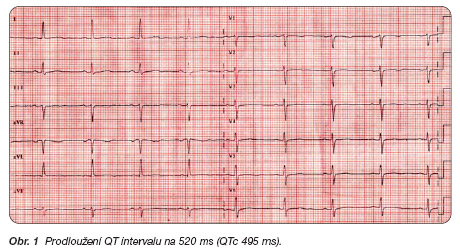
67letá obézní diabetička (BMI 45,7) bez anamnézy kardiovaskulárního onemocnění byla přijata na interní kliniku pro dekompenzovaný diabetes mellitus k intenzivní inzulinoterapii. V rámci depresivní poruchy užívala dlouhodobě amitriptylin (175 mg/den) a thioridazin (200 mg/den). Vstupní povrchové EKG bylo bez repolarizačních změn, QT interval 400 ms (QTc 420 ms). Terapie hypertenze byla posílena o diuretika. 11. den hospitalizace prodělala nemocná krátkou poruchu vědomí (synkopa). Na povrchovém EKG byla přítomna sinusová bradykardie s nespecifickými repolarizačními změnami (difuzně ploché T) a došlo k prodloužení QT intervalu na 520 ms (QTc 495 ms) (obr. 1).
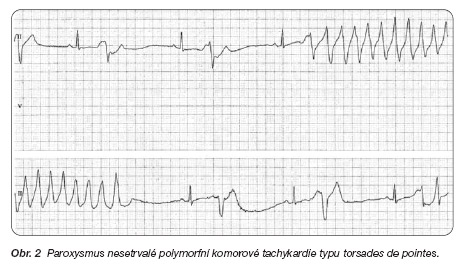
Následně byly dokumentovány paroxysmy nesetrvalé polymorfní komorové tachykardie typu torsades de pointes (obr. 2).
Sérová hladina kalia byla v době arytmické příhody 4,4 mmol/l. Amitriptylin a thioridazin byly nahrazeny sertralinem v dávce 50 mg/ den. Paroxysmy komorových arytmií TdP zcela vymizely po dočasné kardiostimulaci pravé komory (urychlení komorové frekvence na 90 tepů/min), při které došlo ke zkrácení QT intervalu. Nemocná byla za 18 dní od ataky TdP propuštěna domů kardiopulmonálně kompenzovaná, na výstupním EKG byl QT interval v normě (QTc byl 408 ms). V následujících 4 letech byla nemocná bez recidivy arytmií s normálním QT intervalem při ambulantních kontrolách v uspokojivém somatickém i psychickém stavu.
Myokarditida
Nejčastější příčinou myokarditid obecně je těžce probíhající infekční onemocnění (chřipkové viry, coxsakie B, echoviry, toxoplazmóza, borelióza) nebo toxoalergická reakce. Klinicky méně závažné formy se mohou projevit ektopickými stahy myokardu nebo převodními poruchami, závažnější formy jsou charakterizovány poruchou systolické funkce levé komory se sníženou ejekční frakcí a dilatací komory. Myokarditida může přecházet v dilatovanou kardiomyopatii [18].
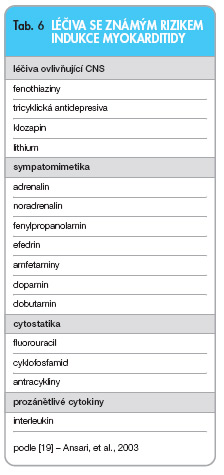
Myokarditidy indukované farmaky mají nejčastěji hypersenzitivní nebo toxickou etiologii. Léčiva se známým rizikem indukce myokarditidy jsou uvedena v tab. 6.
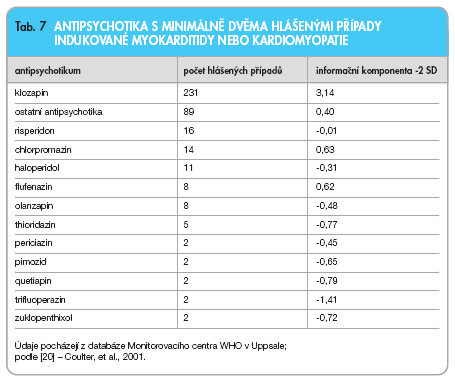
Byly popsány jednotlivé případy myokarditid indukovaných antipsychotiky první i druhé generace (tab. 7). Podle databáze Světové zdravotnické organizace (WHO) je relativně nejvyšší riziko vzniku myokarditidy nebo kardiomyopatie spojené s podáváním klozapinu. Riziko pro vznik myokarditidy znamená v menší míře také léčba chlorpromazinem a haloperidolem [20]. Riziko myokarditidy indukované antipsychotikem zvyšuje současný abúzus amfetaminových derivátů, kokainu a alkoholu [19].
První případy myokarditidy při léčbě klozapinem se v literatuře objevily na začátku 80. let minulého století. Vesterby a spolupracovníci [21] zaznamenali smrt mladého pacienta v důsledku myokarditidy po náhodném předávkování klozapinem. Větší pozornost je věnována spojení klozapin a myokarditidy od uveřejnění práce Kiliana a kol. [22]. Mezi 8000 Australany léčenými klozapinem našli 15 případů myokarditidy, z nichž 5 skončilo letálně. Kardiomyopatii zjistili u 8 nemocných. Firma Novartis obdržela 213 spontánních hlášení výskytu myokarditidy indukované klozapinem, z toho 50 pacientů zemřelo. V 85 % případů se obtíže vyskytly během prvních dvou měsíců léčby. Zpravidla byl lék podáván v doporučených denních dávkách. Asi 40 % hlášení se týkalo lidí mladších 30 let [23]. Riziko myokarditidy je u nemocných léčených klozapinem 17–322krát vyšší než v obecné populaci. Riziko fatální myokarditidy je 14–161krát vyšší [23]. Celkem bylo evidováno 231 případů myokarditidy a kardiomyopatie při léčbě klozapinem. U všech ostatních antipsychotik je hlášeno 89 případů [20, 24].
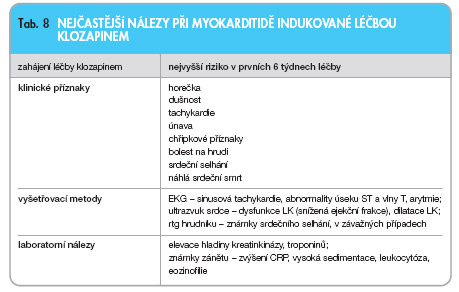
Skutečné riziko myokarditidy vyvolané léčbou klozapinem je zřejmě vyšší. Důvodů je několik. Dobrovolná hlášení tvoří asi 1–15 % z celkového počtu nežádoucích účinků. Velká variabilita příznaků myokarditidy znesnadňuje její diagnostiku. Stupeň klinického podezření na klozapinem indukovanou myokarditidu je u psychiatrů obecně nízký. Některé příznaky myokarditidy – teplota, tachykardie a únava – jsou běžnými obtížemi vyskytujícími se na začátku podávání a při titraci dávky klozapinu [25]. Pacienti se schizofrenií věnují svým tělesným obtížím většinou malou pozornost. Lehčí formy kardiálního onemocnění tak mohou proběhnout bez povšimnutí.
Náhlou srdeční smrt v důsledku hypersenzitivní myokarditidy indukované klozapinem popsal Fineshi a kol. [26]. 29letému muži s farmakorezistentní schizofrenií byl indikován klozapin. Po jednom týdnu léčby dostal pacient horečku a průjem. Neměl chuť k jídlu a byl unavený. Po dalším týdnu nemocný náhle zemřel. Dávka klozapinu byla 400 mg pro die. Pitevní nález určil akutní myokarditidu s eozinofilními infiltráty jako příčinu smrti.
Pieroni a kol. [27] zaznamenali klozapinem indukovanou myokarditidu po 11 dnech léčby. Diagnózu podpořil histologický obraz eozinofilních infiltrátů v myokardu. Vzorek získali pomocí endokardiální biopsie levé komory při katetrizaci srdce. Nemocný se uzdravil několik dnů po ukončení léčby klozapinem při terapii kortikosteroidy.
Merrill a kol. [24] analyzovali články z databází PubMed a MEDLINE z let 1970–2004. V nalezených 69 případech byl medián doby léčby klozapinem do stanovení diagnózy myokarditidy méně než tři týdny. Polovina případů skončila smrtí nemocného. Nejčastějšími klinickými symptomy byly febrilie, dušnost, chřipkové příznaky, náhlá smrt, bolest na hrudi a únava. Přibližně u poloviny postižených byla na ultrazvuku srdce patrná hypokinéza levé komory a/nebo snížená ejekční frakce. Jedna třetina měla abnormální EKG, zejména změny vlny T a periferní eozinofilii. Dalšími nálezy byly zvýšená hladina kreatinkinázy v séru, perikardiální výpotek a srdeční selhání.
Biopsie myokardu je v porovnání s jejím užitkem riskantní zákrok. Z laboratorních parametrů jsou vysoce senzitivní pro poškození myokardu troponiny, kreatinkináza a její MB izoforma. Stanovení počtu eozinofilů nebo eozinofilního kationtového proteinu může přispět ke stanovení diagnózy myokarditidy. Souhrn nálezů při myokarditidě indukované klozapinem je uveden v tab. 8.
Vztah mezi myokarditidou a léčbou klozapinem je zjevný. Příčinná souvislost však není zcela objasněna. Podle Kiliana a kol. [22] lze v některých případech usuzovat na polékovou myokarditidu způsobenou alergickou rekací typu I (hypersenzitivitu zprostředkovanou IgE). Spuštěna je pak kaskáda tvorby a výdeje zánětlivých mediátorů a prostaglandinů. Hägg a kol. [28] hovoří o hypereozinofilním syndromu indukovaném klozapinem jako o alergické reakci typu I. Možná je bioaktivace klozapinu na chemicky reaktivní metabolity, které byly nalezeny v myokardiální tkáni. Méně pravděpodobným mechanismem je alergická reakce typu III a přímý toxický účinek eozinofilů na myokard cestou blokády cholinergních receptorů M2.
Vysoké plazmatické hladiny klozapinu s možným vlivem na srdeční činnost se mohou objevit u lidí s nedostatečnou činností jaterních enzymů CYP 1A2 a CYP 1A3. Pöllmacher a kol. [29] se domnívají, že klozapin podporuje uvolňování cytokinů, především tumor nekrotizujícího faktoru (TNF). Při myokarditidě indukované klozapinem je zvýšená hladina TNF-a.
Riziko myokarditidy při léčbě klozapinem (případně dalšími antipsychotiky) by mělo být bráno v úvahu při sestavení plánu dlouhodobého sledování nemocných. Před započetím léčby klozapinem je nutné provést fyzikální vyšetření a EKG. Zaměříme se na osobní a rodinnou anamnézu onemocnění srdce. Největší riziko vzniku myokarditidy je v prvních dvou měsících podávání klozapinu. Zvláště pozorně je nutno v této době sledovat případné příznaky kardiálního onemocnění [30, 31].
Diagnóza myokarditidy je obtížná. Lze ji stanovit až po vyloučení všech ostatních možných příčin stavu. Z vyšetření je vhodné provést EKG a rtg plic, ultrazvuk srdce a laboratorní vyšetření. Další postup by měl být veden ve spolupráci s kardiologem. Endomyokardiální biopsie může být v akutní fázi přínosná. Může však přinést falešně pozitivní výsledky. Navíc pro nemocného znamená riziko vzniku tamponády. Při podezření na myokarditidu musí být ukončena léčba klozapinem (nebo jiným antipsychotikem). V léčbě jsou vzhledem k předpokládaným imunologickým mechanismům doporučovány kortikosteroidy [28]. Podávání inhibitorů ACE přichází v úvahu při dysfunkci, dilataci nebo selhání levé komory. Dále jsou užívány b-blokátory v nízkých dávkách (carvedilol, metoprolol sukcinát) pro svůj antiischemický a antiarytmický efekt. Snižují nároky myokardu na kyslík a jsou účinné v prevenci náhlé smrti. Při srdečním selhávání je indikována léčba diuretiky.
Při stanovení diagnózy hypersenzitivní myokarditidy by již daný lék neměl být nemocnému v budoucnu podáván. Byly popsány případy rekurence srdečního onemocnění.
Kazuistika
43letý pacient byl léčen pro koincidenci schizoafektivní poruchy a Parkinsonovy nemoci (PN). V takovém případě je lékem volby klozapin, který významně nezhoršuje motorické příznaky PN. Našemu nemocnému byl klozapin nasazen dvakrát v průběhu půl roku. Podobnost klinického obrazu, laboratorních hodnot, nálezů při ultrazvukovém vyšetření srdce a doby od zahájení léčby klozapinem byla více než nápadná. V obou případech došlo po 11, resp. 12 dnech k rozvoji myokarditidy. V klinickém obraze dominovaly febrilie, dušnost, tachykardie a únava. Laboratorní známky zánětu (CRP) odpovídaly postižení myokardu. Podle ultrazvuku srdce byla dilatovaná levá komora, byla přítomna hypokinéza levé komory a snížená ejekční frakce. Scintigrafické vyšetření srdce ukázalo typický nález pro myokarditidu: zvýšený záchyt radiofarmaka v myokardu. Po vysazení klozapinu obtíže odezněly a nález na echokardiogramu srdce se upravil. Popsané nálezy vedly k závěru, že se velmi pravděpodobně jednalo o klozapinem indukovanou myokarditidu. V současné době je pacient léčen olanzapinem v kombinaci s L-DOPA a amantadinem [32].
Perikarditida
Je dokumentováno několik případů perikarditidy, perikardiálního výpotku a polyserositidy v prvních třech týdnech po započetí léčby klozapinem. Po jejím ukončení většinou příznaky ustoupily [24, 31].
Kardiomyopatie
Jako kardiomyopatie (KMP) je označována skupina onemocnění myokardu provázených poruchou srdeční funkce. Klasifikují se ve čtyřech typech podle dominantní patofyziologie (KMP dilatační, hypertrofická, restriktivní a arytmogenní). KMP mohou způsobit různé etiologické faktory (ischémie, chlopenní vady, hypertenze, zánět myokardu, metabolické a endokrinní poruchy, systémová onemocnění, neuromuskulární poruchy, vliv toxických faktorů včetně vlivu farmak) [33]. Z tohoto přehledu vyplývá, že etiopatogenetický vztah schizofrenie a KMP může vznikat na různých úrovních. Toxická poléková reakce je jen jedna z diferenciálně diagnostických možností. Příčinou KMP při onemocnění schizofrenií může být ischemické poškození srdečního svalu, hypertenzní choroba nebo metabolické a endokrinní poruchy. Všechny uvedené somatické komorbidní poruchy jsou u nemocných se schizofrenií častější než v obecné populaci. Příčinou KMP bývá chronické zneužívání alkoholu. Kardiomyopatie může být konečným, ireverzibilním stadiem chronické myokarditidy. Dlouho trvající zánět srdečního svalu je příčinou myocytolýzy. Zaniklé myocyty jsou nahrazovány fibrózní tkání [34].
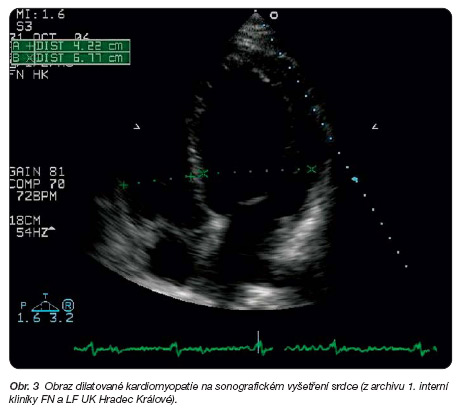
Nejčastější formou KMP u schizofrenních nemocných je dilatační KMP (obr. 3).
Dochází při ní k výraznému rozšíření srdce, které je příčinou poškození systolické i diastolické funkce myokardu komor. Funkční postižení může vést k rozvoji srdečního selhání a ke vzniku plicní hypertenze.
Klinicky se dilatační KMP projevuje námahovou dušností, která se postupně prohlubuje do klidové dušnosti. Obraz může být v dalším průběhu komplikován noční dušností (asthma cardiale) a plicním edémem. Selhávání pravé komory způsobí zvýšení náplně krčních žil, hepatomegalii, otoky a ascites. Komplikací může být embolizace do plicního nebo systémového oběhu. Klinické známky rozvoje srdeční nedostatečnosti by měly vést ošetřujícího psychiatra ke konzultaci stavu s internistou. Základními pomocnými vyšetřeními jsou EKG a ultrazvukové vyšetření srdce. Při vyjádřených projevech srdečního selhávání umírá do jednoho roku přibližně 20 % nemocných [33] a do pěti let 50 % nemocných [24]. Kontraindikována jsou fenotiazinová antipsychotika, haloperidol a klozapin pro jejich kardiotoxicitu [20, 22, 24]. Nemocný by měl přestat kouřit a pít alkohol, měl by redukovat hmotnost a redukovat příjem solí v dietě. Pro redukci hmotnosti je nejdůležitější úprava diety. Zvýšená fyzická námaha při KMP se známkami srdečního selhávání není možná.
Povlsen a kol. [35] popsali nežádoucí účinky terapie klozapinem u 216 nemocných léčených v letech 1971–1983. U dvou nemocných došlo k srdečnímu selhání. U jednoho, 48letého muže léčeného klozapinem, byla diagnostikována dilatační forma KMP, která se zlepšila tři dny po ukončení léčby klozapinem.
Leo a kol. [36] publikovali kazuistiku nemocné s rozvojem dilatační KMP po 4 týdnech léčby klozapinem. Ejekční frakce levé komory byla u nemocné snížena na 18 %. Tři měsíce po ukončení léčby klozapinem se ejekční frakce levé komory zlepšila na 33 %.
Merrill a kol. [24] uvedli, že v USA bylo Federálnímu úřadu pro potraviny a léky (FDA) hlášeno 41 případů KMP spojené s léčbou klozapinem. V deseti případech končila KMP smrtí nemocného. Výrobce klozapinu firma Novartis uvádí 178 hlášení KMP, z nichž 32 skončilo fatálně [23]. Délka od počátku terapie klozapinem do prvních projevů KMP může být ve velkém rozpětí 2 týdnů až 7 let s mediánem 9 měsíců [24]. Častěji se KMP při léčbě klozapinem objeví u mužů (80 %) mladších než 50 let.
Tanner a Culling [37] publikovali případ 31letého muže léčeného 6 let klozapinem, který trpěl sinusovou tachykardií (110 tepů/min) a obtížemi s dýcháním. Na EKG byly zjištěny známky hypertrofie levé komory a prodloužený QTc interval. Sonografické vyšetření srdce potvrdilo přítomnost dilatační KMP s ejekční frakcí levé komory sníženou na 9 %. Klinické známky srdeční nedostatečnosti se zlepšily po 6 týdnech při podávání b-blokátoru, diuretika, inhibitoru ACE a při převedení z léčby klozapinem na léčbu olanzapinem.
Nejen podávání klozapinu, ale i léčba jinými antipsychotiky může být spojena s rozvojem kardiomyopatie.
Ansari a kol. [19] popsali klinický případ nemocné, která se od svých 35 let léčila pro chronickou paranoidní schizofrenii. V posledních 10 letech užívala kombinaci perfenazinu (2 mg) a amitriptylinu (25 mg). V 66 letech u ní bylo zjištěno srdeční selhávání a blok levého Tawarova raménka. Ultrazvukovým vyšetřením srdce byla zjištěna dilatace komor s mitrální i trikuspidální regurgitací. Hemodynamicky se těžké postižení levé komory projevovalo významně sníženou ejekční frakcí. Po dvou letech přes intenzivní kardiologickou léčbu nemocná zemřela. Pitvou byla prokázána chronická toxická myokarditida s fibrózou a dilatační kardiomyopatie.
Brakoulias a kol. [38] publikovali kazuistiku 29letého muže, otce dvou dětí, který se léčil pro schizofrenii, abúzus alkoholu a panickou poruchu. Pro vzestup glykémie byl z léčby olanzapinem převeden na léčbu amisulpridem. Po 7 dnech užívání amisulpridu začal být nemocný dušný, stěžoval si na bolesti na hrudi a měl zvýšenou teplotu. K hospitalizaci byl přijat pro plicní edém. Ultrazvuk srdce prokázal dilataci levé srdeční komory, výrazné snížení ejekční frakce a lehkou mitrální regurgitaci. U nemocného byla diagnostikována pneumonie. Propuštěn byl po 6 týdnech při léčbě inhibitorem ACE a b-blokátorem. Antipsychotikum nebylo nemocnému podáváno. Sonografický obraz srdce zůstal nezlepšen.
Ve vlastním souboru jsme vyšetřili 82 nemocných léčených pro schizofrenii v ambulanci Psychiatrické kliniky FN Hradec Králové [32]. 68 nemocných bylo léčeno dlouhodobě (průměrně 10 let) depotními antipsychotiky první generace (flufenazin, flupentixol, haloperidol), 14 nemocným byl dlouhodobě (průměrně 16 let) podáván klozapin. Screeningové vyšetření zahrnovalo klidové EKG, ultrazvukové vyšetření srdce a stanovení koncentrací troponinu T a kreatinkinázy MB v séru. V tomto souboru jsme nezaznamenali žádný případ myokarditidy. U žádného z nemocných nebyly nalezeny patologické změny na elektrokardiogramu. Koncentrace vyšetřovaných enzymů byla ve fyziologickém rozmezí u všech nemocných. Na echokardiogramu byly nalezeny známky hraniční velikosti srdečních oddílů ve čtyřech případech nemocných léčených depotními antipsychotiky. Žádné známky kardiální patologie nebyly nalezeny ve skupině 14 nemocných dlouhodobě léčených klozapinem.
Závěr
Zvýšené riziko závažných arytmických příhod (komorové polymorfní arytmie typu torsades de pointes) a náhlé srdeční smrti u pacientů léčených pro schizofrenii může být způsobeno prodloužením QT intervalu léčbou některými antipsychotiky. Riziko náhlé srdeční smrti je vyšší u žen, u pacientů s organickým onemocněním srdce (např. městnavé srdeční selhání, kardiomyopatie, bradykardie), při hypokalémii nebo při snížení jaterních funkcí. Při léčbě antipsychotiky (a to již před zahájením terapie) by měl být QT interval sledován a korigován na srdeční frekvenci (QTc). Lékař indikující antipsychotika by měl podrobně znát somatickou anamnézu nemocného, nežádoucí účinky a interakce podávaných léčiv. U nemocných trpících schizofrenií léčených antipsychotiky je rovněž zvýšené riziko žilního tromboembolismu.
Problematika tromboembolických komplikací při léčbě schizofrenie překračuje rámec tohoto přehledu.
Psychiatr při monitorování tělesného stavu nemocných se schizofrenií často zastupuje praktického lékaře. Bývá někdy jediným lékařem, kterého nemocný navštěvuje. Ačkoliv frekvence výskytu myokarditidy, kardiomyopatie nebo perikarditidy je při terapii antipsychotiky nízká, je třeba na tyto kardiální komplikace myslet a včas konzultovat stav nemocného s internistou. Kardiální komplikace léčby antipsychotiky mohou ohrozit život nemocného.
Práce byla podpořena výzkumným záměrem Ministerstva zdravotnictví České republiky MZO 00179906 a výzkumným záměrem 3. LF UK MSM 0021620816.
Seznam použité literatury
- [1] Jeste DV, Gladsjo JA, Lindamer LA, Lacro JP. Medical comorbidity in schizophrenia. Schizophr Bull 1996; 22: 413–430.
- [2] Vieweg V, Levenson J, Pandurangi A, Silverman J. Medical disorders in the schizophrenic patient. Int J Psych Med 1995; 25: 137–172.
- [3] Buckley NA, Sanders P. Cardiovascular adverse effects of antipsychotic drugs. Drug Saf 2000; 23: 215–228.
- [4] Novotný T, Semrád B. Psychofarmaka, změny QT intervalu a riziko arytmií. Čes a slov Psychiat 2002; 98: 100–103.
- [5] Bytešník J, Čihák R. Arytmie v medicínské praxi. Praha, Triton, 1999.
- [6] Moss AJ, Robinson J. Clinical features of the idiopathic long QT syndrome. Circulation 1992; 85 (Suppl 1): 1140–1144.
- [7] Zareba W, Lin DA. Antipsychotic drugs and QT interval prolongation. Psych Q 2003; 74: 291–306.
- [8] Švestka J. Antipsychotika a QT interval. Psychiatrie pro praxi 2001; 3: 125–127.
- [9] Mezinárodní registr léků prodlužujících QT interval a/nebo způsobujících torsades de pointes. Získáno 24. října 2006 na www.torsades.org.
- [10] Vlay SC. Sudden Cardiac Death: An Overview. In: A Practical Approach to cardiac Arrhythmias. Vlay SC (Ed.) Boston, Little, Brown and Company 1996; 1–11.
- [11] Bayes de Luna A, Coumel P, Leclerq JF. Ambulatory sudden cardiac death: mechanism of production of fatal arrhythmia on the basis on data from 157 cases. Am J Cardiol 1997; 80: 770–774.
- [12] Kelly HG, Fay JE, Lavery SG. Thioridazine hydrochloride (Mellaril): Its effect on the electrocardiogram and a report of two fatalities with electrocardiographic abnormalities. Can Med Assoc J 1963; 89: 546–554.
- [13] Baštecký J, Kvasnička J, Vortel J, et al. Sebevražedné požití thioridazinu jako příčina závažné poruchy srdečního rytmu – polymorfní komorové tachykardie. Čs Psychiat 1990; 86: 264–268.
- [14] Gordon M. Memorandum from the Division of CardioRenal Drug Products Consultation Regarding Ziprasidone. NDA # 20825, study report of Clinical Pharmacology Protocol #128–054. June 14, 2000. Získáno z www.fda.gov/ohrms/dockets/ac00/backgrd/3619b1b.pdf.
- [15] Hennessy S, Bilker WB, Knauss JS, et al. Cardiac arrest and ventricular arrhythmia in patients taking antipsychotic drugs: cohort study using administrative data. BMJ 2002; 325: 1070–1072.
- [16] Ray WA, Meredith S, Thapa PB, et al. Antipsychotics and the risk of sudden cardiac death. Arch Gen Psych 2001; 58: 1161–1167.
- [17] Straus SM, Bleumink GS, Dieleman JP, et al. Antipsychotics and the risk of sudden cardiac death. Arch Intern Med 2004; 164: 1293–1297.
- [18] Bureš J, Horáček J. Základy vnitřního lékařství. Praha, Galén 2003.
- [19] Ansari A, Maron BJ, Berntson DG. Drug-induced toxic myocarditis. Tex Heart Indy J 2003; 30: 76–79.
- [20] Coulter DM, Bate A, Meyboom RHB, et al. Antipsychotic drugs and heart muscle disorder in international pharmacovigilance: data mining study. BMJ 2001; 322: 1207–1209.
- [21] Vesterby A, Pedersen JH, Kaempe B, Thomsen NJ. Sudden death dutiny treatment with clozapine (Leponex). Ugeskr Laeger 1980; 142: 170–171.
- [22] Kilian JG, Kerr K, Lawrence CH, Celermajer DS. Myocarditis and cardiomyopathy associated with clozapine. Lancet 1999; 354: 1841–1845.
- [23] Novartis Pharmaceuticals Corporation. Clozaril (clozapine) Tablets [product monograph]. Dezember 2003.
- [24] Merrill DB, Dec GW, Goff DC. Adverse cardiac effects associated with clozapine. J Clin Psychopharmacol 2005; 25: 32–41.
- [25] Merrill DB, Ahmari SE, Bradford JME, Lieberman JA. Myocarditis during clozapine treatment. Am J Psych 2006; 163: 204–208.
- [26] Fineschi V, Neri M, Riezzo I, Turillazzi E. Sudden cardiac death due to hypersensitivity myocarditis during clozapine treatment. Int J Legal Med 2004; 118: 307–309.
- [27] Pieroni M, Cavallaro R, Chimenti C, et al. Clozapine-induced hypersensitivity myocarditis. CHEST 2004; 126: 1703–1705.
- [28] Hägg S, Spigset O, Bate A. Myocarditis related to clozapine treatment. J Clin Psychopharmacol 2001; 21: 382–388.
- [29] Pollmächer T, Schuld A, Kraus T, et al. Zur klinischen relevanz der wirkung von Clozapin auf die freisetzung von zytokinen und löslichen zytokinrezeptoren. Fortschritte der Neurologie-Psychiatrie 2001; 69 (Suppl 2): S65–S74.
- [30] Wooltorton E. Antipsychotic clozapine (Clozaril): myocarditis and cardiovascular toxicity. Can Med Assoc J 2002; 166: 1185–1186.
- [31] Wehmeier PM, Heiser P, Remschmidt H. Myocarditis, pericarditis and cardiomyopathy in patients treated with clozapine. J Clin Pharm Ther 2005; 30: 91–96.
- [32] Tůma I, Masopust J, Malý R. Antipsychotiky indukované myokarditidy a kardiomyopatie. In: Raboch J, Zrzavecká I, Doubek P. Nemocná duše – nemocný mozek: klinická zkušenost a fakta. Sborník přednášek a abstrakt VI. sjezdu České psychiatrické společnosti s mezinárodní účastí. Praha, Galén, 2006; 251–253.
- [33] Aschermann M. Kardiomyopatie. In: Klener P, et al. Vnitřní lékařství. Galén, Karolinum 1999: 198–203.
- [34] Kawai C. From myokarditis to cardiomyopathy: mechanisms of inflammation and cell death: learning from the past for the future. Circulation 1999; 99: 1091–1100.
- [35] Povlsen UJ, Noring U, Fog R, Gerlach J. Tolerability and therapeutic effect of clozapine. A retrospective investigation of 216 patients treated with clozapine for up to 12 years. Acta Psych Scand 1985; 71: 176–185.
- [36] Leo RJ, Kreeger JL, Kim KY. Cardiomyopathy associated with clozapine. Ann Pharmacother 1996; 30: 603–605.
- [37] Tanner MA, Culling W. Clozapine associated dilated cardiomyopathy. Postgrad Med J 2003; 79: 412–413.
- [38] Brakoulias V, Bannan E, Cohen P, Geary G. Amisulpride and cardiomyopathy. Aust NZ J Psych 2005; 39: 738.