Kardiovaskulární rizika léčby plicních onemocnění
Respirační nemoci představují v České republice třetí nejčastější příčinu úmrtí u žen a čtvrtou u mužů. Jsou nejčastějšími příčinami pracovních neschopností (35,5 %, 2011, ÚZIS). Jejich prevalence narůstá a již po desetiletí tato onemocnění patří mezi závažné zdravotní problémy (plicní karcinom). V jejich léčbě se používají léky různých farmakologických skupin, nejčastěji se jedná o bronchodilatátory (β2-agonisté, anticholinergika), antibiotika, cytostatika a další. V tomto článku jsou stručně popsány základní terapeutické postupy u nejčastějších pneumopatií a zdůrazněna jsou kardiovaskulární rizika, která s sebou tato léčba přináší.
Úvod
Nejčastější příčinou úmrtí v České republice jsou nemoci oběhové soustavy (v roce 2011 tvořily 49,3 % z počtu 106 848 všech úmrtí). Druhou nejčastější příčinou smrti byly novotvary, které se vyskytovaly u čtvrtiny všech zemřelých osob (25,4 %), přičemž u mužů byl tento podíl vyšší než u žen (27,7 % vs. 23,7 %). Třetí nejčastější příčinou smrti u mužů byly vnější příčiny (např. dopravní nehody, pády, sebevraždy, utonutí atd.), které se podílely na celkovém počtu zemřelých 8 % (oproti 3,5 % u žen). V případě žen byly třetí nejčastější příčinou smrti nemoci dýchací soustavy (4,6 % úmrtí žen). Na nemoci dýchací soustavy zemřelo 6 % mužů; tato onemocnění u nich představovala čtvrtou nejčastější příčinu úmrtí.
Nemocní s pneumopatiemi mají často kardiovaskulární (KV) komorbidity, a naopak kardiaci mohou mít komplikující onemocnění plic. Je tedy namístě popsat, jaké spektrum léků se užívá v současnosti v léčbě respiračních onemocnění a jak tato léčba může ovlivnit KV systém, eventuálně jak může interferovat se zahájenou kardiologickou léčbou.
Vzhledem k rozsahu článku si nelze činit nárok na vyčerpávající popis všech možných nežádoucích účinků léků indikovaných u všech pneumopatií. Dovolím si tedy vybrat nemoci vyskytující se v naší populaci nejčastěji. Budu se věnovat především problematice léčby chronické obstrukční plicní nemoci, plicním fibrózám, pneumoniím, tuberkulóze a plicnímu karcinomu. U všech uvedu základní doporučovanou léčbu, nejvíce užívané přípravky a jejich možné nežádoucí působení na KV aparát i možné interference se zahájenou kardiologickou léčbou.
Chronická obstrukční plicní nemoc
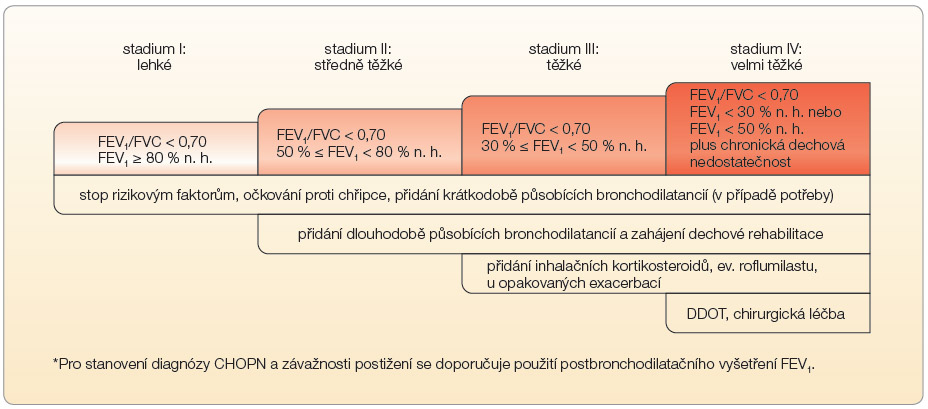
 Chronická obstrukční plicní nemoc (CHOPN) je závažné onemocnění, jehož prevalence trvale narůstá. Dle dostupných informací postihuje až 7,7 % obyvatelstva. Příčinou je kouření, trvalé znečišťování ovzduší (polétavý prach) i stárnutí populace. U nás je dobře známá a stále používaná klasifikace CHOPN podle jednoduchých spirometrických postbronchodilatačních hodnot, přestože od roku 2011 existuje nové mezinárodní doporučení podle Global Initiative for Chronic Obstructive Lung Disease (GOLD) [1]. Jednotlivé způsoby klasifikace uvádějí tab. 1 a obr. 1.
Chronická obstrukční plicní nemoc (CHOPN) je závažné onemocnění, jehož prevalence trvale narůstá. Dle dostupných informací postihuje až 7,7 % obyvatelstva. Příčinou je kouření, trvalé znečišťování ovzduší (polétavý prach) i stárnutí populace. U nás je dobře známá a stále používaná klasifikace CHOPN podle jednoduchých spirometrických postbronchodilatačních hodnot, přestože od roku 2011 existuje nové mezinárodní doporučení podle Global Initiative for Chronic Obstructive Lung Disease (GOLD) [1]. Jednotlivé způsoby klasifikace uvádějí tab. 1 a obr. 1.
![Obr. 1 Klasifikace CHOPN dle GOLD 2011. Dělení CHOPN na čtyři kategorie (A, B, C, D) dle nové klasifikace; příznakové skóre je hodnoceno buď podle modifikované škály dušnosti – mMRC (Medical Research Council), nebo podle dotazníku CAT (COPD Assessment Test). Jak je patrno, pro CAT je mezní hodnotou dosažení 10 bodů, mezníkem pro mMRC je hodnota 2 body; v počtu exacerbací je rozhodující počet 2 a více exacerbací za posledních 12 měsíců. CAT – COPD Assessment Test; CHOPN – chronická obstrukční plicní nemoc; GOLD – Global Initiative for Chronic Obstructive Lung Disease; mMRC – škála dušnosti dle Medical Research Council (modifikovaná škála dušnosti; stupeň 4 znamená dušnost při běžných činnostech) podle [1] – Global Initiative for Chronic Obstructive Lung Disease, 2011](https://www.remedia.cz/photo-a-29276---.jpg) I přes rozdílnost klasifikací CHOPN se léčba zásadně nemění a má ustálený postup. První podmínkou léčby je eliminace rizikových faktorů, především kouření, eliminace vlivu znečištěného ovzduší (pozor na profesní škodliviny), podávání léků, zvážen
I přes rozdílnost klasifikací CHOPN se léčba zásadně nemění a má ustálený postup. První podmínkou léčby je eliminace rizikových faktorů, především kouření, eliminace vlivu znečištěného ovzduší (pozor na profesní škodliviny), podávání léků, zvážen í možnosti indikace dlouhodobé domácí oxygenoterapie či indikace chirurgických léčebných modalit (volum reduktivní plicní operace či transplantace plic). Zkratky léčiv užívaných v této indikaci uvádí tab. 2, která zahrnuje (vzhledem k podobnosti s tímto onemocněním) také léčiva používaná v terapii asthma bronchiale. Doporučenou léčbu dle závažnosti CHOPN shrnují obr. 2 a tab. 3.
í možnosti indikace dlouhodobé domácí oxygenoterapie či indikace chirurgických léčebných modalit (volum reduktivní plicní operace či transplantace plic). Zkratky léčiv užívaných v této indikaci uvádí tab. 2, která zahrnuje (vzhledem k podobnosti s tímto onemocněním) také léčiva používaná v terapii asthma bronchiale. Doporučenou léčbu dle závažnosti CHOPN shrnují obr. 2 a tab. 3.
 Největší počet pacientů (cca 40 %) s CHOPN trpí II. stadiem (dle starší klasifikace středně těžká CHOPN) tohoto onemocnění. Standardní léčbou je u nich tiotropium bromid, někdy v kombinaci s inhalačními agonisty adrenergních receptorů β2 (β2-agonisté) s dlouhodobým účinkem (LABA). Mnozí nemocní s FEV1 (usilovně vydechnutý objem za 1 s) nižším než 60 % užívají fixní kombinace s inhalačními kortikosteroidy (ICS):
Největší počet pacientů (cca 40 %) s CHOPN trpí II. stadiem (dle starší klasifikace středně těžká CHOPN) tohoto onemocnění. Standardní léčbou je u nich tiotropium bromid, někdy v kombinaci s inhalačními agonisty adrenergních receptorů β2 (β2-agonisté) s dlouhodobým účinkem (LABA). Mnozí nemocní s FEV1 (usilovně vydechnutý objem za 1 s) nižším než 60 % užívají fixní kombinace s inhalačními kortikosteroidy (ICS): 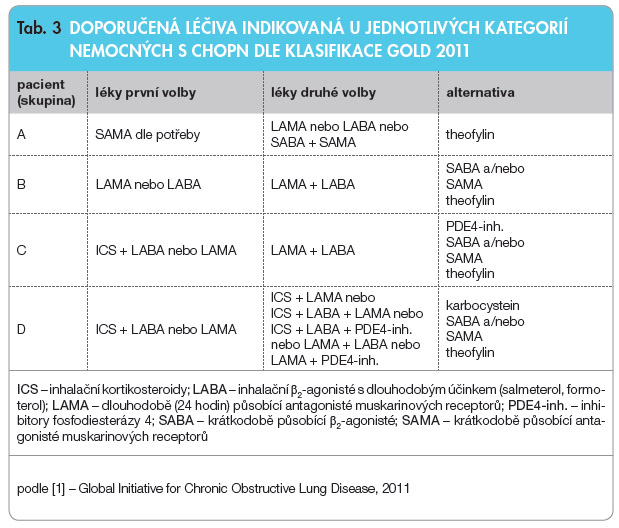 salmeterol/flutikason nebo formoterol/budesonid. Nemocní někdy užívají také theofyliny a jako záchrannou léčbu u sebe mají některý přípravek s krátkodobě působícím β2-agonistou (SABA), např. salbutamol, nebo kombinaci fenoterolu a ipratropia bromidu.
salmeterol/flutikason nebo formoterol/budesonid. Nemocní někdy užívají také theofyliny a jako záchrannou léčbu u sebe mají některý přípravek s krátkodobě působícím β2-agonistou (SABA), např. salbutamol, nebo kombinaci fenoterolu a ipratropia bromidu.
U nemocných s CHOPN se častěji vyskytují KV nemoci ve srovnání s osobami s normální ventilací, jak bylo potvrzeno v mnoha studiích [2]. Léčba nemocných s CHOPN je dlouhodobá (trvá i desetiletí), a tak se může sčítat zmíněné vyšší riziko vzniku KV nemocí s KV nežádoucími účinky léků indikovaných u CHOPN.
Agonisté adrenergních receptorů β2
Již několik desetiletí se vedou diskuse týkající se bezpečnosti léčby β2-agonisty.
Stále se objevují nové studie potvrzující jejich potenciál způsobit KV nežádoucí účinky, ale i studie, které tyto účinky neprokazují.
Agonisté adrenergních receptorů β2 mají pozitivní inotropní a chronotropní účinky, které mohou zvýšit riziko arytmií i zhoršit existující kardiomyopatii. Toto potvrdila studie publikovaná v roce 2004, která prokázala, že chronické užívání β2-agonistů může být spojeno se zvýšením KV rizika, které je závislé na dávce léku. Poškozeni mohou být zejména nově indikovaní nemocní s konkomitantním srdečním onemocněním (infarkt myokardu, srdeční selhání, zástava srdce). Data z metaanalýz svědčí pro dvojnásobné zvýšení rizika KV příhod ve srovnání s placebem [3].
V minulosti bylo v souvislosti s užitím β2-agonistů prokázáno nebezpečí prodloužení QT intervalu, což potvrdila i metaanalýza 33 studií posuzujících arytmogenní potenciál těchto léků oproti placebu (n = 6623) [3]. Proto se u každého nového β2-agonisty prověřuje, jak významný má vliv na tento ukazatel. Tak tomu bylo i v případě nového léčiva indakaterolu s ultradlouhým účinkem (přetrvává 24 hodin). Ve studii bylo 404 účastníků rozděleno do několika skupin: tvořili je pacienti užívající postupně se zvyšující dávky léku (150, 300, 600 µg), dále ti, kteří dostávali placebo, a v poslední skupině byli zařazeni nemocní užívající 400 mg moxifloxacinu (pozitivní kontrola), o kterém je známo, že interval QT prodlužuje. Indakaterol nezpůsobil žádné významné prodloužení QT intervalu oproti placebu, QT interval byl oproti placebu významně prodloužen o 13,2 ms ve skupině osob užívajících moxifloxacin vs. placebo. Autoři studie uzavírají, že indakaterol v dávce 2krát až 4krát vyšší, než je obvyklá, QT interval neprodlužoval [4].
Randomizovaná studie (LABA v různých dávkách vs. placebo) z roku 2008 prokázala, že síňová tachykardie byla u nemocných jen nevýznamně vyšší (o 2–5 %) po podání LABA než po podání placeba (p = 0,70) [5]. Léčba nemocných s LABA (formoterolem nebo salmeterolem) neměla za následek žádné významné změny v četnosti výskytu arytmií ve srovnání s placebem; častěji se u nich vyskytl třes. Podobně rozsáhlá tříletá studie TORCH (Towards a Revolution in COPD Health, n = 6200) prokázala, že chronické užívání salmeterolu v monoterapii u pacientů s CHOPN je bezpečné a nevede ke zvýšení úmrtnosti [6].
Bezpečnost podávání LABA nemocným s CHOPN potvrdila i metaanalýza (n = 2853) prověřující údaje ze sedmi klinických studií, která neprokázala žádné klinicky významné rozdíly ve výskytu KV příhod mezi užíváním salmeterolu a placeba [7]. V další velké metaanalýze (27 studií) [8] se prokázalo, že nebyl zjištěn žádný rozdíl ve výskytu respiračních úmrtí mezi nemocnými s LABA a že LABA významně snižují riziko těžkých exacerbací ve srovnání s placebem. Navíc použití LABA v kombinaci s ICS snížilo riziko respiračního úmrtí ve srovnání s užíváním LABA samotných. Autoři se shodují, že β2-agonisty je nutno používat s opatrností u pacientů se srdečním onemocněním, a to včetně ischemické choroby srdeční.
V souhrnné publikaci zabývající se indikací LABA u nemocných s CHOPN autoři uvádějí, že ačkoli β2-agonisté mohou vyvolávat KV nežádoucí účinky léčby u citlivých osob a u nemocných s CHOPN či s konkomitantní kardiopatií, je jejich podávání dostatečně bezpečné [9].
Anticholinergika
Při podávání anticholinergik se relativně často setkáváme s nežádoucími účinky léčby, jako je sucho v ústech (u 4 % dle SPC, 16 % dle [10]), retence moči a zvýšené riziko vzniku glaukomu uzavřeného úhlu. Podobně jako v případě β2-agonistů lze i v této skupině léků nalézt mnoho kontroverzních studií a metaanalýz.
Bezpečnost těchto látek – anticholinergik dlouze i krátce působících – byla zpochybňována výsledky metaanalýzy [11] posuzující 14 783 nemocných ze 17 klinických studií. Jejím hlavním výsledkem bylo zjištění, že inhalační anticholinergika významně zvyšují riziko vzniku infarktu myokardu (relativní riziko, RR, 1,52; konfidenční interval, CI, 1,04–2,22) a KV úmrtí (RR 1,92, CI: 1,23–3,0), jež se vyskytly u 1,8 % nemocných ze skupiny užívající anticholinergika oproti 1,2 % nemocných ze skupiny s kontrolní terapií (placebo, ICS/salmeterol, albuterol, salmeterol), p < 0,001.
Mechanismus vzniku KV nežádoucích účinků léčby není zcela jasný. Vedle prolongace QT intervalu (kontroverzní závěry) je uváděn vagolytický efekt s následnou supraventrikulární tachykardií či efekt zánětlivých cytokinů na srdeční rytmus [12].
Další analýza 15 klinických studií [13], z nichž ale pouze tři měly odpovídající design k hodnocení KV nežádoucích účinků, přinesla kontroverzní závěry. V prvně hodnocené Lung Health Study bylo prokázáno, že u nemocných užívajících ipratropium byl zaznamenán častější výskyt KV úmrtí než u nemocných, kteří dostávali placebo. Autoři této analýzy však soudí, že statistické zpracování nebylo adekvátní a že šlo většinou o nespolupracující nemocné.
Druhou hodnocenou studií byla INSPIRE (Investigating New Standards for Prophylaxis in Reducing Exacerbations), kte rá posuzovala efekt fixní kombinace salmeterol a flutikason vs. tiotropium bromid. Fatální KV nežádoucí účinky léčby byly pozorovány u 1 % nemocných užívajících kombinaci salmeterolu a flutikasonu a u 3 % nemocných užívajících tiotropium bromid. Autoři uvádějí, že INSPIRE nebyla uspořádána jako mortalitní studie.
rá posuzovala efekt fixní kombinace salmeterol a flutikason vs. tiotropium bromid. Fatální KV nežádoucí účinky léčby byly pozorovány u 1 % nemocných užívajících kombinaci salmeterolu a flutikasonu a u 3 % nemocných užívajících tiotropium bromid. Autoři uvádějí, že INSPIRE nebyla uspořádána jako mortalitní studie.
V přímém rozporu s výsledky této metaanalýzy jsou informace z třetího posuzovaného sledování – čtyři roky trvající prospektivní studie UPLIFT (Understanding the Potential Long-Term Impacts on Function with Tiotropium), která zahrnovala 5993 nemocných a srovnávala efekty tiotropia s placebem. Úmrtnost na závažné KV komplikace, srdeční selhání a infarkt myokardu byla významně nižší u pacientů užívajících tiotropium ve srovnání s placebem [14]. Autoři uzavírají, že zatím neumíme vysvětlit zjištěné rozdíly ve výskytu KV rizik při podávání anticholinergik, které jsou prezentovány ve velkých a věrohodných studiích provedených v minulosti. Je tedy potřeba nové provedení prospektivní a dostatečně průkazné klinické randomizované studie k posouzení bezpečnostních rizik při podání tiotropia. Frekvenci KV nežádoucích účinků tiotropium bromidu shrnuje tab. 4.
Methylxantiny
Methylxantiny (theofylin) jsou tradiční doplňkovou léčbou CHOPN. V současnosti se pro úzké rozmezí jejich terapeutických plazmatických koncentrací podávají především v retardovaných formách. Doporučuje se kontrolovat sérové hladiny theofylinu, jehož koncentrace by se měla nacházet v rozmezí 5–20 mg/l. Podávání theofylinu je kontraindikováno u osob s infarktem myokardu prodělaným v nedávné době, s akutní arytmií a s tachykardií. Zvláštní opatrnost se doporučuje u pacientů s nestabilní anginou pectoris, se sklonem k arytmiím s tachykardií a s těžkou hypertenzí, dále u nemocných s hypertrofickou obstrukční kardiomyopatií, hypertyreoidismem, epilepsií aj. Po podání theofylinu, zejména při užití vyšší dávky, než bylo doporučeno lékařem, se objevuje nespavost, třes, neklid, palpitace, tachykardie, zvracení i křeče. Vyšší riziko výskytu těchto příznaků hrozí při současně probíhající viróze, naopak snížená citlivost je u kuřáků.
Zpomalené odbourávání a/nebo vzestup hladiny theofylinu v plazmě, spojené se zvýšeným nebezpečím předávkování a zvýšeným rizikem výskytu nežádoucích účinků, může provázet současné užití léčiv uvedených v následujícím výčtu: perorální kontraceptiva, makrolidová antibiotika (zvláště erythromycin a troleandomycin), chinolony (inhibitory gyrázy, zvláště ciprofloxacin, enoxacin a pefloxacin), imipenem (zejména negativní působení na CNS – záchvaty), isoniazid, blokátory vápníkového kanálu (např. verapamil nebo diltiazem), propranolol, mexiletin, propafenon, tiklopidin, cimetidin, ranitidin, allopurinol, febuxostat, zafirlukast, vakcína proti chřipce. Současné podání theofylinu s furosemidem může vést k vyšším ztrátám kalia [15]. Naopak podání barbiturátů, fenytoinu (farmakokinetická interakce: enzymatická indukce) a β2-agonistů (farmakodynamická interakce) snižuje účinek theofylinu. Nejčastěji je třeba počítat s těmito KV nežádoucími účinky léčby: palpitace, tachykardie, extrasystoly, návaly, hypertenze, oběhové selhání, ventrikulární arytmie.
Fixní kombinace
GOLD doporučuje nemocným s CHOPN, kteří nejsou plně kontrolováni bronchodilatancii v monoterapii, léčbu fixní kombinací LABA/ICS, která zlepšuje plicní funkce, zmírňuje symptomy pacientů a snižuje frekvenci exacerbací nemocných se středně těžkou a těžkou formou CHOPN. Tato doporučení byla podrobena kritické metaanalýze 18 studií s 12 446 účastníky, která byla uveřejněna v časopise Chest v roce 2009 [16]. Vyplynulo z ní, že fixní kombinace ICS/LABA (ve srovnání s monoterapií LABA) nesnižuje počet těžkých exacerbací, počet úmrtí ze všech příčin, počet úmrtí na respirační onemocnění ani z KV příčin. Podání kombinace ICS a LABA snížilo počty středně závažných exacerbací a zlepšilo kvalitu života; dále bylo prokázáno zlepšení FEV1, avšak za cenu nárůstu počtu pneumonií. Autoři uzavírají, že nebylo dosaženo predefinovaných klinicky významných efektů léčby. Tyto výsledky však byly v kontradikci s dříve provedenou metaanalýzou [17], v níž kombinace ICS/LABA významně snižovala všechny exacerbace CHOPN.
Z výše uvedeného je zřejmé, že názory na efektivitu léčby se vyvíjejí a nejsou jednotné. Faktem je, že se fixní kombinace staly velice populárními v indikaci léčby nemocných s CHOPN, nejčastěji s hodnotou FEV1 < 60 %. Poslední studie stále více zpochybňují efektivitu podávání ICS pacientům s touto nemocí, rovněž doporučení GOLD 2011 [1] uvádí, že přínos těchto léčiv u CHOPN je kontroverzní. Studie provedené u nás i v zahraničí posuzující frekvenci podávání ICS nemocným s CHOPN prokazují jejich nadbytečné podávání.
Z KV hlediska se při podávání fixních kombinací (kvůli přítomnosti LABA) dají očekávat tyto nežádoucí účinky: třes, tachykardie, palpitace a bolest hlavy, fibrilace síní, supraventrikulární tachykardie a extrasystoly; u některých nemocných i periferní vazodilatace a zrychlení srdeční frekvence [15].
Kardiovaskulární komplikace po podání kortikosteroidů
Nežádoucí účinky objevující se při léčbě kortikosteroidy lze dělit na asociované s krátkodobým podáním (doba léčby trvající maximálně 3 týdny) a s dlouhodobým podáním (doba léčby přesahující 3 týdny). Nežádoucími účinky krátkodobé léčby jsou nejčastěji růst tělesné hmotnosti kvůli zadržování vody v organismu v důsledku retence sodíku, hyperglykemie a glukózová intolerance. Dále se může objevit hypokalemie, gastrointestinální obtíže včetně vředové choroby, reverzibilní útlum osy hypotalamus-hypofýza-nadledviny (HPA). Někdy se objeví změny nálady kolísající od euforie a nespavosti přes nervozitu, neklid, mánii, depresi, bludy, halucinace až po násilné chování.
Mezi nejčastější dlouhodobé nežádoucí účinky léčby steroidy patří potlačení osy HPA, Cushingova nemoc, hirsutismus nebo virilismus. Léčbu může provázet také impotence, nepravidelná menstruace, peptická vředová choroba, šedý zákal a zvýšení nitroočního tlaku, myopatie či osteoporóza včetně možných kompresivních zlomenin obratlů.
KV nežádoucí účinky zahrnují arteriální hypertenzi a městnavé srdeční selhání v důsledku dlouhodobé retence tekutin. Dále se může objevit bradykardie, srdeční zástava, srdeční arytmie, dilatace srdce, oběhový kolaps či tuková embolie. Rovněž tak byly zaznamenány a hlášeny ruptury myokardu po nedávném infarktu myokardu, synkopa, tachykardie, tromboembolismus, tromboflebitidy a vaskulitidy [18].
Inhibitory fosfodiesterázy 4
Poslední zde zmiňovanou skupinou léků určených pro nemocné s těžkou a velmi těžkou CHOPN jsou inhibitory fosfodiesterázy 4, konkrétně roflumilast. Jde o selektivní inhibitor, který je prvním léčivem s prokázaným protizánětlivým efektem užívaným v léčbě CHOPN. V klinických studiích, v nichž byl roflumilast srovnáván s placebem, se nežádoucí účinky vyskytly u přibližně 16 % nemocných užívajících roflumilast v porovnání s 5 % nemocných užívajících placebo. Nejčastějšími nežádoucími účinky byly průjem (5,9 %), snížení hmotnosti (3,4 %), nevolnost (2,9 %), bolest břicha (1,9 %) a bolest hlavy (1,7 %). Většina těchto nežádoucích účinků měla mírný až středně těžký průběh; objevily se během prvních týdnů léčby a většinou vymizely s pokračující léčbou.
KV nežádoucí účinky byly méně časté a jednalo se pouze o palpitace. V posledních letech přibývá informací dokonce o protektivním efektu roflumilastu. Na konferenci ATS (American Thoracis Society) v Denveru referoval William B. White o metaanalýze 14 studií zahrnujících 6563 nemocných, kde se porovnávaly KV nežádoucí účinky léčby roflumilastem s účinky placeba. Riziko všech těchto nežádoucích účinků bylo nízké a srovnatelné s placebem, ale při odděleném hodnocení, tzv. major adverse cardiovascular events (MACE), se úmrtí na nefatální infarkty myokardu vyskytovala významně méně často ve skupině léčených roflumilastem oproti skupině užívající placebo (hazard ratio, HR, 0,65; 95% CI: 0,45–0,93; p = 0,019). Tento výsledek svědčí pro určitý přínos roflumilastu v zabránění vzniku KV příhod, který by měl být v dalších klinických studiích posouzen [19].
Dlouhodobá domácí oxygenoterapie
Mezi moderní způsoby léčby nemocných s CHOPN patří i dlouhodobá domácí oxygenoterapie (DDOT). Nepřináší nemocným KV rizika (spíše naopak). Na její indikaci je třeba myslet u všech spolupracujících nemocných s CHOPN v respirační insuficienci, jejichž hodnota parciálního tlaku v arteriální krvi (PaO2) je nižší než 7,3 kPa.
Plicní fibrózy
Idiopatická plicní fibróza (IPF) je závažné onemocnění, jehož incidence dosahuje v USA 6–16/100 000 obyvatel ročně, v České republice, dle domácích studií, je nižší, asi 1/100 000. Definice popisuje IPF jako specifickou formu chronické progredující fibrotizující intersticiální pneumonie nejasné etiologie, která se objevuje primárně u dospělých jedinců, postihuje pouze plíce a je spojena s histopatologickým a/nebo radiologickým obrazem obvyklé intersticiální pneumonie.
V současnosti lze doporučit nemocným buď léčbu N-acetylcysteinem (1800 mg/den) nebo pirfenidonem (2403 mg/den). Podávání N-acetylcysteinu zvažujeme u všech stadií IPF, léčbu pirfenidonem pak pouze u mírných a středně těžkých forem.
Pirfenidon má antifibrotické a protizánětlivé vlastnosti. Studie prokázaly, že pirfenidon snižuje proliferaci fibroblastů, inhibuje produkci kolagenu stimulovanou TGF-β (transformující růstový faktor) i produkci fibrogenních mediátorů, jako je TGF-β, dále snižuje produkci zánětlivých mediátorů, jako je TNF-α (tumor nekrotizující faktor α) a IL-1β (interleukin 1β).
Z hlediska kardiologického je důležité, že v dosavadních studiích nebyly prokázány významné KV nežádoucí účinky léčby. Dosud byly popsány zejména gastrointestinální obtíže (nauzea, gastroezofageální reflux), kožní poškození (fotosenzitivita, pruritus, suchá kůže) a hepatální poškození (elevace hladin jaterních enzymů AST, ALT, GGT). Z hlediska kardiologického by mohlo být zajímavé, že se pirfenidon nesmí podávat společně s inhibitory CYP1A2, jako je amiodaron, propafenon a ciprofloxacin.
Dalším lékem podávaným osobám s IPF je nám dlouho dobře známé mukolytikum N-acetylcystein. Léčba je hodnocena jako bezpečná, občas provázená nežádoucími účinky, jako jsou nauzea, zvracení, průjem nebo obstipace, vzácně pak zarudnutí kůže, bolest hlavy. Jen ojediněle byly po užití N-acetylcysteinu popsány následující KV nežádoucí účinky léčby: bolest na hrudi, tachykardie a pokles krevního tlaku.
Pneumonie
Výskyt pneumonií se u nás odhaduje na 1000/100 000 obyvatel, jen asi 20 % z těchto případů je léčeno v nemocnici, ostatní jsou při adekvátní léčbě zvládnuty ambulantně. Ročně u nás na pneumonie umírá asi 3000 nemocných. Za nejčastější etiologické agens je u nás stále považován Streptococcus pneumoniae a další „typická agens“, atypická agens (Mycoplasma pneumoniae a Chlamydophila pneumoniae) se na vzniku onemocnění podílejí tímto poměrem: v ambulancích kolem 30 % a v nemocnicích až 46 % případů.
Je dobře známou skutečností, že ke vzniku pneumonie jsou náchylní oslabení nemocní se základním onemocněním srdce (ischemickou chorobou srdeční), cukrovkou či jinak imunokompromitovaní (např. při dlouhotrvající kortikoterapii či jiné imunosupresi). Kardiologům je jistě dobře znám průběh (často s nenápadnou symptomatologií) nozokomiálních pneumonií u starších osob hospitalizovaných nejčastěji na interních odděleních.
V léčbě pneumonií se u nás jako první volba doporučuje podání betalaktamového antibiotika (penicilin, aminopenicilin s inhibitorem/bez inhibitoru betalaktamázy). Benzylpenicilin snižuje účinnost perorálních antikoagulancií. Nejzávažnějším nežádoucím účinkem léčby jsou alergické reakce, jejichž výskyt je častější u osob s alergickou dispozicí (1–10 % pacientů). Nejtěžším projevem je anafylaktická reakce, která se dostaví za 1–2 minuty po podání, někdy do půl hodiny, ojediněle i později. Nejčastěji se jedná o kolaps provázený kardiorespiračním selháním, někdy i s případným letálním koncem. Při anafylaktickém šoku po aplikaci benzylpenicilinu je potřeba především zvládnout selhání krevního oběhu a případné poruchy dýchání podáním adrenalinu, noradrenalinu, hydrokortizonu, antihistaminik a vápníku. Jiné KV nežádoucí účinky jsou extrémně vzácné.
V současnosti, pravděpodobně v souvislosti s narůstajícím počtem pneumonií vyvolaných atypickým agens, se stále častěji používají moderní makrolidové přípravky buď v monoterapii, nebo v kombinaci, nejčastěji s betalaktamy. Vedle rizika narůstající rezistence na tyto přípravky (v zahraničí je to až 30 % rezistentních kmenů Streptococcus pneumoniae, v ČR v roce 2011 zatím „pouze“ 4,3 %) bylo popsáno i mírné riziko vzniku KV příhod. Nejvíce je v tomto směru zmiňován azithromycin, makrolidové antibiotikum se širokým spektrem, o kterém bylo v minulosti referováno jako o léčivu s minimálním kardiotoxickým efektem [20]. Později bylo prokázáno, že azithromycinu příbuzná antibiotika, jako je erythromycin a klarithromycin, mohou vyvolat vážné komorové arytmie a náhlou srdeční smrt [21].Další studie prokázaly, že i azithromycin má proarytmogenní potenciál; bylo publikováno nejméně sedm kazuistik nemocných s normálním QT intervalem, u nichž vyvolal arytmie. Jednalo se o prodloužení QT intervalu, o torsades de pointes (polymorfní ventrikulární tachykardie, při které se směr QRS komplexů postupně otáčí kolem izoelektrické linie EKG). Tato arytmie obvykle vzniká u pacientů s abnormálně prodlouženým QT intervalem s iontovou dysbalancí, jako je hypokalemie, hypokalcemie a hypomagnezemie. Klinicky mohou torsades de pointes vyvolat hypotenzi, synkopy, eventuálně i komorovou fibrilaci a smrt. Dále byly po podání azithromycinu popsány polymorfní ventrikulární tachykardie i při absenci prodloužení QT intervalu. Americká FDA databáze nežádoucích účinků (The Food and Drug Administration’s Adverse Event Reporting System) přijala minimálně dvacet hlášení o torsades de pointes asociovaných s azithromycinem.
V roce 2012 byla uveřejněna studie z USA posuzující četnost KV úmrtí spojených s podáváním azithromycinu, aminopenicilinu, chinolinů, ciprofloxacinu a levofloxacinu [22]. Studie sledovala po dlouhé období (trvající od roku 1996 do 2006) 347 795 osob s předepsaným azithromycinem, 1 348 672 s předepsaným amoxicilinem, 264 626 s ciprofloxacinem a 193 906 s levofloxacinem. Azithromycin byl indikován především u žen – tvořily 77,5 % ze sledovaného počtu pacientů a průměrný věk osob léčených azithromycinem byl 49 let. Osoby užívající azithromycin měly významně vyšší riziko KV úmrtí i náhlé smrti jak ve srovnání s kontrolami bez antibiotik, tak oproti nemocným užívajícím amoxicilin (p < 0,001). I při porovnání KV úmrtí pacientů léčených azithromycinem oproti léčbě ciprofloxacinem byl prokázán jejich vyšší počet ve skupině azithromycinu (p = 0,01), úmrtnost se významně nelišila mezi skupinou nemocných léčených azithromycinem a levofloxacinem (p = 0,48).
Autoři studie uzavírají, že pětidenní léčba azithromycinem způsobuje jen malý absolutní nárůst počtu KV úmrtí. Ve srovnání s amoxicilinem tak lze očekávat zvýšení o 47 úmrtí z KV příčin na milion indikací léčby azithromycinem u všech nemocných. Pokud se analýza zaměřila jen na pacienty s vysokým rizikem vzniku KV nemocí, jednalo se o 245 úmrtí navíc. Vedlejším nálezem bylo prokázání relativní bezpečnosti ciprofloxacinu (stejné riziko KV úmrtí jako při léčbě amoxicilinem) a zvýšené riziko při podávání levofloxacinu. Americká FDA na základě této studie doporučuje lékařům, aby při podávání azithromycinu vždy zvážili riziko prolongace QT intervalu a možnosti vzniku arytmií.
Nakonec bych rád ještě upozornil na zvýšené riziko vzniku myopatie a rhabdomyolýzy po podání kombinace makrolidů se statiny. Pokud je podání makrolidů u nemocných užívajících statiny nutné, doporučuje se přechodné přerušení léčby statiny, zejména pokud jsou přítomny další rizikové faktory, jako je diabetes mellitus nebo CHOPN.
Tuberkulóza
Nemocných s tuberkulózou u nás stále ubývá. Poslední údaje z roku 2011 udávají 609 nových případů onemocnění, z nichž 18,4 % bylo zjištěno u cizinců. Pokud je léčba dodržena, její výsledky jsou výborné. V léčbě se nejvíce uplatňují čtyři základní antituberkulotika (isoniazid, rifampicin, pyrazinamid, ethambu-
tol). Podávají se ve čtyřkombinaci v iniciální fázi, která trvá dva měsíce, a poté následuje fáze pokračovací, kdy nemocní užívají kombinaci rifampicinu a isoniazidu až do celkové doby šest měsíců.
KV rizika léčby tuberkulózy jsou minimální. V dostupných zdrojích lze nalézt pouze údaj o možném poklesu arteriálního krevního tlaku po podání rifampicinu.
Plicní karcinom
Onemocnění plicní rakovinou zůstává i nadále jedním z nejzávažnějších onkologických problémů. V roce 2009 bylo v ČR hlášeno celkem 6435 případů tohoto onemocnění. Onemocnělo 4518 mužů (incidence 87,7/100 000) a 1917 žen (incidence 35,9/100 000), téměř polovina nemocných byla diagnostikována ve IV. stadiu TNM (klasifikace popisující pokročilost nádoru). Přestože se absolutní počty nových případů v posledních letech lehce snížily, závažnost nemoci se nemění, o čemž svědčí relativní pětileté přežití nemocných z let 2000–2004, které se pohybuje u obou pohlaví lehce nad hranicí 10 %. Pro srovnání lze uvést obdobný údaj pětiletého přežití u kolorektálního karcinomu, které je cca 50 %.
Nemoc postihuje nejčastěji osoby mezi 60.–69. rokem věku. Vedle operační léčby, která je indikována zhruba u desetiny nemocných, se v léčbě plicní rakoviny užívají klasická chemoterapeutika i nové biologické léky. Tab. 5 s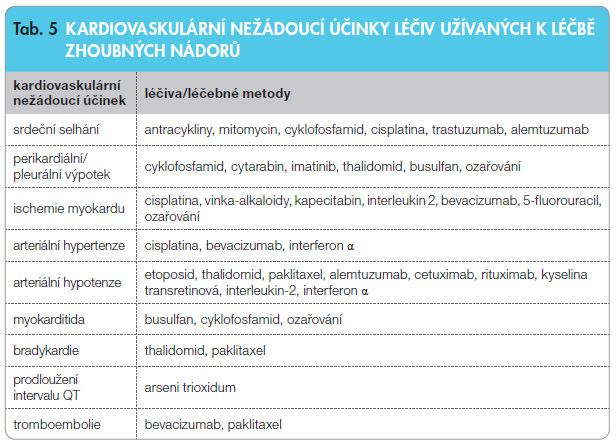 umarizuje možná KV rizika spojená s podáním těchto léků, z nichž některé se používají i k terapii pacientů s plicními nádory.
umarizuje možná KV rizika spojená s podáním těchto léků, z nichž některé se používají i k terapii pacientů s plicními nádory.
Nejvíce prostudovanými léky s ohledem na kardiotoxicitu jsou antracykliny (doxorubicin, daunorubicin aj.), které se nejčastěji používají k léčbě hematologických malignit a některých solidních nádorů. Jejich kardiotoxicita, ať již akutní (nespecifické EKG abnormality), či pozdní (kumulativní při dávkách doxorubicinu > 550 mg/m2),
může způsobit selhání levé komory a městnavou srdeční slabost. Příčinou je přímé poškození myokardu indukované tvorbou volných radikálů. Odhaduje se, že se může výrazně podílet na mortalitě takto léčených osob.
Alkylační chemoterapeutika (busulfan, cyklofosfamid, cisplatina, mitomycin), která se používají i při léčbě plicní rakoviny, mohou způsobovat srdeční komplikace, například srdeční selhání, myokarditidu a perikarditidu. Tyto látky i jejich toxické metabolity přímo poškozují endotel a buňky myokardu. Cisplatina je základním lékem kombinované léčby používané v pneumoonkologii. Nejčastější KV komplikaci po jejím podání představuje arteriální hypertenze a ischemie myokardu, která se někdy dostavuje až s odstupem 10–20 let po léčbě.
Kardiotoxickým efektem antimetabolitů (5-fluorouracil, kapecitabin) je ischemický syndrom (angina pectoris a infarkt myokardu), arytmie a kardiomyopatie. Antimikrotubulární léky (paklitaxel, vinka-alkaloidy) jsou běžně užívány v léčbě plicní rakoviny. Mohou indukovat arytmie, trombózu a ischemii myokardu. Nejčastější KV komplikací spojenou s etoposidem, jehož podávání představuje základní léčbu malobuněčné plicní rakoviny, je arteriální hypotenze, méně často pak tato látka může vyvolat ischemii myokardu. Monoklonální protilátky, z nichž se v pneumoonkologii používá bevacizumab, mohou vyvolat hypotenzi. Trastuzumab, rekombinantní IgG1 monoklonální protilátka s vazbou na receptor EGF (epidermální růstový faktor), může způsobovat městnavou srdeční slabost.
Ozařování má také významné kardiotoxické efekty; může poškodit všechny struktury srdce (perikard, myokard i srdeční chlopně a koronární arterie) i periferní cévy v závislosti na obdržené dávce a různých časových odstupech od ozáření (akutní a chronické poškození). Takto může vzniknout tamponáda srdce či akutní infarkt myokardu. Někdy se komplikace ozáření projeví až po letech zhoršením aterosklerózy koronárních tepen, a to i u osob bez rizikových faktorů. Vlivem iradiace dochází k hyperplazii cévní intimy a k ukládání kolagenu do cévních stěn (karotid) s důsledky, které se mohou projevit až s odstupem několika let. Postiženy mohou být také srdeční chlopně, do kterých se rovněž ukládá kolagen. Mohou tak vzniknout stenózy či chlopenní insuficience, poškozeny jsou zejména mitrální a aortální chlopně.
Poškození perikardu ozářením je nejčastější, interval od ozáření do vzniku této komplikace kolísá v širokém rozmezí 2–145 měsíců. Hemodynamicky významnou komplikací je konstriktivní perikarditida, která se projeví až s odstupem několika let od iradiace. Lékaři sledující nemocné po ozáření by měli znát KV rizika spojená s ozařováním a měli by po jejich přítomnosti aktivně pátrat (EKG, ECHO). V posledních letech se situace poněkud zlepšila díky technologickému vývoji ozařovačů, které umožňují lepší a přesnější cílení záření na nádor s vycloněním zdravých tkání či orgánů, včetně srdce [23].
Závěr
Z výše uvedeného je zřejmé, že při léčbě nemocných s pneumopatiemi se mohou jak pneumologové, tak i ostatní specialisté setkat s KV nežádoucími účinky. Je dobré je znát, a zejména u rizikových nemocných po nich aktivně pátrat a společně je řešit.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
Seznam použité literatury
- [1] Global Initiative for Chronic Obstructive Lung Disease. Global strategy for diagnosis, management, and prevention of COPD. http://www.nhlbi. goldcopd.org, 2011.
- [3] Salpeter SR. Cardiovascular safety of beta(2)-adrenoceptor agonist use in patients with obstructive airway disease: a systematic review. Drugs Aging 2004; 21: 405–414.
- [4] Khindri S, Sabo R, Harris S, et al. Cardiac safety of indacaterol in healthy subjects: a randomized, multidose, placebo- and positive-controlled, parallel-group thorough QT study. BMC Pulm Med 2011; 11: 31.
- [5] Hanrahan JP, Grogan DR, Baumgartner RA, et al. Arrhythmias in patients with chronic obstructive pulmonary disease (COPD): occurrence frequency and the effect of treatment with the inhaled long-acting beta2-agonists arformoterol and salmeterol. Medicine (Baltimore) 2008; 87: 319–328.
- [6] Calverley PM, Anderson JA, Celli B, TORCH investigators, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356: 775–789.
- [7] Ferguson GT, Funck-Brentano C, Fischer T, et al. Cardiovascular safety of salmeterol in COPD. Chest 2003; 123: 1817–1824.
- [8] Rodrigo GJ, Nannini LJ, Roisin RR. Safety of long-acting beta-agonists in stable COPD: a systematic review. Chest 2008; 133: 1079–1087.
- [9] Tashkin DP, Fabbri LM. Long-acting beta-agonists in the management of chronic obstructive pulmonary disease: current and future agents. Respir Res 2010; 11: 149.
- [10] Casaburi R, Mahler DA, Jones PW, et al. A long-term evaluation of once-daily inhaled tiotropium in chronic obstructive pulmonary disease. Eur Respir J 2002; 19: 217–224.
- [11] Singh S, Loke YK, Furberg CD. Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA 2008; 300: 1439–1450.
- [12] Mentz RJ, Fiuzat M, Kraft M, et al. Bronchodilators in heart failure patients with COPD: Is it time for a clinical trial? J Card Fail 2012; 18: 413–422.
- [13] Hilleman DE, Malesker MA, Morrow LE, Schuller D. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis 2009; 4: 253–263.
- [14] Celli B, Decramer M, Kesten S, et al., UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180: 948–955.
- [15] Ohar JA, Donohue JF. Mono- and Combination Therapy of Long-acting Bronchodilators and Inhaled Corticosteroids in Advanced COPD. Semin Respir Crit Care Med 2010; 31: 321–333.
- [16] Rodrigo GJ, Castro-Rodriguez JA, Plaza V. Safety and efficacy of combined long-acting beta-agonists and inhaled corticosteroids vs long-acting beta-agonists monotherapy for stable COPD: a systematic review. Chest 2009; 136: 1029–1038.
- [17] Nannini LJ, Cates CJ, Lasserson TJ, Poole P. Combined corticosteroid and long-acting beta-agonist in one inhaler versus long-acting beta-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2007; (4): CD006829.
- [18] http://www.drugs.com/sfx/medrol-side-effects.html
- [19] White WB, Gorelick PB, Cooke G, et al. Cardiovascular events in patients receiving roflumilast: findings from a pooled analysis of 14 randomized clinical trials involving over 12 000 patients witch COPD. J Am Coll Cardiol 2011; 57(14s1): E603–E603.
- [20] Owens RC Jr, Nolin TD. Antimicrobial-associated QT interval prolongation: pointes of interest. Clin Infect Dis 2006; 43: 1603–1611.
- [21] Koh TW. Risk of torsades de pointes from oral erythromycin with concomitant carbimazole (methimazole) administration. Pacing Clin Electrophysiol 2001; 24: 1575–1576.
- [22] Wayne RA, Murray KT, Hall KBS, et al. Azithromycin and the Risk of Cardiovascular Death. N Engl J Med 2012; 366: 1881–1890.
- [23] Galderisi M, Marra F, Esposito R, et al. Cancer therapy and cardiotoxicity: The need of serial Doppler echocardiography. Cardiovascular Ultrasound 2007; 5: 4 doi:10.1186/1476-7120-5-4.