Klinický význam postprandiální glykemie u diabetu 2. typu
The therapeutic goal in patients with type 2 diabetes is complication risk reduction by intervention to control hyperglycemia. Postprandial hyperglycemia is a cardiovascular risk factor. To achieve the target level of glycated hemoglobin, intervention may be needed to control not only the fasting but also the postprandial blood glucose level. The postprandial blood glucose level influences the total glycated hemoglobin level: the lower the total glycated hemoglobin level, the greater the influence of the postprandial blood glucose level. When choosing the drug therapy in type 2 diabetes mellitus, consideration should be given to the difference between the fasting and postprandial blood glucose levels.
Úvod
Cílem terapie diabetu je snížení mortality a morbidity. Dosáhnout tohoto cíle je možné zlepšením kompenzace pacientů pomocí nefarmakologické a farmakologické intervence [1]. Metabolická kompenzace je hodnocena z hlediska krátkodobého – přítomnosti či nepřítomnosti subjektivních příznaků hyperglykemie, aktuální hodnoty glykemie, glykosurie a ketonurie. Základním parametrem hodnocení úrovně dlouhodobé kompenzace je glykovaný hemoglobin (HbA1c), jehož hodnota těsně koreluje s plochou pod křivkou glykemie v průběhu 1–3 měsíců před vyšetřením. Morbidita (pozdní komplikace diabetu) a mortalita v celé populaci pacientů koreluje s glykovaným hemoglobinem a také s glykemií [2].
Z hlediska léčby je cíl – snížení rizika komplikací – definován prostřednictvím glykovaného hemoglobinu. Směr dosažení cíle udává však aktuální glykemie, hodnota glykovaného hemoglobinu slouží jako kontrola výsledku terapie (nebo je iniciátorem revize terapeutického postupu) [3].
Pro srovnání se obvykle používají veličiny měřené za stabilního stavu, tímto parametrem může být glykemie nalačno. Vypovídá o průměrné glykemii během přibližně jedné třetiny dne (noční spánek, klid). Více než dvě třetiny dne se však organismus pacienta s diabetem nalézá ve stavu postprandiálním. Je celkem zřejmé, že vliv postprandiální glykemie na celkovou úroveň kompenzace a také na celkové riziko komplikací nemůže být zanedbatelný.
Postprandiální hyper/glykemie
Jako postprandiální glykemii označujeme (na základě konsenzu) glykemii změřenou v době 60–120 minut po jídle. U zdravého jedince dosahuje glykemie po jídle maximální hodnoty v době okolo jedné hodiny po jídle, u pacienta s diabetem 2. typu je to naopak v době blížící se 120. minutě po jídle [4]. Diabetes mellitus 2. typu se vyvíjí postupně [1], dynamika zvyšování průměrné hodnoty glykemie lačné a postprandiální u osob přecházejících z normální glukózové tolerance k diabetu 2. typu je odlišná. Do jisté míry je to akcentovaný obraz fyziologických změn obou hodnot v souvislosti s věkem. Pro vyšší věk je charakteristická relativně vyšší hodnota postprandiální glykemie než glykemie lačné.
Obecně je postprandiální glykemie u diabetiků 2. typu determinována kvantitou inzulinové rezistence, kvalitou a kvantitou sekreční odpovědi inzulinu na prandiální podnět, kvantitou endogenní produkce glukózy, neadekvátní supresí sekrece glukagonu, perzistencí zvýšené koncentrace volných mastných kyselin v plazmě a jejich nabídkou hepatocytům, prandiální náloží sacharidů a jejich kvalitou (složením), glykemickým indexem potravy, akcelerací/decelerací evakuace žaludku, u léčeného pacienta také terapií [4, 5].
U pacientů s postupně se rozvíjející poruchou glukózové tolerance se glykemie po zátěži sacharidy (postprandiální glykemie) v průběhu času zvyšuje absolutně více než glykemie nalačno. Příčinou je zejména inzulinorezistence jaterních buněk a ztráta první fáze sekrece inzulinu. Důsledkem je, že postprandiálně nedochází ke snížení uvolňování glukózy z jater (zejména chybí inhibice glukoneogeneze), postprandiální glykemie je proto významně vysoká. První – časná – fáze sekrece inzulinu umožňuje dosáhnout po jídle rychle rovnovážné koncentrace mezi plazmou a intersticiem, tím umožňuje rychlý nástup účinku inzulinu na periferii. Toto vše se děje vedle vlastního efektu v jaterních buňkách a tukové tkáni (v adipocytech inzulin zejména tlumí lipolýzu a snižuje tak uvolňování glycerolu a zejména volných mastných kyselin do periferní krve).
Patofyziologie diabetu 2. typu
Hlavní podíl na vzniku diabetu v terénu genetické predispozice má rozvoj inzulinové rezistence a porucha sekrece inzulinu. U nemocných se zachovalou postprandiální sekrecí inzulinu a výrazně vyjádřenou inzulinovou rezistencí je typickým nálezem vysoká glykemie nalačno s minimálními vzestupy postprandiálně, naopak u osob s relativně zachovalou citlivostí k inzulinu a selháváním jeho sekrece jsou charakteristické zejména vysoké exkurze postprandiální glykemie. Na hyperglykemii je tak možno nazírat jako na integrovanou výpověď o přítomnosti selhávající zpětné vazby, která v normální situaci zajišťuje normoglykemii změnou sekrece inzulinu adekvátně změněné citlivosti tkání k inzulinu.
Nalačno je odbržděna jaterní glykogenolýza a glukoneogeneze, což je způsobeno nízkou inzulinemií. Postprandiálně játra ukládají glukózu do zásob (syntéza glykogenu) a současně zastaví novotvorbu glukózy. Tento obrat v metabolismu je způsoben prudkým zvýšením koncentrace inzulinu uvolněného v důsledku zvýšené sekrece indukované aktivací vegetativního nervového systému (cefalická fáze) a následně vstřebáváním glukózy a aminokyselin ze zažívacího traktu. Významným způsobem se na výsledné glykemii podílí také změna sekrece glukagonu. Fyziologická sekreční odpověď inzulinu na sekreční podnět je typicky dvoufázová, první (tzv. časná) fáze inzulinu je krátkodobá (minuty) a je následována druhou (tzv. pozdní) fází inzulinové sekrece Chybění první fáze sekrece inzulinu má významný klinický dopad, neboť první – časná – fáze sekrece inzulinu umožňuje dosáhnout po jídle rychle rovnovážné koncentrace mezi plazmou a intersticiem (při zachovalé 1. fázi nastává ekvilibrium do 10 minut, bez 1. fáze do 35 minut), jinými slovy, umožňuje rychlý nástup účinku inzulinu na periferii. Z výše uvedeného lze odvodit, že časná fáze sekrece inzulinu má kritický význam pro udržení postprandiální glykemie v normálním rozmezí.
V poslední době bylo potvrzeno, že děje, které se podílejí na řízení glykemie, jsou mnohem komplexnější, než popisuje výše uvedená základní koncepce. Zejména podíl inkretinů a dalších působků, popřípadě podíl poruchy regulace jejich sekrece či účinku, se ukazuje jako velmi významný.
Na základě současných poznatků můžeme oprávněně předpokládat, že u naprosté většiny osob s diabetem 2. typu jsou přítomny obě poruchy, ale v různém poměru významnosti. Toto zjištění je velmi důležité pro racionální doporučení léčby, neboť můžeme izolovaně intervenovat poruchu sekrece inzulinu a inzulinovou rezistenci. Současně nabízí využití postprandiální glykemie, respektive rozdílu mezi glykemií nalačno a postprandiálně, k návrhu terapie.
„Toxicita“ postprandiální hyperglykemie
Teprve glykemie nalačno vyšší než 7 mmol/l představuje riziko pro rozvoj specifických mikrovaskulárních komplikací diabetu (prokázáno to bylo zejména pro retinopatii) [1]. Tato glykemie odpovídá hodnotě glykemie 11,1 mmol/l ve 120. minutě orálního glukózového tolerančního testu (podle přijatých závěrů, které sloužily jako podklad pro změnu diagnostické hodnoty glykemie nalačno; avšak jsou k dispozici údaje, které udávají lehce odlišné hodnoty) [3]. Diabetes je tedy stav, kdy u pacienta selžou regulační mechanismy a glykemie je vyšší než diskriminační hodnota pro nastartování vzniku specifických komplikací – jsou přímým důsledkem hyperglykemie. Kritéria jsou různá pro stav nalačno a postprandiálně.
Zvýšení postprandiální glykemie o pouhý 1 mmol/l relativní riziko úmrtí zdvojnásobuje, osoby s glykemií nalačno v rozmezí normálních hodnot a postprandiální glykemií vysokou mají stejné relativní riziko smrti jako osoby s hodnotami glykemie nalačno vyšší než 7 mmol/l a s vysokou postprandiální glykemií [6]. Postprandiální hyper/glykemie je nyní všeobecně přijímána jako nezávislý rizikový faktor mortality a kardiovaskulárních komplikací. Nicméně potvrzení těchto jednoznačných epidemiologických souvislostí intervenčními studiemi se zatím nepodařilo (zejména studie HEART2D, NAVIGATOR) [4, 7–13].
Příčina vysoké rizikovosti postprandiální glykemie není doposud jednoznačně stanovena, je velmi pravděpodobné, že ani nikdy s jistotou nebude, a to právě z důvodu heterogenity profilu populace pacientů s diabetem 2. typu. Jako základní se nabízejí tři modely. První, podle nějž rizikovost, respektive toxicita glykemie neroste s koncentrací lineárně, ale exponenciálně. To znamená, že způsobuje-li zvýšení glykemie z hodnoty 7,0 mmol/l na 8,0 mmol/l nárůst rizika o x %, pak zvýšení glykemie z hodnoty 14,0 mmol/l na 15,0 mmol/l zvýší riziko o násobek x % (x2). Této představě odpovídá křivka vztahu rizika mikrovaskulárních komplikací a kompenzace podle glykovaného hemoglobinu ve studii UKPDS. Druhé vysvětlení přináší koncept hyperglykemie jako znamení selhávajících regulačních funkcí organismu kompenzujících inzulinorezistenci. Podle tohoto konceptu není tedy primárním a jediným nositelem rizika pouze postprandiální glykemie, ale tato je zejména příznakem rizikového metabolismu. Této teorii odpovídají průkazy rizikovosti postprandiální hyperlipidemie apod. Konečně třetí možností je vztah délky expozice hyperglykemii během dne – většinu z 24 hodin tráví pacient s diabetickou dietou (6 porcí stravy denně) v postprandiálním stavu.
Klinický význam postprandiální hyperglykemie u diabetu 2. typu
Postprandiální glykemie se významně podílí na celkové hodnotě glykovaného hemoglobinu [14]. To je základní důvod, proč by měla být intervenována. Druhým důvodem, který ale nemá oporu v intervenčních studiích, je skutečnost, že postprandiální hyper/glykemie je markerem vysokého kardiovaskulárního rizika a rizika mortality.
Rozdíl mezi glykemií nalačno a postprandiálně je dobrým vodítkem pro návrh léčby, což je dobrý důvod, proč postprandiální glykemii měřit. Postprandiální glykemie by měla být měřena vždy, když je nalezen rozpor mezi hodnotami glykemie nalačno a hodnotami glykohemoglobinu, vždy, když dojde ke zhoršení kompenzace (zvýšení hodnoty glykohemoglobinu), vždy, když se objevují, případně rychle progredují, mikrovaskulární komplikace, vždy, když se objeví nevysvětlitelné hypoglykemie. Stanovujeme ji po běžném nebo definovaném jídle v rozmezí 60–120 minut. Podle doporučení České diabetologické společnosti by u dobře léčeného pacienta s diabetem neměla překračovat postprandiální glykemie hodnotu 7,5 mmol/l, u nemocných s vysokým rizikem kardiovaskulárních komplikací je třeba cílové hodnoty stanovovat individuálně [15].
Epidemiologické souvislosti mezi zvýšeným kardiovaskulárním rizikem, mortalitou a postprandiální glykemií byly opakovaně prokázány. Jsou i nepřímé důkazy, že kardiovaskulární riziko se snižuje intervencí postprandiální glykemie. Přesvědčivé přímé důkazy, které by potvrdily, že intervence postprandiální glykemie snižuje kardiovaskulární riziko, však nejsou k dispozici. Tato skutečnost je příčinou názoru některých autorů, že klinický význam postprandiální glykemie je přeceňován. Soudím ale, že je celkem irelevantní, jestli důkazy jsou, či nejsou k dispozici. Nezpochybnitelná je totiž skutečnost, že postprandiální glykemie se podílí významně na celkové hodnotě glykovaného hemoglobinu. Pokud je cílem terapie těsná kompenzace hodnocená glykovaným hemoglobinem, je zřejmé, že při jeho neuspokojivé hodnotě je třeba pátrat po postprandiální hyperglykemii a také ji intervenovat.
Vztah metabolické kompenzace u diabetu 2. typu a postprandiální glykemie
S rozšiřujícím se spektrem účinných léčebných postupů se do popředí dostává význam možnosti individualizovat léčbu pro každého nemocného s diabetem 2. typu – vzhledem k heterogenitě této nemoci a také proto, že výsledek léčebných snah je snad více než v kterékoliv jiné oblasti interní medicíny závislý na vlastní struktuře osobnosti nemocného a jeho spolupráci s lékařem. Právě přihlédnutí k absolutní výši postprandiální glykemie, popřípadě k její změně oproti lačné glykemii, by mělo být jedním z úhelných kamenů, na nichž je postaven návrh léčby pacienta s diabetem 2. typu.
Ve vztahu k postprandiální glykemii jsou důležitá zjištění z poslední doby, která dokládají významnost podílu právě postprandiální glykemie na celkové hodnotě glykovaného hemoglobinu. Zejména práce Monniera z roku 2003 ukázala, že až 70 % celkové úrovně kompenzace u osob s glykovaným hemoglobinem do 7,3 % (DCCT) je definováno postprandiální glykemií, u osob s hodnotou glykovaného hemoglobinu pohybující se v rozmezí 7,3–8,4 % (DCCT) je to až polovina [16]. Tato zjištění odpovídají známé skutečnosti, že rozdíl v kompenzaci hodnocený glykohemoglobinem byl mezi intenzivně a konvenčně léčenými probandy ve studii DCCT až dvojnásobný proti studii UKPDS. Nehledě na rozdílný typ diabetu, byla terapie upravována podle glykemie nalačno i postprandiálně (DCCT) proti pouze glykemii nalačno (UKPDS). Příčinou relativně se snižujícího podílu postprandiální glykemie na výsledné hodnotě glykovaného hemoglobinu se zvyšující se jeho hodnotou je relativně stálá postprandiální exkurze glykemie při zhoršující se kompenzaci. Je to celkem očekávaný jev, neboť již v začátku rozvoje diabetu 2. typu je ztracen důležitý efekt první fáze inzulinové sekrece pro udržení postprandiální glykemie v normálních mezích. Proto stejný prandiální přísun sacharidů vyvolá přibližně stejný absolutní vzestup glykemie v jakékoliv fázi vývoje diabetu 2. typu.
Monnierova práce poskytuje i návod ke správnému postupu terapie u špatně kompenzovaného pacienta s diabetem. V prvním kroku je třeba snížit glykemii nalačno, v kroku druhém, pokud není dosaženo cílového glykovaného hemoglobinu, je třeba přidat intervenci postprandiální glykemie.
Principy léčby postprandiální glykemie u diabetu 2. typu
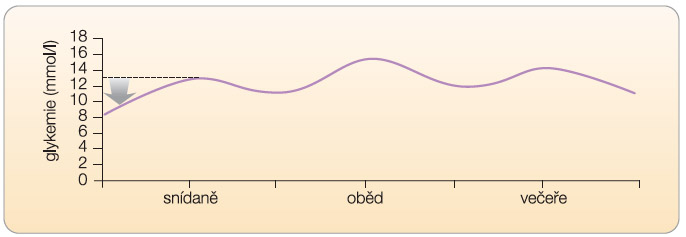
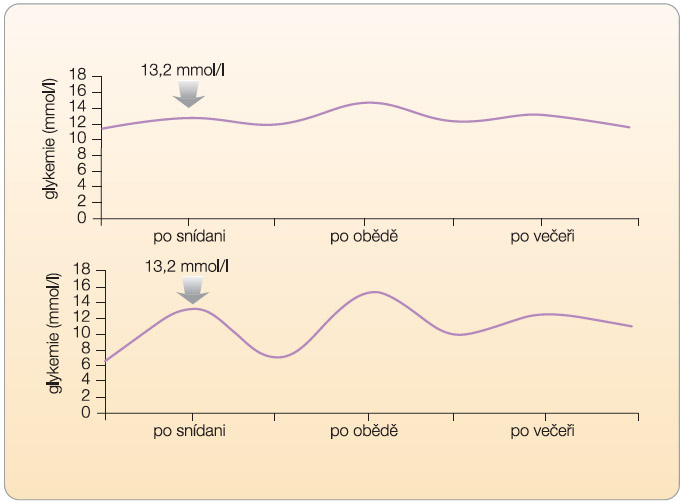 Pro správné rozhodnutí o způsobu intervence diabetu 2. typu je zapotřebí znát několik základních údajů. Základní otázkou, na kterou musí lékař odpovědět, je, jaký vztah má zvýšená postprandiální glykemie k absolutní výšce glykemie nalačno. Tedy jaký je rozdíl mezi glykemií nalačno a postprandiálně (změna glykemie), viz graf 1.
Pro správné rozhodnutí o způsobu intervence diabetu 2. typu je zapotřebí znát několik základních údajů. Základní otázkou, na kterou musí lékař odpovědět, je, jaký vztah má zvýšená postprandiální glykemie k absolutní výšce glykemie nalačno. Tedy jaký je rozdíl mezi glykemií nalačno a postprandiálně (změna glykemie), viz graf 1.
Při vysokém rozdílu (viz graf 2, 3) je třeba intervenovat zejména vzestup 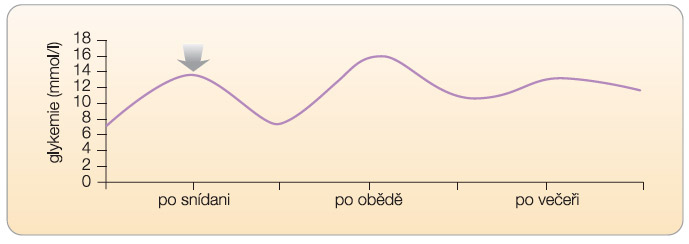 postprandiální glykemie. Takovou intervenci můžeme označit jako specifickou léčbu postprandiální hyperglykemie. Přitom je třeba vnímat souvislosti glykemií v celodenním profilu. Pokud nastane absolutní vzestup glykemie postprandiální po snídani oproti glykemii nalačno o 8 mmol/l (vzestup z 6 mmol/l na 14 mmol/l), je zřejmé, že výslednou hodnotou postprandiální glykemie (v daném případě 14 mmol/l) je ovlivněna preprandiální glykemie před obědem. Lze tak
postprandiální glykemie. Takovou intervenci můžeme označit jako specifickou léčbu postprandiální hyperglykemie. Přitom je třeba vnímat souvislosti glykemií v celodenním profilu. Pokud nastane absolutní vzestup glykemie postprandiální po snídani oproti glykemii nalačno o 8 mmol/l (vzestup z 6 mmol/l na 14 mmol/l), je zřejmé, že výslednou hodnotou postprandiální glykemie (v daném případě 14 mmol/l) je ovlivněna preprandiální glykemie před obědem. Lze tak 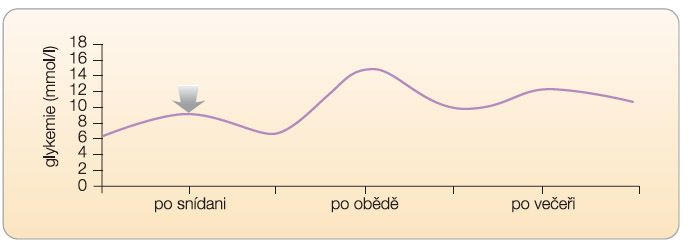 předpokládat, že intervence vedoucí ke snížení postprandiální hyperglykemie po snídani sníží také preprandiální glykemii před obědem, a tedy také (při zachování konstantní exkurze glykemie po obědě) absolutní hodnotu postprandiální glykemie po obědě.
předpokládat, že intervence vedoucí ke snížení postprandiální hyperglykemie po snídani sníží také preprandiální glykemii před obědem, a tedy také (při zachování konstantní exkurze glykemie po obědě) absolutní hodnotu postprandiální glykemie po obědě.
 Druhou krajní podobou glykemického profilu je situace, ve které ranní glykemie nalačno definuje celý glykemický profil během dne. Podmínkou je relativně zachovalá schopnost organismu kompenzovat prandiální nálož sacharidů (tj. zachovalá postprandiální sekrece inzulinu; viz graf 4). V takovémto případě může být absolutní hodnota postprandiální glykemie
Druhou krajní podobou glykemického profilu je situace, ve které ranní glykemie nalačno definuje celý glykemický profil během dne. Podmínkou je relativně zachovalá schopnost organismu kompenzovat prandiální nálož sacharidů (tj. zachovalá postprandiální sekrece inzulinu; viz graf 4). V takovémto případě může být absolutní hodnota postprandiální glykemie 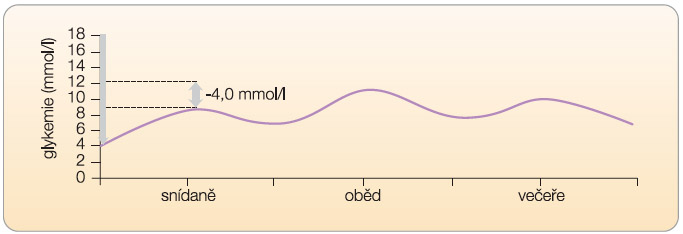 vysoká, nicméně vzestup glykemie postprandiální oproti glykemii preprandiální je minimální. Terapií volby bude ta léčba, která ovlivní zejména glykemii nalačno (například depotní inzulin na noc, intervence inzulinové rezistence). Ve vztahu k postprandiální glykemii můžeme tuto léčbu označit za nespecifickou (graf 5).
vysoká, nicméně vzestup glykemie postprandiální oproti glykemii preprandiální je minimální. Terapií volby bude ta léčba, která ovlivní zejména glykemii nalačno (například depotní inzulin na noc, intervence inzulinové rezistence). Ve vztahu k postprandiální glykemii můžeme tuto léčbu označit za nespecifickou (graf 5).
Proč je důležité rozhodnout o léčbě na základě právě posouzení vztahu/poměru glykemie nalačno (preprandiální) a glykemie postprandiální, ukáže následující schematický příklad. Použijeme-li pro léčbu pacienta, který je charakterizován vysokou ranní glykemií nalačno a minimálními vzestupy glykemie po jídle, specifickou intervenci postprandiální glykemie a budeme-li tuto léčbu titrovat podle ranní glykemie nalačno, výrazně zvýšíme riziko těžké hypoglykemie během dne (mezi jídly).
Je třeba zdůraznit, že pokud hovoříme o rizikovosti postprandiální glykemie ve vztahu ke komplikacím diabetu, veškerá data, která jsou k dispozici, vztahují riziko zejména k absolutní výšce postprandiální glykemie. Obvykle není tudíž hodnocena rizikovost kvantifikované dynamické změny glykemie, popřípadě rizikovost relativního poměru glykemie nalačno a postprandiálně. Z dat získaných v epidemiologických studiích lze pouze nepřímo odvodit, že právě vysoký vzestup glykemie postprandiálně je oním vlastním nositelem rizika. O to více je třeba věnovat pozornost specifické intervenci postprandiální glykemie. Některé zprávy z poslední doby potvrzují tuto tezi experimentálními výsledky.
Nefarmakologickým opatřením snižujícím postprandiální glykemii je zejména dodržování diabetické diety, respektování glykemického indexu a také pohybová aktivita. Mezi specifickou farmakologickou intervenci postprandiální glykemie můžeme řadit zejména glinidy, krátkodobě působící inzulin a jeho analoga či pramlintid. Mezi nespecifické farmakologické intervence pak řadíme podávání metforminu a glitazonů. Kombinovaný efekt vykazují zejména sulfonylurea, analoga GLP-1, inhibitory DPP-4, orlistat či akarbóza. Někdy se účinky překrývají (glitazony), proto považujme toto dělení za velmi orientační a schematické, umožňující pouze názornější pochopení významu jednotlivých léčebných postupů pro ovlivnění postprandiální glykemie.
Závěr
Diabetes mellitus 2. typu je chronická, trvale progredující nemoc závažná zejména svými důsledky – chronickými komplikacemi – s trvale se zvyšující prevalencí. Základním cílem léčby diabetu je zabránit rozvoji akutních komplikací a vzniku komplikací chronických. Podmínkou dosažení tohoto cíle je normalizace hodnot glykemie a vyrovnání všech dalších odchylek metabolismu (diabetické dyslipidemie), normalizace krevního tlaku a dosažení normální hmotnosti. Splnění těchto cílů je základním předpokladem léčby diabetu, kterým je snížení morbidity a mortality diabetické populace současně se zlepšením kvality života.
Pro správné vyhodnocení výsledků měření glykemie u jednoho každého pacienta je třeba chápat souvislost mezi lačnou a postprandiální glykemií. Z hlediska nutné intervence je stejně jako absolutní výše změřené postprandiální glykemie důležité absolutní (i relativní) navýšení glykemie postprandiální proti glykemii nalačno (preprandiálně). Jinými slovy, znalost pouze jedné absolutní hodnoty lačné glykemie nám nevypoví nic o tom, jaká intervence je vhodnější – zdali cílená pouze na postprandiální glykemii, či zdali stačí snížit lačnou glykemii a touto cestou dosáhnout snížení celého glykemického profilu.
Kvůli chronicitě nemoci a jejímu vývoji v čase je v současnosti léčba diabetu pojímána jako dynamicky se měnící reakce ošetřujícího lékaře odpovídající zejména stadiu vývoje diabetu a relativní významnosti každé ze dvou základních poruch u daného jedince. Zjištění postprandiální hyperglykemie může hrát často rozhodující roli při volbě nejvhodnějšího léčebného postupu.
Seznam použité literatury
- [1] U.K. prospective diabetes study 16. Overview of 6 years' therapy of type II diabetes: a progressive disease. U.K. Prospective Diabetes Study Group. Diabetes 1995; 44: 1246–1258.
- [2] UK Prospective diabetes study (UKPDS) Group: Intensive blood-glucose control with sulphonyl-ureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837–853.
- [3] American Diabetes Association. Standards of Medical Care in Diabetes–2011. Diabetes Care 2011; 34(Suppl. 1): S11–S61.
- [4] Kvapil M, Perušičová J. Postprandiální glykémie. 1. vyd. Praha: Triton, 2006.
- [5] Node K, Inoue T. Postprandial hyperglycemia as an etiological factor in vascular failure. Cardiovasc Diabetol 2009; 8: 23–33.
- [6] The DECODE Study Group. Glucose tolerance and mortality: comparision of WHO and American Diabetes Association diagnostic criteria. Diabetes Epidemiology: Collaborative analysis of Diagnostic criteria in Europe. Lancet 1999; 354: 617–621.
- [7] Bonora E, Muggeo M. Postprandial blood glucose as a risk factor for cardiovascular disease in type II diabetes: the epidemiological evidence. Diabetologia 2001; 44: 2107–2114.
- [8] Ciasson JL. Acarbose for the preventions of diabetes, hypertension, and cardiovascular disease in subjects with impaired glucose tolerance: the Study to Prevent Non-Insulin-Dependent Diabetes Mellitus (STOP-NIDDM) Trial. Endocr Pract 2006; 12 (Suppl 1): 25–30.
- [9] Gerich JE, Woerle HJ. Clinical Significance of Postprandial Hyperglycemia. Drug Dev Res 2006; 67: 587–590.
- [10] Hanefeld M, Temelkova-Kurktschiev TS. The postprandial state and the risk of atherosclerosis. Diabet Med 1997; 14: 6–11.
- [11] Hanefeld M, Fischer S, Julius U, et al. Risk factors for myocardial infarction and death in newly detected NIDDM: the Diabetes Intervention Study, 11- year follow- up. Diabetologia, 1996; 39: 1557–1583.
- [12] Charvát J, Kvapil M. Vztah terapie hyperglykemie a riziko ischemické choroby srdeční: In: Diabetologie. 1. vyd. Praha: Triton, 2010.
- [13] Temelkova-Kurktschiev TS, Koehler C, Henkel E, et al. Postchallenge plasma glucose and glycemic spikes are more strongly associated with atherosclerosis than fasting glucose or HbA1c level. Diabetes Care 2000; 23: 1830–1834.
- [14] Ceriello A. Postprandial Glucose Levels Are a Clinically Important Treatment Target. Diabetes Care 2010; 33: 1905–1907.
- [15] Doporučený postup péče o diabetes mellitus 2. typu – aktualizace 2011, česká diabetologická společnost, dostupné na www.diab.cz, citováno 31. října 2011.
- [16] Monnier L, Lapinski H, Colette C. Contributions of fasting and postprandial glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA1c. Diabetes Care 2003; 26: 881–885.