Klíšťová meningoencefalitida – aktuální situace v ČR, onemocnění a očkování
Klíšťová meningoencefalitida (KME) je onemocnění centrální nervové soustavy endemické v mnoha oblastech Evropy a Asie. Ohnisek, jež jsou rozptýlena po celém území České republiky, v poslední době přibývá zřejmě následkem změn klimatu. Změnily se i aktivity lidí v přírodě, zvláště starší lidé jsou exponováni přírodním ohniskům více než v minulých desetiletích. Výsledkem je prudký nárůst lidských onemocnění. Klíšťová encefalitida probíhá u většiny nemocných ve dvou fázích. Druhá fáze je spojena s postižením centrální nervové soustavy: meningitidou, závažnější encefalitidou a méně často s encefalomyelitidou. Encefalitida a myelitida jsou spojeny s přechodnými i trvalými následky, jež výrazně ovlivňují kvalitu života nemocných. Závažnost onemocnění narůstá s věkem. Etiologická léčba není možná, symptomatická léčba musí být u mnohých nemocných značně intenzivní. Očkování proti KME efektivně chrání proti vzniku nemoci a bylo s úspěchem zavedeno do endemických zemí. Ve většině evropských zemí jsou dostupné dvě vakcíny, obě jsou bezpečné a účinné. Vzhledem k nárůstu počtu nemocných v České republice je na místě, aby stát a pojišťovny zvážily větší podporu očkování zvláště ve vyšších věkových skupinách.
Klíšťová meningoencefalitida (KME, tick borne encephalitis, TBE) je přírodně ohniskovou nákazou, která se vyskytuje na mnoha místech České republiky. Její výskyt je dán místními přírodními podmínkami, a je proto rozprostřen po území mozaikovitě. Onemocnění klíšťovou meningoencefalitidou je veřejností považováno (na rozdíl od borreliózy) za nepříliš závažné. Skutečnost je však jiná. V roce 2006 byl nahlášen rekordní počet celkem 1028 onemocnění a zatím 3 úmrtí. V následujícím textu se pokusíme odpovědět na otázky, jaká je skutečná závažnost tohoto onemocnění, co jsme vykonali, abychom pomohli zabránit jeho vzniku a šíření, a co bychom proti vzniku a šíření tohoto onemocnění vykonat měli.
Původce onemocnění
Původcem onemocnění je virus klíšťové encefalitidy, který patří mezi flaviviry. Je sférický, kapsida tvořená proteinem C obsahuje jednovláknitou RNA, obaluje ji lipidová membrána s proteiny M a E. Virus-neutralizační protilátky zodpovídající za imunitu jsou zaměřeny proti glykoproteinu E. Genetickou analýzou rozlišujeme evropský, sibiřský a dálněvýchodní subtyp se shodou v antigenu E 96 %. Očkování evropskou vakcínou proto chrání i proti ostatním subtypům [1].
Přenašeč a přírodní ohnisko
Mezilidsky se virus nepřenáší. Člověk může být nakažen sáním klíštěte v jakémkoli stadiu vývoje, výjimečně i požitím nepasterovaného mléka nakaženého dobytka (kozy, ovce, krávy). Přenašečem u nás je klíště obecné Ixodes ricinus. Pro aktivitu klíšťat má zásadní význam vlhkost prostředí a teplota. Virus cirkuluje v přírodním ohnisku mezi myší a klíštětem a také mezi jednotlivými vývojovými fázemi klíštěte. Ve vývojovém cyklu klíštěte jsou velké ztráty: zhruba z 2000 nakladených vajíček se vyvine asi 200 larev, z nich 10 nymf a z nich pak jen jeden dospělec. Aby v ohnisku byly nakažené nymfy a dospělci, musí se nakazit „v mládí" mnoho larev. To nastává jen za ideálních klimatických podmínek, když nakažená nymfa saje na jedné myšce současně s množstvím dosud nenakažených larev. Tehdy v ohnisku virus cirkuluje a je tam možná i náhodná infekce velkých savců a člověka.
Chování v přírodě a nákaza
Sání klíštěte na člověku je příležitostné, vyžaduje poměrně těsný kontakt člověka s přírodním ohniskem (nemusí však nutně být dlouhý). Pravděpodobnost nákazy člověka je tedy dána nejen procentem infikovaných klíšťat, ale i jeho chováním. KME v naší zemi je spojena s rekreačními aktivitami v ohnisku, které nahrávají přisátí klíšťat, jako je houbaření, jogging, jízda na kole, procházky. Profil našich nemocných je výrazně ovlivněn změnou chování generace 50+, její příslušníci změnili značně přístup k životu: cítí se mladší, jsou aktivní, ekonomicky silnější a svůj volný čas tráví aktivně v přírodě. V současnosti stále více lidí žije v přírodních ohniscích následkem jejich rozšiřování do nových oblastí a nadmořských výšek. Další lidé tam přijíždějí strávit svou dovolenou, někteří opouštějí velká města každý víkend a odjíždějí na chatu či chalupu, a to i do značné vzdálenosti od místa bydliště. Mnozí důchodci pak tráví na svých chalupách celou teplejší polovinu roku. Lidé z Prahy a jiných velkých měst tak mohou získat tuto nemoc i ve vzdáleném ohnisku. Cizinci přijíždějící do ČR o riziku většinou nevědí a očkováni nejsou. KME je tak pravděpodobně exportována do zemí, kde se přirozeně nevyskytuje, jako je Holandsko, Francie, Anglie či Španělsko. Lékaři tam etiologii diagnostikované neuroinfekce patrně nerozpoznají, protože na KME nemyslí a specifické sérologické testy nemají k dispozici.
Klíšťová meningoencefalitida v České republice
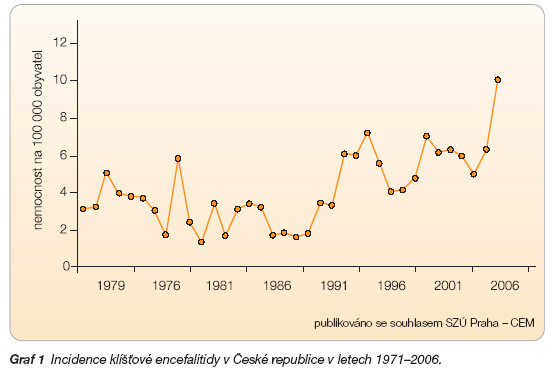
Incidenci onemocnění zachycuje graf 1.
Zhodnocení satelitních map a další sledování přírodního prostředí ukázaly již dříve na možnost šíření ohnisek do vyšších nadmořských výšek, což potvrdil aktuální vývoj (obr. 1). Současně s šířením ohnisek působí vysoká mobilita našich občanů a změna jejich chování. Vzhledem ke svým aktivitám jsou muži postiženi touto infekcí častěji než ženy.
Patogeneze onemocnění
Po přisátí vytvoří klíště svými slinami v podkoží kavernu, ze které saje krev a kam může regurgitovat. Virus KME přítomný ve slinách pronikne do tkáně, primárně se pomnoží a vznikne prvá virémie. Druhá virémie po dalším pomnožení se může projevit necharakteristickým horečnatým onemocněním zvaným první fáze onemocnění. Tehdy může virus vstoupit do CNS a po intervalu bez obtíží pak vyvolá neurologické příznaky.
Klinický obraz onemocnění
Onemocnění probíhá u většiny nemocných ve dvou fázích, ne však vždy. Část infikovaných si vůbec není vědoma přisátí klíštěte, protože klíště se přednostně přisává v kožních záhybech, sání nebolí a po nasátí se klíště pustí a odpadne. V naší studii uvedlo přisátí klíštěte 71 % nemocných, dvoufázový průběh byl pozorován u 79 %.
První fáze klíšťové encefalitidy
Klinický obraz I. fáze je popisován zřídka. Pacient je většinou vyšetřen s chřipkovými příznaky praktickým lékařem a nebývá provedeno důkladnější laboratorní vyšetření. Naše studie provedené v dřívějších letech hodnotí 27 nemocných (16 mužů, věk 5–75 let), kteří byli hospitalizování v I. fázi a poté i ve II. fázi onemocnění. Stesky pacientů při prvém přijetí byly necharakteristické (teplota, bolest hlavy, zvracení, závrať), klinické známky opět lehké a nejasné: lehký meningismus, zarudlé hrdlo. Časté byly změny v krevním obrazu: leukopenie (74 %), trombocytopenie (66 %), bicytopenie (25 %) a zvýšení sérové koncentrace transamináz. Sérologické vyšetření je v tomto období negativní.
Druhá fáze klíšťové encefalitidy
Druhá fáze klíšťové encefalitidy (KE) je charakterizována postižením CNS, které se projevuje jako meningitida, encefalitida, myelitida, vzácněji bývá popisována i radikulitida [2, 3].
Dále jsou uvedeny poznatky z retrospektivní studie provedené na Infekčním oddělení nemocnice v Českých Budějovicích během 5 let (1993–1997). V tomto období bylo přijato 630 pacientů s podezřením na KE. Do studie byli zařazeni nemocní s klinickým obrazem meningitidy, encefalitidy či encefalomyelitidy a sérologickým i likvorovým průkazem nemoci: celkem 493 osob (278 mužů, 215 žen) ve věku 39,2 Î 18,4 let (rozpětí 3–87 let). Nejčastějšími stížnostmi byly: horečky, bolest hlavy a zvracení. Průběh onemocnění byl velmi odlišný u jednotlivých nemocných. Syndrom těžší encefalitidy jsme zaznamenali zhruba u třetiny pacientů, stejně tak meningitický syndrom. Zbytek tvořili pacienti s převahou meningitických příznaků a lehčími známkami poruchy funkce mozku a mozečku. Přechodné poruchy hybnosti byly zaznamenány u 11,7 % nemocných, z toho významné parézy v 6,1 % případů, změny vědomí kvantitativní u 21 % a kvalitativní u 19 % nemocných. Leukocytóza a elevace jaterních testů byly časté. Proteinocytologická asociace v moku byla spojena s převahou mononukleárních leukocytů v diferenciálním rozpočtu, ale v prvém získaném moku byla u 27 % nemocných převaha polynukleárů.
Klinický obraz a věk nemocného
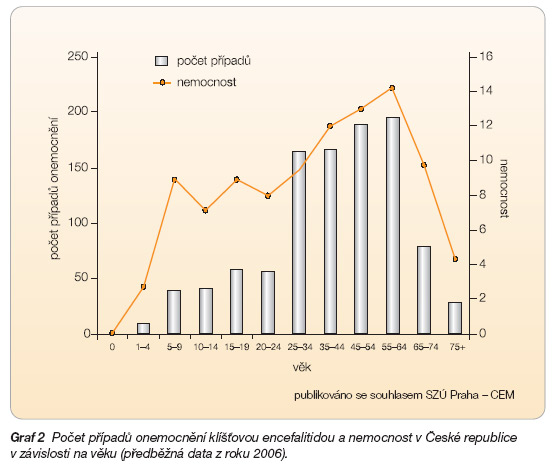
Onemocnění probíhá závažněji s narůstajícím věkem, jeho výskyt v závislosti na věku ukazuje graf 2.
Onemocnění u dětí obvykle probíhá jako meningitis, i když těžké průběhy u dětí byly popsány a vedly i k úmrtí [4]. Podle prospektivní německé studie s narůstajícím věkem stoupá počet encefalitid [2]. Významně se tak zvyšuje počet poruch vědomí, obrn, mozečkových příznaků, nutnost péče na jednotce intenzivní péče, umělé plicní ventilace a též počet fatálních zakončení nemoci. Podobné výsledky jsou popsány i jinými autory [3, 5, 6]. V naší retrospektivní studii byl klinický nález a následky nejhorší u pacientů starších 65 let. Závažnější onemocnění bylo pozorováno u dospělých ve srovnání s dětmi, rekonvalescence byla delší a s větším dyskomfortem u žen ve srovnání s muži.
Následky onemocnění
Jsou uváděny různými autory různě (35–58 %). V naší výše zmíněné studii tři pacienti (0,6 %) zemřeli. Po prodělaném onemocnění byli nemocní sledováni 12 měsíců, 18 % z nich předčasně ukončilo sledování. Hlavními obtížemi, na něž si rekonvalescenti stěžovali, byly: bolest hlavy, závratě (velmi časté ve věkové skupině nad 65 roků věku), třes, problémy s koncentrací, problémy se spánkem. U 24 % pacientů jsme diagnostikovali postencefalitický syndrom. Trvalé následky jsme zaznamenali u 5,2 % pacientů (v 1,2 % byly příčinou invalidity). Významně ovlivněna je po klíšťové encefalitidě rovněž kvalita života. V naší studii [4] jsme vyšetřili metodou tzv. Oxfordského testu 49 rekonvalescentů po KME (31 mužů, 18 žen) ve věku 48,7 Î 14,7 let (rozpětí 18–72 let). Oproti kontrolní skupině byly významně ovlivněny fyzické funkce, fyzické omezení rolí, emoční omezení rolí, fyzické a emoční omezení sociálních funkcí, bolest, mentální zdraví, všeobecné vnímání vlastního zdraví. Vitalita nebyla ovlivněna významně. Kvalita života byla u žen významně zhoršena ve srovnání s muži.
Diagnostika
Diagnóza se klinicky opírá o anamnézu a nález meningeálního dráždění. Rozhodujícím vyšetřením je pak nález v mozkomíšním moku: desítky až stovky buněk/3 mm3, zvýšená hladina bílkovin s normální či vyšší hladinou glukózy a s nezvýšenou hladinou laktátu. Sedimentace erytrocytů bývá zvýšená a ve druhé fázi bývá přítomna i leukocytóza. Pro vyloučení ložiskového postižení mozku (cerebritis, ischémie, demyelinizace) se provádí magnetická rezonance (MRI) mozku. Typickým výsledkem MRI při KME je hypersignální nález v thalamu. Etiologii nakonec potvrdí sérologické vyšetření. Na začátku prvé fáze již bývá zvýšená plazmatická koncentrace specifických protilátek IgM a do druhého odběru stoupají i koncentrace IgG. Průkaz protilátek v moku není přínosem, na počátku onemocnění bývají negativní a později je již diagnóza zřejmá z průkazu protilátek v krvi. Průkaz viru polymerázovou řetězovou reakcí (PCR) nemá význam: virémie je prchavá v první fázi a v období neuroinfekce je již negativní v moku i v krvi.
Diferenciální diagnóza
Diferenciálnědiagnostické problémy působí leukopenie a trombocytopenie v prvé fázi onemocnění (hematologická onemocnění). Zvýšená sedimentace, leukocytóza, spolu s výraznějším zvýšením množství leukocytů a celkové bílkoviny v moku (někdy i s převahou polymorfonukleárních leukocytů) mohou vést k úvaze o hnisavé neuroinfekci (absces mozku, purulentní meningitis) a k podání antibiotika. V případech, kde chybí údaj o přisátí klíštěte a první sérologické vyšetření je neurčité, je nutno vyloučit encefalitidu způsobenou herpes virem a dále etiologii enterovirovou, popř. jiná agens. V nejednoznačných situacích je třeba vyšetření rozšířit, abychom mohli vyloučit demyelinizační a cévní onemocnění mozku. Zvýšení ALT může budit podezření na onemocnění jater.
Léčba
Pro léčbu KE neexistuje specifické virostatikum. První fáze onemocnění je dobře zvládána podáním antipyretik, analgetik. Meningitický průběh onemocnění vyžaduje základní symptomatickou léčbu, po jejímž podání příznaky spontánně ustoupí a následuje delší rekonvalescence.
Encefalitida má dramatičtější příznaky a dle závažnosti stavu je symptomatická léčba mnohem aktivnější. U starších polymorbidních nemocných je nutno dosáhnout co nejlepší kompenzace základních onemocnění, dobré hydratace, výživy, těsné kontroly diabetu. Zmatenost či těžší porucha vědomí (kvalitativní i kvantitativní) pak vede k indikaci antiedematózní léčby, k podání nootropik a psychofarmak. Mozečkové příznaky a obrny jsou spojeny s dlouhodobou rehabilitací. Poruchy dýchání u těžkých encefalitid a encefalomyelitid vyžadují umělou plicní ventilaci. Podání kortikoidů je kontroverzní. Autoři z německy mluvících zemí jejich podání odmítají. U těžkých progredujících příznaků encefalitidy je však na našem pracovišti jednotlivým nemocným podáme. Léčba imunoglobuliny není přínosná. Antibiotika jsou někdy podána v případě diferenciálnědiagnostických rozpaků nad tím, zda se jedná o virový, či o bakteriální zánět. Stav po proběhlé encefalitidě je spojen s množstvím jednotlivých dysfunkcí, které vyžadují komplexní léčebný přístup: dlouhodobou rehabilitaci v nejširším slova smyslu spojenou s podáváním analgetik, nootropik, sedativ, antidepresiv či neuroleptik. Léčení by mělo být vždy dlouhodobé, jeho výsledky však často nejsou uspokojivé.
Prevence vzniku onemocnění
Chování v přírodě
Pravděpodobnost přisátí klíštěte můžeme ovlivnit změnou chování v přírodě, používáním repelentů. Pravděpodobnost nákazy virem KME můžeme snížit osobní prohlídkou po návratu z lesa a včasným vytažením klíštěte jen do jisté míry (tímto způsobem ovlivníme spíše nákazu B. burgdorferi). Dříve podávané imunoglobuliny již nejsou na trhu. Léčbě těmito látkami byl přičítán těžší průběh onemocnění encefalitidou pozorovaný u několika dětí (šlo však o pozorování z jednoho pracoviště).
Očkování
Očkování je tedy jedinou skutečně účinnou metodou, jak předcházet vzniku onemocnění. Preventivní očkování proti klíšťové encefalitidě má více než třicetiletou historii. Prvá široce používaná očkovací látka byla vyvinuta z kmene Neudörfl v Rakousku Christianem Kunzem a spolupracovníky v 70. letech. V západní a střední Evropě jsou nyní na trhu vakcíny dvou výrobců, FSME-IMMUN obsahující virus Neudörfl a vakcína Encepur obsahující kmen K23. Sekvenování virového genomu ukazuje vysokou homogenitu kmenů Neudörfl a K23 [1]. Obě vakcíny jsou silně imunogenní a vyvolávají produkci neutralizujících protilátek, které jsou známkou protektivní imunity. Tyto protilátky zkříženě reagují s různými evropskými i asijskými izolovanými kmeny (včetně sibiřských a dálněvýchodních). Obě vakcíny prodělaly určitý vývoj, který směřoval k minimalizaci vedlejších účinků očkování, k vytvoření varianty očkovací látky určené pro imunizaci dětí a k vývoji zkráceného schématu očkování [7]. Vakcíny jsou v principu zaměnitelné. V praxi se poměrně běžně provádí přeočkování alternativní vakcínou, v základním schématu není ale střídání vakcín doporučeno v SPC [8].
Složení vakcín
Obě jmenované vakcíny obsahují inaktivovaný celý virus absorbovaný na aluminium hydroxid. Během vývoje byly prováděny u obou vakcín změny, především stabilizátoru [7].
Snaha snížit teoretické riziko užívání lidského albuminu vedla k náhradě FSME-IMMUN vakcínou Ticovac (nebyla uvedena do ČR). Tento přípravek neobsahující albumin vykazoval vyšší počet vedlejších účinků, hlavním problémem byly častěji se vyskytující teploty. Na základě poznatku, že vakcína s albuminem má lepší cytokinový profil (nižší indukce TNF-a), se výroba vrátila opět k FSME-IMMUN stabilizovanému albuminem.
Alternativní přístup, formulaci bez proteinového stabilizátoru (albuminu), ale se zvýšeným obsahem sacharózy, využil výrobce přípravku Encepur. Po aplikaci starší formule Encepuru, která obsahovala stabilizátor polygelin, se vyskytly alergické reakce u dětí, a proto nová formule vakcíny již tento stabilizátor nemá [9].
Varianta vakcíny určená k imunizaci dětí
Vakcína FSME-IMMUN byla původně určena pro všechny věkové skupiny. I přípravek Encepur obsahoval zprvu dávku antigenu stejnou pro všechny věkové skupiny. Při širším používání se ale ukázalo, že hlavně u předškolních dětí byl pozorován častější výskyt teplot [10]. Výrobci tedy započali s vývojem vakcíny cílené pro určitý věk. Ukázalo se, že poloviční dávka antigenu vakcíny Encepur vyvolávala u dětí stejně imunogenní účinky, ale byla lépe snášena. Podobně i nová varianta přípravku FSME-IMMUN určená k imunizaci dětí obsahuje poloviční dávku antigenu.
Očkovací schéma
Konvenční očkovací schéma zůstává již delší dobu pro obě vakcíny nezměněno. Sestává z prvé dávky podané v den 0, další dávky podané za 1–3 měsíce a třetí dávky aplikované o 9–12 měsíců později. Protektivní imunity je dosaženo přibližně po 2 týdnech po podání druhé dávky. Toto schéma je vhodné začít aplikovat na podzim či v zimě, aby po podání 2. dávky v jarních měsících byla již plně rozvinuta protektivní imunita.
Zkrácené schéma je vhodné pro použití během sezony v případě neplánovaného odjezdu do přírodního ohniska nákazy. Vakcína FSME-IMMUN je pak podávána v den 0, druhá dávka je podána za 2 týdny a třetí dávka za 5–12 měsíců. Významných hladin protilátek bylo po druhé dávce dosaženo u více než 90 % po 2 týdnech při vyšetření metodou ELISA IgG, zatímco při vyšetření virus-neutralizačních protilátek již po týdnu. Encepur je podáván v den 0, 7 a 21. Sérokonverzi je možno očekávat nejdříve za 14 dnů po 2. vakcinaci. Při imunizaci prováděné podle zkráceného schématu musí být první booster dávka podána již za 12–18 měsíců.
Mnoho let bylo doporučováno přeočkování každé 3 roky. Nejnovější výsledky sérologických studií vedly k poznatku, že imunita přetrvává déle a v roce 2004 doporučila rakouská komise pro očkování změnu: prvý booster aplikovaný po 3 letech následují u lidí mladších než 60 let další přeočkování každých 5 let. U lidí starších než 60 let se nadále doporučuje přeočkování každé 3 roky. Nový (značně kontroverzní) přístup přijala očkovací komise švýcarská: po základním očkování doporučuje přeočkování každých 10 let. Proti tomuto přístupu mluví skutečnost, že již před podáním prvního boosteru u některých lidí hladiny protilátek klesají, ale po jeho podání jejich hladina významně stoupá. To svědčí o velkém významu prvého boosteru podaného 3 roky po základním očkování.
Naše doporučení se shoduje s doporučením rakouským: tedy základní očkování třemi dávkami, prvé přeočkování po 3 letech a u mladších lidí pak přeočkování každých 5 let, u lidí starších než 60 let pak přeočkování každé tři roky.
Rakouská zkušenost
V Rakousku se očkování proti klíšťové encefalitidě rozvinulo krátce po uvedení vakcíny profesora Kunze a firmy Immuno AG [11]. Zavedení očkovací látky podporovala celonárodní dlouhodobá kampaň. KME se tak v Rakousku stala sledovanou a obávanou nemocí a očkování proti ní získalo na důležitosti (a svým způsobem jsou úspěchy vakcinační kampaně i předmětem národní hrdosti). S postupným proočkováním populace v endemických spolkových zemích začaly plynule klesat počty onemocnění. V současnosti je očkováno zhruba 88 % občanů Spolkové republiky Rakousko, přičemž nejvyšší proočkovanost je v endemických zemích, jako je Dolní Rakousko, Štýrsko, Korutany a Burgenland. To vedlo ke snížení počtu nemocných z původních 600–700 za rok na 88 onemocnění v roce 2006. Populace občanů naší republiky je rakouskými autory používána běžně jako kontrolní skupina. Za stejné období došlo u nás navzdory podobným klimatickým podmínkám k velkému nárůstu onemocnění. Podobně srovnání výskytu u slovinských dětí (proočkovanost 4 %) s dětmi ze Štýrska (proočkovanost asi 90 %) svědčí pro úspěšnost rakouské strategie.
Efektivita očkování
Účinnost očkování můžeme jen do jisté míry posuzovat z dosažených titrů protilátek. Přesnější je posuzování efektivity očkování jako srovnání výskytu onemocnění u imunních a neimunních jedinců. Heinz a spolupracovníci [12] stanovují v současnosti efektivitu očkování na 99,3 %.
Vztah naší veřejnosti k očkování
Vztah naší veřejnosti k očkování je formován jinými souvislostmi a jiným kulturním prostředím, než je tomu v Rakousku. Povinná očkování, jež jsou dlouhodobě plně hrazena státem, jsou zaměřena proti onemocněním mezilidsky se šířícím. Hromadným očkováním se u nich dosahuje nejen individuální, ale i kolektivní imunity. Očkování hrazené státem je vnímáno občany jako zásadní, ostatní vakcinace jako méně důležité. KME je nemocí volného času a imunita proti ní je individuální. Takové očkování je považováno za soukromou záležitost jak veřejností, tak institucemi. Pro některé sociální skupiny je pak celé základní schéma i značnou ekonomickou zátěží. Zdravotní pojišťovny zatím podporovaly očkování dětí do 15 let tak, že hradily 3. dávku základního očkovacího schématu. V principu je to strategie správná (vede ke kompletaci základního schématu) a je to dobrá investice do budoucnosti. Nejvíce ohroženou skupinou nemocných a současně skupinou, která vyžaduje nejnákladnější péči, jsou však senioři. Pro ně je očkování drahé a nejsou k němu motivováni. Mezi našimi občany, a dokonce mezi lékaři navíc přetrvává množství legend o tiché sérokonverzi: „Když žijete v ohnisku několik desítek let a zaznamenal jste přisátí stovek klíšťat, musíte být již imunní!" Tuto představu jsme se pokusili vyvrátit v římovské studii [13, 14]. V endemickém městečku byli vyšetřeni rezidenti na přítomnost protilátek a byla jim nabídnuta zlevněná vakcína. Protilátky mělo vytvořeno 6 % vyšetřených obyvatel jako důsledek prodělané nemoci, 15 % mělo postvakcinační protilátky a necelých 10 % mělo vytvořeno protilátky, aniž byli očkováni nebo u nich byla diagnostikována KME. Všichni ostatní obyvatelé byli k nemoci vnímaví. Na takzvanou „promořenost" lidí v ohnisku nákazy tedy nelze spoléhat. Přesto praktičtí lékaři pro dospělé očkování svým klientům nedoporučují příliš často.
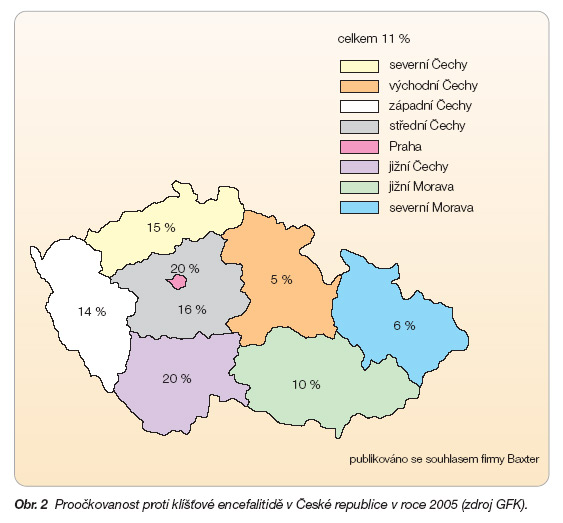
Výsledkem tohoto vnímání vakcinace je nízká proočkovanost. V ČR je nyní očkováno přibližně 11 % obyvatel (obr. 2). Tradiční ohniskové oblasti, jako jsou jižní Čechy, dosahují až 20 %. Většina očkovaných osob je mladších 20 let věku.
Závěr
KE má v našich podmínkách poměrně nízkou mortalitu. Přináší však nemocným obtíže nejen v akutní fázi, ale je zdrojem dlouhodobých problémů v rekonvalescenci a dlouhé pracovní neschopnosti. Má statisticky významně závažnější průběh u pacientů starších 65 let, rekonvalescence je obtížnější u žen. Vývoj nemocnosti v minulém roce ukázal, že naše současná proočkovanost je zcela nedostatečná k tomu, aby případů výskytu nemoci dále nepřibývalo. Důvodem je vznik nových přírodních ohnisek infekce a změna chování lidí v přírodě, zvláště u vyšších věkových skupin. KME se tak stává stále větším celospolečenským i ekonomickým problémem. Nové skutečnosti by měly vést Ministerstvo zdravotnictví ČR a zdravotní pojišťovny k novému zhodnocení situace a případně i ke změně přístupu k očkování. Prvním krokem by se mohla stát úhrada 3. dávky vakcíny v základním očkovacím schématu i v jiných věkových skupinách než u dětí – především ve skupině lidí starších než 60 let. Velký úkol čeká i na praktické lékaře. Měli by svým klientům (zvláště starším a alespoň přechodně se vyskytujícím v ohnisku) doporučovat vakcinaci s mnohem větším důrazem.
Seznam použité literatury
- [1] Heinz F.X., Molecular aspects of TBE virus research. Vaccine 2003; 21: 53–530.
- [2] Kaiser R. The clinical and epidemiological profile of tick-borne encephalitis in Southern Germany 1994–98. Brain 1999; 122; 2067–2078.
- [3] Haglund M, Günther G. Tick-borne encephalitis-pathogenesis, clinical course and long-term follow-up. Vaccine 2003; 21 (Suppl.1): 11–18.
- [4] Chmelik V, Petr P, Slamova I, et al. Quality of Life after Tick Borne Encephalitis. Clinical Microbiology and Infection 2004; 10 (Suppl. 3): 397.
- [5] Kunze U, Asokliene L, Busse A, et al. Tick borne encephalitis in childhood: conference report and consensus of the International Scientific Working Group on tick-borne encephalitis (ISW-TBE) Vaccine 2004; 23: 729–731.
- [6] Kunze U, Baumbach U, Bretschneider R, et al. The Golden Agers and Tick Borne Encephalitis. Vaccine 2006; 24.
- [7] Zent O, Broker M. Tick-borne encephalitis vaccines: past and present. Expert Rev Vaccines 2005; 4: 747–755.
- [8] Bröker M, Schöndorf I. Are tick-borne encephalitis vaccines interchangeable? Expert Rev Vaccines 2006; 5: 461–466.
- [9] Broker M, Zent O. A tick-borne encephalitis vaccine without human serum albumin as stabilizer. Vaccine 2005; 23: 5699.
- [10] Rosenkranz G. Can we reduce the dose of a vaccine? Control Clin Trials 1997; 18: 43–53.
- [11] Kunz C. Vaccination against TBE in Austria: the succes story continues. Int J Med Microbiol 2002; 291: 56–57.
- [12] Handouts of 9th ISW TBE 2007 Vienna, 25–26 Jan 2007.
- [13] Chmelik V, Lunackova J, Sipova I, et al. The Rimov TBE vaccination project. International Symposium for Tick Borne Diseases. Berlin, 11–12. 3. 2003.
- [14] Luňáčková J, Chmelík V, Šípová I, et al. Epidemiologické sledování klíšťové encefalitidy v jižních Čechách Lokalita Římov Poměr manifestních a inaparentních forem infekce, stanovení protilátkové odezvy ve sledovaném souboru. Snaha zvýšit intervencí stupeň imunity mimořádným očkováním u osob s nízkými či negativními titry v lokalitě Římov v období přelomu roku 2001/2002. Epidemiol Mikrobiol Imunol 2003; 52: 51–58.