Kombinační či hybridní léčba arytmií
V posledních letech převažuje v léčbě arytmií jasné směřování k nefarmakologickým metodám. V léčbě bradyarytmií zaujímá již dlouho dominantní postavení trvalá kardiostimulace. Většinu supraventrikulárních tachykardií lze kurativně ovlivnit katetrizační ablací. U hemodynamicky závažných komorových tachyarytmií je hlavní metodou léčby implantace kardioverteru-defibrilátoru. K docílení co nejlepšího léčebného účinku u významné části tachyarytmií (zejména u fibrilace síní a u části komorových tachykardií) je zatím využívána kombinace různých nefarmakologických postupů, případně ve spojení s medikamentózní léčbou – tzv. hybridní terapie. Podstata této strategie spočívá v tom, že částečné ovlivnění arytmogenního substrátu nebo vyvolávajících a modulujících faktorů jedním způsobem léčby může usnadnit a zvýraznit efekt dalšího postupu, který při samostatném použití není dostatečně účinný. Článek shrnuje současné trendy v kombinační (či hybridní) léčbě fibrilace síní a komorových tachyarytmií a upozorňuje na některé nežádoucí interakce daných léčebných postupů.
Úvod
V léčbě poruch srdečního rytmu v současné době výrazně převažují nefarmakologické metody. Tento trend zaznamenává v posledních letech každoroční vzestup. U poruch v důsledku zpomalené tvorby nebo blokády vedení vzruchu dominuje elektrická kardiostimulace a farmakoterapie je využívána obvykle jen u přechodných bradyarytmií, podmíněných například ischémií nebo při funkční poruše autonomní kardiální kontroly při podráždění nervus vagus. U rychlých poruch srdečního rytmu – tachyarytmií – je situace složitější a k docílení co nejlepšího léčebného účinku mohou být kombinovány různé medicínské postupy. Při současném použití různých typů farmak hovoříme o kombinační terapii. Spojení různých nefarmakologických metod nebo kombinace léků a nefarmakologických léčebných postupů bývá označováno termínem hybridní terapie [31]. Jejím cílem je pomocí několika různých terapeu-tických postupů dosáhnout vyšší úspěšnosti léčby a snížit výskyt vedlejších, nežádoucích účinků léčby. Výchozím bodem je skutečnost, že významnou část tachyarytmií zatím nelze definitivně odstranit jedním léčebným způsobem. Ten však může částečně ovlivnit arytmogenní substrát či vyvolávající nebo tzv. modulující faktory, a tak usnadnit nebo zvýraznit účinek dalšího aplikovaného způsobu léčby, který by sám o sobě nebyl dostatečně účinný. Tato léčebná strategie se uplatňuje především u síňové fibrilace a u komorových tachy-arytmií.
Kombinační/hybridní léčba fibrilace síní
Fibrilace síní (FS) je nejčastější setrvalou tachyarytmií, jejíž výskyt v celé dospělé populaci je odhadován na 4 % [25]. Její prevalence zřetelně stoupá s věkem. Dle nejčastěji užívané klasifikace se vyskytují 3 hlavní formy této arytmie: paroxysmální, perzistující a permanentní [10, 25]. Patofyziologický podklad FS může být různý. U některých pacientů převažuje podíl frekventní ektopické aktivity zejména z oblasti ústí plicních žil, což přispívá k elektrické a později i strukturální remodelaci síní. V jiných případech hraje primární roli strukturální postižení síňového myokardu se zvýšeným podílem vazivové tkáně, amyloidu a se změnami mezibuněčných spojů, což usnadňuje vznik mnohočetných „reentry" okruhů, které jsou podkladem FS. Je více teorií o reentry mechanismu u této arytmie – od představy o funkci mnohočetných reentry okruhů různé velikosti až po koncepci hlavních rotorů (rotující reentry spirálového tvaru), tzv. mateřských reentry okruhů, které jsou lokalizovány v určitých strukturách síně, především opět kolem ústí plicních žil. Významnou roli mohou hrát i ganglia autonomního nervového systému v oblasti síní [25].
Léčba FS respektuje individuální přístup, který sleduje ovlivnění symptomů, hemodynamické situace a prevenci tromboembolických komplikací. Cílem léčby může být obnovení a udržení sinusového rytmu nebo kontrola komorové frekvence při přetrvávající FS. Vždy by měla být dodržena zásada podávání účinné antikoagulační léčby pacientům s přetrvávající FS či s trvajícím rizikem jejích recidiv. U pacientů se zřetelně nižším rizikem tromboembolické komplikace lze akceptovat antiagregační léčbu [10].
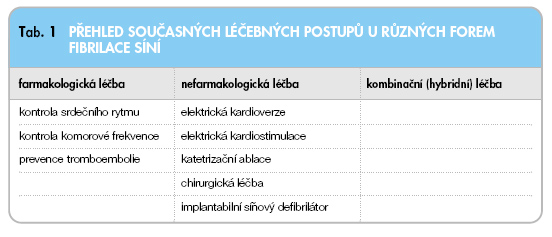
Placebem kontrolované studie v minulosti prokázaly krátkodobou účinnost antiarytmik I. a III. skupiny (dle Vaughanovy-Williamsovy klasifikace) na udržení sinusového rytmu po paroxysmu FS zhruba u 40–60 % případů. Při delším sledování efekt této léčby výrazně klesá [10, 27, 28]. Jsou proto využívány další léčebné možnosti k ovlivnění uvedené arytmie (tab. 1).
Z hlediska pojetí tohoto článku se soustředíme více na antiarytmickou farmakoterapii indikovanou jako prevenci recidiv FS po spontánním obnovení sinusového rytmu nebo po předchozí elektrické kardio-verzi či po ablační léčbě a v kombinaci s trvalou elektrickou kardiostimulací. Při výběru antiarytmika zvažujeme, jaký mechanismus účinku léčiva má v daném případě větší naději na úspěch vzhledem k okolnostem vzniku arytmie (tab. 2) [28].
Po první zjištěné epizodě FS, zejména v případě izolované („lone") FS – tedy bez přítomnosti strukturálního srdečního postižení – obvykle nepodáváme preventivní antiarytmickou léčbu [10].
Pokud byla epizoda uvedené arytmie málo symptomatická a je pravděpodobné, že pacient další ataku nerozpozná krátce po jejím vzniku, měl by být jeho stav alespoň přechodně zajištěn antikoagulační léčbou. K prevenci recidiv FS přednostně používáme antiarytmika třídy IC (propafenon či flecainid) nebo třídy III (sotalol, amiodaron, v zahraničí je používán dofetilid, ibutilid, azimilid) [27–29]. Probíhají též studie s novými antiarytmiky. U pacientů bez strukturálního onemocnění srdce, s normální kontraktilní funkcí levé komory a bez známek prodloužené repolarizace je možno použít i antiarytmikum třídy IA. Na-opak u pacientů se strukturálním postižením srdce a se systolickou dysfunkcí levé komory je preferován v dané indikaci antiarytmické léčby amiodaron (tab. 3).
Propafenon či další antiarytmika I. skupiny zpomalují především vedení vzruchu, amio-daron prodlužuje efektivní refrakterní periodu v myocytech síňového myokardu. Oba tyto účinky mohou přispět k ukon-čení tachyarytmie typu reentry. Kombinované použití těchto antiarytmik je uplat-ňováno jen ojediněle u pacientů bez strukturálního srdečního onemocnění a pacient musí být pečlivě kontrolován, aby se snížilo potenciální riziko vedlejších účinků – zejména proarytmie s vyvoláním komorové tachyarytmie typu torsade de pointes.
Při použití antiarytmik třídy IA či IC má být podáván současně b-blokátor ke kontrole síňokomorového převodu a tedy komorové frekvence při případném vzniku a přetrvávání FS. Antiarytmika III. třídy jsou doporučována některými autory v rámci farmakologické přípravy před elektrickou kardioverzí. Například poměrně nedávno publikovaná prospektivní studie japonských autorů ukázala, že „předléčení" nifekalantem (tj. novým blokátorem draslíkových iontových kanálů) před elektrickou kardioverzí statisticky významně zvýšilo úspěšnost této léčby a významně snížilo výskyt recidivy FS [15].
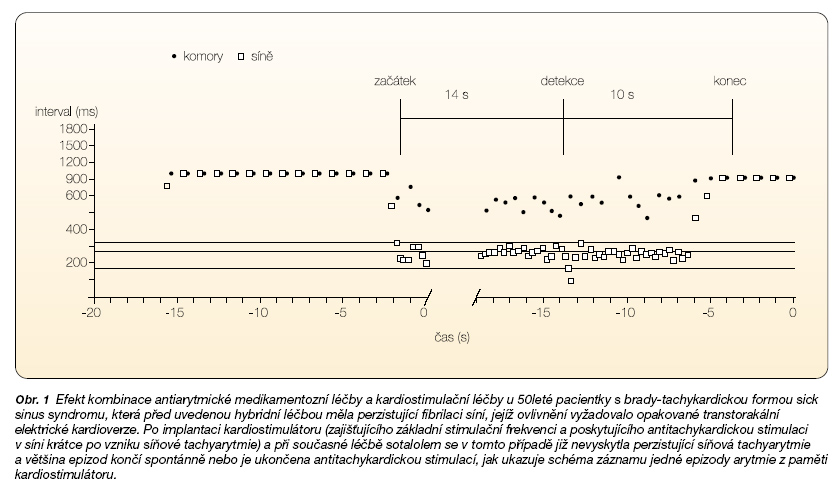
I když kombinace kardiostimulační léčby s antiarytmickou medikací má v současné době podstatně menší zastoupení mezi léčebnými přístupy, je třeba uvést, že především u pacientů s brady-tachykardickou formou sick sinus syndromu s paroxysmální FS je tato léčebná kombinace poměrně efektivní (obr. 1) [12].
Dlouhodobější efekt (udržení pravidelné síňové akce) u téměř 80 % pacientů byl docílen, pokud byla síňová stimulace aplikována na oblast horní části mezisíňového septa (případně při stimulaci oblasti Bachmanova svazku) [24].
Řada studií ověřovala efekt různých stimulačních algoritmů na prevenci recidiv FS.
Cílem těchto specifických stimulačních režimů bylo potlačení spouštěcího faktoru (síňové extrasystolie) přechodným stimulačním zvýšením frekvence síní či zabráněním vzniku postextrasystolické pauzy, dále snížení disperze refrakterností v síňovém myokardu stimulačním vyrovnáním kolísání délek srdečního cyklu a případnou stimulací z více míst a také celkovou modifikací arytmogenního substrátu stimulací [7]. Byl též testován efekt elektrické stimulace v kombinaci s antiarytmickou medikamentózní léčbou [30, 31].
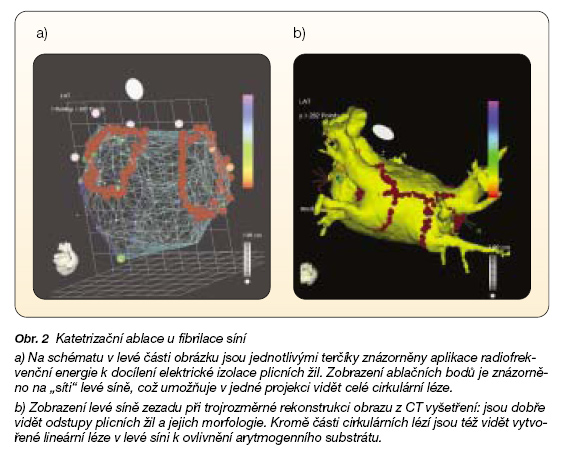
Také po provedené katetrizační ablaci či po chirurgické ablaci k ovlivnění FS jsou poměrně často podávána antiarytmika [31]. Aplikace ablačních postupů se snaží o izolaci plicních žil (ta má zabránit uplatnění ektopické aktivity z dané oblasti a zabránit vzniku hlavních reentry rotorů v okolí plicních žil) a vytvoření linií bloku vedení v levé síni (někdy jsou linie vytvářeny i v pravé síni) – což má modifikací potenciálního arytmogenního substrátu zabránit vzniku a udržení mnohočetných reentry okruhů [13, 17, 19] (obr. 2).
Katetrizační ablační postupy využívají především endokardiální přístup, při chirurgické ablaci (v podobě tzv. „MAZE" operace) je energie (nejčastěji v podobě kryoablace či radiofrekvenční ablace) aplikována na epikardiální i endokardiální straně síňového myokardu.
Dlouhodobější efekt po katetrizační ablační léčbě FS je docílen zhruba u poloviny pacientů – bez potřeby další antiarytmické medikace. Novější práce uvádějí, že v závislosti na zkušenosti příslušného centra a na výběru pacientů ke katetrizační ablaci pro fibrilaci síní je příznivý efekt, tj. bez symptomů recidivy arytmie a bez následné antiarytmické léčby, udáván mezi 15 % a 90 % [6, 15, 34]. U zbývajících pacientů je situace obvykle řešena dlouhodobým podáváním antiarytmika. Výběr léku se přitom řídí obdobným rozhodováním jako při léčbě pacientů s paroxysmální FS, u nichž zatím nebyla zvažována katetrizační ablace. Někteří autoři doporučují též podávání ACEI (inhibitoru enzymu konvertujícího angiotenzin) a verapamilu – k podpoře pozitivní remodelace síně, jejíž elektrofyziologické i anatomické parametry jsou změněny v důsledku předchozí déletrvající arytmie [25].
Úspěšnost chirurgické léčby FS je srovnatelná s komplexnějšími katetrizačními ablacemi. Při recidivách fibrilace síní je možno indikovat katetrizační ablaci nebo antiarytmickou medikaci, jejíž výběr respektuje výše uvedené zásady. V delším odstupu po chirurgické ablaci bývá pozorován atypický flutter síní či jiná makroreentry tachykardie lokalizovaná v levé síni. Úspěšnou terapií této tachykardie je selektivní katetrizační ablace.
Je evidentní, že kombinace nefarmakologické léčby a podávání antiarytmik může docílit dlouhodobější stabilizaci síňové elektrické aktivity u významné části pacientů. Saksena při použití kombinace bifokální stimulace v pravé síni, antiarytmické medikace a katetrizační ablace uvádí trvání sinusového rytmu po 20 měsících u 79 % takto léčených pacientů s paroxysmální či perzistující fibrilací síní [31]. Tato hybridní terapie byla spojena se zá-važnějšími komplikacemi u méně než 2 % pacientů. Při dynamickém rozvoji této oblasti kardiologie lze očekávat, že v blízké době budou k dispozici ještě efektivnější a bezpečnější léčebné postupy.
Kombinační/hybridní léčba komorových tachyarytmií
Zatímco u supraventrikulárních tachykardií při indikaci léčby hraje hlavní roli ovlivnění symptomů, při výběru léčby komorové tachyarytmie (KTA) je v popředí hledisko prognostické. Je to dáno skutečností, že setrvalé komorové tachyarytmie (s-KTA) jsou dominantní příčinou náhlé srdeční smrti (NSS) [26]. Klinicky významnější formy KTA vznikají ve více než 90 % případů na podkladě koronární nemoci. Proto je největší pozornost věnována otázce jejich ovlivnění jak u akutních forem, tak zejména u chronických stadií ischemické choroby srdeční.
Po proběhlém infarktu myokardu (IM) je pozornost zaměřena na možnost rizikové stratifikace pacientů, tj. vytipování těch, kteří jsou ve zvýšené míře ohroženi výskytem s-KTA a NSS. Základním rizikovým ukazatelem je spontánní výskyt s-KTA. U pacientů s tímto nálezem je v rámci tzv. sekundární prevence NSS indikována co nejúčinnější terapie, což v praxi znamená především implantaci kardioverteru-defibrilátoru (ICD). Toto platí i pro neischemickou kardiomyopatii a pro závažné KTA i bez nálezu strukturálního srdečního onemocnění, pokud uvedená arytmie nebyla podmíněna reverzibilní příčinou (intoxikace, hypoxémie, akutní ischémie myokardu, iontová dysbalance aj.). Sekundárně preventivní indikace léčby ICD je v doporučeních většiny kardiologických společností včetně amerických (ACC a AHA), Evropské kardiologické společnosti i České kardiologické společnosti zařazena do indikační třídy I – v rámci kritérií medicíny založené na důkazech [33]. Opírá se to o konzistentní výsledky 3 prospektivních randomizovaných studií (AVID, CIDS a CASH), které ukázaly přesvědčivě větší efektivitu ICD v ovlivnění arytmické smrti i celkové mortality ve srovnání s antiarytmiky [5]. Při dvouletém a delším sledování ukazují relativní snížení celkové mortality o 20 % až 37 % při léčbě ICD oproti léčbě amiodaronem či jiným antiarytmikem [5, 8]. Vliv ICD na snížení výskytu arytmické smrti byl ještě výraznější. Při metaanalýze uvedených 3 studií bylo konstatováno relativní snížení mortality náhlou smrtí o 57 % [8].
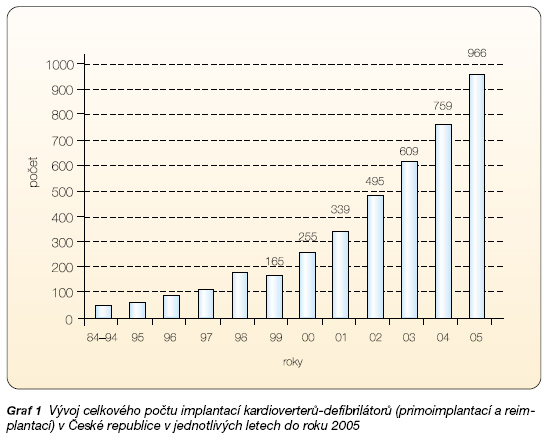
U ostatních méně dramaticky se manifestujících forem komorových arytmií u pacientů s koronární nemocí i s neischemickou kardiomyopatií jsou využívány další diagnostické postupy k posouzení rizika NSS [4, 26]. Při nálezu svědčícím o jasně zvýšeném riziku NSS je indikována implantace ICD [33]. Tato léčba je indikována i u pacientů, kteří dle rizikové stratifikace mají vysoké riziko NSS, ale dosud klinickou setrvalou KTA neměli. U nich se jedná o tzv. primárně preventivní indikaci léčby ICD. Efekt této léčby na snížení NSS a celkové mortality je u určitých skupin rizikových pacientů ještě účinnější než při léčbě ICD v rámci sekundárně preventivní indikace. Ukázaly to výsledky studií MADIT, MUSTT, MADIT II a SCD-HeFT [3, 16, 21, 22 ]. Rozšíření indikací léčby ICD vede ke každoročnímu nárůstu počtu implantací těchto přístrojů (graf 1).
Je třeba zdůraznit, že ICD nebrání vzniku KTA. Proto u pacientů s častými epizodami KTA, případně až rázu tzv. arytmické bouře, je potřeba tuto situaci ovlivnit další doplňující léčbou.
V rámci hybridní terapie se tím v praxi rozumí především antiarytmická medikace nebo katetrizační ablace či modifikace arytmogenního substrátu.
Z antiarytmik je nejčastěji používán k ovlivnění KTA amiodaron. Po implantaci ICD bývá tento lék podáván u 15–55 % pacientů [9]. Jeho účinek na ovlivnění KTA byl v dřívějších letech testován řadou studií u pacientů se strukturálním srdečním postižením. Jednotlivé větší multicentrické studie s amiodaronem sice neprokázaly zřetelnější efekt profylaktického podávání tohoto přípravku na snížení celkové mortality, byl však významně snížen výskyt náhlé smrti. Metaanalýza řady prospektivních randomizovaných studií s amiodaronem u pacientů po infarktu myokardu a s chronickým srdečním selháváním (CHSS) ukázala trend ke snížení celkové mortality při léčbě amiodaronem [16]. Příznivý efekt amiodaronu byl výraznější, pokud byl tento lék podáván v kombinaci s b-blokátorem.
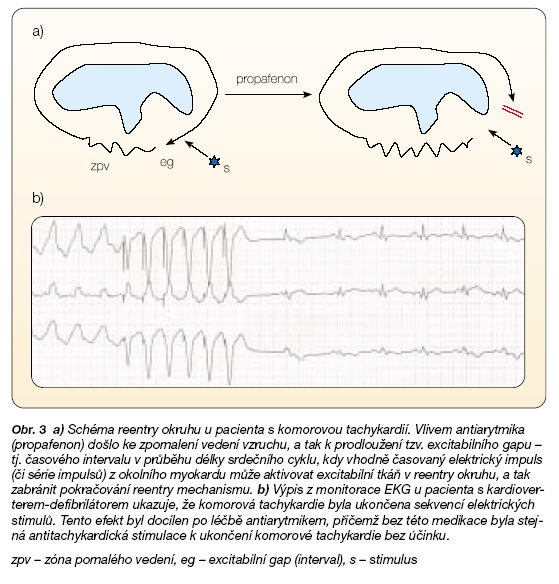
Dalším osvědčeným lékem v dané indikaci je sotalol [23]. Ostatní antiarytmika jsou pacientům s ICD podávána jen sporadicky a zhodnocení jejich účinnosti – při respektování kritérií medicíny založené na důkazech – se neopírá o větší randomizované studie. Z kazuistických sdělení je však zřejmé, že i antiarytmika I. třídy u některých pacientů potencují efekt léčby ICD (obr. 3).
V rámci informace o této hybridní terapii je třeba zmínit možný problém interakce antiarytmika s ICD [32]. Použitý lék může ovlivnit funkci systému ICD řadou mechanismů, jejichž přehled uvádí tab. 4.
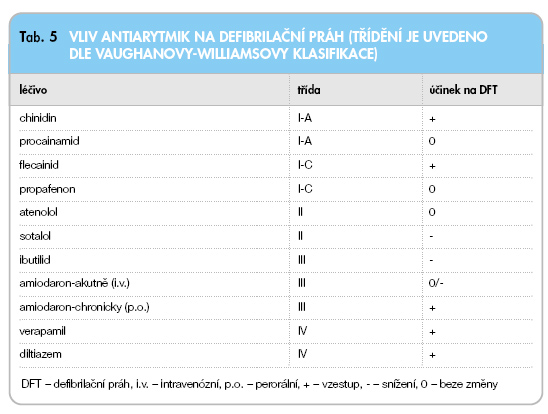
Při klinických kontrolách pacientů s ICD je v případě zahájení antiarytmické léčby či při podstatném zvýšení dosavadních dávek antiarytmika potřeba mít na zřeteli zejména riziko nežádoucího ovlivnění (tj. zvýšení) defibrilačního prahu a možnost zhoršení detekce s-KTA. Je známo, že amiodaron (při chronickém podávání), chinidin, flecainid a lidocain typicky zvy-šují defibrilační práh.
Je proto doporučeno provést testování defibrilačního prahu u pacientů s ICD v případech, kdy u nich byla zahájena antiarytmická léčba nebo byla zřetelně zvýšena dávka léku, který může způsobit nežádoucí změnu tohoto parametru [18, 32].
Přehled účinků jednotlivých antiarytmik na defibrilační práh je uveden v tab. 5.
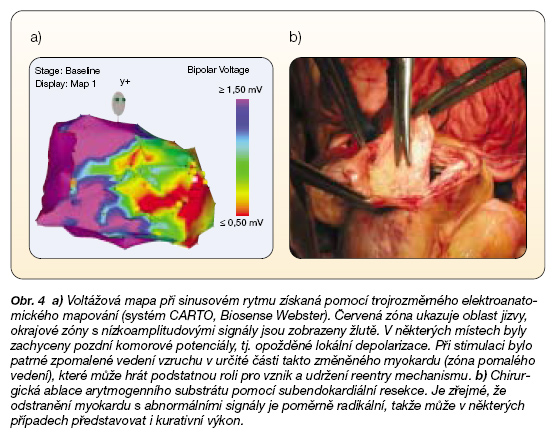
Další léčebnou možností u častých paroxysmů KTA je cílená katetrizační či chirurgická ablace arytmogenního substrátu, která může být dokonce kurativním výkonem. Typickým arytmogenním substrátem u pacientů po infarktu myokardu je periinfarktová zóna. Prolínají se zde okrsky vitálního myokardu s jizevnatou tkání, myocyty jsou odděleny vazivem, takže tvoří jakýsi labyrint funkční tkáně, ve které se však aktivace šíří abnormálním způsobem v důsledku anizotropie daného okrsku myokardu. Na řadě míst dochází k výraznému zpomalení vedení vzruchu, a to spolu s rozdíly v refrakternostech sousedních skupin myocytů usnadňuje vznik reentry okruhu. Pokud se jedná o stabilní reentry okruh, je možno jej úspěšně ovlivnit cílenou katetrizační ablací. U většiny pacientů po IM je však arytmogenní substrát většího rozsahu a umožňuje uplatnění více reentry okruhů. Přes značný pokrok v mapovacích i ablačních technikách však zatím nelze katetrizační ablaci u těchto komplexních arytmií považovat za kurativní výkon, ale je přijímána jako doplňující léčba při zajištění pacienta ICD. Chirurgická ablace je v tomto směru účinnější, neboť umožňu-je spolehlivější a radikálnější odstranění poškozeného myokardu a v některých případech tak může představovat kurativní výkon (obr. 4).
Kombinační/hybridní léčba arytmií u chronického srdečního selhávání
V léčbě chronického srdečního selhávání (CHSS) bylo v posledních letech docíleno zřetelného pokroku. Komplexní medikamentózní léčba zahrnuje kombinaci diuretik, spironolactonu, b-blokátorů, ACEI i dalších léků. Léčebný efekt zmíněných medikamentů byl testován opakovaně ve velkých randomizovaných prospektivních studiích [20]. Rozbor této situace je předmětem jiného sdělení.
Novým prvkem v léčbě pacientů s CHSS je srdeční resynchronizační terapie, jejímž cílem je zmírnění symptomů a zlepšení hemodynamických parametrů optimalizací průběhu elektrické srdeční aktivace a následně též kontrakce srdečních komor. Je to docíleno synchronizovanou elektrickou aktivací obou komor, kdy levá komora je stimulována pomocí elektrody zavedené do vhodné větve koronárního sinu, případně pomocí epikardiální elektrody. Jsou již k dispozici data, která ukazují příznivý dopad této léčby na potlačení ektopické komorové aktivity a na snížení počtu oprávněných intervencí systému ICD [11]. Rovněž výsledky prospektivní randomizované studie COMPANION ukazují, že srdeční resynchronizační terapie v kombinaci s ICD v primárně profylaktické indikaci snížila celkovou mortalitu pacientů s CHSS o 36 % ve srovnání s tzv. optimální medikamentózní léčbou. Ze dvou třetin je tento efekt způsoben právě srdeční resynchronizační terapií [2]. Indikace uvedené hybridní terapie je již zahrnuta ve verzi doporučení České kardiologické společnosti [4, 33].
Závěr
Kombinační či hybridní léčba arytmií se v současné době uplatňuje především v těchto indikacích:
– ‑U komplexních supraventrikulárních tachyarytmií včetně fibrilace síní, které recidivují i po katetrizační nebo chirurgické ablaci či modifikaci arytmogenního substrátu. Úplného nebo alespoň částečného potlačení arytmie lze docílit medikamentózní léčbou, zejména anti-arytmiky III. třídy (u fibrilace síní bez strukturálního srdečního postižení je možno použít i antiarytmika I. třídy v kombinaci s b-blokátorem nebo verapamilem). U brady-tachykardické formy sick sinus syndromu je kombinována trvalá kardio-stimulace s antiarytmikem a b-blokátorem.
– ‑U komorových tachyarytmií se zvýšeným rizikem náhlé srdeční smrti, kde je léčebná strategie tato: pokud má pacient po implantaci kardioverteru-defibrilátoru častější recidivy KTA vedoucí k intervenci ICD, je možno dosáhnout ústupu výskytu epizod KTA kombinací různých léčebných postupů farmakologických i nefarmakologických (hybridní terapií), např. katetrizační či chirurgickou ablací či stimulační resynchronizační terapií, případně antiarytmikem III. třídy a další medikamentózní léčbou.
Zásadní význam má léčba základního kardiálního postižení (například provedení revaskularizace myokardu, korekce závažné chlopenní vady, léčba srdeční insuficience aj.). Měla by platit zásada, že pacient s dokumentovanou komorovou tachykardií či s výrazně zvýšeným rizikem výskytu s-KTA je odeslán do specializovaného kardiologického centra, které je schopno zajistit tuto komplexní diagnostiku i léčbu včetně nových nefarmakologických metod.
Seznam použité literatury
- [1] Amiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomised trials. Lancet 1997; 350: 1417–1424.
- [2] Bristow MR, Saxon LA, Boehmer J, et al. Car-diac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350: 2140– 2150.
- [3] Buxton AE, Lee KL, Fisher JD, et al. A randomized study of the prevention of sudden cardiac death in patients with coronary artery disease. N Engl J Med 1999; 341: 1882–1890.
- [4] Bytešník J, Táborský M, Kautzner J, et al. Doporučené postupy pro diagnostiku a léčbu komorových arytmií. Cor Vasa 2005; 47 (Suppl): 41–57.
- [5] Cappato R. Secondary prevention of sudden death: The Dutch Study, the Antiarrhythmics versus Implantable Defibrillator Trial, the Cardiac Arrest Study Hamburg, and the Canadian Implantable Defibrillator Study. Am J Cardiol 1999; 83: 68D–73D.
- [6] Cappato R, Calkins H, Chen SA, et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation 2005; 111: 1100–1105.
- [7] Carlson MD, Ip J, Messenger J, et al. A new pacemaker algorithm for the treatment of atrial fibrillation: results of the Atrial Dynamic Overdrive Pacing Trial (ADOPT). J Am Coll Cardiol 2003; 20: 627–633.
- [81] Connolly SJ, Hallstrom AP, Cappato R, et al. Meta-analysis of the implantable cardioverter-defibrillator secondary prevention trials. Eur Heart J 2000; 21: 2071–2078.
- [9] Copie X, Piot O, Said MA, et al. Temporal and geographical trends in indications for implantation of cardiac defibrillators in Europe 1993–1998. PACE 2000; 23: 979–984.
- [10] Čihák R. Supraventrikulární arytmie. In: Kardiologie, ed. Aschermann M, et al. Praha, Galén, 2004.
- [11] Ermis C, Seutter R, Zhu AX, et al. Impact of upgrade to cardiac resynchronization therapy on ventricular arrhythmia frequency in patients with implantable cardioverter-defibrillators. J Am Coll Cardiol 2005; 46: 2258–2263.
- [12] Gulizia M, Mangiameli S, Chiaranda G, et al. Pharmacological and antitachycardia pacing hybrid therapy in sinus node disease patients improves quality of life and reduces symptoms and hospitalizations: preliminary results of the PITAGORA trial. Eur Heart J 2005; 25 (Abstr Suppl): 492.
- [13] Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659–666.
- [14] Haissaguerre M, Hocini M, Sanders P, et al. Catheter ablation of long-lasting persistent atrial fibrillation: clinical outcome and mechanisms of subsequent arrhythmias. J Cardiovasc Electrophysiol 2005; 16: 1138–1147.
- [15] Hayashi M, Tanaka K, Kato T, et al. Enhancing electrical cardioversion and preventing immediate reinitiation of hemodynamically deleterious atrial fibrillation with class III drug pretreatment. J Cardiovasc Electrophysiol 2005, 16: 740–747.
- [16] Heidenreich PA, Keeffe B, Mc Donald KM, Hlatky MA. Overview of randomized trials of antiar-rhythmic drugs and devices for the prevention of sudden cardiac death. Am Heart J 2002; 144: 422–430.
- [17] Hocini M, Sanders P, Jais P, et al. Techniques for currative treatment of atrial fibrillation. J Cardiovasc Electrophysiol 2004, 15: 1467–1471.
- [18] Lloyd MA, Hayes DL, Friedman PA. Clinically relevant basics of pacing and defibrillation. In: Cardiac pacing and defibrillation: a clinical ap-proach. Ed. Hayes DL, Lloyd MA, Friedman PA, Futura Publishing Company, Inc., Armonk, New York, 2000; 1– 51.
- [19] Mantovan R, Verlato R, Calzolari V, et al. Comparison between anatomical and integrated approaches to atrial fibrillation ablation: adjunctive role of electrical pulmonary vein disconnec-tion. J Cardiovasc Electrophysiol 2005; 16: 1293–1297.
- [20] MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT- HF). Lancet 1999; 353: 2001–2007.
- [21] Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillatorin patients with coronary disease at high risk for ventricular arrhythmia. N Engl J Med 1996; 335: 1933–1940.
- [22] Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002; 346: 877–883.
- [23] Pacifico A, Hohnloser S, Williams JH, et al. Prevention of implantable-defibrillator shocks by treatment with Sotalol. N Engl J Med 1999; 340: 1855–1862.
- [24] Padeletti L, Michelucci A, Pieragnoli P, Colella A. Atrial septal pacing: A new approach to prevent atrial fibrillation. PACE 2004; 27: 850–854.
- [25] Podrid PJ. Etiology and pathogenesis of atrial fibrillation. In: Atrial Fibrillation, ed. Kowey P, Naccarelli GV. Marcel Dekker, New York, 2005; 27–60.
- [26] Priori SG, Aliot E. Blomstrom-Lundqvist C, et al. Task Force on Sudden Cardiac Death, European Society of Cardiology. Europace 2002; 4: 3–18.
- [27] Reiffel JA. Drug choices in management of atrial fibrillation. Am J Cardiol 2000; 85: 12D–19D.
- [28] Reiffel JA. Maintenance of normal sinus rhythm with antiarrhythmic drugs. In: Atrial Fibrillation, ed. Kowey P, Naccarelli GV. Marcel Dekker, New York, 2005; 195– 217.
- [29] Roy D, Talajic M, Dorian P, et al. Amiodaron to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med 2000; 342: 913–920.
- [30] Saksena S, Prakash A, Biegler P, et al., for DAPPAF Investigators. Improved suppression of recurrent atrial fibrillation with dual-site right atrial pacing and antiarrhythmic drug therapy. J Am Coll Cardiol 2002; 40: 1140–1150.
- [31] Saksena S, Skadsberg N. Hybrid therapy as an alternative in refractory atrial fibrillation: When, why, and how? In: Cardiac Arrhythmias 2005. Ed. Raviele A., Springer-Verlag Italia 2006; 267–278.
- [32] Singer I, Guarnieri T, Kupersmith J. Implanted automatic defibrillators: effects of drugs and pacemakers. PACE 1988; 11: 2250–2262.
- [33] Táborský M, Kautzner J, Bytešník J, et al. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a srdeční resynchronizační léčbu (2005). Cor Vasa 2005; 47 (Suppl): 59–68.
- [34] Tojo H, Kumagai K, Noguchi H, et al. Hybrid therapy with Pilsicainide and pulmonary vein isolation for atrial fibrillation. Circ J 2005; 69: 1503–1507.