Krvácivé komplikace antikoagulační léčby
Souhrn:
Antikoagulační léčba je neoddělitelně spjata se zvýšeným rizikem krvácivých komplikací. V článku jsou popsány nejvýznamnější příčiny krvácivých komplikací u pacientů léčených nefrakcionovaným heparinem, nízkomolekulárním heparinem, antagonisty vitaminu K, dabigatranem a přímými perorálními inhibitory faktoru Xa včetně mnohočetných lékových interakcí warfarinu. Jsou uvedeny laboratorní testy hemostázy, které mohou být užitečné při určení role antikoagulancií v genezi krvácení. Článek se také zaměřuje na léčbu krvácivých komplikací antikoagulační léčby, shrnuje účinnost i nedostatky antidot dostupných v současné době. Je zdůrazněna role koncentrátů protrombinového komplexu v léčbě krvácivých komplikací u pacientů užívajících warfarin a význam idarucizumabu – specifického antidota dabigatranu –, který se stal v poslední době dostupným v České republice.
Key words: bleeding – anticoagulant therapy – heparin – warfarin – dabigatran – rivaroxaban – antidotes – PCC – idarucizumab.
Summary:
The anticoagulant therapy is inseparably accompanied by an increased risk of bleeding complications. The most prominent causes of bleeding complications in patients treated with unfractionated heparin, low molecular weight heparin, vitamin K antagonists, dabigatran and direct oral inhibitors of factor Xa are described in the article, including multiple drug interactions of warfarin. Laboratory tests of haemostasis, which can be useful for determination of the role of anticoagulant drugs in pathogenesis of bleeding, are mentioned. The article also focuses on the management of bleeding complications of anticoagulant therapy, reviewing the effectiveness and limits of antidotes, which are currently available. The role of prothrombin complex concentrates in treatment of bleeding complications in patients taking warfarin is pointed out as well as the importance of idarucizumab – a specific antidote of dabigatran, which became available in Czech Republic recently.
Úvod
Antikoagulační léčba uměle navozuje poruchu krevního srážení s cílem zabránit vzniku trombózy nebo zastavit progresi již existujícího trombu. Neoddělitelným důsledkem posunu koagulační rovnováhy navozeného antikoagulační léčbou je zvýšené riziko vzniku krvácivých komplikací, přičemž míra tohoto rizika je přímo úměrná intenzitě účinku antikoagulancia. K závažným krvácivým komplikacím tedy dochází nejčastěji při předávkování antikoagulancia nebo při traumatu u antikoagulovaného pacienta. Ke „klasickým“ antikoagulanciím (heparinová antikoagulancia a antagonisté vitaminu K) přibyly v posledních letech přímé inhibitory trombinu a aktivovaného faktoru X (FXa).
Krvácení při léčbě heparinovými antikoagulancii
Nefrakcionovaný heparin
Nefrakcionovaný heparin (unfractionated heparin, UFH) se u nás v posledních letech používá velmi málo (dominantně jako antikoagulans při použití mimotělního oběhu), a tak výrazně ubylo i krvácivých komplikací způsobených UFH. K předávkování může dojít při náhodném nebo při úmyslném podání vyšší dávky UFH. Laboratorní nález při předávkování je typický: prodloužení aktivovaného parciálního tromboplastinového času (activated partial thromboplastin time, APTT), trombinového času (thrombin time, TT) i protrombinového času; poměr APTT R (poměr času srážení testované plazmy a plazmy normální) je vyšší než 3,0 a zpravidla vyšší než protrombinový index. Při velkém předávkování může být APTT neměřitelný. K laboratornímu ověření předávkování UFH je možno použít korekční test s protaminem a k průkaz u i ke kvantifikaci předávkování slouží vyšetření aktivity inhibující FXa (anti-Xa). Referenční meze koagulačních testů využívaných při podezření na předávkování antikoagulancii si většinou stanovují laboratoře vyšetřením souboru zdravých dobrovolníků nebo jsou uvedeny v příbalovém letáku konkrétního reagencia. Obvyklé hodnoty referenčních mezí těchto testů jsou uvedeny v tab. 1.
u i ke kvantifikaci předávkování slouží vyšetření aktivity inhibující FXa (anti-Xa). Referenční meze koagulačních testů využívaných při podezření na předávkování antikoagulancii si většinou stanovují laboratoře vyšetřením souboru zdravých dobrovolníků nebo jsou uvedeny v příbalovém letáku konkrétního reagencia. Obvyklé hodnoty referenčních mezí těchto testů jsou uvedeny v tab. 1.
Při velkém krvácení v souvislosti s léčbou UFH je doporučeno použít jako antidotum protamin sulfát v dávce 1 mg protaminu na 100 jednotek UFH. V praxi v emergentních situacích je doporučeno podat 25 mg protaminu pomalu intravenózně (i.v.) během minimálně 5 minut a dávku při přetrvávajícím krvácení eventuálně zopakovat [1]. V současné době je u nás dostupný protamin hydrochlorid, u něhož je doporučeno při velkém krvácení podat 1 000 IU pomalu i.v. a dávku ev. opakovat do normalizace prodlouženého TT.
Nízkomolekulární hepariny
Nízkomolekulární hepariny (low molecular weight heparins, LMWH) jsou široce používány v profylaxi a v léčbě tromboembolické nemoci (TEN). Riziko krvácení je při jejich použití významně nižší než při léčbě UFH [2]. Jejich předávkování hrozí vzhledem k dominantně renálnímu vylučování především při podávání terapeutické dávky u osob s významným poklesem renálních funkcí. Opatrnosti je třeba zejména při poklesu glomerulární filtrace pod 30 ml/min [3]. U těchto pacientů je možno dávku LMWH empiricky snížit nebo adjustovat podle hodnoty anti-Xa měřené za 3–4 hodiny po aplikaci LMWH [1]. Podání profylaktické dávky LMWH nevede k předávkování ani u pacientů se selháním ledvin.
Při závažném krvácení u pacienta léčeného LMWH je doporučeno podat protamin v dávce 1 mg protamin sulfátu na 100 anti FXa IU LMWH; maximální jednotlivá dávka představuje podle Souhrnu údajů o přípravku 50 mg protaminu. V současné době je v České republice dostupný protamin hydrochlorid, v případě jeho použití je možno podat 1 000 IU pomalu i.v. Je třeba si však uvědomit, že protamin neutralizuje pouze větší molekuly LMWH a účinek inhibující FXa přetrvává, nicméně i tak je u většiny pacientů jeho klinický efekt patrný [4]. V několika kasuistikách [5–7] byl popsán velmi dobrý klinický účinek podání rekombinantního faktoru VIIa (Novoseven®) u pacientů s velkým krvácením při předávkování LMWH, v případě život ohrožujícího krvácení je tedy možno ho použít.
Krvácení při léčbě antagonisty vitaminu K
Antagonisté vitaminu K (vitamin K antagonists, VKA) jsou u nás reprezentováni warfarinem, v některých evropských zemích je používán acenokumarol nebo fenprokumon. Přestože je u nás warfarin v některých indikacích postupně nahrazován novými perorálními antikoagulancii, je stále v klinické praxi nejpoužívanějším antikoagulanciem. Antagonisté vitaminu K zabraňují recyklaci aktivní formy vitaminu K a po jejím vyčerpání dojde k omezení tvorby účinných koagulačních faktorů II, VII, IX, X a inhibitorů koagulace – proteinů C a S. Nevýhodami warfarinu jsou zejména vysoká interindividuální a intraindividuální variabilita účinku, úzké terapeutické okno, opožděný účinek a biotransformace, která vede k významným a mnohočetným lékovým interakcím. Naštěstí existuje dobrá korelace laboratorního a klinického účinku, takže laboratorní poddávkování je v klinice provázeno nedostatečnou účinností a zvýšeným rizikem trombotických komplikací, laboratorní předávkování je ukazatelem zvýšeného rizika krvácivých komplikací. Pro monitoraci účinku VKA se používá protrombinový (Quickův) test; vyjádření výsledku ve formě mezinárodního normalizovaného poměru (international normalized ratio, INR) přineslo možnost získat srovnatelné výsledky při použití různých přístrojů a reagencií. Zavedení této monitorace spolu se standardizovanými léčebnými protokoly podstatně zlepšilo kvalitu antikoagulační léčby [8].
Existuje řada prací zabývajících se rizikovými faktory krvácení při antikoagulační léčbě. Základním faktorem zvyšujícím riziko krvácení je vysoká intenzita antikoagulační léčby, dalšími samostatnými rizikovými faktory krvácení jsou: nedostatečně korigovaná hypertenze, prodělaná cévní mozková příhoda, závrativý syndrom při mozkové ateroskleróze, anamnéza krvácení do trávicího traktu, vysoký věk (některé studie toto nepotvrdily), renální selhání, současná léčba nesteroidními antirevmatiky a významná komorbidita (tři a více souběžných onemocnění). Ke krvácivým komplikacím dochází častěji v prvních třech měsících léčby a při vysoké variabilitě hodnoty INR [9–11]. Nestabilita antikoagulace zvyšuje nejen riziko velkého krvácení, ale i riziko vzniku trombózy a mortalitu [11].
Zvýšení účinku warfarinu při jeho nezměněném dávkování může být způsobeno nefarmakologickými faktory nebo lékovými interakcemi. Nejčastějšími nefarmakologickými příčinami předávkování jsou horečnatá onemocnění, průjem, snížený příjem potravy a požití většího množství alkoholu.
Existuje několik mechanismů lékových interakcí, z nichž nejvýznamnější je ovlivnění biotransformace S warfarinu. Jeho odbourávání se uskutečňuje především prostřednictvím cytochromu P450 – izoenzymu CYP2C9, méně významný je podíl CYP3A4. Z hlediska vzniku krvácivých komplikací jsou tedy nejnebezpečnější enzymatické inhibitory, které blokují CYP2C9; po jejich podání dochází s každou další dávkou warfarinu k výraznému zvyšování koncentrace jeho S izomeru, a tedy k prohlubování antikoagulačního účinku warfarinu. Známou zkušeností je rychle vzniklé a často nebezpečné předávkování warfarinu po zahájení léčby cotrimoxazolem, fluconazolem, metronidazolem, capecitabinem nebo amiodaronem [12,13]. Inhibitorům CYP2C9 je proto vhodné se při léčbě warfarinem raději vyhnout a nahradit je jinými léky. V případě, že je léčba těmito přípravky nezbytná, a podávat je tedy (nejčastěji amiodaron nebo capecitabin) musíme, je nutno od prvního dne snížit dávku antikoagulancia přibližně na 70 % a pečlivě kontrolovat INR, zpočátku nejméně dvakrát týdně.
Induktory syntézy cytochromu P450, mezi něž patří především barbituráty, carbamazepin, fenytoin, griseofulvin, rifampicin, rifabutin a třezalka tečkovaná, vedou k urychlenému odbourávání warfarinu, a tedy ke snížení účinnosti léčby. Krvácivými komplikacemi je pacient ohrožen po jejich vysazení, kdy dochází k obnovení původní účinnosti warfarinu. Je proto důležité, aby po zahájení i ukončení léčby enzymatickými induktory byl po dobu několika týdnů zvýšen počet kontrol INR na frekvenci zhruba jedenkrát týdně – dávku warfarinu je pak nutno včas upravovat podle zjištěných hodnot [14,15].
Další skupinou léčiv, jež způsobují při současném užívání významné předávkování warfarinu, jsou fibráty, které působí komplexním farmakodynamickým mechanismem [16].
Zvláštní pozornost je třeba při léčbě warfarinem věnovat nesteroidním antiflogistikům (NSA). Některá z nich (piroxicam a jeho deriváty, fenylbutazon, ibuprofen, vysoké dávky salicylátů) významně zvyšují antikoagulační účinek warfarinu a měli bychom se jim raději vyhnout. Kromě selektivních inhibitorů COX 2 (cyklooxygenáza 2) mají všechna NSA ulcerogenní účinek na žaludeční a duodenální sliznici, což u pacientů léčených warfarinem významně zvyšuje riziko krvácení do gastrointestinálního traktu [17]. Ulcerogennímu působení NSA a krvácení z horní části trávicího traktu lze účinně bránit současným podáváním inhibitorů protonové pumpy [18]. Jejich podání je tedy nezbytné u pacientů léčených warfarinem v kombinaci s NSA, ale také u pacientů užívajících současně warfarin a kyselinu acetylsalicylovou, kterých v poslední době významně přibývá v důsledku častého zavádění koronárních stentů.
Léčba krvácivých komplikací u pacientů léčených warfarinem musí být individualizována podle závažnosti krvácení, podle aktuální hodnoty INR a podle nezbytnosti antikoagulační léčby vyplývající z její původní indikace. Kromě lokálního stavění krvácení, k němuž musíme přistoupit vždy, když je to možné, máme čtyři možnosti, jak omezit, případně zrušit koagulopatii navozenou warfarinem:
- Přerušení antikoagulační léčby, od něhož lze očekávat odeznění účinku warfarinu během několika dní.
- Podání vitaminu K, od něhož lze očekávat odeznění účinku warfarinu do několika hodin. Tento postup tedy sám o sobě nestačí ke zvládnutí masivního, život ohrožujícího krvácení. Použití vysokých dávek vitaminu K (více než 10 mg) mívá za následek navození rezistence na warfarin trvající několik dní až několik týdnů, a je tedy třeba se mu vyhnout zejména u pacientů s umělými chlopněmi, s nedávnou anamnézou plicní embolie nebo s recidivujícími tromboembolickými příhodami.
- Dodání chybějících faktorů koagulační kaskády buď formou čerstvě zmražené plazmy, nebo v podobě koncentrátu vitamin K dependentních koagulačních faktorů. Podání koncentrátu koagulačních faktorů – koncentrátů protrombinového komplexu (PCC) – je podstatně účinnější [19–21]. Tento postup volíme vždy při nutnosti co nejrychlejšího zrušení antikoagulačního účinku warfarinu, tedy při masivním krvácení nebo při přípravě k urgentní operaci.
- Podání rekombinantního aktivovaného faktoru VIIa. Tento postup je zatím používán vzhledem k ekonomické náročnosti spíše výjimečně. Pokud je podán současně s PCC, může zvyšovat riziko vzniku trombotických komplikací [22].
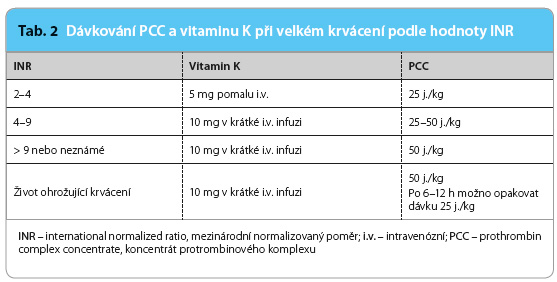
Při výskytu velkého krvácení tedy u pacienta léčeného warfarinem vždy přerušíme podávání warfarinu, lokálně stavíme krvácení, pokud je to možné, a podáváme PCC a vitamin K v množství podle aktuální hodnoty INR (tab. 2). Stejné dávkování PCC (zpravidla bez vitaminu K) je doporučeno při přípravě pacienta k urgentní operaci, ke které je možno přistoupit prakticky okamžitě po podání PCC.
Krvácení při léčbě dabigatranem
Dabigatran je zatím jediným perorálně podávaným přímým inhibitorem trombinu. Mechanismus jeho účinku je jednoduchý – váže se k aktivnímu místu trombinu a tím ho inhibuje. Používá se v profylaxi TEN po endoprotéze kyčelního a kolenního kloubu, v léčbě TEN a v profylaxi systémové embolizace při fibrilaci síní. Má široké terapeutické okno a málo lékových interakcí. Vzhledem k jednoduchému mechanismu účinku existuje jen malá interindividuální variabilita účinku, léčba dabigatranem nemusí být tedy monitorována. Pro orientační ověření účinku je možno použít APTT a TT, které jsou oba významně prodloužené, přičemž prodloužení TT je větší než prodloužení APTT. Významně prodloužený je ekarinový koagulační čas, jehož měření se však ve většině laboratoří neprovádí. V případě potřeby je možno koncentraci dabigatranu změřit nepřímo testem založeným na dilutovaném trombinovém testu (DTI Hemoclot) [23].
Ke krvácivým komplikacím dochází nejčastěji v souvislosti s narušením integrity cévního řečiště, k předávkování může dojít v důsledku kumulace při poklesu renálních funkcí nebo vzácně při interakcích s užívanými léky. Vzhledem k dominantně renálnímu vylučování dabigatranu je jeho podávání kontraindikováno při poklesu glomerulární filtrace pod 30 ml/min. Je však třeba opatrnosti i u osob s chorobami ledvin a s glomerulární filtrací vyšší než 30 ml/min, neboť při interkurentním onemocnění a zejména při dehydrataci je riziko dalšího poklesu renálních funkcí, a tedy i kumulace dabigatranu vysoké. Lékové interakce nejsou četné, ale je třeba na ně pamatovat. Kontraindikována je současná léčba ketoconazolem, itraconazolem, cyklosporinem, tacrolimem a dronedaronem, opatrnost, resp. snížení dávky dabigatranu se doporučuje při léčbě verapamilem a amiodaronem.
Při velkém krvácení při léčbě dabigatranem je nutno vyvinout maximální snahu o lokální stavění krvácení, je třeba dbát na udržení krevního oběhu – zejména s ohledem na zachování dostatečné perfuze ledvin. Naštěstí je již dostupné účinné antidotum – idarucizumab. Jde o FAB fragment humanizované monoklonální protilátky proti dabigatranu. Účinek byl ověřen ve studii RE VERSE [24] jak u pacientů s velkým krvácením, tak u pacientů, které bylo nutno připravit k urgentní operaci. Bylo prokázáno velmi rychlé zrušení účinku dabigatranu po podání idarucizumabu s velmi dobrým klinickým efektem. U osob s renální insuficiencí je vylučování idarucizumabu prodloužené, což je výhodné z důvodu prodlouženého vylučování dabigatranu [25]. V praxi je doporučeno u pacientů léčených dabigatranem podat při velkém krvácení nebo před urgentní operací 5 g idarucizumabu rozdělených do dvou dávek po 2,5 g aplikovaných v pomalé i.v. injekci nebo v rychlé i.v. infuzi. Při momentální nedostupnosti idarucizumabu je možno podat PCC nebo aktivovaný PCC v dávce 50 j./kg [26].
Krvácení při léčbě přímými perorálními inhibitory FXa
Rivaroxaban a apixaban jsou zatím jedinými u nás používanými přímými perorálními inhibitory FXa. Používají se v profylaxi TEN po endoprotéze kyčelního a kolenního kloubu, v léčbě TEN a v profylaxi systémové embolizace při fibrilaci síní [27,28]. Nízká dávka rivaroxabanu byla ověřena jako účinná u pacientů po akutním koronárním syndromu [29], v této indikaci však u nás dosud není stanovena úhrada ze zdravotního pojištění. Rivaroxaban a apixaban mají podobně jako dabigatran široké terapeutické okno a jejich účinek není nutno laboratorně monitorovat. Pro orientační ověření účinku dobře poslouží vyšetření anti-Xa, kdy terapeutické dávky vedou k vyšším hodnotám, než jaké bývají naměřeny při léčbě LMWH. Na rozdíl od dabigatranu neprodlužují přímé perorální inhibitory FXa trombinový čas, bývá pozorováno mírné prodloužení APTT i protrombinového času v období maximální koncentrace antikoagulancií. V případě potřeby je možno stanovit jejich koncentraci nepřímo testem založeným na měření anti-Xa kalibrovaným na rivaroxaban nebo na apixaban [23].
Ke krvácivým komplikacím dochází především v souvislosti s narušením integrity cévního řečiště, k předávkování může dojít vzácně v důsledku kumulace při poklesu renálních funkcí nebo v důsledku lékových interakcí. Na rozdíl od dabigatranu je podíl renálního vylučování u obou inhibitorů FXa menší, riziko kumulace při snížení renálních funkcí je tedy podstatně nižší. Jejich podávání je kontraindikováno při poklesu glomerulární filtrace pod 15 ml/min. Vzhledem k diverzitě vylučování a biotransformace jsou lékové interakce málo četné, ale i tak je nutno na ně myslet. Kontraindikováno je současné podávání azolových antimykotik (kromě fluconazolu) a inhibitorů HIV proteáz.
Pro léčbu krvácivých komplikací bylo vyvinuto antidotum inhibitorů FXa – andexanet. Jde o rekombinantní molekulu FXa modifikovanou tak, aby ztratila své prokoagulační vlastnosti. Po jejím podání dochází k vyvázání inhibitorů FXa a k jejich neutralizaci [30]. Účinek andexanetu byl ověřen ve studiích se zdravými dobrovolníky [31]. Andexanet zatím bohužel není dostupný pro klinické použití. V malé randomizované studii se zdravými dobrovolníky byl demonstrován účinek PCC v dávce 50 j./kg na normalizaci koagulačních poměrů alterovaných podáním rivaroxabanu [32].
Při velkém krvácení u pacientů léčených rivaroxabanem nebo apixabanem je tedy nutno vyvinout maximální úsilí k lokálnímu stavění krvácení, namístě je podání antifibrinolytik (kyseliny tranexamové), snaha o udržení cirkulujícího volumu, podání fibrinogenu v případě poklesu jeho sérové koncentrace pod 2 g/l. Vzhledem k nedostupnosti andexanetu a dostupnosti PCC je navrhováno podání PCC v dávce 50 j./kg, byť bez přímých důkazů o účinnosti u těchto pacientů [33].
Seznam použité literatury
- [1] Smythe MA, Priziola J, Dobesh PP, et al. Guidance for the practical management of the heparin anticoagulants in the treatment of venous thromboembolism. J Thromb Thrombolysis 2016; 41: 165–186.
- [2] Erkens PM, Prins MH. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism.Cochrane Database Syst Rev 2010; CD001100. doi: 10.1002/14651858.CD001100.pub3.
- [3] Lim W, Dentali F, Eikelboom JW, Crowther MA. Meta‑analysis: low‑molecular‑weight heparin and bleeding in patients with severe renal insufficiency. Ann Intern Med 2006; 144: 673–684.
- [4] van Veen JJ, Maclean RM, Hampton KK, et al. Protamine reversal of low molecular weight heparin: clinically effective? Blood Coagul Fibrinolysis 2011; 22: 565–570.
- [5] Ng HJ, Koh LP, Lee LH. Successful control of postsurgical bleeding by recombinant factor VIIa in a renal failure patient given low molecular weight heparin and aspirin. Ann Hematol 2003; 82: 257–258.
- [6] Wang CH, Chen YC, Tsao CW, Yang SS. Dalteparin‑associated catastrophic retroperitoneal hematoma successfully treated with recombinant factor VIIa. Int Urol Nephrol 2012; 44: 1091–1095.
- [7] Cherfan A, Arabi Y, Al Askar A, Al Shimemeri A. Recombinant activated factor VII treatment of retroperitoneal hematoma in a patient with renal failure receiving enoxaparin and clopidogrel. Pharmacotherapy 2007; 27: 755–759.
- [8] Phillips WS, Smith J, Greaves M, et al. An Evaluation and Improvement Program for Inpatient Anticoagulant Control. Thromb Haemost 1997; 77: 283–288.
- [9] Fihn SD, McDonell M, Martin D, et al. Risk factors of complications of chronic anticoagulation. Ann Intern Med 1993; 118: 511–520.
- [10] Fihn SD, Callahan CM, Martin DC, et al. The Risk for and Severity of Bleeding Complications in Elderly Patients Treated with Warfarin. Ann Intern Med 1996; 124: 970–979.
- [11] Currie CJ, McEwan P, Emmas C, et al. Anticoagulation in patients with non‑valvular atrial fibrillation: an evaluation of stability and early factors that predict longer‑term stability on warfarin in a large UK population. Curr Med Res Opin 2005; 21: 1905–1913.
- [12] Harder S, Thurmann P. Clinically important drug interactions with anticoagulants. An Update. Clin Pharmacokinet 1996; 30: 416–444.
- [13] Kessler P. Porovnání warfarinu a nových antitrombotik z hlediska lékových interakcí. Klin Farmakol Farm 2012; 26: 74–78.
- [14] Mannheimer B, Andersson ML, Järnbert‑Pettersson H, Lindh JD. The effect of carbamazepine on warfarin anticoagulation: a register‑based nationwide cohort study involving the Swedish population. J Thromb Haemost 2016; 14: 765–771.
- [15] Martins MA, Reis AM, Sales MF, et al. Rifampicin‑warfarin interaction leading to macroscopic hematuria: a case report and review of the literature. BMC Pharmacol Toxicol 2013; 14: 27.
- [16] Dixon DL, Williams VG. Interaction between gemfibrozil and warfarin: case report and review of the literature. Pharmacotherapy 2009; 29: 744–748.
- [17] Shorr RI, Ray WA, Daughert JR, et al. Concurrent use of nonsteroidal anti‑inflamatory drugs and oral anticoagulants places elderly persons at high risk for haemorrhagic peptic ulcer disease. Arch Intern Med 1993; 153: 1665–1670.
- [18] Massó González EL, García Rodríguez LA. Proton pump inhibitors reduce the long‑term risk of recurrent upper gastrointestinal bleeding: an observational study. Aliment Pharmacol Ther 2008; 28: 629–637.
- [19] Karaca MA, Erbil B, Ozmen MM. Use and effectiveness of prothrombin complex concentrates vs fresh frozen plasma in gastrointestinal hemorrhage due to warfarin usage in the ED. Am J Emerg Med 2014; 32: 660–664.
- [20] Frontera JA, Gordon E, Zach V, et al. Reversal of coagulopathy using prothrombin complex concentrates is associated with improved outcome compared to fresh frozen plasma in warfarin‑associated intracranial hemorrhage. Neurocrit Care 2014; 21: 397–406.
- [21] Yanamadala V, Walcott BP, Fecci PE, et al. Reversal of warfarin associated coagulopathy with 4‑factor prothrombin complex concentrate in traumatic brain injury and intracranial hemorrhage. J Clin Neurosci 2014; 21: 1881–1884.
- [22] Barton CA, Johnson NB, Case J, et al. Risk of thromboembolic events after protocolized warfarin reversal with 3‑factor PCC and factor VIIa. Am J Emerg Med 2015; 33: 1562–1566.
- [23] Kitchen S, Gray E, Mackie I, et al. Measurement of non‑coumarin anticoagulants and their effects on tests of Haemostasis: Guidance from the British Committee for Standards in Haematology. Br J Haematol 2014; 166: 830–841.
- [24] Pollack CV Jr, Reilly PA, Eikelboom J, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511–520.
- [25] Glund S, Stangier J, van Ryn J, et al. Effect of Age and Renal Function on Idarucizumab Pharmacokinetics and Idarucizumab‑Mediated Reversal of Dabigatran Anticoagulant Activity in a Randomized, Double‑Blind, Crossover Phase Ib Study. Clin Pharmacokinet 2016 Jun 17 [Epub ahead of print].
- [26] Grottke O, Aisenberg J, Bernstein R, et al. Efficacy of prothrombin complex concentrates for the emergency reversal of dabigatran‑induced anticoagulation. Crit Care 2016; 20: 115.
- [27] Patel A, Goddeau RP Jr, Henninger N. Newer Oral Anticoagulants: Stroke Prevention and Pitfalls. Open Cardiovasc Med J 2016; 10: 94–104.
- [28] Becattini C, Agnelli G. Treatment of Venous Thromboembolism With New Anticoagulant Agents. J Am Coll Cardiol 2016; 67: 1941–1955.
- [29] Mega JL, Braunwald E, Murphy SA, et al. Rivaroxaban in patients stabilized after a ST‑segment elevation myocardial infarction: results from the ATLAS ACS‑2‑TIMI‑51 trial (Anti‑Xa Therapy to Lower Cardiovascular Events in Addition to Standard Therapy in Subjects with Acute Coronary Syndrome‑Thrombolysis In Myocardial Infarction‑51). J Am Coll Cardiol 2013; 61: 1853–1859.
- [30] Lu G, DeGuzman FR, Hollenbach SJ, et al. A specific antidote for reversal of anticoagulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med 2013; 19: 446–451.
- [31] Siegal DM, Curnutte JT, Connolly SJ, et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med 2015; 373: 2413–2424.
- [32] Eerenberg ES, Kamphuisen PW, Sijpkens MK, et al. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo‑controlled, crossover study in healthy subjects. Circulation 2011; 124: 1573–1579.
- [33] Majeed A, Schulman S. Bleeding and antidotes in new oral anticoagulants. Best Pract Res Clin Haematol 2013; 26: 191–202.