Léčba časných stadií roztroušené sklerózy mozkomíšní
Roztroušená skleróza je chronické autoimunitní demyelinizační a neurodegenerativní onemocnění centrálního nervového systému. Od časných stadií nemoci probíhají procesy, které vedou k poměrně rychlé ztrátě funkce neuronů ústící v ireverzibilní postižení korelující s trvalým neurologickým deficitem a invaliditou nemocného. Agresivní autoimunitní zánět a současně probíhající zánik axonů a dalších nervových struktur právě v nejranějších obdobích onemocnění výrazně ovlivňují dlouhodobou prognózu a vyžadují terapeutický zásah se snahou zachovat funkčnost a bránit definitivním změnám. Časným stadiem roztroušené sklerózy rozumíme klinicky izolovaný syndrom a první měsíce klinicky definitivní roztroušené sklerózy. Řada klinických studií se zabývala efektem léků modifikujících průběh choroby v časných stadiích a prokázala, že včasnou léčbou v době prvních příznaků je možné zásadně ovlivnit další průběh. Také současně probíhající klinické zkoušky hledají nadějné látky s jinými mechanismy účinků, další probíhají se záměrem najít jednoznačné prognostické faktory, které by určily další průběh onemocnění, a tím definovaly intenzitu léčby.
Úvod
Roztroušená skleróza mozkomíšní (RS) je chronické autoimunitní, zánětlivé, demyelinizační a neurodegenerativní onemocnění centrálního nervového systému (CNS). V etiopatogenezi, která není známá v celém rozsahu, sehrává klíčovou roli autoimunitní imunopatologická aktivita, která je charakterizována jako zhroucení imunitní tolerance závislé na genetické dispozici, spouštěcích faktorech zevního prostředí a na poruše imunitní regulace [1]. Celosvětově přijatá základní definice charakterizuje RS jako onemocnění diseminované v prostoru (mozek a 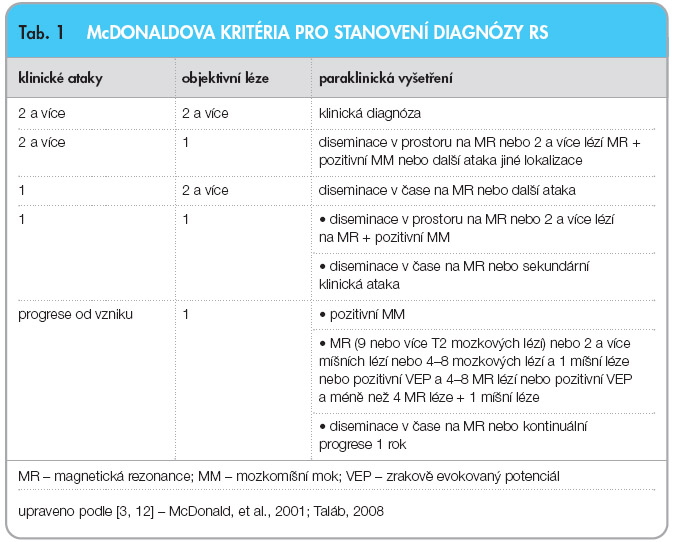 mícha) a v čase. Vychází z klinického popisu nemoci a zdůrazňuje chronicitu průběhu. K podrobnější diagnostice, kategorizaci průběhu nemoci a také pro výzkum účinné léčby v rámci klinických studií musel být klinický průběh podpořen paraklinickými metodami. Kvalitativní změnu a průlom v posouzení autoimunitních a degenerativních pochodů v CNS přineslo vyšetření magnetickou rezonancí (MR) a vyšetření mozkomíšního moku. Dřívější klinická kritéria, formulovaná Schumacherem v roce 1965, doplnil Poser v roce 1983 [2]; po mnoha diskusích a revizích s využitím dalších poznatků a nálezů pak byla definována nová diagnostická kritéria. Největší praktický význam pro klinickou léčbu i výzkum mají McDonaldova kritéria z roku 2001 [3] a jejich revize, kterou učinil Polman v roce 2005 [4], viz tab. 1.
mícha) a v čase. Vychází z klinického popisu nemoci a zdůrazňuje chronicitu průběhu. K podrobnější diagnostice, kategorizaci průběhu nemoci a také pro výzkum účinné léčby v rámci klinických studií musel být klinický průběh podpořen paraklinickými metodami. Kvalitativní změnu a průlom v posouzení autoimunitních a degenerativních pochodů v CNS přineslo vyšetření magnetickou rezonancí (MR) a vyšetření mozkomíšního moku. Dřívější klinická kritéria, formulovaná Schumacherem v roce 1965, doplnil Poser v roce 1983 [2]; po mnoha diskusích a revizích s využitím dalších poznatků a nálezů pak byla definována nová diagnostická kritéria. Největší praktický význam pro klinickou léčbu i výzkum mají McDonaldova kritéria z roku 2001 [3] a jejich revize, kterou učinil Polman v roce 2005 [4], viz tab. 1.
Poznámky k patogenezi
V patogenezi se promítají zánětlivé i neurodegenerativní pochody, které probíhají již od časných stadií nemoci [5]. Čerstvé výzkumy neuropatologických změn se zabývají souhrou mezi mechanismy poškození a reparace nervové tkáně. Histopatologické nálezy nekorespondují jen s fokálním zánětlivým postižením bílé hmoty, ale jde také o difuzní zánět následovaný axonálním poraněním, který je prokazatelný i v normálně vypadající bílé hmotě. Axonální léze je základní komponentou patologie RS a jeví se rozhodující v klinickém výsledku. Axony jsou zvlášť citlivé na zranění ve fázi ztráty myelinových obalů. Fokální léze jsou ohraničeny velmi ostrou hranicí od normálně myelinizované okolní tkáně a jsou infiltrované imunitními buňkami, zvláště CD4+ a CD8+ T buňkami, které se však mohou nacházet, byť v menší míře, také v lézích chronických. Zánět v dalších fázích onemocnění – v době progrese – není již omezen ložiskově, ale je odpovědný za rozptýlený vzorec tkáňového postižení nervového systému jako celku. Změny pak ústí v gliální jizvu generovanou aktivovanými astrocyty. Jizvy jsou viditelné makroskopicky a odpovídají změnám popsaným již Jeanem M. Charcotem v 19. století, který je nazval „sklerózou“. Obdobné strukturální změny jsou přítomny v šedé hmotě, objevují se více v sekundárně progresivní fázi a u primárně progresivního průběhu RS. Mechanismus kortikální demyelinizace není jasný, může souviset s přítomností meningeálních útvarů, jež se podobají folikulům a obsahují B buňky.
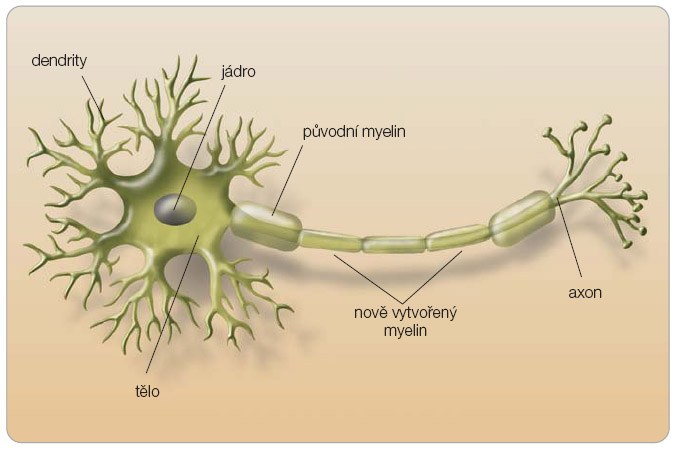 Remyelinizace reprezentuje důležitý mechanismus reparace tkáně a objevuje se již v časném období rozvíjejícího se postižení v bílé i šedé hmotě. V akutních lézích se oligodendrocyty, které vytvářejí nový myelin, nacházejí v blízkosti aktivovaných T buněk a makrofágů destruujících myelin. Naproti tomu ve starších ložiscích, kde je zánětlivá aktivita minimální, jsou sice oligodendrocyty přítomny, ale nejsou všechny zapojeny do aktivní remyelinizace. Některé léze mohou být kompletně remyelinizovány, ale nový myelin je tenčí a má kratší internodia [6], viz obr. 1. Rozsah remyelinizace se zdá být největší v kortikálních lokalitách a v ložiscích dále od mozkových komor [7]. Průběh remyelinizace se různí mezi jednotlivými ložisky u jednoho nemocného, ale i mezi jednotlivci s RS. Důvod jasný není, ale je prokazatelná absence oligodendrocytů nebo jejich prekurzorů. Zásadní rozdíl v reparačních pochodech je dán délkou trvání a fází nemoci.
Remyelinizace reprezentuje důležitý mechanismus reparace tkáně a objevuje se již v časném období rozvíjejícího se postižení v bílé i šedé hmotě. V akutních lézích se oligodendrocyty, které vytvářejí nový myelin, nacházejí v blízkosti aktivovaných T buněk a makrofágů destruujících myelin. Naproti tomu ve starších ložiscích, kde je zánětlivá aktivita minimální, jsou sice oligodendrocyty přítomny, ale nejsou všechny zapojeny do aktivní remyelinizace. Některé léze mohou být kompletně remyelinizovány, ale nový myelin je tenčí a má kratší internodia [6], viz obr. 1. Rozsah remyelinizace se zdá být největší v kortikálních lokalitách a v ložiscích dále od mozkových komor [7]. Průběh remyelinizace se různí mezi jednotlivými ložisky u jednoho nemocného, ale i mezi jednotlivci s RS. Důvod jasný není, ale je prokazatelná absence oligodendrocytů nebo jejich prekurzorů. Zásadní rozdíl v reparačních pochodech je dán délkou trvání a fází nemoci.
Axonální postižení se zdá být nejdůležitější komponentou patologie RS a objevuje se nejen v aktivních zánětlivých lézích, ale také v demyelinizovaných ložiscích, v normálně vypadající bílé hmotě infiltrované imunitními buňkami a v kůře mozkové. Rozsah axonálního postižení je determinantou klinického nálezu a symptomatologie. Kritickým krokem v dosažení efektivní remyelinizace je diferenciace prekurzorů oligodendrocytů na zralé buňky. Jedním z faktorů, který brání těmto pochodům, je myelinová drť uvnitř ložiska. Proto jsou důležité úklidové reakce, především funkce makrofágů s jejich schopností odstraňovat poškozené části myelinu a tím facilitovat diferenciaci prekurzorů. Tyto poznatky představují slibné terapeutické cíle na podporu remyelinizace a možné limitace ireverzibilního postižení [8].
Odůvodnění časné intervence a nutnost včasné léčby
Histopatologické studie demonstrují přítomnost axonální transsekce u nemocných s trváním RS méně než 5 let a zvláště pak během prvních 12 měsíců. Počet relapsů během prvních roků nemoci je v relaci k reziduálním neurologickým příznakům a k narůstajícímu trvalému postižení. Stejně tak longitudinální studie sledující vývoj MR nálezů u pacientů s prvními projevy nemoci ukazují, že dokonce i velmi malý počet lézí na MR je spojen s významným rizikem rozvoje dalšího relapsu a v prvních pěti letech koreluje s vývojem klinického postižení v dlouhodobé prognóze. Co se stane velmi brzy na počátku onemocnění, má důležitý vliv na rozvoj neurologického deficitu v dlouhodobém průběhu. Výsledky klinických studií a výzkumů potvrzují, že je nutno vybrat ten nejvhodnější čas v raném stadiu autoimunitního procesu a zahájit léčbu [9, 10]. Tímto se mění postoj k terapeutickému algoritmu a celosvětově převažuje snaha o zahájení terapie léky modifikujícími průběh onemocnění (disease-modifying drugs, DMD) již v prvním roce choroby. Intenzivní hledání léčiv a časování terapeutického zásahu je spojeno s usilovným výzkumem včetně studia těchto procesů na molekulární úrovni. Léčba RS by měla od počátku sestávat nejen z protizánětlivých a imunomodulačních léčiv, která ovlivňují dlouhodobý průběh choroby, ale současně i z neuroprotektivních preparátů [5].
Časná stadia RS a jejich léčba
Začátek rozvoje autoimunitní patologie v CNS není znám, první prezentaci klinickou, neurologicky postihnutelnou, představuje klinicky izolovaný syndrom (CIS, clinically isolated syndrom). Následuje různě dlouhé období rozvoje dalších příznaků a vývoj klinicky definitivní diagnózy RS (CDMS, clinically definite multiple sclerosis) podle kritérií McDonaldových a Polmanových [3, 4]. Takových pacientů je zpočátku 80–85 %, zbytek pacientů má primárně progresivní a progresivně relabující průběh onemocnění [11].
Klinicky izolovaný syndrom
Je charakterizován jako výskyt prvních neurologických obtíží, které jsou podezřelé z možnosti rozvinutí RS. Jde o projev klinický, neurologicky se subjektivními potížemi pacienta a s objektivním neurologickým nálezem. Ke stanovení diagnózy musí být provedena podstatná paraklinická vyšetření – především MR mozku, míchy, vyšetření moku mozkomíšního a elektrofyziologické vyšetření (evokované potenciály) [12]. Získáme informace o současném nálezu – diseminaci v prostoru, ale většinou nelze s jistotou rozhodnout, jak dlouho již subklinický vývoj probíhá a jak velká je pravděpodobnost rozvoje CDMS – diseminace v čase [13]. Snahou je najít prognostické faktory, které by predikovaly intenzitu a další průběh onemocnění a jednoznačně by určily druh léčby [14–16]. Musíme vzít v úvahu fakt, že v současné době nemáme léčiva, která by postihla degenerativní složku a ovlivnila difuzní zánět za uzavřenou hematoencefalickou bariérou. Musíme proto využít všech možností, abychom léčebně zasáhli v době první fáze, kdy předejdeme generalizaci zánětlivého a degenerativního procesu [17]. Probíhají diskuse o tom, kdy je časná léčba skutečně účinná a nutná, v které době je nutné zasáhnout. Autoři souhlasí s nutností léčit „včas“, ale vzhledem k neznalosti jednoznačného prognostického faktoru je doba a způsob léčby stále předmětem polemik. Z klinické praxe, potvrzené výsledky klinických studií, jednoznačně vyplývá, že zbytečné oddálení léčby hrozí ztrátou terapeutického intervalu, ve kterém dokážeme pozitivně ovlivnit dlouhodobý vývoj nemoci (obr. 2). V Evropské unii byly zaregistrovány léky pro terapii CIS a pacienti s předpokládaným vysokým rizikem vzniku CDMS jsou jimi běžně léčeni. Také v České republice došlo k významné změně v indikačních kritériích a od května 2009 je pro léčbu CIS registrován interferon b-1b. Toto léčivo je nyní určeno také pro léčbu pacientů s jedinou demyelinizační příhodou s aktivním zánětlivým procesem, která byla natolik závažná, že k léčbě bylo nutné podat intravenózně kortikoidy. U těchto pacientů byla vyloučena jiná možná diagnóza a bylo u nich stanoveno vysoké riziko klinicky definitivní roztroušené sklerózy [25].
Klinicky definitivní RS
Klinicky definitivní RS je již jednoznačně definovaná. Mimo léky symptomatické se používají v dlouhodobé terapii DMD jako léky první volby – interferony b-1a, -1b (IFN-b-1a, -1b) a glatirameracetát (GA) [18, 19], viz tab. 2. Léky druhé volby představují natalizumab a intravenózní imunoglobuliny (IVIG) [19, 20]. Jsou zpracovány i algoritmy léčby při selhání DMD k eskalaci a optimalizaci léčby [19]. V souladu se znalostmi patogeneze platí zásada léčit včas, s cílem ochránit co nejvíce axonů a nervových buněk. Řečeno s E. Havrdovou, doslova „boj o každý axon“ vystihuje naléhavost potřeby začít léčit co nejdříve a tímto zabránit progresi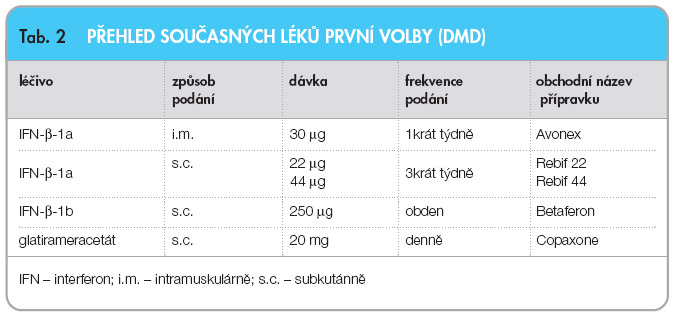 nemoci a trvalému neurologickému deficitu. Tím zásadnější překážku účinné terapie pak představuje skutečnost, že kritéria pro použití DMD jako léků první volby jsou v České republice stále ještě modifikována smlouvou se zdravotními pojišťovnami. Ta podmiňuje léčbu DMD prokázáním 2 klinických atak u pacienta za rok nebo 3 atak za 2 roky. Diseminace zánětlivých ložisek v čase potvrzená aktivitou při vyšetření pomocí MR je ovšem dostatečným průkazem k indikaci DMD a měla by být signálem k zahájení včasné a účinné léčby roztroušené sklerózy mozkomíšní.
nemoci a trvalému neurologickému deficitu. Tím zásadnější překážku účinné terapie pak představuje skutečnost, že kritéria pro použití DMD jako léků první volby jsou v České republice stále ještě modifikována smlouvou se zdravotními pojišťovnami. Ta podmiňuje léčbu DMD prokázáním 2 klinických atak u pacienta za rok nebo 3 atak za 2 roky. Diseminace zánětlivých ložisek v čase potvrzená aktivitou při vyšetření pomocí MR je ovšem dostatečným průkazem k indikaci DMD a měla by být signálem k zahájení včasné a účinné léčby roztroušené sklerózy mozkomíšní.
Výsledky klinických studií, které potvrzují nutnost léčby RS v časném stadiu
Klinické studie, které zkoumaly terapii DMD u CIS, ukázaly zásadní rozdíl při sledování klinického průběhu RS a vývoje změn na MR. Mimoto zkoumaly efekt léčby na vývoj klinické aktivity, oddálení vzniku CDMS. Jde o tyto studie:•
-
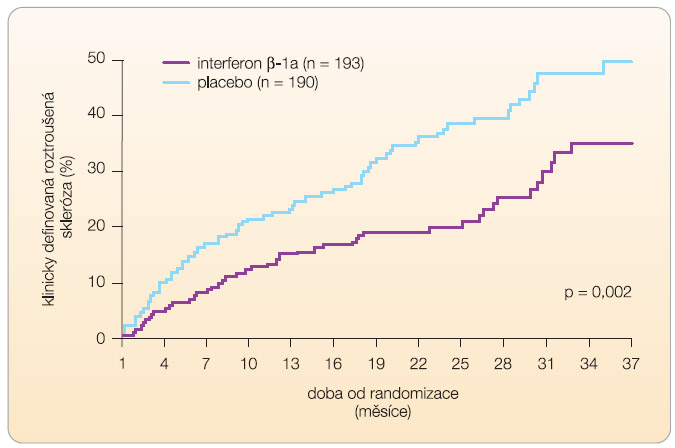 Controlled High-Risk Subjects Avonex Multiple Sclerosis Prevention Study (CHAMPS)
Controlled High-Risk Subjects Avonex Multiple Sclerosis Prevention Study (CHAMPS)
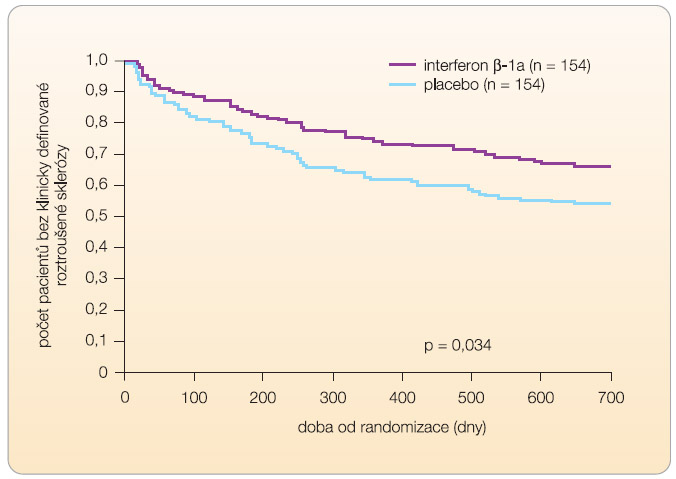
Byli zařazeni pacienti s CIS, při vyšetření mozku magnetickou rezonancí (MR) měli nejméně 2 T2 léze a byli léčeni IFN-b-1a 1krát týdně 30 mg intramuskulárně nebo placebem. Studie prokázala účinek IFN-b-1a na zpoždění rozvoje CDMS u těchto pacientů. Po dvou a třech letech bylo riziko rozvoje CDMS 21 % a 35 % ve skupině s IFN-b-1a a 39 % a 50 % u pacientů s placebem, viz graf 1 [21]. -
 Early Treatment of Multiple Sclerosis (ETOMS)
Early Treatment of Multiple Sclerosis (ETOMS)
Nemocní s CIS byli léčeni IFN-b-1a v dávce 22 mg nebo placebem podkožně po dobu 2 let. Léčbou IFN-β-1a (přestože uvedené množství není adekvátní dávkou a frekvence podání 1krát týdně se u této formy nepoužívá) bylo sníženo procento konverze do CDMS na 34 % v porovnání se 45 % u placebové skupiny (graf 2). Pacienti léčení IFN-b-1a vykazovali signifikantní zpomalení rozvoje mozkové atrofie ve srovnání s pacienty léčenými placebem. V průběhu 2 let aktivní léčba redukovala rozvoj mozkové atrofie o téměř 30 % (dodatečná data na základě měření mozkového objemu) [10, 22]. -
REbif FLEXible (REFLEX)
Jde o 2letou studii u pacientů s CIS, která zkoumá efekt IFN-b-1a podávaného v dávce 44 mg podkožně 1krát nebo 3krát týdně proti placebu. Výsledky této studie jsou ve fázi hodnocení [22]. -
 BEtaferon in NEwly Emerging MS For Initial Treatmetnt (BENEFIT)
BEtaferon in NEwly Emerging MS For Initial Treatmetnt (BENEFIT)
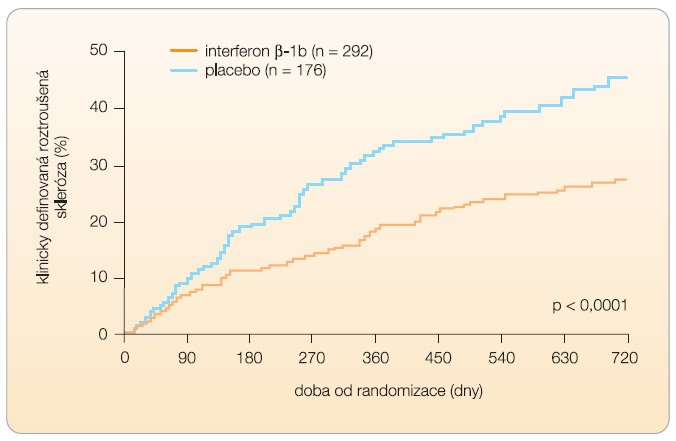
Pacienti s CIS a s nejméně 2 MR lézemi na mozku dostávali každý druhý den 250 mg IFN-b-1b nebo placebo podkožně po dobu 2 let. Tito pacienti byli v případě vývoje druhé ataky (CDMS) převedeni na léčbu IFN-b-1b. Skupina léčená IFN vykazovala 50% redukci rizika druhého relapsu ve srovnání s placebovou větví (p < 0,0001). Signifikantní prodloužení přechodu do CDMS při dvouletém sledování bylo 69 % ve srovnání s 85 % ve skupině s placebem (graf 3) [23]. -
 Presenting With a Clinically Isolating Syndrome (PRECISE)
Presenting With a Clinically Isolating Syndrome (PRECISE)
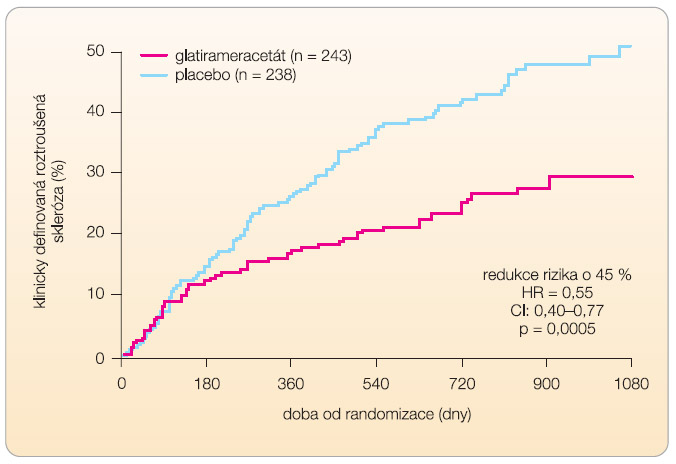
Do studie byli zařazeni nemocní s CIS s nálezem na MR mozku a byli léčeni glatirameracetátem 20 mg denně nebo placebem. Rozvoj CDMS byl u léčené skupiny nižší a činil 25 % proti 43 % (p < 0,0001). Významný je také 61% pokles v nových T2 lézích a 60% snížení nových kontrastních změn na MR (graf 4) [22, 26]. -
Study Early Treatment (SET)
Je to nekomerční studie iniciovaná Neuroimunologickou sekcí České neurologické společnosti a Masarykovou univerzitou v Brně. Pacienti jsou léčeni IFN-b-1a bez placebové větve. Studie zatím probíhá [17]. Tyto rozsáhlé klinické studie využívají DMD, jejichž předpokládaný mechanismus účinku je alespoň v základních rysech znám a u CDMS relabujícího/remitujícího (R/R) typu je ověřen celosvětovou praxí. V ČR jsou používány jako léky první volby u RS typu R/R od roku 1996.
IFN-b redukuje proliferaci a sekreci cytokinů autoimunitními lymfocyty a snižuje permeabilitu hematoencefalické bariéry. Omezuje poškození CNS a množství postižené bílé hmoty redukcí zánětlivých pochodů [19]. K dispozici je několik preparátů, viz tab. 2.
 Mechanismus účinku glatirameracetátu je vysvětlován schopností vazby na molekuly MHC II. třídy antigen-prezentujících buněk. GA je rozpoznán Th2 GA specifickými lymfocyty, které se množí a přestupují přes hematoencefalickou bariéru, kde produkují protizánětlivé cytokiny Th2 subpopulace. Je předpoklad, že tyto buňky také tvoří neurotrofický faktor (BDNF, brain derived neurotrophic factor), který působí ochranně na postižená axonální vlákna [19, 24]. V probíhajících klinických studiích fáze II nebo fáze III jsou zkoumány další nadějné preparáty s využitím jiných mechanismů účinku (např. antiproliferativní vliv na lymfocyty u kladribinu a teriflunomidu, omezení počtu cirkulujících lymfocytů u FTY720 apod.). Jejich hodnocení je však zatím předčasné.K akutní léčbě CIS nebo časné fáze CDMS patří léčba klinické ataky, kdy je standardním postupem podání methylprednisolonu v dávce 3–5 gramů intravenózně. Toto je dávka, která je používána u všech typů akutního vzplanutí RS, je povolena i při výzkumu jiných preparátů u terapeuticky naivních subjektů léčených zkoumanými léčivy. Nedílnou součástí léčby je i medikace symptomatická (například léčba deprese, únavy, spasticity, sfinkterových poruch a další), která však samotný vývoj onemocnění neovlivňuje. Po zvládnutí prvních příznaků nebo ataky, stanovení diagnózy CIS nebo časné CDMS typu R/R uvažujeme o další strategii dlouhodobé léčby se snahou zasáhnout do autoimunitních procesů co nejdříve a co nejúčinněji.
Mechanismus účinku glatirameracetátu je vysvětlován schopností vazby na molekuly MHC II. třídy antigen-prezentujících buněk. GA je rozpoznán Th2 GA specifickými lymfocyty, které se množí a přestupují přes hematoencefalickou bariéru, kde produkují protizánětlivé cytokiny Th2 subpopulace. Je předpoklad, že tyto buňky také tvoří neurotrofický faktor (BDNF, brain derived neurotrophic factor), který působí ochranně na postižená axonální vlákna [19, 24]. V probíhajících klinických studiích fáze II nebo fáze III jsou zkoumány další nadějné preparáty s využitím jiných mechanismů účinku (např. antiproliferativní vliv na lymfocyty u kladribinu a teriflunomidu, omezení počtu cirkulujících lymfocytů u FTY720 apod.). Jejich hodnocení je však zatím předčasné.K akutní léčbě CIS nebo časné fáze CDMS patří léčba klinické ataky, kdy je standardním postupem podání methylprednisolonu v dávce 3–5 gramů intravenózně. Toto je dávka, která je používána u všech typů akutního vzplanutí RS, je povolena i při výzkumu jiných preparátů u terapeuticky naivních subjektů léčených zkoumanými léčivy. Nedílnou součástí léčby je i medikace symptomatická (například léčba deprese, únavy, spasticity, sfinkterových poruch a další), která však samotný vývoj onemocnění neovlivňuje. Po zvládnutí prvních příznaků nebo ataky, stanovení diagnózy CIS nebo časné CDMS typu R/R uvažujeme o další strategii dlouhodobé léčby se snahou zasáhnout do autoimunitních procesů co nejdříve a co nejúčinněji.
Závěr
Roztroušenou sklerózu mozkomíšní doposud nedokážeme vyléčit. Jsou však známy některé patogenetické pochody a probíhají intenzivní výzkumy ke stanovení účinné léčby. Výsledky již zhodnocených klinických studií u nemocných s prvními příznaky onemocnění jednoznačně prokazují přínos léčby DMD, oddálení přechodu v klinicky definitivní RS s dopadem na snížení trvalých následků a zlepšení kvality života těchto nemocných. Neméně významné jsou důsledky socioekonomické. Nemalá cena léčiv podávaných v první fázi roztroušené sklerózy přinese úsporu výdajů na sociální úrovni, protože stejně nebo více nákladná pro společnost je předčasná ztráta práceschopnosti a invalidita nemocných s RS.
Seznam použité literatury
- [1] Tracy DeAngelis, Fred Lublin. Multiple sclerosis: new treatment trials and emerging therapeutic targets. Curr Opin Neurol 2008; 21: 261–271.
- [2] Poser C, Paty D, Scheinberg L, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol 1983; 13: 227–231.
- [3] McDonald WI, Compston A, Edan G, et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50: 121–127.
- [4] Polman Ch, Reingold SC, Edan G, et al. Diagnostic criteria for multiple sclerosis: 2005 revision to
- [5] Havrdová E. Roztroušená skleróza. Neurol pro praxi 2008; 9: 208.
- [6] Stadelmann Ch, Brűck W. Interplay between mechanisms of damage and repair in multiple sclerosis. J Neurol 2008; 255 (Suppl. 1): 12–18.
- [7] Albert M, Antel J, Brűck W, Stadelmann C. Extensive cortical remyelination in patients with chronic multiple sclerosis. Brain Patology 2007; 17: 129–138.
- [8] Franclin RJ, Kotter MR. The biology of CNS remyelination. J Neurol 2008; 255 (Suppl. 1): 19–25.
- [9] Tintoré M. Rationale for early intervention with immunomodulatory treatments. J Neurol 2008; 255 (Suppl. 1): 37–43.
- [10] Tintoré M. Early MS treatment. Int MS J 2007; 14: 5–10.
- [11] Montalban X. Multiple sclerosis therapy: historical and future perspectives. Curr Opin Neurol 2009; 22: S1–S3.
- [12] Taláb R. Cesta ke spolehlivé diagnostice roztroušené sklerózy. Neurol pro praxi 2008; 9: 210–214.
- [13] Taláb R, Fiedler J. Klinicky izolovaný syndrom v rámci včasné diagnostiky roztroušené sklerózy. Cesk Slov Neurol N 2004; 67/100: 381–382.
- [14] Bergamaschi R. Prognosis of multiple sclerosis: clinical factors predicting the late evolution for an early treatment decision. Expert Rev Neurother 2006; 6: 357–364.
- [15] Tintoré M, Rovira A, Rio J, et al. Do oligoclonal bands add information to MRI in first attacts of multiple sclerosis? Neurology 2008; 70: 1079–1083.
- [16] Ebers GC. Prognostic factors for muliple sclerosis: the importance of natural history studies. J Neurol 2005; 252 (Suppl. 3): iii15–iii20.
- [17] Horáková D. Klinicky izolovaný syndrom a prognostické markery u roztroušené sklerózy. Proč léčit včas? Neurol pro praxi 2008; 9: 215–217.
- [18] Krasulová E, Havrdová E. Léčba relaps-remitentní roztroušené sklerózy mozkomíšní. Neurol pro praxi 2008; 9: 218–222.
- [19] Havrdová E. Léčba roztroušené sklerózy. Remedia 2007; 17: 61–72.
- [20] Taláb R. Natalizumab. Remedia 2007; 17: 533–541.
- [21] Jacobs LD, Beck RW, Jimon JH, et al. Intramuscular interferon b-1a therapy initiated during a first demyelinating event in multiple sclerosis. N Engl J Med 2000; 343: 898–904.
- [22] Coyle PK. Early treatment of multiple sclerosis to prevent neurologic damage. Neurology 2008; 71 (Suppl. 3): S3–S7.
- [23] Kappos L, Polman ChH, Freedman MS, et al. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS with clinically isolated syndromes. Neurology 2006; 67: 1242–1249.
- [24] Aharoni R, Kayhan B, Ilam R, et al. Glatiramer acetate-specific T-cells in the brain express T helper 2/3 cytokines and brain derived neurotrophic factor in situ. Proc Natl Acad Sci USA 2003; 100: 1457–1462.
- [25] Betaferon: Souhrn údajů o přípravku. http://www. emea.europa.eu/humandocs/PDFs/EPAR/Betaferon/H-081-PI-cs.pdf.
- [26] Comi G. PreCISe Study. Presented at the 60th Annual Meeting of the American Academy of Neurology (AAN), Chicago, IL. April 16, 2008.