Léčba dyslipidemií u diabetiků 2. typu
Komplexní léčba diabetu 2. typu vede k prodloužení života, zlepšení jeho kvality a k prevenci či oddálení vzniku makrovaskulárních a mikrovaskulárních komplikací. Dosažení těchto cílů v léčbě dyslipidemie je u diabetu 2. typu, který zahrnuje jedince s vysokým kardiovaskulárním (KV) rizikem, obtížné, navzdory dietní, režimové a farmakologické intervenci. Hodnoty absolutního KV rizika jsou zde vyšší než hodnoty odečtené z tabulky SCORE. Recentní randomizované klinické studie prokázaly u pacientů s diabetem přínos a bezpečnost agresivnějšího snižování hladiny LDL cholesterolu. Redukce výskytu KV příhod a ischemických cévních příhod mozkových byly prokázány také v řadě podskupin diabetické populace. Patologická kombinace několika poruch lipidogramu a snaha o dosažení cílových hodnot krevních lipidů často vyžaduje léčbu kombinací hypolipidemik s různým mechanismem účinku. I když léčba statiny u diabetiků 2. typu prokazatelně snižuje KV riziko, stále zůstává i ve skupině aktivně léčených pacientů přítomno signifikantní reziduální riziko. Proto je dalším cílem v léčbě dyslipidemie – vedle dosažení náležitých hodnot LDL – snaha zvýšit koncentraci HDL cholesterolu a snížit triglyceridemii pomocí dalších hypolipidemik v rámci kombinované hypolipidemické terapie. Výběr příslušné kombinace hypolipidemik a sledování možného výskytu nežádoucích účinků, tolerance a compliance pacientů je nutností, zejména s ohledem na zvýšený výskyt lékových interakcí a vedlejších účinků kombinační léčby. Možné kombinace hypolipidemik zahrnují především fibrát/statin a mezi další kombinace patří léčba typu fibrát/niacin, fibrát/ezetimib, statin/niacin, případně statin/ezetimib nebo statin/omega-3 mastné kyseliny.
Léčba makrovaskulárních komplikací u pacientů s diabetem 2. typu
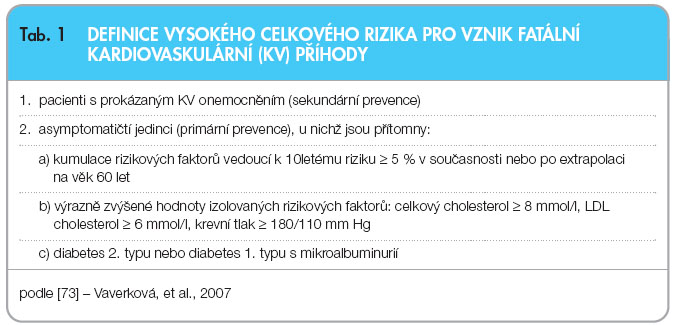 Diabetes mellitus 2. typu (T2DM) je v úzké vazbě k aterosklerotickým cévním onemocněním, a představuje tak závažný kardiovaskulární (KV) rizikový faktor (tab. 1). Celosvětově trpí diabetem 246 milionů lidí a v roce 2025 se očekává zvýšení počtu nemocných na celkem 380 milionů [1]. Proto je problematice hypolipidemické léčby u diabetiků 2. typu věnována v domácí i zahraniční literatuře významná pozornost [2, 3]. Diabetici jsou ohroženi nejméně dvakrát vyšším absolutním rizikem KV onemocnění než lidé bez diabetu a přibližně 80 % diabetiků umírá v důsledku KV onemocnění (KVO) [1, 4, 5]. Tuto skutečnost zohledňují recentní léčebná doporučení pro diabetiky 2. typu. U pacientů s diabetem je přítomnost ischemické choroby srdeční (ICHS) často diagnostikována až v pokročilém stadiu. Prognóza KV onemocnění u diabetiků, včetně přežití, je mnohem závažnější než u nediabetiků. Diabetici po prvním infarktu myokardu mají více než 50% mortalitu během jednoho roku a polovina z nich umírá ještě dříve, než je transportována do nemocnice (náhlé úmrtí). Pacient se současným výskytem KVO a diabetu má 10leté KV riziko vyšší než 20 % a podle Third Adult Treatment Panel (ATP III) National Cholesterol Education Program je takový pacient považován za osobu s velmi vysokým rizikem [6].
Diabetes mellitus 2. typu (T2DM) je v úzké vazbě k aterosklerotickým cévním onemocněním, a představuje tak závažný kardiovaskulární (KV) rizikový faktor (tab. 1). Celosvětově trpí diabetem 246 milionů lidí a v roce 2025 se očekává zvýšení počtu nemocných na celkem 380 milionů [1]. Proto je problematice hypolipidemické léčby u diabetiků 2. typu věnována v domácí i zahraniční literatuře významná pozornost [2, 3]. Diabetici jsou ohroženi nejméně dvakrát vyšším absolutním rizikem KV onemocnění než lidé bez diabetu a přibližně 80 % diabetiků umírá v důsledku KV onemocnění (KVO) [1, 4, 5]. Tuto skutečnost zohledňují recentní léčebná doporučení pro diabetiky 2. typu. U pacientů s diabetem je přítomnost ischemické choroby srdeční (ICHS) často diagnostikována až v pokročilém stadiu. Prognóza KV onemocnění u diabetiků, včetně přežití, je mnohem závažnější než u nediabetiků. Diabetici po prvním infarktu myokardu mají více než 50% mortalitu během jednoho roku a polovina z nich umírá ještě dříve, než je transportována do nemocnice (náhlé úmrtí). Pacient se současným výskytem KVO a diabetu má 10leté KV riziko vyšší než 20 % a podle Third Adult Treatment Panel (ATP III) National Cholesterol Education Program je takový pacient považován za osobu s velmi vysokým rizikem [6].
Poruchy metabolismu lipidů zaujímají v patogenezi KV komplikací diabetu 2. typu centrální úlohu. Lipotoxicita, která se projevuje na buněčné úrovni v různých orgánech a která v B-buňce pankreatu způsobuje postupné selhávání její sekreční schopnosti, i když v tomto stadiu – dosud bez klinických problémů – zůstává v běžné klinické praxi nepovšimnuta, se zatím vzácně označuje jako diabetes lipidus [7]. T2DM je charakterizován zvýšením koncentrace triglyceridů (TG) v séru, snížením koncentrace HDL cholesterolu a zvýšením počtu tzv. malých denzních (small dense) LDL částic, které zvyšují riziko KVO [2]. Zatímco hladina LDL cholesterolu (LDL-C) je velmi dobrým 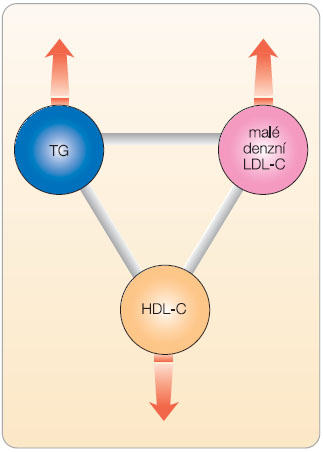 prediktorem KV rizika u jedinců s jejím významným zvýšením (ale současně s normální koncentrací TG v krvi) [8], u pacientů se smíšenou dyslipidemií spojenou s T2DM je riziko podhodnoceno. U této skupiny pacientů se současně vyskytuje vysoká triglyceridemie, nízké hodnoty HDL cholesterolemie (HDL-C) a často také zvýšený výskyt malých denzních LDL částic – tzv. aterogenní triáda (obr. 1) [9]. Monoterapie potentními statiny je u těchto jedinců efektivní v dosahování cílových hodnot LDL-C a non-HDL-C. Významná část takových nemocných však
prediktorem KV rizika u jedinců s jejím významným zvýšením (ale současně s normální koncentrací TG v krvi) [8], u pacientů se smíšenou dyslipidemií spojenou s T2DM je riziko podhodnoceno. U této skupiny pacientů se současně vyskytuje vysoká triglyceridemie, nízké hodnoty HDL cholesterolemie (HDL-C) a často také zvýšený výskyt malých denzních LDL částic – tzv. aterogenní triáda (obr. 1) [9]. Monoterapie potentními statiny je u těchto jedinců efektivní v dosahování cílových hodnot LDL-C a non-HDL-C. Významná část takových nemocných však 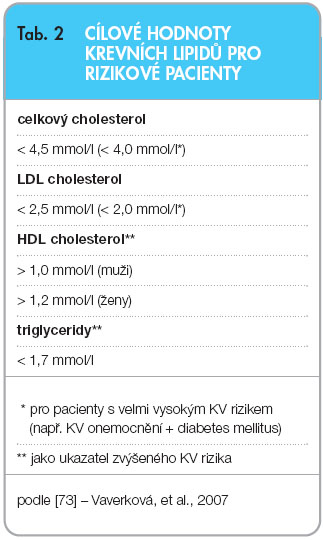 současně trpí i dalšími výše uvedenými abnormalitami v lipidogramu a snaha snížit zvýšenou hladinu TG a zvýšit nízký HDL-C je zde proto důležitou součástí léčby (tab. 2). Protože přítomnost diabetu představuje ekvivalent rizika shodný s osobou s již přítomným KVO, musí být léčba KV rizikových faktorů u diabetiků cílená, agresivní a efektivní. U T2DM by měla být léčba komplexní, se zaměřením na dyslipidemii, hypertenzi, inzulinovou rezistenci, a dále na kouření cigaret, hyperglykemii a protrombotické faktory [6]. Studie Steno-2 a následné sledování po dobu 13,3 let prokázaly přetrvávající prospěch z léčby s ohledem na vaskulární komplikace a počet úmrtí. Tato studie tak přináší důkazy ve prospěch časné intenzivní multifaktoriální intervence včetně kombinace farmak s cílem dosáhnout optimálních cílů a ovlivnit životní styl diabetiků 2. typu [10, 11] (graf 1).
současně trpí i dalšími výše uvedenými abnormalitami v lipidogramu a snaha snížit zvýšenou hladinu TG a zvýšit nízký HDL-C je zde proto důležitou součástí léčby (tab. 2). Protože přítomnost diabetu představuje ekvivalent rizika shodný s osobou s již přítomným KVO, musí být léčba KV rizikových faktorů u diabetiků cílená, agresivní a efektivní. U T2DM by měla být léčba komplexní, se zaměřením na dyslipidemii, hypertenzi, inzulinovou rezistenci, a dále na kouření cigaret, hyperglykemii a protrombotické faktory [6]. Studie Steno-2 a následné sledování po dobu 13,3 let prokázaly přetrvávající prospěch z léčby s ohledem na vaskulární komplikace a počet úmrtí. Tato studie tak přináší důkazy ve prospěch časné intenzivní multifaktoriální intervence včetně kombinace farmak s cílem dosáhnout optimálních cílů a ovlivnit životní styl diabetiků 2. typu [10, 11] (graf 1).
Statiny
![Graf 1 Ovlivnění výskytu závažných příhod multifaktoriální intenzivní léčbou ve srovnání s konvenční léčbou u diabetiků 2. typu. Primární cíl zahrnoval kardiovaskulární úmrtí, infarkty myokardu, cévní mozkové příhody, revaskularizace a amputace; podle [10] – Gaede, et al., 2003.](https://www.remedia.cz/photo-a-28119---.jpg) Studie Heart Protection Study (HPS) přinesla jako první průkazná data o tom, že léčba statiny vedoucí k průměrnému snížení LDL cholesterolemie o 0,9 mmol/l současně sníží výskyt významných KV příhod u diabetiků o 22 % [12]. Další studie – Collaborative Atorvastatin Diabetes Study (CARDS), která se jako první zaměřila speciálně na diabetiky 2. typu, prokázala, že průměrné snížení LDL cholesterolemie o 1,2 mmol/l přináší u diabetiků 37% snížení výskytu KV příhod [13]. Léčba statiny u diabetiků se ukazuje jako efektivní jak v primární, tak v sekundární prevenci. Metaanalýza 14 randomizovaných studií se statiny u celkem 18 686 diabetiků ukázala signifikantní 21% redukci ve výskytu významných KV příhod na každé snížení LDL cholesterolemie o 1 mmol/l, které nebylo závislé na předchozí anamnéze KV onemocnění. Snížení rizika bylo obdobné a stejně účinné u diabetu 1. i 2. typu [14].
Studie Heart Protection Study (HPS) přinesla jako první průkazná data o tom, že léčba statiny vedoucí k průměrnému snížení LDL cholesterolemie o 0,9 mmol/l současně sníží výskyt významných KV příhod u diabetiků o 22 % [12]. Další studie – Collaborative Atorvastatin Diabetes Study (CARDS), která se jako první zaměřila speciálně na diabetiky 2. typu, prokázala, že průměrné snížení LDL cholesterolemie o 1,2 mmol/l přináší u diabetiků 37% snížení výskytu KV příhod [13]. Léčba statiny u diabetiků se ukazuje jako efektivní jak v primární, tak v sekundární prevenci. Metaanalýza 14 randomizovaných studií se statiny u celkem 18 686 diabetiků ukázala signifikantní 21% redukci ve výskytu významných KV příhod na každé snížení LDL cholesterolemie o 1 mmol/l, které nebylo závislé na předchozí anamnéze KV onemocnění. Snížení rizika bylo obdobné a stejně účinné u diabetu 1. i 2. typu [14].
Americká diabetologická asociace (ADA) publikovala roku 2009 standardy lékařské péče o diabetiky [15]. Zahrnují modifikaci životního stylu, snížení příjmu saturovaných tuků, transmastných kyselin a cholesterolu. Je doporučeno zvýšení fyzické aktivity s cílem navodit redukci hmotnosti. Jestliže diabetik 2. typu již trpí KVO, má léčba vedle modifikace životního stylu zahrnovat také terapii statiny, nezávisle na výchozím lipidogramu. Léčba statiny je doporučována také tehdy, když pacient nemá vyjádřené KVO, ale je starší 40 let a je u něj zjištěn jeden nebo více dalších KV rizikových faktorů. U pacientů s nižším rizikem (mladších 40 let, bez přítomného KVO) je doporučováno vedle modifikace životního stylu zvážit léčbu statiny tehdy, pokud je LDL cholesterolemie > 2,6 mmol/l. U diabetiků s KVO je doporučeno dosahovat i nižšího cíle s LDL cholesterolemií < 1,8 mmol/l. Pokud pacienti léčeni farmaky nedosáhnou lipidových cílů při léčbě maximální tolerovatelnou dávkou statinů, představuje snížení hladiny LDL cholesterolu o cca 30–40 % oproti úvodním hodnotám akceptovatelný terapeutický cíl. Žádoucí je dále dosáhnout triglyceridemie < 1,7 mmol/l a HDL cholesterolemie > 1,0 mmol/l u mužů a > 1,3 mmol/l u žen. Léčba statiny zaměřená na LDL cholesterolemii je stále preferovanou léčebnou strategií první volby [15]. Pokud nedojde při léčbě maximální tolerovanou dávkou statinů k dosažení cílových hodnot lipidů, je doporučeno léčit kombinační léčbou s dalšími hypolipidemiky, především s fibráty.
Aterogenní triáda, reziduální kardiovaskulární riziko a fibráty
Dyslipidemie u pacientů s T2DM je charakterizována typickou aterogenní triádou (obr. 1). Statiny signifikantně snižují koncentraci LDL-C a mění distribuci podtříd LDL-C ve prospěch větších částic. Izolované, i když intenzivní snížení LDL-C u této skupiny pacientů významně sníží KV riziko, ale nevede k jeho úplné eliminaci. Analýza podskupin ve studii TNT prokázala, že léčba vysokými dávkami atorvastatinu (80 mg denně) vede k aditivnímu přínosu ve srovnání s konvenční léčbou a u pacientů s T2DM vede k redukci relativního rizika o 25 % (p < 0,001), resp. 29 % (p < 0,001) [16]. V tomto směru je třeba hodnotit i tzv. reziduální kardiovaskulární riziko, které znamená, že i při agresivní léčbě statiny se vyskytuje významný počet KV příhod (11,3 % vs. 8,0 %, hazard ratio 1,44, 95% CI 1,26–1,64, p < 0,0001, medián sledování 4,9 roku). Léčba vysokými dávkami statinu riziko sníží, ale neodstraní zcela zmíněné reziduální KV riziko. Při zhodnocení reziduálního KV rizika u diabetiků léčených statiny je celkový počet KV příhod, k nimž došlo i přes léčbu statiny, velmi vysoký (77 %). U pacientů se smíšenou dyslipidemií je proto doporučována – vedle konvenční léčby statiny – aditivní terapie ke korekci parametrů aterogenního lipidogramu a k redukci reziduálního KV rizika.
Od zavedení klofibrátu jako efektivního antilipidemika v polovině šedesátých let minulého století byly fibráty jako skupina předmětem řady experimentálních i velkých randomizovaných klinických studií. Fibráty jsou od té doby v klinické praxi používány více než čtyři dekády, a to pro jejich potenciál významně snížit hladinu TG, zvýšit HDL-C a mírně, nicméně signifikantně snížit hladinu LDL-C [17]. Díky příznivému vlivu na metabolismus lipidů a glukózy jsou tito agonisté PPAR-α (peroxisome proliferators-activated receptors α agonists) skvělým potenciálně účinným farmakem k redukci KV rizika jedinců s aterogenní dyslipidemií, typicky přítomnou v rámci T2DM [18]. Máme k dispozici řadu dat získaných na molekulární úrovni a in vivo (jak z experimentů na zvířeti, tak z klinických studií), která předpokládají potenciál fibrátů redukovat KV riziko i u pacientů s T2DM a diabetickou dyslipidemií [19].
Primárně preventivní studie Helsinki Heart Study (HHS), která v době randomizace zahrnovala 3 % diabetiků, prokázala, že léčba gemfibrozilem vede k signifikantnímu snížení počtu hlavních KV příhod [20]. V sekundárně preventivní studii Veterans Affairs High-density lipoprotein cholesterol Intervention Trial (VAHIT), která zahrnovala již 25 % diabetiků, snížila léčba gemfibrozilem riziko výskytu KV příhod o 22 % [21]. Ve studii Bezafibrate Infarction Prevention (BIP) s 10 % diabetiků [22] byl celkový trend k redukci primárních cílů 9,4 % (incidence fatálního a nefatálního infarktu myokardu nebo náhlá smrt). Ve skupině 459 pacientů s nejvyšší hladinou TG (> 2,3 mmo/l) byl tento výsledek signifikantní. Recentní extenze studie BIP prokázala, že pacienti s kombinovanou dyslipidemií v rámci metabolického syndromu mají z léčby fibráty největší přínos [23]. Léčba bezafibrátem byla spojena se snížením rizika fatálního a nefatálního infarktu myokardu s hazard ratio (HR) a konfidenčním intervalem (CI) 0,71 (0,54–0,95), resp. 0,67 (0,49–0,91). Riziko KV mortality vykazovalo trend k redukci při léčbě bezafibrátem (HR 0,74; CI 0,54–1,03). Podobně jako tomu bylo v případě gemfibrozilu u Helsinki Heart Study, doložila extenze studie u pacientů s vyjádřenými rysy kombinované dyslipidemie v rámci metabolického syndromu [24] (alespoň 4 rizikové faktory metabolického syndromu) výraznou (56%) redukci KV mortality (HR 0,44; CI 0,25–0,80). Je zajímavé, že u pacientů bez aterogenní dyslipidemie nebyl tento příznivý efekt léčbou bezafibrátem pozorován (např. KV úmrtí 7,7 % vs. 7,7 % při podávání placeba). Ve studii Diabetes Atherosclerosis Intervention Study (DAIS), která zahrnovala výlučně diabetiky 2. typu, vedla léčba mikronizovaným fenofibrátem po dobu 38 měsíců ke snížení progrese angiograficky dokumentované koronární aterosklerózy a zlepšila dyslipoproteinemii ve srovnání s placebem [25].
Do nedávné doby nám však chyběly výsledky velkých randomizovaných studií, které by se zabývaly léčbou fibráty u diabetiků 2. typu. Post hoc analýza studie FIELD (Fenofibrate Intervention and Event Lowering in Diabetes) doložila údaje o prospěchu z léčby u pacientů s elevací TG a snížením HDL-C [26], tj. 27% snížení počtu KV příhod u pacientů s triglyceridemií > 1,7 mmol/l a HDL-C < 1 mmol/l. Recentní velká metaanalýza [27] týkající se vlivu léčby fibráty na KVO zaznamenala větší dopad léčby u jedinců s vyšší bazální průměrnou koncentrací TG (p = 0,030). Ve všeobecné populaci, zahrnující pacienty s aterogenní dyslipidemií i bez ní, byl vliv léčby fibrátem „naředěn“, a tudíž menší, ale přesto dosahoval signifikantního 10% snížení relativního rizika (RR) velké KV příhody (p = 0,048) a 13% redukce RR jakékoli KV příhody (p < 0,0001). V analýze pacientů ze studie FIELD bylo prokázáno, že jednotlivé komponenty kombinované dyslipidemie zvyšují relativní riziko KVO a největší význam má léčba fenofibrátem právě u pacientů s kombinací elevace TG a snížení HDL-C [28]. Pacienti s aterogenní dyslipidemií (zejména se zvýšením TG a snížením HDL-C) mají tedy jasný prospěch z léčby fibráty. Představují tak podskupinu pacientů, kde je dle současných doporučení léčba fibráty indikována, a také podskupinu, jíž jsou dle současné praxe fibráty nejčastěji předepisovány.
![Graf 2 Ovlivnění rizika non-fatálního infarktu myokardu a dalších parametrů kombinovanou léčbou statinem a fibrátem u diabetiků 2. typu; podle [29] – Saha, Arora, 2010.](https://www.remedia.cz/photo-a-28120---.jpg) Zajímavé výsledky přinesla také recentní metaanalýza dat z reprezentativních dlouhodobých, placebem kontrolovaných randomizovaných klinických studií, které hodnotily vliv léčby fibráty na KV riziko diabetiků 2. typu [29]. Do hodnocení byly zahrnuty studie HHS, VA-HIT, BIP, SENCAP, DAIS a FIELD. Metaanalýza prokázala, že kombinovaná léčba statinem a fibrátem u diabetiků 2. typu signifikantně redukuje riziko non-fatálního infarktu myokardu, a uzavírá, že zatímco statiny představují pro diabetiky 2. typu hypolipidemikum první volby, hypolipidemikem první volby do kombinační léčby jsou u diabetiků fibráty (graf 2).
Zajímavé výsledky přinesla také recentní metaanalýza dat z reprezentativních dlouhodobých, placebem kontrolovaných randomizovaných klinických studií, které hodnotily vliv léčby fibráty na KV riziko diabetiků 2. typu [29]. Do hodnocení byly zahrnuty studie HHS, VA-HIT, BIP, SENCAP, DAIS a FIELD. Metaanalýza prokázala, že kombinovaná léčba statinem a fibrátem u diabetiků 2. typu signifikantně redukuje riziko non-fatálního infarktu myokardu, a uzavírá, že zatímco statiny představují pro diabetiky 2. typu hypolipidemikum první volby, hypolipidemikem první volby do kombinační léčby jsou u diabetiků fibráty (graf 2).
Studie ACCORD (Action to Control Cardiovascular Risk in Diabetes) Lipid, publikovaná v dubnu roku 2010 [30], randomizovala 5518 vysoce rizikových diabetiků 2. typu s úvodní koncentrací LDL-C cca 2,6 mmol/l, intervenovaných na cca 2,0 mmol/l monoterapií simvastatinem při průměrné dávce 22 mg/den, k léčbě fenofibrát/simvastatin nebo k léčbě samotným simvastatinem. Ve studii ACCORD Lipid vedla léčba fenofibrátem ke snížení hladiny TG (průměrné snížení o 22,2 % od zahájení studie a o 8,7 % oproti léčbě samotným simvastatinem) a ke zvýšení koncentrace HDL-C (8,4 % vs. 6,0 %). Autoři této studie, poslední dosud publikované studie s fenofibrátem, resp. její části ACCORD Lipid, se před jejím zahájením museli rozhodnout, zda budou studovat aditivní vliv léčby fenofibrátem k léčbě statinem u pacientů s typickou diabetickou dyslipidemií (nízká koncentrace HDL-C a zvýšená hladina TG), nebo zda nebudou vstupní kritéria podobným způsobem modifikovat. Nakonec se rozhodli pro druhou variantu a skupinu pacientů s aterogenní dyslipidemií alespoň předem definovali. Bohužel jedinci s aterogenní dyslipidemií tak tvořili méně než 17 % celkové populace studie ACCORD Lipid (941 z 5518 pacientů), zatímco v rutinní praxi je situace jiná. V celkovém hodnocení studie neprokázala žádný statisticky významný prospěch z léčby v primárním cíli (kombinace KV mortalita, non-fatální infarkt myokardu nebo non-fatální mozková příhoda), ani v sekundárních cílech při srovnání léčby fenofibrát/ simvastatin vs. monoterapie simvastatinem. Autoři v rámci prezentace výsledků zdůrazňují, že prospěch z kombinované léčby statin/fibrát měla předem definovaná skupina pacientů s vysokým KV rizikem. Jedná se o nemocné, jejichž hladiny TG se před zahájením kombinované hypolipidemické léčby pohybovaly v rozmezí horního tercilu studijní populace (≥ 2,3 mmol/l) a koncentrace HDL-C v nejnižším tercilu (≤ 0,88 mmol/l). Tito pacienti, pokud byli léčeni samotným simvastatinem, měli o 70 % vyšší relativní výskyt primárních příhod než nemocní bez této dyslipidemie (v absolutních hodnotách 17,3 % vs. 10,1 %). Při analýze podskupin měli pacienti s aterogenní dyslipidemií (nízká koncentrace HDL-C a zvýšené hladiny TG) přínos z léčby fenofibrát/simvastatin, který byl podobný předchozím studiím s monoterapií fenofibrátem: manifestace primárních cílů byla 12,4 % ve skupině léčené fenofibrátem oproti 17,3 % ve skupině s placebem (statisticky významná 31% redukce HR). U ostatních 4548 pacientů (bez aterogenní dyslipidemie) představoval výskyt příhod shodně 10,1 % ve větvi s fenofibrátem a placebem. Epidemiologická charakteristika ve studii ACCORD Lipid se tak od reálné klinické praxe značně liší, protože mezi jedinci s T2DM nalezneme vysokou prevalenci aterogenní dyslipidemie [31, 32], která podmiňuje a akceleruje riziko KVO.
Další možnosti kombinované léčby hypolipidemiky
Kombinace farmak je u pacientů s aterogenní dyslipidemií v rámci léčby diabetu 2. typu indikována tehdy, pokud není dosaženo cíle dle doporučení (NCEP III, ATP III). Možné kombinace hypolipidemik zahrnují především již výše zmiňované kombinace fibrátu se statinem, mezi další kombinace potom patří léčba typu fibrát/niacin, fibrát/ ezetimib, statin/niacin, případně statin/ezetimib nebo statin/omega-3 mastné kyseliny (tab. 3).
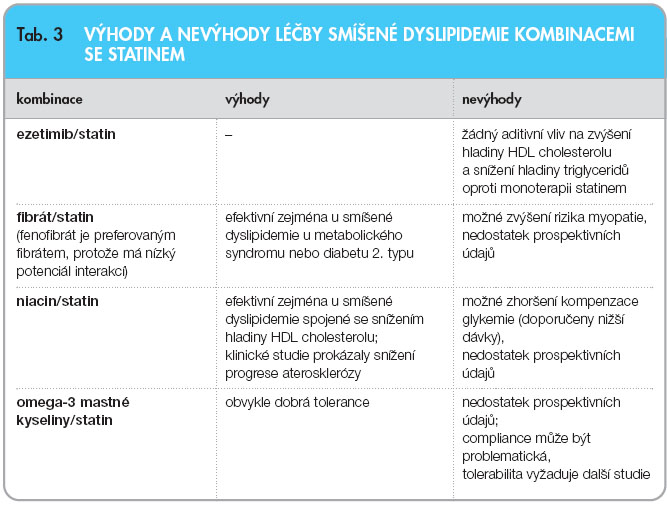 Alternativou léčby s cílem dosáhnout cílových hodnot LDL-C a non-HDL-C je kombinace ezetimib a fibrát (fenofibrát). Léčba ezetimibem a fenofibrátem (10/160 mg denně) po dobu 12 týdnů vedla u 625 pacientů se smíšenou hyperlipidemií (16 % nemocných se léčilo pro diabetes 2. typu a 57 % splňovalo NCEP ATP III kritéria metabolického syndromu) k významnému snížení hladin LDL-C a triglyceridemie a zvýšení koncentrace HDL-C ve srovnání s monoterapií fenofibrátem. Tolerabilita léčby byla srovnatelná s monoterapií fenofibrátem jak v této studii, tak při léčbě po delší časový interval [33].
Alternativou léčby s cílem dosáhnout cílových hodnot LDL-C a non-HDL-C je kombinace ezetimib a fibrát (fenofibrát). Léčba ezetimibem a fenofibrátem (10/160 mg denně) po dobu 12 týdnů vedla u 625 pacientů se smíšenou hyperlipidemií (16 % nemocných se léčilo pro diabetes 2. typu a 57 % splňovalo NCEP ATP III kritéria metabolického syndromu) k významnému snížení hladin LDL-C a triglyceridemie a zvýšení koncentrace HDL-C ve srovnání s monoterapií fenofibrátem. Tolerabilita léčby byla srovnatelná s monoterapií fenofibrátem jak v této studii, tak při léčbě po delší časový interval [33].
V rámci kombinační léčby lze použít také niacin a fibrát. Ve studii Stockholm Ischaemic Heart Disease Secondary Prevention Study bylo 555 pacientů po infarktu myokardu léčeno niacinem (se střední dobou uvolňování) a klofibrátem. Léčba vedla k signifikantnímu snížení jak celkové, tak KV mortality o 26 % (p < 0,05), resp. 36 % (p < 0,01), ve srovnání s kontrolní skupinou [34]. Současná doporučení také poukazují na možnost využití fenofibrátu v kombinaci s niacinem [35, 36]. Překážkou ve spolupráci s pacientem a jeho compliance mohou být vedlejší nežádoucí účinky léčby niacinem, zejména flushing. Alternativním přístupem je podávání nové lékové formy niacinu. Jedná se o lék ve formě ER (extended release), jehož podávání vede ke 42% snížení závažnosti a ke 43% snížení délky trvání flushe ve srovnání s projevy provázejícími léčbu běžnou formou niacinu. Další možností je kombinace niacinu ER s laropiprantem, což je inhibitor prostaglandinu D2 (resp. selektivní antagonista receptoru subtypu 1, DP1, pro prostaglandin D2). Niacin spouští uvolňování prostaglandinu D2 a tak vyvolává vazodilataci v kůži a symptomy flushe. Blok uvolňování prostaglandinu D2 by měl vést ke snížení flushe. V současné době očekáváme výsledky studie HPS2-THRIVE (Treatment of HDL to Reduce the Incidence of Vascular Events), která má být dokončena v lednu roku 2013. Kombinační léčba s niacinem může vést ke zhoršení kompenzace glykemie. Zdá se, že u niacinu ER, za předpokladu adekvátního monitorování, je toto riziko nízké. Studie ADVENT (Assessment of Diabetes Control and Evaluation of the efficacy of Niaspan Trial) sledovala 97 stabilních diabetiků 2. typu (průměrná výchozí hodnota HbA1c 7,2 % a glykemie nalačno 7,7 mmol/l), kteří byli léčeni niacinem ER v dávce 1–1,5 g denně po dobu 16 týdnů. Ve srovnání s placebem nebyly prokázány signifikantní rozdíly v průměrné glykemii nalačno, ani klinicky relevantní změny HbA1c [37]. Recentní doporučení American Diabetes Association a doporučení amerických odborných společností uvádějí, že příznivý vliv léčby niacinem je provázen pouze drobnými změnami glykemie, které lze kompenzovat úpravou léčby diabetu [36].
Omega-3 mastné kyseliny mají příznivý vliv na snížení triglyceridemie, zejména postprandiální, a to zejména u jedinců s aterogenní dyslipidemií v rámci metabolického syndromu nebo diabetu 2. typu [38]. Problematikou kombinační léčby statinem a omega-3 mastnými kyselinami se zabývala řada menších studií. Například léčba kombinací omega-3 mastných kyselin (4 g denně) s atorvastatinem (40 mg denně) u obézních inzulin-rezistentních pacientů s dyslipidemií a metabolickým syndromem vedla ke snížení sekrece VLDL-apoB (o 33 %, p < 0,03) a ke zvýšenému odbourávání (fractional catabolic rate) VLDL-apoB (o 68 %, p < 0,03) a k urychlení přeměny VLDL na LDL (o 51 %, p < 0,05) ve srovnání s monoterapií simvastatinem [39].
Léčba mikrovaskulárních komplikací u pacientů s diabetem 2. typu
![Obr. 2 Schematické znázornění vlivu hypolipidemik na patofyziologické mechanismy a komplikace diabetu. Ke vzniku vaskulárních komplikací u diabetu přispívá řada faktorů. Tyto faktory se buď vyvinou v průběhu onemocnění, nebo jsou přítomny již v době stanovení diagnózy. Hypolipidemika, zejména statiny a fibráty, redukují riziko vzniku makrovaskulárních komplikací diabetu a podle recentních údajů také pravděpodobně přispívají ke snížení výskytu mikrovaskulárních komplikací. K ovlivnění reziduálního rizika je kromě léčby hypolipidemiky třeba uplatnit multifaktoriální přístup, který zahrnuje léčbu hyperglykemie, inzulinové rezistence a hypertenze. Přesto pravděpodobně zůstává část rizikových faktorů, které dosud neznáme, neovlivněna; podle [72] – Matikainen, et al., 2010.](https://www.remedia.cz/photo-a-28122---.jpg) Makrovaskulární komplikace přispívají k extenzivnímu nárůstu KVO, a není tudíž překvapující, že je naše pozornost zaměřena na vliv léčby hypolipidemiky na redukci KV rizika. Neméně významná je však možnost prevence a léčby mikrovaskulárních komplikací diabetu, a proto je důležité zabývat se vlivem hypolipidemik v těchto indikacích (obr. 2). Prevalence mikrovaskulárních komplikací T2DM je vysoká již v době diagnózy (UK Prospective Diabetes Study – UKPDS – Group, PROspective pioglitAzone Clinical Trial In macroVascular Events – PROACTIVE – Study Group, Fenofibrate Intervention and Event Lowering in Diabetes – FIELD – Study Group, viz graf 3).
Makrovaskulární komplikace přispívají k extenzivnímu nárůstu KVO, a není tudíž překvapující, že je naše pozornost zaměřena na vliv léčby hypolipidemiky na redukci KV rizika. Neméně významná je však možnost prevence a léčby mikrovaskulárních komplikací diabetu, a proto je důležité zabývat se vlivem hypolipidemik v těchto indikacích (obr. 2). Prevalence mikrovaskulárních komplikací T2DM je vysoká již v době diagnózy (UK Prospective Diabetes Study – UKPDS – Group, PROspective pioglitAzone Clinical Trial In macroVascular Events – PROACTIVE – Study Group, Fenofibrate Intervention and Event Lowering in Diabetes – FIELD – Study Group, viz graf 3).
O lokálních účincích hypolipidemik v cílových tkáních, jako je retina, ledviny a nervový systém, dosud víme jen velmi málo. Mikrovaskulární komplikace vznikají v důsledku diabetické dyslipidemie, následkem zátěže glukózou, 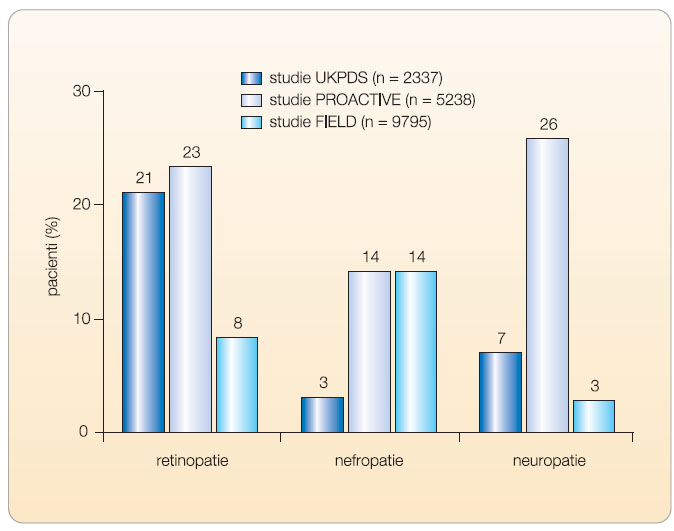 vaskulární dysfunkce, subklinického zánětu a částečně také vlivem hypoglykemických příhod, které zhoršují vaskulární poškození [40]. Úspěch v léčbě je podmíněn délkou trvání diabetu a reverzibilitou mikrovaskulárního poškození. Vliv léčby hypolipidemiky na mikrovaskulární komplikace je spojen s přímým dopadem snížení hladiny lipidů, ale svoji roli mají také pleiotropní nepřímé účinky léčby hypolipidemiky, které zlepšují funkci endotelu, stabilitu aterosklerotického plátu, zeslabují oxidativní stres a zánět, včetně vlivu na inhibici trombogenní aktivity.
vaskulární dysfunkce, subklinického zánětu a částečně také vlivem hypoglykemických příhod, které zhoršují vaskulární poškození [40]. Úspěch v léčbě je podmíněn délkou trvání diabetu a reverzibilitou mikrovaskulárního poškození. Vliv léčby hypolipidemiky na mikrovaskulární komplikace je spojen s přímým dopadem snížení hladiny lipidů, ale svoji roli mají také pleiotropní nepřímé účinky léčby hypolipidemiky, které zlepšují funkci endotelu, stabilitu aterosklerotického plátu, zeslabují oxidativní stres a zánět, včetně vlivu na inhibici trombogenní aktivity.
Studie Steno 2 [10, 11] sledovala 160 pacientů s diabetem 2. typu a perzistentní mikroalbuminurií a zkoumala vliv intenzivní multifaktoriální léčby (v duchu současných léčebných doporučení) ve srovnání s konvenční léčbou. Ve skupině léčené intenzivně užívalo statiny 85 % pacientů ve srovnání s 22 % ve skupině s konvenční léčbou. Během léčebné periody trvající 7,8 roku a následného sledování po dobu 5,5 roku vedla intenzivní léčba ke snížení rizika mikrovaskulárních komplikací včetně nefropatie a terminálního selhání ledvin. Dále došlo ke snížení rizika progrese diabetické retinopatie, léčby laserem a výskytu makulárního edému. Ačkoliv dále došlo ke snížení progrese autonomní neuropatie, periferní neuropatie nebyla ovlivněna. Ze závěrů studie Steno 2 je zřejmé, že ani multifaktoriální léčba (antidiabetika, antihypertenziva, statin) nezabrání vzniku či progresi mikrovaskulární komplikace až u 50 % diabetiků 2. typu.
Retinopatie
Úloha hypolipidemik v prevenci a léčbě diabetické retinopatie zůstává otevřenou otázkou. V patogenezi diabetické retinopatie se uplatňuje jak dyslipidemie, tak další faktory včetně exprese vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF) a zvýšené produkce reaktivních forem kyslíku (reactive oxygen species – ROS) [41]. Recentní elegantní studie in vitro, která zkoumala ovlivnění retinální mikrovaskulatury a endoteliálních buněk, prokázala, že nízká dávka simvastatinu navodila příznivé angiogenní prostředí v důsledku snížení ischemie a prevenci patologické neovaskularizace [42]. Jiná studie na diabetických potkanech prokázala, že simvastatin blokuje zvýšení hladiny VEGF, intracelulárních adhezních molekul-1 (ICAM-1) a ROS navozené hyperglykemií, a chrání tak proti poškození retiny [43]. V léčbě a prevenci diabetické retinopatie se tak pravděpodobně mohou uplatňovat pleiotropní (non-lipidové) účinky statinů.
Tuto teorii dále podpořily dvě kontrolované studie se simvastatinem a atorvastatinem [44, 45], jiná rozsáhlejší však nikoliv [46]. V tomto směru dosud nejrozsáhlejší, i když bez dostatečné statistické síly, randomizovaná kontrolovaná studie CARDS (Collaborative Atorvastatin Diabetes Study) [13] sledovala 2838 diabetiků, u nichž byla prevalence diabetické retinopatie při zahájení studie 30 % a kteří byli léčeni atorvastatinem proti placebu. Během sledování v délce 3,9 roku došlo k signifikantnímu trendu směrem ke snížení potřeby léčby laserem. Je však třeba poznamenat, že retinopatie byla sekundárním cílem studie, že nebyly prováděny fotografie fundu a že stupeň retinopatie byl při zahájení studie posuzován pouze u 65 % pacientů. Významné výsledky přinesla studie FIELD, která prokázala, že diabetici 2. typu mají prospěch z léčby fenofibrátem, protože potřeba první léčby laserem byla snížena o 31 % (CI 0,56–0,84) při pětileté léčebné periodě. Účinek fenofibrátu se uplatňoval u všech typů diabetické retinopatie i u pacientů iniciálně bez retinopatie. Tento účinek byl rychlý (nastával do 8 měsíců od zahájení léčby fenofibrátem), byl aditivní k léčbě krevního tlaku a glykemie a byl zprostředkován nejspíše non-lipidovým efektem [47]. Protože značná část pacientů v kontrolní skupině, která byla léčena kombinací statin a fenofibrát, měla z léčby aditivní prospěch, je pravděpodobné, že monoterapie statinem není dostačující k tomu, aby chránila pacienty před vznikem diabetické retinopatie. V červenci roku 2010 byly publikovány výsledky studie ACCORD-eye, která hodnotila úlohu statinů a fibrátů v prevenci diabetické retinopatie [48]. Analýza zahrnovala podskupinu 2856 účastníků studie ACCORD, u kterých byl posuzován efekt intenzivní nebo standardní léčby glykemie (hladina cílového glykovaného hemoglobinu < 6,0 %, resp. 7,0–7,9 %), dyslipidemie (160 mg fenofibrátu denně/ simvastatin nebo placebo/simvastatin) nebo systolické hypertenze (systolický krevní tlak < 120 mm Hg nebo < 140 mm Hg). U účastníků studie byl hodnocen vliv intervencí v půběhu čtyř let léčby, sledovaným kritériem byla progrese diabetické retinopatie hodnocená třemi nebo více stupni podle Early Treatment Diabetic Retinopathy Study Severity Scale (hodnoceno na stereoskopických snímcích fundu), vznik diabetické retinopatie vyžadující léčbu laserovou fotokoagulací nebo vitrektomií. Po čtyřech letech léčby činila míra progrese diabetické retinopatie 7,3 % při intenzivní kontrole glykemie oproti 10,4 % při standardní léčbě (adjustované OR 0,67; 95% CI 0,51–0,87; p = 0,003); 6,5 % při léčbě fenofibrátem v rámci intenzivní léčby dyslipidemie vs. 10,2 % při léčbě placebem (adjustované OR 0,60; 95% CI 0,42–0,87; p = 0,006) a 10,4 % při intenzivní léčbě hypertenze vs. 8,8 % při standardní terapii (adjustované OR 1,23; 95% CI 0,84–1,79; p = 0,29). Autoři shrnují, že progresi diabetické retinopatie zpomaluje léčba zaměřená na intenzivní kontrolu glykemie a intenzivní kombinační terapie dyslipidemie, nikoliv ale intenzivní kontrola hypertenze.
Nefropatie
Rozsáhlé studie se statiny včetně metaanalýzy HPS a CTT prokázaly, že léčba statiny snižuje u jedinců s diabetickou nefropatií vaskulární morbiditu a mortalitu [12, 14]. Vliv léčby však velmi pravděpodobně závisí na stupni vaskulárního postižení. Wanner a kol. uskutečnili placebem kontrolovanou randomizovanou studii s atorvastatinem, který byl podáván průměrně 2,4 roku 1255 pacientům s diabetem 2. typu (100 %), s ischemickou chorobou srdeční (30 %), s periferním vaskulárním onemocněním (45 %) a cévní mozkovou příhodou (CMP; 18 %). Do studie byli zařazeni pacienti léčení hemodialýzou. Léčba atorvastatinem neovlivnila primární „endpoint” úmrtí na KV onemocnění, nefatální infarkt myokardu nebo CMP (RR 0,93; 95% CI 0,79–1,08), ačkoliv došlo k dramatickému snížení koncentrace LDL z 3,1 mmol/l na 1,9 mmol/l (-42 %) [49]. Podobně rosuvastatin podávaný ve studii AURORA nevedl k pozitivnímu ovlivnění KV mortality [50]. Ve studii Treating to New Targets (TNT) byl hodnocen efekt terapie atorvastatinem na KV riziko pacientů s odhadovanou glomerulární filtrací větší než 60 ml/min/1,73 m2. U pacientů léčených dávkou atorvastatinu 80 mg denně byla progrese renální insuficience signifikantně pomalejší než u pacientů, kteří dostávali 10 mg atorvastatinu denně. Zdá se tedy, že vedle snížení LDL cholesterolemie vede léčba atorvastatinem ke snížení rizika progrese renálního selhání [51]. Vedle tohoto efektu dále došlo k signifikantnímu snížení KV rizika. Autoři studie shrnují, že pacienti s renálním onemocněním ve stadiu 1–3, a zejména diabetici, mají být léčeni statinem, dokud nebude dosaženo cílových hodnot LDL cholesterolemie 1,8 mmol/l. Studie u pacientů s onemocněním ledvin tedy předpokládají, že léčba statiny může zabránit progresi renální dysfunkce alespoň v počátečních stadiích chronického onemocnění ledvin [52]. Proto by měla být léčba statiny zahájena v časné fázi diabetické nefropatie. Údaje o vlivu statinů na prevenci či možnost úpravy mikroalbuminurie jsou omezené. Statiny zlepšují funkci ledvin v rámci diabetické nefropatie ovlivněním lipidogramu, a tak také vedou ke snížení glomerulosklerózy; uplatňují se ale také na lipidech nezávislé vlivy, tj. snížení subklinického zánětu, zlepšení funkce endotelu a průtoku krve ledvinou [53]. Doufáme, že výsledky studie SHARP (Study of Heart and Renal Protection, http: //clinicaltrials.gov/ct2/show/NCT00125593), která hodnotí randomizovaně a prospektivně vliv léčby simvastatinem podávaným v dávce 20 mg denně a simvastatinem 20 mg v kombinaci s ezetimibem 10 mg denně oproti placebu (studie byla uzavřena v září 2010, celkem zahrnula 9438 pacientů s chronickým onemocněním ledvin, z toho cca 6000 v predialyzační fázi a cca 3000 již léčených hemodialýzou), vyjasní roli statinů v rámci diabetické nefropatie.
Data o vlivu léčby fibráty u jedinců s diabetickou nefropatií přinesly další studie. Tonelli a kol. [54] sledovali změnu glomerulární filtrace (GFR) v podskupině 399 z celkového počtu 2531 pacientů z Veterans Administration-High-density lipoprotein Intervention Trial (VAHIT) ve fázi 3 chronického onemocnění ledvin (chronic kidney disease, CKD; GFR 30–59,9 ml/min/1,73 m2). Během 61měsíční periody follow-up nepozorovali autoři při léčbě gemfibrozilem (1200 mg/den) změnu GFR oproti placebu. Naopak, podávání gemfibrozilu vedlo k vyšší incidenci přechodné elevace kreatininemie ≥ 44 mmol/l a současně ke zvýšení CK u celkem 5 pacientů. Tento jev byl pozorován dříve i při terapii jinými fibráty než gemfibrozilem a byl vysvětlován poškozením svalů spíše než skutečnou změnou renálních funkcí. Myopatie v souvislosti s terapií klofibrátem byla u pacientů s nefropatií mimochodem popsána před více než 30 roky a byla důvodem ke všeobecnému odmítavému postoji nefrologů léčit dyslipidemií komplikující CKD. Zcela nové údaje o možném pozitivním efektu fenofibrátu u diabetiků s dyslipidemií a nefropatií přinesly v poslední době zejména subanalýzy studií s fenofibrátem provedené v rámci DAIS (Diabetes Atherosclerosis Intervention Study) a FIELD. Ve studii DAIS [55] vedla léčba diabetiků 2. typu mikronizovaným fenofibrátem po dobu 38 měsíců ke snížení progrese angiograficky dokumentované koronární aterosklerózy a zmírnila dyslipoproteinemii ve srovnání s placebem. Fenofibrát signifikantně zpomaloval progresi nefropatie a zejména albuminurie. Změny v exkreci albuminu byly nezávislé na věku, na změnách koncentrace lipidů a kreatininu, na hmotnosti či krevním tlaku. Ve skupině s fenofibrátem bylo zaznamenáno snížení progrese v exkreci albuminu oproti placebu: 12 (8 %) vs. 28 (18 %) pacientů. Po adjustování na krevní tlak zůstal rozdíl v distribuci pacientů s progresí či regresí a pacientů beze změny signifikantní (p = 0,037). Podobné výsledky přinesla adjustace na kouření nebo výchozí hladiny HbA1c a glykemii. Ze skupiny pacientů s normoalbuminurií před léčbou dospěli do fáze mikroalbuminurie na konci studie 3 pacienti oproti 20 pacientům ve skupině fenofibrát vs. placebo (p < 0,001). Multicentrická, dvojitě zaslepená a placebem kontrolovaná studie FIELD je analýzou efektu fenofibrátu na KV morbiditu a mortalitu u 9795 pacientů s diabetem 2. typu [56]. Vstupním kritériem byla hodnota kreatininemie ≤ 130 µmol/l. U populace léčené fenofibrátem byl prokázán jeho pozitivní vliv na progresi albuminurie (jako časného indikátoru onemocnění ledvin) podobně jako v případě studie DAIS. Léčba fenofibrátem signifikantně redukovala progresi albuminurie. Progrese z normo- na mikroalbuminurii nebo z mikro- na makroalbuminurii byla zaznamenána u 466 pacientů léčených fenofibrátem (10 %) ve srovnání s 539 pacienty (11 %), jimž bylo podáváno placebo. Regrese albuminurie byla častější u nemocných léčených fenofibrátem (p = 0,002 pro všechny skupiny). Počet pacientů, kteří během studie dospěli k hemodialýze, byl 21 ve skupině s placebem, ale jen 16 ve skupině s fenofibrátem.
Neuropatie
Patogeneze diabetické neuropatie je komplexní a její detaily nejsou dosud zcela objasněny. Zahrnuje poruchy vaskulatury, ischemii nervového zásobení, aktivaci aldosoreduktázové cesty a oxidativní stres. Máme k dispozici výsledky epidemiologické studie, která sledovala vztah mezi neuropatií a léčbou hypolipidemiky. Studie prokázala, že statiny i fibráty mohou působit protektivně při rozvoji diabetické periferní senzorické neuropatie [57]. Vliv léčby statiny na diabetickou neuropatii byl zkoumán převážně v několika experimentálních studiích na zvířatech. Výsledky však nejsou jednoznačné, a proto nelze v současné době učinit závěry o vlivu statinů na diabetickou neuropatii. Léčba rosuvastatinem u kmene potkanů typu Zucker s metabolickým syndromem zlepšila rychlost vedení nervem a hypoalgezickou odpověď na termální podnět nejspíše v důsledku snížení koncentrace superoxidu a nitrotyrosinu a spekulativně v důsledku poklesu koncentrace volných mastných kyselin [58]. Jiná studie hodnotila vliv léčby rosuvastatinem na diabetickou neuropatii u myší. Úprava funkce nervů a vasa nervorum zahrnovala non-lipidové mechanismy, zejména úpravu neuronální exprese syntázy oxidu dusnatého. Kromě toho současné podávání specifických inhibitorů syntázy oxidu dusnatého s rosuvastatinem příznivý efekt rosuvastatinu zeslabilo [59]. Studie in vitro prokázaly, že rosuvastatin inhibuje down-regulaci syntázy oxidu dusnatého a upravuje Akt fosforylaci uvnitř Schwannových buněk [59].
![Graf 4 Ovlivnění nutnosti amputace u diabetiků 2. typu ve studii FIELD; podle [61] – Rajamani, et al., 2009.](https://www.remedia.cz/photo-a-28124---.jpg) Diabetická noha vzniká v důsledku diabetické neuropatie a ischemické choroby dolních končetin. Léčba statiny snižuje progresi ischemické choroby dolních končetin, vznik ischemických ulcerací a počet amputací [12] a je také spojena se snížením mortality u pacientů s diabetickou nohou [60]. Subanalýza studie FIELD, publikovaná v roce 2009, hodnotila vliv léčby fenofibrátem na nutnost amputací u diabetiků 2. typu [61]. Studie prokázala, že fenofibrát nutnost amputace redukuje. Kumulativní riziko prokázalo přínos léčby fenofibrátem již za 1,5 roku. Riziko první amputace (uskutečnila se u 115 z 9795 pacientů) bylo u všech léčených o 36 % nižší a riziko amputace pod kotníkem při absenci makroangiopatie (reprezentující „čistou“ formu diabetické neuropatie) bylo dokonce o 47 % nižší (graf 4).
Diabetická noha vzniká v důsledku diabetické neuropatie a ischemické choroby dolních končetin. Léčba statiny snižuje progresi ischemické choroby dolních končetin, vznik ischemických ulcerací a počet amputací [12] a je také spojena se snížením mortality u pacientů s diabetickou nohou [60]. Subanalýza studie FIELD, publikovaná v roce 2009, hodnotila vliv léčby fenofibrátem na nutnost amputací u diabetiků 2. typu [61]. Studie prokázala, že fenofibrát nutnost amputace redukuje. Kumulativní riziko prokázalo přínos léčby fenofibrátem již za 1,5 roku. Riziko první amputace (uskutečnila se u 115 z 9795 pacientů) bylo u všech léčených o 36 % nižší a riziko amputace pod kotníkem při absenci makroangiopatie (reprezentující „čistou“ formu diabetické neuropatie) bylo dokonce o 47 % nižší (graf 4).
Vedlejší účinky a klinická rozvaha při léčbě hypolipidemiky u pacientů s diabetem 2. typu
Přínos léčby statiny u diabetiků je jednoznačný. Při preskripci je nicméně nutno vést v patrnosti tolerabilitu a možné nežádoucí účinky, zejména s ohledem na funkci jater a svalové tkáně. Myopatie indukovaná statiny se objevuje řídce, ale může být spojena se závažnými komplikacemi včetně rhabdomyolýzy [62]. V současné době lze u rizikových pacientů využít možnosti genetické analýzy a lipidomického testování s cílem zlepšit vyhledávání jedinců s geneticky podmíněným zvýšeným rizikem myopatie při léčbě vyššími dávkami statinů. Je popsán význam genotypu SLC01B1, který je spojen se vznikem statinové myopatie [63]. Homozygoti genotypu CC mají 3,2krát vyšší plazmatické koncentrace simvastatinu, 2,4krát vyšší koncentrace atorvastatinu, 1,9krát vyšší koncentrace pravastatinu a 1,7krát vyšší koncentrace rosuvastatinu v plazmě než nositelé genotypu TT. Farmakokinetika lipofilního fluvastatinu se mezi oběma genotypy neliší [64–66]. Další způsob, jak predikovat riziko statinové myopatie, spočívá ve vztahu k plazmatickému lipidomickému profilu, protože svalová exprese arachidonát 5-lipoxygenáza-aktivačního proteinu koreluje s plazmatickou hladinou kreatinkinázy a svalovými symptomy [67].
Také při léčbě kombinací statin/fibrát je třeba respektovat potenciální možnost vzniku myopatie nebo rhabdomyolýzy, i když absolutní riziko je malé. Dalším faktorem jsou rozdíly ve farmakokinetice hypolipidemik [68]. Cytochromy P-450 (CYP) patří mezi biotransformační enzymy; ty jsou odpovědné za detoxikaci a eliminaci organických cizorodých látek (xenobiotik). Reakce katalyzované těmito enzymy se rozdělují na reakce fáze I (funkční) a reakce fáze II (konjugační). Enzymy fáze I (např. cytochrom P-450 nebo epoxidhydroláza) vnášejí do molekuly substrátu funkční skupiny jako např. -OH (hydroxylace); enzymy fáze II (např. glutathion-S-transferázy, N-acetyl-transferázy, UDP-glukuronyltransferázy) pak skupinu -OH používají pro konjugaci kupříkladu s glutathionem, sulfátem, kyselinou glukuronovou apod. za vzniku hydrofilních sloučenin (ve vodě dobře rozpustných), které jsou z organismu snadněji eliminovány. Jsou nejpočetnější skupinou metabolizující léčiva, ale i některé endogenní látky, jako jsou steroidy, mastné kyseliny, prostaglandiny. Provádějí redukci, C-, N-, S-hydroxylaci, dealkylaci, dehalogenaci, deaminaci. Genová nadrodina je tvořena více než 250 geny. Největší obsah je v játrech, ale mohou se nacházet i v jiných tkáních. U člověka bylo charakterizováno více než 30 izoenzymů CYP. Fenofibrát na rozdíl od gemfibrozilu neinteraguje se statiny ani na úrovni cytochromu P-450, ani na úrovni glukuronidizace – je metabolizován subtypy CYP-450 a UDP-glukuronyltransferázy, které statiny k metabolizaci nepotřebují, a proto nevyvolává myopatii. Díky tomuto příznivému metabolismu je kombinace statinů s fenofibrátem mnohem bezpečnější než kombinace s gemfibrozilem, přesto je doporučeno důsledné sledování pacienta kvůli možnému vzniku myopatie (bolesti svalů, zvýšení hladiny kreatinkinázy). Na základě výše uvedených faktů charakterizují současně platná doporučení fenofibrát jako fibrát první volby pro rizikové pacienty s aterogenní dyslipidemií léčené současně statinem [69].
Současná doporučení odborných lékařských autorit lze bez obtíží uplatnit u pacientů s diabetem a klasickými rizikovými KV faktory. Mnohem méně víme o vlivu léčby statiny na mikrovaskulární komplikace. Je důležité uvědomovat si fakt, že u řady podskupin pacientů s diabetem 2. typu – např. žen nebo seniorů – bylo realizováno jen omezené množství randomizovaných kontrolovaných studií s limitovaným počtem sledovaných osob, což ztěžuje klinické rozhodnutí, zda zahájit léčbu statiny, či od ní upustit. Každý lékař musí také zvážit compliance pacienta k dlouhodobé, či dokonce doživotní léčbě. Recentní retrospektivní analýza prokázala, že dlouhodobá adherence k léčbě statiny je u diabetiků suboptimální, protože pouze 65 % z nich pokračovalo v léčbě po 13 letech [70]. Lipidogram nalačno má být u diabetiků 2. typu kontrolován alespoň jednou ročně. To je důležité zejména proto, že léčba statiny je doporučována u velké části populace diabetiků, ale dlouhodobá adherence k léčbě je stále špatná, zejména u těch pacientů, kteří mají malý počet dalších KV rizikových faktorů [70]. Tento fakt mimo jiné zdůrazňuje význam náležitého vztahu lékař–pacient a podtrhuje vedle uplatnění poznatků ze studií také důležitost pravidelných kontrolních návštěv pacientů u lékaře.
Závěr
Léčba statiny u diabetiků 2. typu prokazatelně snižuje KV riziko. Ve skupině aktivně léčených pacientů však stále zůstává signifikantní reziduální riziko. Do budoucna proto musíme hledat odpovědi na takové otázky, zda má být terapie statiny indikována u všech dospělých jedinců souběžně s diagnózou diabetu 2. typu, eventuálně při prvních signálech rozvoje mikrovaskulárních komplikací, nebo zda má být vedena dle současných odborných doporučení. Další otevřenou otázkou jsou indikace ke kombinační léčbě statiny s dalšími hypolipidemiky, jak prokázala recentně např. studie ACCORD [71]. Výběr příslušné kombinace hypolipidemik a sledování možného výskytu nežádoucích účinků, tolerance a compliance pacientů je nutností, zejména s ohledem na zvýšený výskyt lékových interakcí a vedlejších účinků kombinační léčby.
Práce byla podpořena projekty MSM 0021620820 a IGA MZ ČR NS/9743-4.
Seznam použité literatury
- [1] The global challenge of diabetes. Lancet 2008; 371: 1723.
- [2] Kvapil M. Současné možnosti farmakologické léčby hyperlipidémie u diabetes mellitus 2. typu. Remedia 2004; 14: 324–331.
- [3] Svačina Š. Vliv hypolipidemik na mikrovaskulární komplikace diabetu. Remedia 2006; 16: 500–502.
- [4] Taskinen MR. Type 2 diabetes as a lipid disorder. Curr Mol Med 2005; 5: 297–308.
- [5] Keech A, Colquhoun D, Best J, et al. Secondary prevention of cardiovascular events with long-term pravastatin in patients with diabetes or impaired fasting glucose: results from the LIPID trial. Diabetes Care 2003; 26: 2713–2721.
- [6] Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III PRIMARY CARE DIABETES 2010; 4: 9–15.
- [7] Škrha J. Diabetes mellitus 2. typu jako subklinický zánět. Čas Lék čes 2010; 149: 277–281.
- [8] Smith SC, Allen J, Blair SN, et al. AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease: 2006 update. Circulation 2006; 113: 236–272.
- [9] St-Pierre AC, Cantin B, Dagenais GR, et al. Low-density lipoprotein subfractions and the long-term risk of ischemic heart disease in men: 13-year follow-up data from the Quebec Cardiovascular Study. Arterioscler Thromb Vasc Biol 2005; 25: 553–559.
- [10] Gaede P, Vedel P, Larsen N, et al. Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 2003; 348: 383–393.
- [11] Gaede P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008; 358: 580–591.
- [12] Collins R, Armitage J, Parish S, et al. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial. Lancet 2003; 361: 2005–2016.
- [13] Colhoun HM, Betteridge DJ, Durrington PN, et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004; 364: 685–696.
- [14] Cholesterol Treatment Trialists' (CTT) Collaborators, Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008; 371: 117–125.
- [15] American Diabetes Association. Standards of medical care in diabetes – 2009. Diabetes Care 2009; 32: S13–S61.
- [16] Shepherd J, Barter P, Carmena R, et al. Effect of lowering LDL cholesterol substantially below currently recommended levels in patients with coronary heart disease and diabetes: the Treating to New Targets (TNT) study. Diabetes Care 2006; 29: 1220–1226.
- [17] Tenenbaum A, Fisman EZ, Motro M, Adler Y. Optimal management of combined dyslipidemia: what have we behind statins monotherapy? Adv Cardiol 2008; 45: 127–153.
- [18] Verges B. Clinical interest of PPARs ligands. Diabetes Metab 2004; 30: 7–12.
- [19] May HT, Anderson JL, Pearson RR, et al. Comparison of effects of simvastatin alone versus fenofibrate alone versus simvastatin plus fenofibrate on lipoprotein subparticle profiles in diabetic patients with mixed dyslipidemia (from the Diabetes and Combined Lipid Therapy Regimen study). Am J Cardiol 2008; 101: 486–489.
- [20] Frick MH, Elo O, Haapa K, et al. Helsinki Heart Study: primary prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med 1987; 317: 1237–1245.
- [21] Rubins HB, Robins SJ, Collins D, et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. N Engl J Med 1999; 341: 410–418.
- [22] Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease: the Bezafibrate Infarction Prevention (BIP) study. Circulation 2000; 102: 21–27.
- [23] Tenenbaum A, Fisman EZ, Boyko V, et al. Attenuation of progression of insulin resistance in patients with coronary artery disease by bezafibrate. Arch Intern Med 2006; 166: 737–741.
- [24] Tenenbaum A, Motro M, Fisman EZ, et al. Bezafibrate for the secondary prevention of myocardial infarction in patients with metabolic syndrome. Arch Intern Med 2005; 165: 1154–1160.
- [25] Diabetes Atherosclerosis Intervention Study (DAIS) investigators. Effect of fenofibrate on progression of coronary Artery disease in type 2 diabetes: the Diabetes Atherosclerosis Intervention Study, a randomized study. Lancet 2001; 357: 905–910.
- [26] Scott R, O'Brien R, Fulcher G, et al. The effects of fenofibrate treatment on cardiovascular disease risk in 9795 people with type 2 diabetes and various components of the metabolic syndrome: the FIELD study. Diabetes Care 2009; 32: 493–498.
- [27] Jun M, Foote C, Lv J, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet 2010; 375: 1875–1878.
- [28] Hermans MP. Impact of Fenofibrate on Type 2 Diabetes Patients with Features of the Metabolic Syndrome: Subgroup Analysis From FIELD. Curr Cardiol Rev 2010; 6: 112–118.
- [29] Saha A, Arora RR. Fibrates in the prevention of cardiovascular disease in patients with type 2 diabetes mellitus – A pooled meta-analysis of randomized placebo-controlled clinical trials. Int J Cardiol 2010; 141: 157–166.
- [30] ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362: 1563–1574.
- [31] Syvänne M, Taskinen MR. Lipids and lipoproteins as coronary risk factors in non-insulin-dependent diabetes mellitus. Lancet 1997; 350 (Suppl. 1): SI20–SI23.
- [32] Alexander CM, Landsman PB, Teutsch SM, Haffner SM. NCEP-defined metabolic syndrome, diabetes, and prevalence of coronary heart disease among NHANES III participants age 50 years and older. Diabetes 2003; 52: 1210–1214.
- [33] McKenney JM, Farnier M, Lo KW, et al. Safety and efficacy of long-term administration of fenofibrate and ezetimibe in patients with mixed hyperlipidemia. J Am Coll Cardiol 2006; 47: 1584–1587.
- [34] Carlson LA, Rosenhamer G. Reduction of mortality in the Stockholm Ischaemic Heart Disease Secondary Prevention Study by combined treatment with clofibrate and nicotinic acid. Acta Med Scand 1988; 223: 405–418.
- [35] Bultas J. Kombinační léčba dyslipidemií. Interní medicína pro praxi 2006; 7, 8; 314–322.
- [36] Vaverková H, Soška V. Co přinášejí nová doporučení pro diagnostiku a léčbu dyslipidemií. Interní Med 2008; 10: 117–120.
- [37] Grundy SM, Vega GL, McGovern ME, et al. Efficacy, safety, and tolerability of once-daily niacin for the treatment of dyslipidemia associated with type 2 diabetes. Results of the Assessment of Diabetes Control and Evaluation of the Efficacy of Niaspan Trial. Arch Intern Med 2002; 162: 1568–1576.
- [38] Žák A, Tvrzická E, Zeman M, Vecka M. Patofyziologie a klinický význam vícenenasycených mastných kyselin řady n-3. Čas Lék čes 2005; 144 (Suppl. 1): 6–18.
- [39] Chan DC, Watts GF, Barrett PH, et al. Regulatory effects of HMG CoA reductase inhibitor and fish oils on apolipoprotein B-100 kinetics in insulin-resistant obese male subjects with dyslipidemia. Diabetes 2002; 51: 2377–2386.
- [40] Wright RJ, Frier BM. Vascular disease and diabetes: is hypoglycaemia an aggravating factor? Diabetes Metab Res Rev 2008; 24: 353–363.
- [41] Bloomgarden ZT. Diabetic retinopathy and diabetic neuropathy. Diabetes Care 2007; 30: 760–765.
- [42] Medina RJ, O’Neill CL, Devine AB, et al. The pleiotropic effects of simvastatin on retinal microvascular endothelium has important implications for ischaemic retinopathies. PLoS ONE 2008; 3: e2584.
- [43] Al-Shabrawey M, Bartoli M, El-Remessy AB, et al. Role of NADPH oxidase and Stat3 in statin-mediated protection against diabetic retinopathy. Invest Ophthalmol Vis Sci 2008; 49: 3231–3238.
- [44] Sen K, Misra A, Kumar A, Pandey RM. Simvastatin retards progression of retinopathy in diabetic patients with hypercholesterolemia. Diabetes Res Clin Pract 2002; 56: 1–11.
- [45] Gupta A, Gupta V, Thapar S, Bhansali A. Lipid-lowering drug atorvastatin as an adjunct in the management of diabetic macular edema. Am J Ophthalmol 2004; 137: 675–682.
- [46] Zhang J, McGwin G Jr. Association of statin use with the risk of developing diabetic retinopathy. Arch Ophthalmol 2007; 125: 1096–1099.
- [47] Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treatment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007; 370: 1687–1697.
- [48] The ACCORD Study Group and ACCORD Eye Study Group. Effects of Medical Therapies on Retinopathy Progression in Type 2 Diabetes. N Engl J Med 2010; 363: 233–244.
- [49] Wanner C, Krane V, Marz W, et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005; 353: 238–248.
- [50] Fellström BC, Jardine AG, Schmieder RE, et al. AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med 2009; 360: 1395–1407.
- [51] Shepherd J, Kastelein JJ, Bittner V, et al. Treating to New Targets Investigators: Effect of intensive lipid lowering with atorvastatin on renal function in patients with coronary heart disease: the Treating to New Targets (TNT) study. Clin J Am Soc Nephrol 2007; 2: 1131–1139.
- [52] Chan DT, Irish AB, Dogra GK, Watts GF. Dyslipidaemia and cardiorenal disease: mechanisms, therapeutic opportunities and clinical trials. Atherosclerosis 2008; 196: 823–834.
- [53] Athyros VG, Kakafika AI, Karagiannis A, Mikhailidis DP. Do we need to consider inflammatory markers when we treat atherosclerotic disease? Atherosclerosis 2008; 200: 1–12.
- [54] Tonelli M, Collins D, Robins S, et al. Effect of gemfibrozil on change in renal function in men with moderate chronic renal insufficiency and coronary disease. Am J Kidney Dis 2004; 44: 832–839.
- [55] Ansquer JC, Foucher C, Rattier S, et al, for the DAIS Investigators. Fenofibrate Reduces Progression to Microalbuminuria Over 3 Years in a Placebo-Controlled Study in Type 2 Diabetes: Results From the Diabetes Atherosclerosis Intervention Study (DAIS). Am J Kidney Dis 2005; 45: 485–493.
- [56] Keech A, Simes RJ, Barter P, et al. FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005; 366: 1849–1861.
- [57] Davis TM, Yeap BB, Davis WA, Bruce DG. Lipid-lowering therapy and peripheral sensory neuropathy in type 2 diabetes: the Fremantle Diabetes Study. Diabetologia 2008; 51: 562–566.
- [58] CL Oltman, Davidson EP, Coppey L, et al. Attenuation of vascular/neural dysfunction in Zucker rats treated with enalapril or rosuvastatin. Obesity (Silver Spring) 2008; 16: 82–89.
- [59] Li M, Nishimura H, Kusano KF, et al. Neuronal nitric oxide synthase mediates statin-induced restoration of vasa nervorum and reversal of diabetic neuropathy. Circulation 2005; 112: 93–102.
- [60] Young MJ, McCardle JE, Randall LE, Barclay JI. Improved survival of diabetic foot ulcer patients 1995–2008: possible impact of aggressive cardiovascular risk management. Diabetes Care 2008; 31: 2143–2147.
- [61] Rajamani K, Colman PG, Li LP, et al. Effect of fenofibrate on amputation events in people with type 2 diabetes mellitus (FIELD study): a prespecified analysis of a randomised controlled trial. Lancet 2009; 373: 1780–1788.
- [62] Armitage J. The safety of statins in clinical practice. Lancet 2007; 370: 1781–1790.
- [63] SEARCH Collaborative Group, Link E, Parish S, et al. SLCO1B1 variants and Statin-Induced Myopathy – A Genomewide Study. N Engl Med 2008; 359: 789–799.
- [64] Pasanen MK, Neuvonen M, Neuvonen PJ, Niemi M. SLCO1B1 polymorphism markedly affects the pharmacokinetics of simvastatin acid. Pharmacogenet Genom 2006; 16: 873–879.
- [65] Pasanen MK, Fredrikson H, Neuvonen PJ, Niemi M. Different effects of SLCO1B1 polymorphism on the pharmacokinetics of atorvastatin and rosuvastatin. Clin Pharmacol Ther 2007; 82: 726–733.
- [66] Niemi M, Pasanen MK, Neuvonen PJ. SLCO1B1 polymorphism and sex affect the pharmacokinetics of pravastatin but not fluvastatin. Clin Pharmacol Ther 2006; 80: 356–366.
- [67] Laaksonen R, Katajamaa H, Paiva H, et al. A systems biology strategy reveals biological pathways and plasma biomarker candidates for potentially toxic statin-induced changes in muscle. PLoS One 2006; 1: e97.
- [68] Jones PH, Davidson MH. Reporting rate of rhabdomyolysis with fenofibrate and statin versus gemfibrozil and any statin. Am J Cardiol 2005; 95: 120–122.
- [69] Grundy SM, Hansen B, Smith SC Jr, et al. Clinical management of metabolic syndrome: report of the American Heart Association/National Heart, Lung, and Blood Institute/American Diabetes Association conference on scientific issues related to management. Circulation 2004; 109: 551–556.
- [70] Donnelly LA, Doney AS, Morris AD, et al. Long-term adherence to statin treatment in diabetes. Diabet Med 2008; 25: 850–855.
- [71] ACCORD Study Group, JB Buse, JT Bigger, et al. Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial: design and methods. Am J Cardiol 2007; 99: 21i–33i.
- [72] Matikainen N, Kahri J, Taskinen MR. Reviewing statin therapy in diabetes–towards the best practise. Prim Care Diabetes 2010; 4: 9–15.
- [73] Vaverková H, Soška V, Rosolová H, et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Cor Vasa 2007; 49: K73–K86.