Léčba esenciální trombocytémie ve světle důkazů účinnosti, bezpečnosti a stávající zákonné úpravy
Léčba esenciální trombocytémie je soustředěna do specializovaných pracovišť, respektive je těmito pracovišti schvalována. Základní používané terapeutické přístupy vycházejí ze zhodnocení zdravotního stavu konkrétního pacienta, přičemž jsou v léčbě používány anagrelid nebo hydroxymočovina, případně interferon alfa, vždy po vyhodnocení míry rizika pacienta ve vztahu k jeho věku. Vědecké důkazy o účinnosti anagrelidu a hydroxymočoviny a dosavadní klinické zkušenosti lze považovat za jednoznačné. Z hlediska bezpečnosti lze považovat za dosud ne zcela uzavřenou otázku potenciálního leukemogenního účinku hydroxymočoviny. Z právního hlediska žádný léčivý přípravek obsahující hydroxymočovinu nemá schválenou indikaci esenciální trombocytémie, použití takového léčivého přípravku je proto možné pouze za podmínek stanovených zákonem o léčivech. Článek na příkladu léčby esenciální trombocytémie ilustruje stávající zákonná ustanovení platná pro preskripci off-label přípravku a jejich úskalí.
Medicínské aspekty léčby esenciální trombocytémie
Esenciální trombocytémie je chronické myeloproliferativní onemocnění, pro které je charakteristická megakaryocytární hyperplazie s průvodní trombocytózou. Onemocnění často doprovázejí zejména trombotické komplikace nebo hemoragická diatéza vyvolané zvýšením počtu trombocytů s jejich dysfunkcí. V současné době se v podmínkách ČR i v evropském regionu používají k léčbě esenciální trombocytémie léčivé přípravky obsahující léčivou látku anagrelid (v podmínkách ČR obchodován a dostupný jako léčivý přípravek Thromboreductin®) a léčivou látku hydroxymočovinu (v podmínkách ČR obchodována a dostupná jako léčivý přípravek Litalir®, který však má v ČR jiné terapeutické indikace, nikoliv esenciální trombocytémii). Registrované, ale neobchodované jsou dále léčivé přípravky Xagrid® (anagrelid) a Siklos® (hydroxy-močovina). Zatímco léčivý přípravek Xagrid® má prakticky stejné indikace jako Thromboreductin®, v případě léčivého přípravku Siklos® je tomu jinak, na rozdíl od léčivého přípravku Litalir®, který je indikován k léčbě rezistentní chronické leukémie nebo k léčbě karcinomu děložního hrdla, je léčivý přípravek Siklos® indikován k prevenci rekurentních venookluzivních krizí u pacientů trpících srpkovitou anémií [1]. Vedle výše uvedených léčivých přípravků jsou v terapii esenciální trombocytémie používány léčivé přípravky obsahující léčivou látku interferon alfa, v této práci nejsou diskutovány, ale platily by pro ně přiměřeně všechny informace uvedené v části zabývající se právními aspekty léčby on-label/off-label léčivým přípravkem, neboť všechny léčivé přípravky obsahující interferon alfa nemají indikaci esenciální trombocytémie schválenou [1].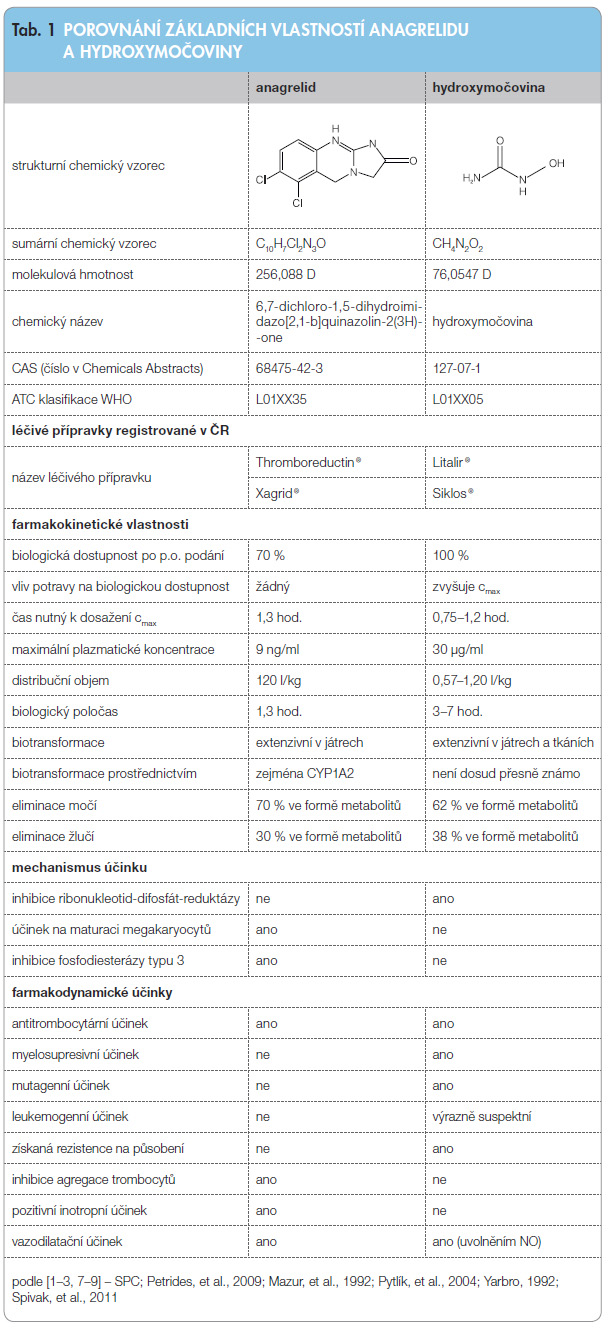
Léčivé přípravky Litalir® a Siklos® nejsou terapeuticky vzájemně zaměnitelné, protože mají zcela odlišné indikace [1], a tím i klinické využití. Léčivé přípravky Thromboreductin® a Xagrid® též nejsou vzájemně terapeuticky zaměnitelné, protože mají zásadně odlišnou biologickou dostupnost [2]. Rozdíly v incidenci nežádoucích účinků těchto dvou léčivých přípravků vedly německé a rakouské autory k provedení studie bioekvivalence uskutečněné ve zkříženém uspořádání u 24 zdravých dobrovolníků, v níž byly prokázány statisticky rozdílné hodnoty výše maximálních plazmatických koncentrací a velikosti plochy pod křivkou svědčící pro nižší hodnoty v případě léčivého přípravku Thromboreductin®. Tuto skutečnost dávají autoři studie do souvislosti s literárními údaji o nižším výskytu nežádoucích účinků tohoto léčivého přípravku a nižším podílu pacientů, u kterých je nutné z důvodu nežádoucích účinků terapii ukončit. V samotné studii bioekvivalence byl pozorován statisticky hraniční trend nižšího výskytu nežádoucích účinků po podání léčivého přípravku Thromboreductin® (celkem 29 nežádoucích účinků ve srovnání se 46 nežádoucími účinky v případě léčivého přípravku Xagrid®). Z klinického hlediska je však důležité, že nebyly prokázány rozdíly ve tromboreduktivní účinnosti těchto dvou léčiv, i když se jednalo o krátkodobou studii (4 týdny) terapeutické ekvivalence u pacientů s esenciální trombocytémií nebo u pacientů s jiným chronickým myeloproliferativním onemocněním [2].
Anagrelid, specifický perorální inhibitor trombopoézy, je významným léčivem u pacientů s histologicky ověřeným mye-
loproliferativním onemocněním (MPO) typu esenciální trombocytémie. Anagrelid je účinný též u trombocytémie doprovázející další typy myeloproliferativních onemocnění včetně primární polycytémie, primární myelofibrózy a chronické myeloidní leukémie, jak ostatně vyplývá z podmínek úhrady stanovených Státním ústavem pro kontrolu léčiv. Jde o látku necytostatické povahy ze skupiny imidazochinazolinů, která, na rozdíl od všech ostatních tromboreduktivních látek, působí selektivně na megakaryopoezu a neovlivňuje počet leukocytů a erytrocytů. Aktivní (účinný) metabolit anagrelidu 3-hydroxyanagrelid ovlivňuje postmitotickou fázi vývoje megakaryocytů. Brání maturaci megakaryocytů, snižuje jejich ploiditu a velikost (nikoliv však počet), což ve svém důsledku vede k tromboredukci dané snížením „odštěpování“ trombocytů z jejich prekurzorů [3–7]. Mechanismus účinku anagrelidu tedy nespočívá v ovlivnění proliferace buněk, ale v ovlivnění jejich dospívání. Anagrelid působí současně jako inhibitor fosfodiesterázy typu III, a proto má antiagregační, vazodilatační a pozitivně inotropní účinky [3, 7].
Mechanismus účinku hydroxymočoviny je velmi komplexní a zahrnuje inhibici řady enzymů, indukci apoptózy a některé další účinky. U esenciální trombocytémie působí hydroxyurea prostřednictvím nitroxidových metabolitů, které vyvolávají inhibici ribonukleotid-difosfát-reduktázy. Tento enzym je složen ze dvou subjednotek, R1 a R2. Subjednotka R1 obsahuje vazebná místa pro alosterické efektory, zatímco menší subjednotka R2 obsahuje nehemové železo a volný tyrosylový radikál, které jsou esenciální pro enzymatickou aktivitu. Metabolity hydroxymočoviny selektivně inaktivují („zhášejí“) volný tyrosylový radikál, čímž inhibují aktivitu výše uvedeného enzymu, a zprostředkovaně pak inhibují i syntézu DNA a následně způsobují smrt buňky v S fázi [8, 9]. Hydroxyurea má tedy nespecifický panmyelosupresivní účinek.
Podle něk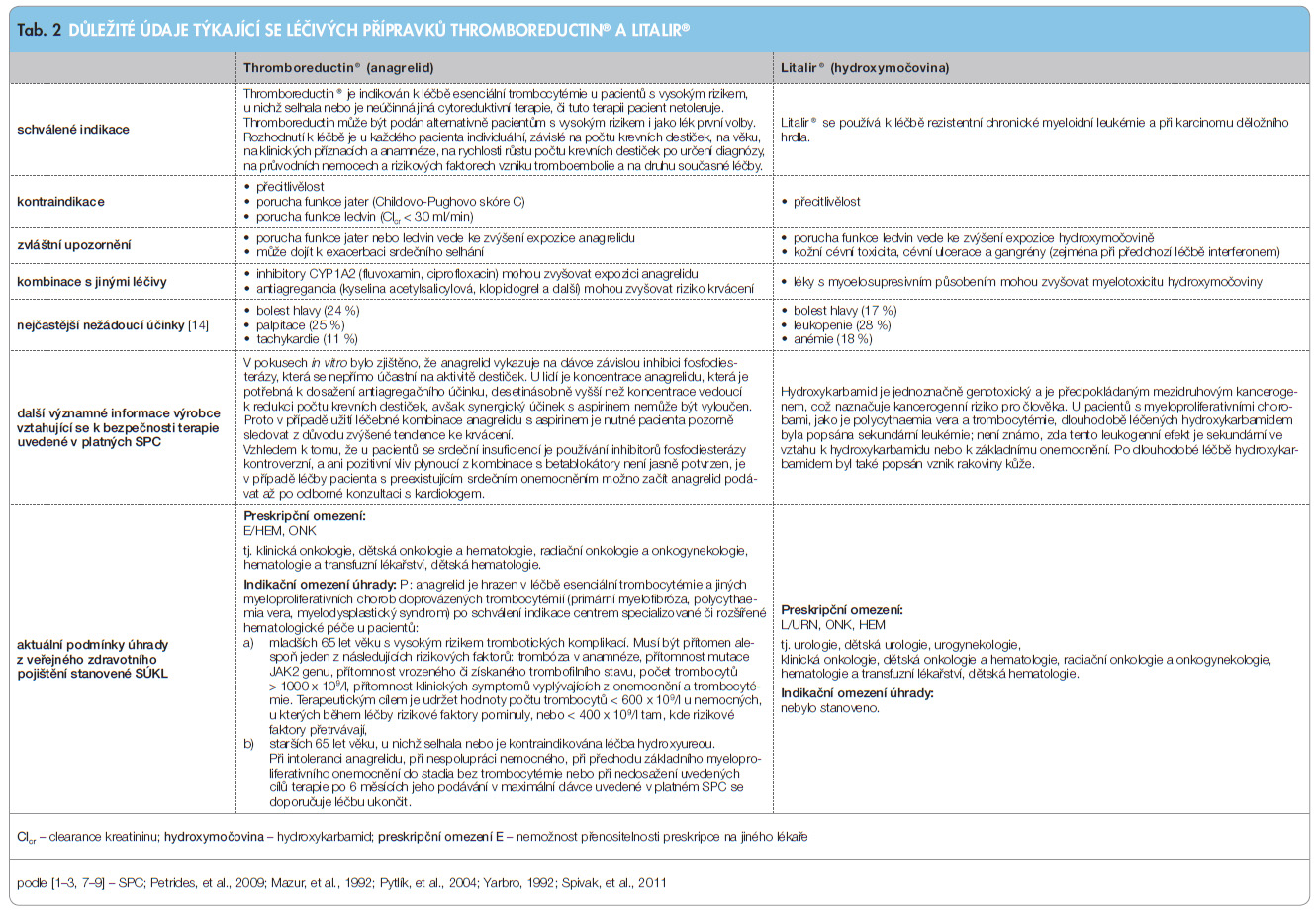 terých zahraničních doporučených postupů je u rizikových pacientů indikovaná léčba esenciální trombocytémie hydroxyureou [10]. V této souvislosti je však třeba uvést, že v některých evropských zemích má hydroxyurea schválenou indikaci esenciální trombocytémie. Ve všech zemích EU je totiž seznam schválených terapeutických indikací součástí závazného souhrnu údajů o přípravku (SPC), který se posuzuje v rámci registračního řízení, jak požaduje směrnice Evropského parlamentu a Rady č. 2001/83/ES ze dne 6. listopadu 2001, ve znění pozdějších předpisů (v tomto ohledu jde zejména o směrnici č. 2004/27/ES ze dne 31. března 2004). Autoři v této souvislosti uvádějí, že např. ve Velké Británii [11] má jeden z registrovaných léčivých přípravků obsahující hydroxymočovinu (Hydroxycarbamide Medac) schválenou indikaci „Treatment of patients with essential thrombocythemia or polycythemia vera with a high risk for thromboembolic complications“.
terých zahraničních doporučených postupů je u rizikových pacientů indikovaná léčba esenciální trombocytémie hydroxyureou [10]. V této souvislosti je však třeba uvést, že v některých evropských zemích má hydroxyurea schválenou indikaci esenciální trombocytémie. Ve všech zemích EU je totiž seznam schválených terapeutických indikací součástí závazného souhrnu údajů o přípravku (SPC), který se posuzuje v rámci registračního řízení, jak požaduje směrnice Evropského parlamentu a Rady č. 2001/83/ES ze dne 6. listopadu 2001, ve znění pozdějších předpisů (v tomto ohledu jde zejména o směrnici č. 2004/27/ES ze dne 31. března 2004). Autoři v této souvislosti uvádějí, že např. ve Velké Británii [11] má jeden z registrovaných léčivých přípravků obsahující hydroxymočovinu (Hydroxycarbamide Medac) schválenou indikaci „Treatment of patients with essential thrombocythemia or polycythemia vera with a high risk for thromboembolic complications“.
Podle národních doporučených postupů vypracovaných Českou pracovní skupinou pro Ph-negativní myeloproliferativní onemocnění a Českou hematologickou společností JEP [12] musí být léčba vždy přísně individuální, zejména ve vztahu ke konkrétním rizikům pacienta včetně rizika biologického vývoje onemocnění. V doporučených postupech se výslovně uvádí, že postup lékaře musí vycházet z principu primum non nocere. K rozhodujícím faktorům, které je nezbytné zhodnotit před zahájením léčby, patří věk pacienta, krevní obraz a stanovení míry rizika konkrétního pacienta (anamnéza trombózy nebo krvácení, trombofilní stavy, mutace JAK2V617F, kardiovaskulární riziko). Z doporučených postupů obecně vyplývá, že léčit tromboreduktivními léčivy je třeba všechny rizikové pacienty – mladší 65 let anagrelidem nebo interferonem alfa a pacienty starší 65 let hydroxymočovinou.
Anagrelid i hydroxymočovina jsou léčiva nepochybně dostatečně účinná a snižují počet trombocytů. Obě léčiva byla srovnávána ve dvou randomizovaných studiích [13, 14]. Ve studii PT1 [13] bylo sledováno celkem 809 pacientů s esenciální trombocytémií, kteří byli léčeni nízkou dávkou kyseliny acetylsalicylové v kombinaci s anagrelidem (n = 405) nebo s hydroxyureou (n = 404), přičemž medián doby sledování byl 39 měsíců. Ve skupině pacientů léčených anagrelidem (v kombinaci s kyselinou acetylsalicylovou) byl zjištěn zvýšený výskyt arteriální trombózy (p = 0,004), závažného krvácení (p = 0,008) a transformace do myelofibrózy (p = 0,01) a současně snížené riziko žilního tromboembolismu (p = 0,006). Pacienti léčení anagrelidem statisticky významně častěji ukončili terapii (p < 0,001). Podle tuzemských autorů byl design této studie nevhodný a výsledky studie byly navíc chybně interpretovány [15]. Ve studii ANAHYDRET [14] bylo sledováno celkem 259 dosud neléčených pacientů s esenciální trombocytémií, kteří byli léčeni buď anagrelidem (n = 122) nebo hydroxymočovinou (n = 137), přičemž celková doba sledování byla 730 pacientoroků (tj. průměrně přibližně 34 měsíců). Během sledování nebyly zjištěny žádné statisticky významné rozdíly ve sledovaných primárních cílech studie (arteriální nebo venózní trombóza, krvácivé příhody, ukončení terapie nebo nedostatečný efekt terapie). V této studii byla prokázána noninferiorita anagrelidu vůči hydroxymočovině.
Pokud vyjdeme z výsledků nedávno publikované studie ANAHYDRET, jsou z hlediska účinnosti, ale i výskytu nežádoucích účinků a podílu pacientů, u nichž byla terapie ukončena, obě terapeutické intervence ekvivalentní (výsledky jsou vztaženy na dobu sledování – 36 měsíců). V této souvislosti se jeví velmi významným porovnání bezpečnostního profilu obou terapeutických intervencí. Bezpečnost terapie u esenciální trombocytémie je totiž vzhledem k dlouhodobosti léčby zcela zásadní.
Anagrelid lze podávat s opatrností u pacientů se srdeční nedostatečností nebo s jiným závažným kardiovaskulárním onemocněním. Důvodem jsou účinky dané inhibicí fosfodiesterázy typu III. Výskyt kardiovaskulárních účinků popisovaných v souvislosti s terapií anagrelidem však není zásadní. Retrospektivní analýza italského registru [16] (tato analýza popisuje výskyt nežádoucích účinků spojených s podáváním léčivého přípravku Xagrid®) sice ukázala přibližně 30% výskyt kardiovaskulárních nežádoucích účinků, avšak naprostou většinu z nich (přibližně 24 %) tvořily palpitace. Kardiovaskulární účinky byly důvodem pro ukončení terapie u 9 pacientů z 232 sledovaných (tj. 3,9 %).
Dostupná data prokazují, že i dlouhodobá terapie anagrelidem (medián 10,8 roku s rozptylem 7–15,5 roku) je bezpečná [17]. Anagrelid nemá mutagenní působení, a ačkoliv nejsou k dispozici standardní studie kancerogenity na experimentálních zvířecích modelech, nebylo dosud v klinické praxi pozorováno kancerogenní nebo leukemogenní působení anagrelidu [1].
Hydroxymočovina je obecně dobře tolerovaným léčivem a dominujícím nežádoucím účinkem je útlum krvetvorby, zejména leukopenie (kolem 28 %) a anémie (kolem 18 %) [14]. Avšak je genotoxická a je mezidruhovým kancerogenem. Zatím není zcela definitivně zřejmé, zda má hydroxymočovina leukemogenní potenciál u člověka [1]. Na základě dosud publikovaných informací však lze vyslovit silné podezření, že by hydroxymočovina mohla mít leukemogenní potenciál při dlouhodobé, více než 10 let trvající terapii [9].
U pacientů s esenciální trombocytémií byl pozorován výskyt akutní leukémie a/nebo myelodysplastického syndromu s výskytem závislým na délce terapie hydroxymočovinou. Ve studiích s délkou sledování do 10 let buď nebyly zaznamenány žádné případy akutní leukémie [18, 19], nebo byly popsány ojedinělé případy [20]. Při dostatečně dlouhé době sledování (více než 10 let) činil výskyt akutní leukémie až téměř 10 % [21].
U pacientů s polycythaemia vera [22] (sledováno bylo 292 pacientů mladších 65 let) bylo riziko vzniku akutní leukémie v prvních letech terapie minimální, po 10leté terapii se blíží 5 % a u pacientů léčených déle než 15 let již přesahuje 10 %. Tyto výsledky byly potvrzeny další analýzou publikovanou v roce 2011 [23]. Sledováno bylo 285 pacientů a kumulativní incidence akutní myeloidní leukémie a/nebo myelodysplastického syndromu činila 6,6 % (po 10leté expozici hydroxymočovině), 16,5 % (po 15leté expozici hydroxymočovině), respektive 24 % (po 20leté expozici hydroxymočovině). Kumulativní incidence myelofibrózy činila 15 %, 24 % a 32 % ve stejných časových odstupech sledování.
Autoři uvádějí, že nemají ambici podrobně rozebírat příčinnou souvislost mezi podáváním hydroxymočoviny a jejím potenciálním leukemogenním působením, jejich snahou bylo pouze upozornit na problém potenciálního velmi závažného nežádoucího účinku, který je odborné obci nepochybně dobře znám, jak ostatně plyne z příslušných doporučených postupů [12].
Právní aspekty léčby on-label/off-label léčivým přípravkem
Při rozhodování o konkrétním způsobu léčby pacienta trpícího esenciální trombocytémií je vždy třeba vycházet z celého komplexu informací. Východiskem jsou samozřejmě informace odborné, vyplývající z provedených klinických studií, které jsou obvykle zcela promítnuty do doporučených postupů. Dalším aspektem, který může být rozhodný, je dosavadní vlastní klinická zkušenost příslušného lékaře a jeho posouzení konkrétního stavu pacienta, jeho onemocnění, eventuální přítomnosti současných komorbidit, eventuální současné komedikace a předpokládané ochoty pacienta na léčbě náležitě spolupracovat. Vedle těchto aspektů by měl však lékař vycházet i z platné zákonné úpravy, zejména za situace, kdy existují alternativní možnosti terapie.
Obecně má pacient podle ustanovení § 28 odst. 2 zákona č. 372/2011 Sb., o zdravotnických službách a jejich poskytování, právo na poskytování zdravotnických služeb na náležité odborné úrovni a lékař má podle ustanovení § 45 odst. 1 tohoto zákona povinnost nejen poskytovat zdravotnické služby na náležité odborné úrovni, ale současně má povinnost vytvořit podmínky a opatření k zajištění uplatňování práv a povinností pacientů.
Podle ustanovení § 45 odst. 2 písm. a) tohoto zákona je poskytovatel zdravotnických služeb povinen informovat pacienta o ceně poskytovaných zdravotnických služeb nehrazených nebo částečně hrazených z prostředků veřejného zdravotního pojištění, a to před jejich poskytnutím.
Podle ustanovení § 7 odst. 1 písm. a) zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů, ve znění pozdějších předpisů, jsou osoby zacházející s léčivy povinny dbát na maximální prospěšnost léčiv při jejich použití a omezit na nejnižší možnou míru nepříznivé důsledky působení léčiv na zdraví člověka a veřejné zdraví, zdraví zvířat a životní prostředí. Podle ustanovení § 7 odst. 1 písm. b) zákona o léčivech pak jsou osoby zacházející s léčivy povinny dodržovat pokyny k zacházení s léčivým přípravkem podle souhrnu údajů o přípravku, pokud nejde o používání léčivých přípravků podle § 8 odst. 3 až 5 zákona o léčivech. Citované ustanovení § 7 odst. 1 písm. b) zákona o léčivech dává všem osobám zacházejícím s léčivy povinnost respektovat v plném rozsahu veškeré údaje obsažené v SPC. Součástí SPC je vždy seznam terapeutických indikací, pro které lze přípravek použít. Pouze v těchto indikacích lze proto daný přípravek použít. Výjimkou z této povinnosti dodržovat pokyny a respektovat údaje obsažené v SPC, tedy i léčebné indikace, je použití přípravku podle § 8 odst. 3 až 5 zákona o léčivech. Toto ustanovení umožňuje použít přípravek způsobem off-label za splnění stanovených podmínek. Podle ustanovení § 8 odst. 4 zákona o léčivech může ošetřující lékař, pokud není léčivý přípravek distribuován nebo není v oběhu léčivý přípravek potřebných terapeutických vlastností, použít registrovaný léčivý přípravek způsobem, který není v souladu s SPC (jde tedy o použití přípravku off-label neboli v neregistrované indikaci), je-li však takový způsob dostatečně odůvodněn vědeckými poznatky. Citované ustanovení § 8 odst. 4 zákona o léčivech tedy umožňuje použití registrovaného přípravku způsobem off-label pouze za splnění těchto podmínek:
- žádný léčivý přípravek potřebných terapeutických vlastností (tj. přípravek, který má v SPC danou terapeutickou indikaci) není registrován, nebo
- léčivý přípravek potřebných terapeutických vlastností (tj. přípravek, který má v SPC danou terapeutickou indikaci) sice je registrován, avšak není distribuován a současně,
- použití přípravku off-label je dostatečně odůvodněno vědeckými poznatky.
Přitom podmínka 3) musí být splněna vždy a současně musí být splněna podmínka 1) nebo 2). V praxi znamená splnění podmínky 1) nebo 2) typicky to, že pacientovi nelze předepsat v dané indikaci přípravek, který má danou indikaci v SPC, neboť takový přípravek je reálně nedostupný.
Skutečnost, že na trhu je registrovaný jiný léčivý přípravek, který v dané indikaci lze z odborného hlediska rovněž použít (a to i tehdy, pokud by jeho použití v dané indikaci bylo uvedeno v některých doporučeních odborných společností), nelze z hlediska zákona o léčivech považovat samu o sobě za dostatečnou pro použití tohoto přípravku v dané indikaci, pokud tato indikace není uvedena v SPC. Tato skutečnost (tj. fakt, že použití v dané indikaci je uvedeno v některých doporučeních odborných společností) svědčí o splnění podmínky sub 3) podle ustanovení § 8 odst. 4 zákona o léčivech, tedy svědčí o tom, že takové použití přípravku v neregistrované indikaci je dostatečně odůvodněno vědeckými poznatky. Nicméně, jak je uvedeno shora, je nutno, aby byla současně splněna některá z podmínek sub 1) nebo sub 2), tedy buď neexistence registrovaného přípravku potřebných terapeutických vlastností či to, že takový přípravek není distribuován.
Nadto je třeba ve všech těchto případech vzít v úvahu skutečnost, že poskytovatel zdravotních služeb odpovídá za škodu na zdraví nebo za usmrcení člověka, ke kterým došlo v důsledku použití léčivého přípravku v jiné než schválené indikaci. Tato odlišná úprava právní odpovědnosti má zásadní význam, a to i s ohledem na skutečnost, že nároky plynoucí z odpovědnosti za škodu na zdraví nemají objektivní promlčecí dobu. I tento fakt je nutno zvážit, a to i v souvislosti například s možným potenciálním leukemogenním působením při dlouhodobém podávání.
Lze tedy shrnout, že po právní stránce je třeba při předpisu léčivého přípravku v neschválené indikaci v ČR mít na paměti následující skutečnosti:
a) pacient musí být náležitě a v dostatečném rozsahu poučen, zejména musí být provedeno poučení o tom, že jde o léčivý přípravek, který není v dané indikaci registrován, přičemž tato poučení by měla zahrnovat i poučení o možných důsledcích takového použití
b) léčivých přípravků, dále je nutné poučení o ceně péče, tyto skutečnosti je nutno uvést do zdravotní dokumentace pacienta;
léčivý přípravek musí být pro konkrétního individuálního pacienta skutečně a prokazatelně potřebný a musí být zřejmé, že nelze
c) použít registrovaný a dostupný léčivý přípravek v dané indikaci schválený, taková situace může nastat např. při kontraindikaci, intoleranci nebo neúčinnosti léčivého přípravku, případně při potřebě kombinované terapie (typicky z důvodu nedostatečné účinnosti léčivého přípravku, tyto skutečnosti je nutno uvést do zdravotní dokumentace pacienta);
použití registrovaného léčivého přípravku v neschválené indikaci (tj. v indikaci jiné, než je uvedena v SPC) musí být podloženo (odůvodněno) vědeckými poznatky, což obecně v případě léčivých přípravků obsahujících léčivou látku anagrelid nebo hydroxyurea splněno nepochybně je;
d ) při použití registrovaného přípravku v jiné než schválené indikaci je třeba počítat s případnou odpovědností za škodu na zdraví nebo za usmrcení člověka, pokud by k této škodě na zdraví či úmrtí došlo v příčinné souvislosti s takovým použitím.
Aktuální podmínky úhrady z veřejného zdravotního pojištění
Léčivý přípravek Thromboreductin® je hrazen z prostředků veřejného zdravotního pojištění, pokud jej předepíše hematolog nebo onkolog, za následujících podmínek úhrady (preskripci nelze „delegovat“ na jiného lékaře).
Anagrelid je hrazen v léčbě esenciální trombocytémie a jiných myeloproliferativních chorob doprovázených trombocytémií (primární myelofibróza, polycythaemia vera, myelodysplastický syndrom) po schválení indikace centrem specializované či rozšířené hematologické péče u pacientů:
a) mladších 65 let věku s vysokým rizikem trombotických komplikací. Musí být přítomen alespoň jeden z následujících rizikových faktorů: trombóza v anamnéze, přítomnost mutace JAK2 genu, přítomnost vrozeného či získaného trombofilního stavu, počet trombocytů > 1000 × 109/l, přítomnost klinických symptomů vyplývajících z onemocnění a trombocytémie. Terapeutickým cílem je udržet hodnoty počtu trombocytů < 600 × 109/l u nemocných, u kterých během léčby rizikové faktory pominuly, nebo < 400 × 109/l tam, kde rizikové faktory přetrvávají;
b)starších 65 let věku, u nichž selhala nebo je kontraindikována léčba hydroxyureou. Při intoleranci anagrelidu, při nespolupráci nemocného, při přechodu základního myeloproliferativního onemocnění do stadia bez trombocytémie nebo při nedosažení uvedených cílů terapie po 6 měsících jeho podávání v maximální dávce uvedené v platném Souhrnu údajů o přípravku se doporučuje léčbu ukončit.
Léčivý přípravek Litalir® je hrazen z prostředků veřejného zdravotního pojištění, pokud jej předepíše hematolog, onkolog nebo urolog, přičemž další podmínky úhrady (indikační omezení) nebyly stanoveny.
Léčivý přípravek Litalir® není, podle názoru autorů tohoto sdělení, hrazen z prostředků veřejného zdravotního pojištění v indikaci esenciální trombocytémie. Důvodem tohoto názoru autorů je skutečnost, že zákon č. 48/1997 Sb. o veřejném zdravotním pojištění, v platném znění, výslovně uvádí v ustanovení § 39b odst. 3, že Státní ústav pro kontrolu léčiv může stanovit úhradu u registrovaného léčivého přípravku i pro indikace v SPC neuvedené, jestliže je použití léčivého přípravku dostatečně odůvodněno současným vědeckým poznáním a je-li použití léčivého přípravku jedinou možností léčby nebo je-li nákladově efektivní ve srovnání se stávající léčbou.
O výši a podmínkách úhrady léčivého přípravku Litalir® bylo rozhodováno v roce 2010 Státním ústavem pro kontrolu léčiv, tedy již v době platnosti výše citovaného ustanovení § 39b odst. 3 (spisová značka příslušného správního řízení je SUKLS82579/2010 a rozhodnutí vydané v tomto řízení nabylo právní moci dne 16. 10. 2010), přičemž léčivý přípravek nebyl zařazen do žádné referenční skupiny, úhrada byla stanovena ve výši 976,79 Kč (nyní, v důsledku zvýšení DPH, činí 1023,02 Kč) a podmínky úhrady byly stanoveny následovně: L/URN, ONK, HEM. Nebyly tedy schváleny žádné podmínky úhrady v neschválené (neregistrované) indikaci. Proto v takovéto neschválené indikaci hrazen není.
Závěrem je ale nutno podotknout, že právní výklad a podmínky úhrady jsou věc jedna a prospěch pacienta věc druhá. Je vždy plně na ošetřujícím lékaři, jakou léčebnou metodu vybere, aby z ní měl konkrétní pacient co největší prospěch. Dle současného vědeckého poznání a doporučených postupů má hydroxymočovina své nezastupitelné místo v léčbě některých pacientů s myeloproliferativním onemocněním. Autoři chtěli upozornit na daný problém a podnítit veřejnou diskusi a případná jednání mezi plátci veřejného zdravotního pojištění, odbornými společnostmi a výrobci léčiv, aby se tato medicínsko-právní úskalí vyřešila a léčba se tím stala schůdnou jak pro pacienty, tak pro lékaře. Podobných případů je totiž v současné době ve farmakoterapii více.
Seznam použité literatury
- [1] znění platných SPC uvedené na adrese: http://www.sukl.cz/modules/medication/search.php
- [2] Petrides PE, et al. Pharmacokinetics, Bioequivalence, Tolerability, and Effects on Platelet Counts of Two Formulations of Anagrelide in Healthy Volunteers and Patients With Thrombocythemia Associated With Chronic Myeloproliferation. Clin Ther 2009; 31: 386–398.
- [3] Mazur EM, et al. Analysis of the mechanism of anagrelide-induced thrombocytopenia in humans. Blood 1992; 79: 1931–1937.
- [4] Solberg LA, et al. The effects of anagrelide on human megakaryocytopoiesis. Br J Haematol 1997; 99: 174–180.
- [5] Pescatore SL, Lindley C. Anagrelide: a novel agent for the treatment of myeloproliferative disorders. Expert Opin Pharmacother 2000; 1: 537–546.
- [6] Petrides PE. Anagrelide a decade of clinical experience with its use for the treatment of primary thrombocythaemia. Expert Opin Pharmacother 2004; 5: 1781–1798.
- [7] Pytlík R, et al. Úloha anagrelidu v léčbě esenciální trombocytemie. Transf Hematol dnes 2004; 10: 154–160.
- [8] Yarbro JW. Mechanism of action of hydroxyurea. Semin Oncol 1992; 19 (suppl 9): 1–10.
- [9] Spivak JL, Hasselbalch H. Hydroxycarbamide: a user’s guide for chronic myeloproliferative disorders. Expert Rev Anticancer Ther 2011; 11: 403–414.
- [10] Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol 2011; 29: 761–770.
- [11] http://www.medicines.org.uk/emc/medicine/18928/SPC/Hydroxycarbamide+medac+500+mg+capsule%2c+hard/
- [12] M. Penka, et al. Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací. Vnitř Lék 2011; 57: 189–213.
- [13] Harrison CN, et al. Hydroxyurea compared with anagrelide in high-risk essential thrombocythemia. N Engl J Med 2005; 353: 33–45.
- [14] Gisslinger H, Gotic M, Holowiecki J, et al. Anagrelide compared with hydroxyurea in WHO-classified Essentials thrombocythemia: the ANAHYDRET Study, a randomized controlled trial. Blood 2013; 121: 1720–1728.
- [15] Schwarz J, et al. Analysis of risk factors: the rationale of the guidelines of the Czech Hematological Society for diagnosis and treatment of chronic myeloproliferative disorders with thrombocythemia. Semin Thromb Hemost 2006; 32: 231–245.
- [16] Gugliotta L, et al. Low impact of cardiovascular adverse events on anagrelide treatment discontinuation in a cohort of 232 patients with essential thrombocythemia. Leuk Res 2011; 35: 1557–1563.
- [17] Storen EC, Tefferi A. Long-term use of anagrelid in young patients with essential thrombocythemia. Blood 2001; 97: 836–866.
- [18] Palandri F, Catani L, Testoni N, et al. Long-term follow-up of 386 consecutive patients with Essentials thrombocythemia: safety of cytoreductive therapy. Am J Hematol 2009; 84: 215–220.
- [19] Bernasconi P, Boni M, Cavigliano PM, et al. Acute myeloid leukemia (AML) having evolved from essentials thrombocythemia (ET): distinctive chromosome abnormalities in patients treated with pipobroman or hydroxyurea. Leukemia 2002; 16: 2078–2083.
- [20] Radaelli F, Onida F, Rossi FG, et al. Second malignancies in Essentials thrombocythemia (ET): a retrospective analysis of 331 patients with longterm follow-up from a single institution. Hematology 2008; 13: 195–202.
- [21] Kiladjian JJ, et al. Long-term incidence of hematological evolution in three French prospective studies of hydroxyurea and pipobroman in polycythemia vera and essential thrombocythemia. Semin Thromb Hemost 2006; 32: 417–421.
- [22] Najean Y, Rain JD. Treatment of polycythemia vera: the use of hydroxyurea and pipobroman in 292 patients under the age of 65 years. Blood 1997; 90: 3370–3377.
- [23] Kiladjian JJ, Chevret S, Dosquet C, et al. Treatment of polycythemia vera with hydroxyurea and pipobroman: final results of a randomized trial initiated in 1980. J Clin Oncol 2011; 29: 3907–3913.