Léčba gastrointestinálních stromálních tumorů
Gastrointestinální stromální tumory (GIST) byly dlouhou dobu mylně řazeny do skupiny leiomyomů, leiomyosarkomů nebo leiomyoblastomů. Základem jejich terapie je léčba chirurgická. GIST se vyznačují rezistencí na chemoterapii a radioterapii. Po zavedení inhibitorů tyrozinkináz (TKI, tyrosine kinase inhibitors), imatinib mesylátu a sunitinib malátu, jsou dnes k dispozici účinné léky v terapii pokročilých a metastatických gastrointestinálních stromálních tumorů. Výsledky klinických studií rovněž potvrdily význam imatinibu v adjuvantní léčbě.
Epidemiologie
Gastrointestinální stromální tumory (GIST) představují 0,1–3 % všech nádorů trávicího ústrojí a přibližně 5 % sarkomů měkkých tkání. Incidence činí přibližně 11–15 případů/milion obyvatel. Průměrný věk pacientů je 60 let.
Definice
Současná definice GIST je poněkud široká. Jedná se o skupinu neepitelových nádorů trávicího traktu tvořených vřetenitými a/nebo epiteloidními buňkami, výjimečně jde o pleiomorfní mezenchymální nádory. Většina autorů předpokládá původ v progenitorové buňce diferencující se směrem ke Cajalovým intersticiálním buňkám, které jsou považovány za pacemakery hybnosti žaludku a střev a vyznačují se expresí c-kit (CD117 proteinu). V současné době již není za nezbytnou podmínku diagnózy GIST považována exprese KIT proteinu a většina autorů nepokládá za zcela vylučující ani absenci mutace KIT (a případně PDGFRA ) genu při odpovídající morfologii. U těchto nádorů se GIST stává diagnózou per exclusionem po vyloučení ostatních mezenchymálních lézí trávicího traktu [1–7].
Lokalizace a makroskopický nález
V typických případech se tento nádor tvoří v žaludku (60–70 %) nebo v tenkém střevě (20–25 %), příležitostně však může vzniknout také v rektu nebo v tlustém střevě (5 %), vzácně i v jícnu (< 5 %). Méně často se stromální tumory nacházejí mimo trávicí trubici, a to v mezenteriu, omentu a retroperitoneu, vzácně v pankreatu, žlučníku; ojedinělé práce popisují stromální tumory primárně i v seróze močového měchýře, v prostatě a ve vagině. Stromální nádory žaludku mají příznivější prognózu než nádory intestinální.
Při své nejčastější lokalizaci v trávicí trubici vycházejí z některé vrstvy pod sliznicí, nejčastěji z muscularis propria, a vyklenují se většinou do lumina, případně na serózní povrch žaludku či střeva. Často dochází k ulceraci přilehlé sliznice. Tumory bývají dobře ohraničené, někdy s tenkou pseudokapsulou, z níž mohou do nádoru vybíhat septa rozdělující jej na pseudolobuly. Jejich konzistence je elastická, pokud není změněna regresivními změnami, jako je nekróza, prokrvácení, kalcifikace nebo pseudocystická přeměna [7].
Histologický nález
Klasicky se gastrointestinální stromální tumory rozdělují na dvě hlavní skupiny: vřetenobuněčné a epiteloidní. Četné nádory mají smíšený fenotyp. Imunohistochemické vyšetření zahrnuje především stanovení CD117 (KIT) jako zlatý standard v konfirmaci diagnózy GIST. Dalšími pozitivními markery jsou PDGFR-alfa, DOG1 (discovered on GIST-1), protein-kináza C-theta a CD34.
Molekulární genetika
Gastrointestinální stromální tumory jsou spojovány s mutacemi genů dvou receptorových tyrozinkináz: KIT a PDGFRalfa (platelet-derived growth factor receptor alfa, receptor alfa destičkového růstového faktoru). Mutace či deregulace genů pro receptory s vnitřní tyrozinkinázovou aktivitou mohou vést k propagaci aberantního proliferačního signálu, který vzniká nezávisle na přítomnosti ligandu (ligand-independent signaling) a který hraje klíčovou roli při maligní transformaci a při přežívání a proliferaci nádorových buněk. KIT receptor je transmembránový protein, který se skládá z části extracelulární, transmembránové a intracelulární. Extracelulární část vytváří receptor pro specifický ligand a část intracelulární je nositelem tyrozinkinázové domény, která je aktivována konformačními změnami proteinu po vazbě ligandu. Tato aktivace vede k dimerizaci příslušné receptorové tyrozinkinázy a k autofosforylaci tyrozinových zbytků v tyrozinkinázové doméně, čímž se stabilizuje vazebné místo pro intracelulární signální molekuly.
Přibližně 95 % gastrointestinálních stromálních tumorů obsahuje aktivující mutaci v
KIT protoonkogenu, kdežto 3–5 % pacientů může mít mutaci v PDGFRA , genu kódujícím receptor alfa destičkového růstového faktoru (PDGFRalfa) s minimální nebo žádnou expresí KIT . Lidský KIT je lokalizován na dlouhém ![Obr. 1 KIT receptor a jeho možné mutace; volně podle [1] – D’Amato, et al., 2005.](https://www.remedia.cz/photo-a-27729---.jpg) raménku 4. chromozomu a skládá se z 21 exonů. Exony 2–9 kódují extracelulární domény, exon 10 kóduje transmembránovou, exon 11 juxtamembránovou a exony 13–20 kódují dvoudílnou tyrozinkinázovou doménu [8, 9]. Nejčastější je mutace exonu 11 KIT juxtamembránové domény, mutace exonu 9 je specifická pro intestinální stromální tumory, viz obr. 1 [1].
raménku 4. chromozomu a skládá se z 21 exonů. Exony 2–9 kódují extracelulární domény, exon 10 kóduje transmembránovou, exon 11 juxtamembránovou a exony 13–20 kódují dvoudílnou tyrozinkinázovou doménu [8, 9]. Nejčastější je mutace exonu 11 KIT juxtamembránové domény, mutace exonu 9 je specifická pro intestinální stromální tumory, viz obr. 1 [1].
Gen kódující PDGFRA je lokalizován na dlouhém raménku 4. chromozomu v těsné blízkosti genu KIT a má s ním podobnou strukturu. Tvoří jej 23 exonů, extracelulární domény zde kódují exony 2–10, transmembránovou doménu kóduje exon 11, juxtamembranózní doména je kódována exonem 12 a exony 14–21 kódují intracelulární dvoudílnou tyrozinkinázovou doménu [10].
Prognostické faktory
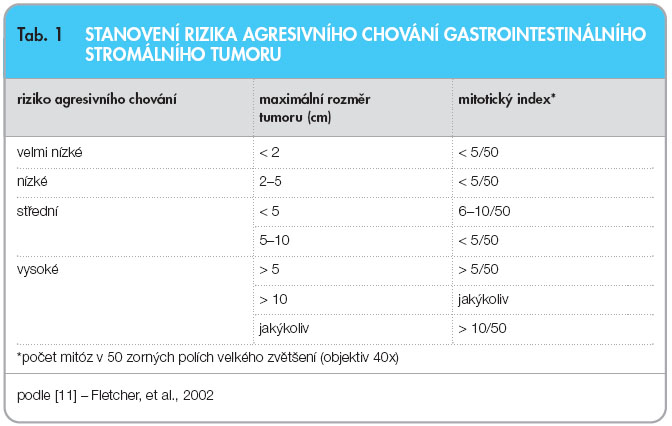 Celkem 10–30 % gastrointestinálních stromálních tumorů je vysoce maligní povahy, metastazují nejčastěji do jater a peritonea. V současnosti patří mezi dva základní faktory agresivního chování rozměr nádoru a mitotický index; podle nich se nádory rozdělují do čtyř skupin: s velmi nízkým, nízkým, středním a vysokým rizikem agresivního chování, viz tab. 1 [11]. Biologické chování ovlivňuje i primární lokalizace nádoru, nádory lokalizované v oblasti žaludku se vyznačují lepší prognózou než nádory tenkého a tlustého střeva a nádory extraintestinální.
Celkem 10–30 % gastrointestinálních stromálních tumorů je vysoce maligní povahy, metastazují nejčastěji do jater a peritonea. V současnosti patří mezi dva základní faktory agresivního chování rozměr nádoru a mitotický index; podle nich se nádory rozdělují do čtyř skupin: s velmi nízkým, nízkým, středním a vysokým rizikem agresivního chování, viz tab. 1 [11]. Biologické chování ovlivňuje i primární lokalizace nádoru, nádory lokalizované v oblasti žaludku se vyznačují lepší prognózou než nádory tenkého a tlustého střeva a nádory extraintestinální.
Prediktivní faktory odpovědi na léčbu imatinib mesylátem
Tumory s mutací exonu 11 KIT nebo exonu 12 PDGFRA jsou obecně považovány za responzivní (odpovídají na léčbu), zatímco nádory s mutací exonu 17 KIT nebo exonu 18 PDGFRA za primárně rezistentní.
V klinických studiích se četnost dosažení parciální remise (PR) u gastrointestinálních stromálních tumorů s mutací v exonu 11 KIT pohybovala v rozmezí 69–83,5 %, zatímco u nádorů s mutací v exonu 9 stejného genu to bylo v rozmezí 34–47,8 %. Bylo zjištěno, že zvýšení dávky imatinibu na 800 mg/den vede u GIST s mutací v exonu 9 KIT k signifikantnímu prodloužení intervalu bez progrese onemocnění [12]. KIT a PDGFRA-wild type GIST byly původně považovány za rezistentní vůči působení imatinib mesylátu, nicméně i u nich byla prokázána jeho účinnost, ať už v navození parciální remise, nebo stabilizace onemocnění [13]. Rozporuplnost výsledků může být dána skutečností, že se jedná o značně heterogenní skupinu tumorů. Například GIST u pacientů s neurofibromatózou 1. typu jsou imatinib-senzitivní, přestože jsou typicky KIT i PDGFRA-wild type [14].
Klinické symptomy
Příznaky nemoci jsou obvykle nespecifické, zahrnují nadýmání, pocit plnosti, bolesti, krvácení, úbytek hmotnosti, obstipaci, dysfagie nebo únavu.
Léčebné možnosti
Základem léčby lokalizovaného gastrointestinálního stromálního tumoru je chirurgická resekce. Radikální chirurgický výkon s dosažením R0 resekce (tzn. okraje tkáně bez nádoru, potvrzeno mikroskopicky) je nejdůležitějším faktorem pro přežití nemocného. Regionální lymfaden-ektomie není standardním postupem. Při operaci by se mělo zabránit ruptuře nádoru, protože může dojít ke vzniku ![Obr. 2 Algoritmus léčby neresekabilních/metastatických gastrointestinálních stromálních tumorů (GIST); podle [15] – NCCN. Clinical practise guidelines. SST.V.2.2009.](https://www.remedia.cz/photo-a-27731---.jpg) peritoneálních implantačních metastáz. Do pěti let po operaci dochází téměř u 50 % pacientů k recidivě nádoru. Nejčastějšími místy recidivy jsou povrch peritonea a játra. Extrémně vzácné jsou metastázy do lymfatických uzlin. Diseminace do plic nebo jiných extraabdominálních lokalit se pozoruje jenom v pokročilých případech onemocnění. Pětileté přežití po kurativní resekci představuje 50–65 %. V případě inkompletní resekce či diseminace onemocnění je medián přežití < 1 rok, 5leté přežití < 35 %. Primární chirugická léčba pro metastazující GIST je vyhrazena jen pro nemocné s krvácením či obstrukcí. U pacientů s hraničně resekabilním onemocněním nebo s rizikem závažné operační morbidity má být zahájena neoadjuvantní léčba imatinibem, viz obr. 2 [15].
peritoneálních implantačních metastáz. Do pěti let po operaci dochází téměř u 50 % pacientů k recidivě nádoru. Nejčastějšími místy recidivy jsou povrch peritonea a játra. Extrémně vzácné jsou metastázy do lymfatických uzlin. Diseminace do plic nebo jiných extraabdominálních lokalit se pozoruje jenom v pokročilých případech onemocnění. Pětileté přežití po kurativní resekci představuje 50–65 %. V případě inkompletní resekce či diseminace onemocnění je medián přežití < 1 rok, 5leté přežití < 35 %. Primární chirugická léčba pro metastazující GIST je vyhrazena jen pro nemocné s krvácením či obstrukcí. U pacientů s hraničně resekabilním onemocněním nebo s rizikem závažné operační morbidity má být zahájena neoadjuvantní léčba imatinibem, viz obr. 2 [15].
Farmakologická léčba
Rezistence gastrointestinálních stromálních tumorů na konvenční typy chemoterapie je známá. Průlomem v léčbě bylo zavedení nových molekul do klinické praxe, konkrétně imatinibu a sunitinibu. Mluvíme o léčbě cílené neboli „targeted therapy“. Primární systémovou léčebnou modalitou je imatinib mesylát, který je indikován je k léčbě pacientů s KIT (CD117) pozitivními inoperabilními a/nebo metastatickými maligními stromálními tumory zažívacího traktu. Indikace se rozšířila také na léčbu adjuvantní [16]. Výsledky klinické studie fáze III, kdy bylo testováno podání cílené adjuvantní léčby po resekci lokalizovaného primárního gastrointestinálního stromálního tumoru, ukazují, že imatinib prodlužuje přežití bez progrese.
Imatinib mesylát
Imatinib mesylát je perorální léčivo, malá molekula, která působí jako selektivní inhibitor tyrozinkinázových domén různých receptorů (KIT, PDGFRalfa, ABL a BCR-ABL). Imatinib je chemicky 4-[(4-methylpiperazin-1-yl)methyl]-N-[4-methyl-3-[(4-pyridin-3-ylpyrimidin-2-yl)amino]fenyl]benzamid. Vyskytuje se ve formě soli jako imatinib mesylát.
Imatinib byl nejprve použit v léčbě chronické myeloidní leukemie. V roce 2000 byla poprvé prokázána účinnost imatinibu v léčbě metastatického GIST [17] a tato účinnost byla později potvrzena v klinických studiích fáze II a III (zejména rozsáhlá klinická studie fáze III B2222). V současnosti je imatinib mesylát indikován v 1. linii systémové léčby pacientů s KIT (CD117) pozitivním gastrointestinálním stromálním nádorem, který je inoperabilní a/nebo metastatický. Klinický prospěch (dosažení parciální remise, kompletní remise nebo stabilního onemocnění) je zaznamenáván u 68–84 % pacientů. Medián celkového přežití je 57 vs. 19 měsíců u historické skupiny. Kompletní remise bylo dosaženo u 5 % pacientů, parciální remise u 47 % a stabilizace onemocnění u 32 % pacientů. Předpovědním faktorem odpovědi na imatinib a přežití je mutační status nádoru. Ve sloučené analýze 1640 pacientů s metastatickým gastrointestinálním tumorem léčených ve dvou studiích fáze III měli nejdelší přežití bez progrese pacienti s mutací exonu 11 genu KIT , nejhorších výsledků bylo dosaženo u pacientů s mutací exonu 9 KIT ; délka přežití pacientů bez mutace KIT nebo PDGFRalfa ležela zhruba uprostřed [18].
Dávkování
Počáteční dávka imatinibu je 400 mg denně. K monitorování léčebné odpovědi se používá CT, MRI a PET, nebo PET/CT, a to v pravidelných intervalech. K hodnocení se používají standardní RECIST kritéria. Jako vhodnější se nicméně jeví kritéria léčebné odpovědi podle Choie, protože hodnotí nejen velikost a počet nádorových ložisek, ale i jejich denzitu.
V případě progrese onemocnění při léčbě 400 mg imatinibu denně se dávka zvyšuje na 800 mg denně. Přínos z eskalace dávky prokázaly klinické studie S0033 a EORTC 60025 [19, 20]. Denní iniciální dávka 800 mg ve srovnání s dávkou 400 mg nezměnila celkové přežití, ale mírně prodloužila tříleté přežití bez progrese (34 vs. 30 %). Prodloužené přežití bez progrese bylo nejvíce patrné u pacientů s mutacemi exonu 9 KIT léčených počáteční dávkou 800 mg, ve srovnání s pacienty, kteří dostávali dávku 400 mg. Studie BFR14 prokázala přínos z pokračování v léčbě imatinib mesylátem po dosažení kompletní či parciální remise. Po jejím přerušení dochází u většiny pacientů k rychlým recidivám [21, 22].
Nežádoucí účinky
Nejčastějšími nežádoucími účinky při léčbě imatinibem jsou retence tekutin (otoky víček, obličeje, dolních končetin, méně často pleurální výpotek, ascites, plicní edém, rychlý přírůstek tělesné hmotnosti se superficiálními otoky nebo bez nich), poruchy pohybového aparátu (svalové křeče, bolesti svalů, kloubů a kostí), gastrointestinální (nevolnost, žaludeční dyspepsie, průjem, bolesti břicha), únava, vyrážka, pruritus, alergické kožní reakce. Nebezpečná může být hepatotoxicita, vzácně vedoucí k selhání jater; doporučuje se sledovat jaterní testy a omezit podávání paracetamolu nebo paracetamol nepodávat vůbec. Z hematologických nežádoucích účinků jsou to zejména neutropenie a trombocytopenie. Během léčby imatinib mesylátem u pacientů po tyreoidektomii, kteří dostávají substituční terapii levothyroxinem, byly popsány případy hypotyreózy, proto je třeba důkladně kontrolovat hladiny TSH.
Nežádoucí účinky jsou většinou mírné a odeznívají během několika dnů či týdnů po vysazení léčby.
Rezistence na imatinib mesylát
Získaná rezistence na imatinib u pacientů s metastatickým GIST, kteří zpočátku na podání léku odpověděli, je častá. K progresi nádoru dochází s odstupem doby s mediánem 18–24 měsíců [23, 24], obvykle po vzniku sekundární mutace genu KIT
.Primární rezistence (tj. progrese onemocnění po 2–3 měsících léčby, přibližně u 12–14 % pacientů) je nejčastější u pacientů s mutací KIT exonu 9 a PDGFRA exonu 18.
Sekundární rezistence (tj. iniciální stabilizace onemocnění při léčbě imatinibem, po které dochází k progresi, nebo k relapsu, přibližně u 50 % pacientů po 2 letech léčby) vzniká především u pacientů s nádory se sekundární mutací KIT nebo PDGFRA , amplifikací KIT nebo PDGFRA s následnou overexpresí příslušné receptorové tyrozinkinázy; dále může docházet k aktivaci alternativní receptorové tyrozinkinázy, nebo vzniká funkční rezistence. Dojde-li ke klinické progresi, je u některých pacientů možno navodit léčebnou odpověď zvýšením dávky imatinibu nebo podáním multikinázového inhibitoru tyrozinkinázy sunitinibu [25, 26].
Snaha o překonání primární a sekundární rezistence GIST vedla k vývoji nových inhibitorů receptorových tyrozinkináz (RTK), z nichž u sunitinibu bylo již prokázáno prodloužení přežití po selhání léčby imatinibem a vyšší senzitivita u nádorů s mutací v exonu 9 KIT a u KIT-wild type GIST [27]. Dalšími novými inhibitory RTK jsou nilotinib a dasatinib, inhibitor ras-dependentního aktivátoru MAPK-proteinkinázy C (PKC412), inhibitor HSP 90 (heat shock protein 90) bránící degradaci KIT nebo inhibitor fosfoinositid-3-kinázy.
Adjuvantní léčba
Účinnost imatinibu, sklon nádorů k recidivě po resekci a nedostatek účinných konvenčních chemoterapeutik byly důvody pro ověření přínosu adjuvantního podávání imatinibu nemocným s GIST. Stěžejními studiemi adjuvantního podávání imatinibu v léčbě pacientů s GIST jsou studie ACOSOG Z9000 a ACOSOG Z9001 [28, 29]. Adjuvantní léčba je přínosem zejména pro vysoce rizikové pacienty (např. s nádory o velikosti 10 nebo více centimetrů nebo u nádorů s vysokou mitotickou aktivitou), kteří mohou mít bez adjuvantní terapie po dvou letech pravděpodobnost recidivy vyšší než 50 %. Je třeba zdůraznit, že přibližně 18 měsíců po operaci (tj. 6 měsíců po dokončení adjuvantní terapie) se zvyšuje četnost recidiv. Adjuvantní podávání imatinibu by mohlo u některých pacientů po odstranění primárního nádoru eradikovat reziduální mikroskopickou nemoc. Doporučuje se 12 měsíců léčby imatinib mesylátem v dávce 400 mg/den u skupiny pacientů s intermediálním až vysokým rizikem. K rozhodnutí, zda by v případě adjuvantní léčby měly být použity dávky vyšší než 400 mg denně po dobu delší než rok, bude třeba provést další studie. Probíhající evropské studie srovnávají 0 vs. 2 roky (studie European Organization for Research and Treatment of Cancer EORTC 62024) a dále 1 vs. 3 roky adjuvantní léčby imatinibem (studie Scandinavian Sarcoma Group SSG XVIII) s cílem posoudit celkové přežití, resp. přežití bez recidivy. Výsledky budou k dispozici až po několika letech.
Sunitinib malát
Sunitinib malát (známý také jako SU 11248) je perorální, multitargetový tyrozinkinázový inhibitor, který může navodit léčebnou odpověď u pacientů s GIST rezistentním na imatinib. Sunitinib je chemicky N-[2-(diethylamino)ethyl]-5-[(Z)-(5-fluoro-1,2-dihydro-2-oxo-3H-indol-3-ylidin)methyl]-2,4-dimethyl-1H-pyrrol-3-karboxamid. Vyskytuje se ve formě soli jako sunitinib malát.
Indikace a mechanismus působení
![Obr. 3 Schematické znázornění mechanismu účinku sunitinibu; přetištěno z [30] – Brančíková, Adámková Krákorová, 2008.](https://www.remedia.cz/photo-a-27732---.jpg) Indikací sunitinibu je léčba neresekovatelného a/nebo metastatického GIST po selhání léčby imatinib mesylátem v důsledku rezistence nebo intolerance. Sunitinib působí jako inhibitor receptorů pro destičkový růstový faktor (PDGFRalfa a PDGFR-beta), receptorů pro endotelový růstový faktor (VEGFR1, VEGFR2 a VEGFR3), receptoru faktoru kmenových buněk (KIT), Fms-podobné tyrozinkinázy 3 (Fms-like tyrosine kinase-3, FLT3), receptoru kolonie stimulujícího faktoru (CSF-1R) a receptoru pro neurotrofický faktor odvozený od gliálních buněk (glial cell-line derived neurotrophic factor receptor, RET). Sunitinib se váže na aktivní místo proteinkinázy, čímž brání fosforylaci proteinů a přenosu signálu do buňky. Váže se na více různých proteinkináz a má mnohem vyšší afinitu k c-kit. Ovlivňuje tím buněčnou proliferaci a angiogenezi ( obr. 3 ) [30]. Délka trvání léčebné odpovědi je 18 měsíců až 2 roky, pak se onemocnění stává rezistentním.
Indikací sunitinibu je léčba neresekovatelného a/nebo metastatického GIST po selhání léčby imatinib mesylátem v důsledku rezistence nebo intolerance. Sunitinib působí jako inhibitor receptorů pro destičkový růstový faktor (PDGFRalfa a PDGFR-beta), receptorů pro endotelový růstový faktor (VEGFR1, VEGFR2 a VEGFR3), receptoru faktoru kmenových buněk (KIT), Fms-podobné tyrozinkinázy 3 (Fms-like tyrosine kinase-3, FLT3), receptoru kolonie stimulujícího faktoru (CSF-1R) a receptoru pro neurotrofický faktor odvozený od gliálních buněk (glial cell-line derived neurotrophic factor receptor, RET). Sunitinib se váže na aktivní místo proteinkinázy, čímž brání fosforylaci proteinů a přenosu signálu do buňky. Váže se na více různých proteinkináz a má mnohem vyšší afinitu k c-kit. Ovlivňuje tím buněčnou proliferaci a angiogenezi ( obr. 3 ) [30]. Délka trvání léčebné odpovědi je 18 měsíců až 2 roky, pak se onemocnění stává rezistentním.
Dávkování
Standardní dávkování je 50 mg/den po dobu čtyř týdnů; následuje 2týdenní pauza, která zakončuje celý 6týdenní cyklus. V případě závažnějších nežádoucích účinků se doporučuje snížení dávky sunitinibu na 37,5 mg/den, režim podávání zůstává stejný. Při dobré toleranci lze dávku opět eskalovat na 50 mg/den.
Výsledky studie fáze III
Randomizovaná, dvojitě zaslepená studie fáze III kontrolovaná placebem u pacientů s GIST, kteří imatinib netolerovali nebo u nichž onemocnění progredovalo (medián maximální dávky imatinibu 800 mg/den), prokázala efektivitu sunitinibu. Randomizováno bylo 312 pacientů, již byli léčeni sunitinibem v dávce 50 mg/den (207 pacientů), nebo jim bylo podáváno placebo (105 pacientů) v režimu 4 + 2 týdny až do progrese nebo odstoupení z jiného důvodu. Sunitinib výrazně prodloužil dobu do progrese, ve větvi se sunitinibem o 6,3 měsíce (27,3 týdne), ve větvi s placebem o pouhých 1,5 měsíce (6,4 týdne). Pacienti ve větvi s placebem byli při progresi onemocnění převedeni do již otevřené větve se sunitinibem. Rozdíl v celkovém přežití byl statisticky příznivější pro pacienty užívající sunitinib (poměr rizika 0,49; CI 0,29–0,83), riziko úmrtí bylo v prvním roce sledování ve skupině placeba dvakrát vyšší než ve skupině léčené sunitinibem. Podíl úmrtí byl 14 % v rameni se sunitinibem vs. 25 % v rameni s placebem [31, 32].
Nežádoucí účinky sunitinibu
Nežádoucí účinky, které limitovaly dávku sunitinibu v klinických studiích, jsou únava, nevolnost, zvracení. Dále se popisuje riziko kardiotoxicity (kongestivní srdeční selhání, pokles ejekční frakce levé srdeční komory), arteriální hypertenze, vznik hypotyreózy, gastrointestinální poruchy, jako jsou průjem, nauzea, stomatitida, dyspepsie a zvracení; depigmentace kůže a vlasů, dysgeuzie a anorexie. Nejdůležitejšími závažnými nežádoucími účinky jsou plicní embolie, trombocytopenie, krvácení do tumoru, febrilní neutropenie a hypertenze. Současné podávání se silnými induktory CYP3A4, jako je rifampicin, může snížit koncentrace sunitinibu v plazmě. Současné podávání se silnými inhibitory CYP3A4, jako je ketokonazol, může zvýšit koncentrace sunitinibu v plazmě. V případě progrese při léčbě imatinibem i sunitinibem se nabízí možnost podávat nové inhibitory tyrozinkinázy, z nich je nejlépe prozkoumán nilotinib ( tab. 2 ) [33].
Závěr
Dle dosavadních zkušeností je možné podávat imatinib a sunitinib ambulantně. Mají příznivý profil nežádoucích účinků, terapie umožňuje zachovat dobrou kvalitu života pacientů. Adjuvantní léčba imatinibem je určena pacientům po resekci KIT (CD117) pozitivního gastrointestinálního stromálního tumoru s vysokým rizikem relapsu. Neměla by být podávána pacientům s nízkým nebo velmi nízkým rizikem návratu onemocnění.
Seznam použité literatury
- [1] D’Amato G, Steinert DM, MCAuliffe JC, et al. Update on the biology and therapy of gastrointestinal stromal tumors. Cancer Control 2005; 12: 44–56.
- [2] Miettinen M, Sobin LH, Lasota J, et al. Gastrointestinal stromal tumors of the stomach: a clinicopathological, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29: 52–68.
- [3] Mechtersheimer G, Egerer G, Hensel M, et al. Gastrointestinal stromal tumours and their response to treatment with the tyrosine kinase inhibitor imatinib. Virchows Arch 2004; 444: 108–118.
- [4] Hornick JL, Fletcher CD. The significance of Kit (CD117) in gastrointestinal stromal tumors. Int J Surg Pathol 2004; 12: 93–97.
- [5] Dei Tos AP. The reappraisal of gastrointestinal stromal tumors: from Stout to the KIT revolution. Virchows Arch 2003; 442: 421–428.
- [6] Rosai J. GIST: an update. Int J Surg Pathol 2003; 11: 177–186.
- [7] Daum O, Linke Z, Vaněček T, et al. Gastrointestinální stromální tumory (GIST), www.gist.nadory.cz
- [8] Vandenbark GR, Decastro CM. Cloning and structural analysis of the human c-kit gene. Oncogene 1992; 7: 1259–1266.
- [9] Giebel LB, Strunk KM. Organization and nucleotide sequence of the human KIT (mast/stem cell growth factor receptor) proto-oncogene. Oncogene 1992; 7: 2207–2217.
- [10] Kawagishi J. Structure, organization, and transcription units of the human alpha-platelet-derived growth factor receptor gene, PDGFRA. Genomics 1995; 30: 224–232.
- [11] Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002; 33: 459–465.
- [12] Debiec-Rychter M, Sciot R, Dumez H, et al. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 2006; 42: 1093–1103.
- [13] Debiec-Rychter M, Dumez H, Sciot R, et al. Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 2004; 40: 689–695.
- [14] Lee JL, Kim JY, Ryu MH, et al. Response toimatinib in KIT- and PDGFRA-wild type gastrointestinal stromal tumours associated with neurofibromatosis type 1. Dig Dis Sci 2006; 51: 1043–1046.
- [15] NCCN.Clinical practise guidelines.SST.V.2.2009. http://www.nccn.org/professionals/physician_gls/f_guidelines.asp
- [16] DeMatteo RP, Ballman K, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 2009; 373: 1097–1104.
- [17] Joensuu H, Roberts PJ, Sarlomo-Rikala M, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med 2001; 344: 1052–1056.
- [18] Van Glabbeke M, Owzar K, Rankin C, et al. Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumor (GIST): a meta-analysis based on 1,640 patients J Clin Oncol 2007; 2518S (abstr 10004).
- [19] Rankin C, Von Mehren M, Blanke C, et al. Dose effect of imatinib in patients with metastatic GIST: Phase III Sarcoma Group Study S0033 (abstract 9005). Proc ASCO 2004; 23: 825.
- [20] Van Glabbeke M, Verweij J, Casali PG, et al. Initial and late resistance to imatinib in advanced gastrointestinal stromal tumors are predicted by different prognostic factors: a European Organisation for Research and Treatment of Cancer-Italian Sarcoma Group-Australasian Gastrointestinal Trials Group study. J Clin Oncol 2005; 23: 5795–5804.
- [21] Blay JY, Le Cesne A, Bui B, et al. Prospective multicenter randomized phase III study od imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: The French Sarcoma Group. J Clin Oncol 2007; 25: 1107–1013.
- [22] Rios M, La Cesne A, Buli B, et al. Interruption of imatinib in GIST patients with advanced disease after one year of treatment: Updated results of the prospective French Sarcoma Group randomized phase III trial on long term survival. ASCO Ann Meet 2007, abstract 10004.
- [23] Verweij J, Casali PG, Zalceberg J, et al. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 2004; 364: 1127–1134.
- [24] Blanke CD, Rankin C, Demetri GD, et al. Phase III randomised, intergroup trial assessing imatinib mesylat at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 2008; 26: 626–632.
- [25] Zalcberg JR, Verweij J, Casali PG, et al. Outcome of patients with advanced gastrointestinal stromal tumours crossing over to a daily imatinib dose of 800 mg after progression on 400 mg. Eur J Cancer 2005; 41: 1751–1757.
- [26] Demetri GD, van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006; 368: 1329–1338.
- [27] Judson I, Demetri G. Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 2007; 18 (Suppl. 10): x20–24.
- [28] DeMatteo RP, Antonescu CR, Chadaram V, et al. Adjuvant imatinib mesylate in patients with primary high risk gastrointestinal stromal tumor (GIST) following complete resection: Safety results from the U.S. Intergroup Phase II trial ACOSOG Z9000; ASCO Annual Meeting 2008.
- [29] DeMatteo RP, Owzar K, Maki R, et al. Adjuvant imatinib mesylate increases recurrence free survival (RFS) in patients with completely resected localized primary gastrointestinal stromal tumor: North American Intergroup Phase III trial ACOSOG Z9001; ASCO Annual Meeting 2008.
- [30] Brančíková D, Adámková Krákorová D. Sunitinib. Remedia 2008; 18: 187–193.
- [31] Demetri GD, van Oosterom AT, Garrett CR, et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006; 368: 1329–1338.
- [32] Casali PG, Garret CR, Blackstein ME, et al. Updates results from a phase III trial of sunitinib on GIST patients for whom imatinib therapy has failed due to resistance or intolerance. J Clin Oncol (Meeting Abstracts) 2006; 24 (Suppl. 18): 9513.
- [33] Linke Z. Novinky v adjuvantní léčbě GIST. Farmakoterapie 2009; 5: 113–248.