Léčba mužů s vysoce rizikovým nemetastatickým kastračně rezistentním karcinomem prostaty
Souhrn:
Katolická J. Léčba mužů s vysoce rizikovým nemetastatickým kastračně rezistentním karcinomem prostaty. Remedia 2019; 29: 329–333.
U pacientů s nemetastatickým kastračně rezistentním karcinomem prostaty (M0 CRPC) a krátkým časem zdvojnásobení hodnoty prostatického specifického antigenu (PSA; < 6 měsíců), kteří mají vyšší riziko rozvoje metastáz, studie PROSPER a SPARTAN doložily, že jak apalutamid, tak enzalutamid prokazují podstatný přínos pro přežití bez progrese choroby (metastasis free survival, MFS) a bez jiných událostí souvisejících s progresí.
Summary:
Katolicka J. Treatment of men with high-risk non-metastatic castration-resistant prostate cancer. Remedia 2019; 29: 329–333.
Patients with non‑metastatic castration‑resistant prostate cancer (M0 CRPC) and short prostatic antigen (PSA) doubling time (< 6 months) are at higher risk of developing metastasis. The PROSPER and SPARTAN trials have demonstrated that both apalutamide and enzalutamide offer substantial benefits with regards to metastasis‑free survival (MFS) and other progression events in these patients.
Key words: non‑metastatic castration‑resistant prostate cancer, enzalutamide, apalutamide.
Úvod
Androgen deprivační terapie (ADT) sehrává od čtyřicátých let minulého století zásadní roli v léčbě karcinomu prostaty. V případě primárně metastatické choroby sice nemocného nevyléčí, ale umožňuje dosáhnout poklesu hodnoty prostatického specifického antigenu (PSA) a dočasného ústupu choroby. U lokálně pokročilého onemocnění je v kombinaci s radioterapií součástí kurativního postupu. V případě biochemického relapsu po předchozí chirurgické nebo radioterapeutické lokální léčbě je podání ADT standardní indikací. Progresí při ADT, i přes kastrační koncentrace testosteronu, nemoc přechází do kastračně rezistentní fáze. V této chvíli je důležité rozlišit, zda jsou, nebo nejsou přítomny metastázy, tj. zda hovoříme o nemetastatickém (castrate resistant prostate cancer, M0 CRPC), nebo metastatickém (M1 CRPC) kastračně rezistentním karcinomu prostaty [1].
Progrese karcinomu prostaty při androgen deprivační léčbě
V současné době nejrozšířenější definice progrese při ADT je založena na zvýšení hodnoty PSA a následuje doporučení Prostate Cancer Working Group (PCWG3) primárně určené pro klinická hodnocení ‒ 25% nárůst nad nadir (s ohledem na výchozí hodnotu ≥ 1,0 ng/ml), s minimálním nárůstem o 2 ng/ml, při kastrační koncentraci testosteronu (< 50 ng/dl). Doporučení Evropské urologické asociace (EUA guidelines) nemají jasně definovanou progresi na základě PSA, ale obvykle dva po sobě následující vzestupy hodnoty PSA > 0,2 ng/ml jsou považovány za náznaky progrese [2]. Progrese na základě PSA po ADT může nastat před detekcí metastáz v přítomnosti buď lokální recidivy v lůžku po prostatektomii, nebo v důsledku přetrvávajícího lokálního onemocnění po radioterapii, anebo bez průkazu nemoci v primárním místě nádorového postižení, bez detekovaného postižení lymfatických uzlin pomocí počítačové tomografie (CT)/magnetické rezonance (MR), případně v důsledku postižení kostí nebo viscerálních orgánů neprokázaného vyšetřovacími metodami. Konvenční a nejběžněji používané diagnostické zobrazovací metody pro definici M0 CRPC zahrnují scintigrafii kostí pomocí technecia (99mTc), dále CT hrudníku, břicha a pánve, případně MR, pokud je CT vyšetření kontraindikováno. Dohodou v rámci skupiny RADAR (Radiographic Assessments for Detection of Advanced Recurrence) bylo navrženo provádět scintigrafii kostí a CT sken, když sérová koncentrace PSA dosahuje 2 ng/ml. V případě, že výsledky jsou negativní, doporučuje se opakování, když úroveň PSA dosáhne 5 ng/ml, a poté opět po každém zdvojení hodnoty PSA, na základě testování PSA každé tři měsíce u asymptomatických nemocných. Skupina též doporučuje, aby tato frekvence vyšetření byla prováděna u pacientů se symptomatickým onemocněním, u nichž došlo ke klinickému vývoji bez ohledu na hodnotu PSA [3]. Výchozí koncentrace PSA, PSA velocita a doba zdvojení PSA (PSA doubling time, PSA DT) jsou spojeny s časem do vzniku metastáz, rovněž ale s přežitím bez metastáz (metastasis free survival, MFS) a s celkovým přežitím (OS) z M0 CRPC [4]. Tyto parametry jsou běžně používány k rozhodování, kteří pacienti by se měli podrobit vyšetření zobrazovacími metodami a v jaké četnosti. Parametr MFS je novým pojmem v hodnocení přínosu léčby. Až do doby schválení apalutamidu a enzalutamidu americkým Úřadem pro kontrolu potravin a léčiv (FDA) nebylo regulačními orgány řádně uznáno použití MFS v registrační studii jako náhradního koncového bodu pro hodnocení přežití.
Enzalutamid v léčbě M0 CRPC
Enzalutamid je antagonista androgenního receptoru [5] a jeho
využití u M1 CRPC je dnes standardním léčebným postupem
v běžné klinické praxi. Enzalutamid již v roce 2016,
v rámci studie STRIVE, prokázal ve srovnání
s bikalutamidem potenciální léčebný přínos u nemocných
s M0 CRPC. Ve studii bylo randomizováno 396 mužů
léčených ADT s M0 (n = 139) nebo M1 (n = 257)
CRPC. V jednom rameni užívali enzalutamid (160 mg/den),
ve druhém rameni bikalutamid (50 mg/den). Enzalutamid
redukoval riziko progrese nebo úmrtí o 76 % ve srovnání
s bikalutamidem (p < 0,001).
Medián MFS byl o 13,7 měsíce delší po léčbě
enzalutamidem. Tyto výsledky však nebyly dostatečné pro schválení
využití enzalutamidu u M0 CRPC [6]. Mnohem větší přínos
pro tuto skupinu nemocných představují výsledky studie
fáze III PROSPER, která zkoumala použití enzalutamidu u pacientů
s nemetastatickým CRPC [7] (obr. 1). Zařazeni byli muž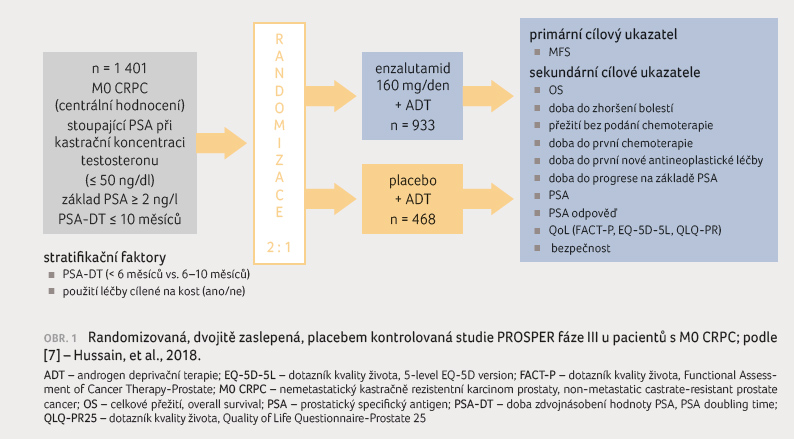 i v dobrém klinickém stavu,
s performance status (PS) 0‒1, léčení ADT, s kastrační
koncentrací testosteronu, s alespoň třemi stoupajícími
hodnotami PSA v minimálně týdenních intervalech, s časem
zdvojnásobení hodnoty PSA 10 měsíců nebo méně a se
základní hodnotou PSA ≥ 2 ng/ml. Pacienti byli
rozděleni do podskupin založených na času zdvojnásobení
hodnoty PSA (< 6 měsíců nebo ≥ 6 měsíců)
a na základě toho, zda byli léčeni antiosteoklastickým
přípravkem. Primárním cílem bylo stanovení MFS nebo
i v dobrém klinickém stavu,
s performance status (PS) 0‒1, léčení ADT, s kastrační
koncentrací testosteronu, s alespoň třemi stoupajícími
hodnotami PSA v minimálně týdenních intervalech, s časem
zdvojnásobení hodnoty PSA 10 měsíců nebo méně a se
základní hodnotou PSA ≥ 2 ng/ml. Pacienti byli
rozděleni do podskupin založených na času zdvojnásobení
hodnoty PSA (< 6 měsíců nebo ≥ 6 měsíců)
a na základě toho, zda byli léčeni antiosteoklastickým
přípravkem. Primárním cílem bylo stanovení MFS nebo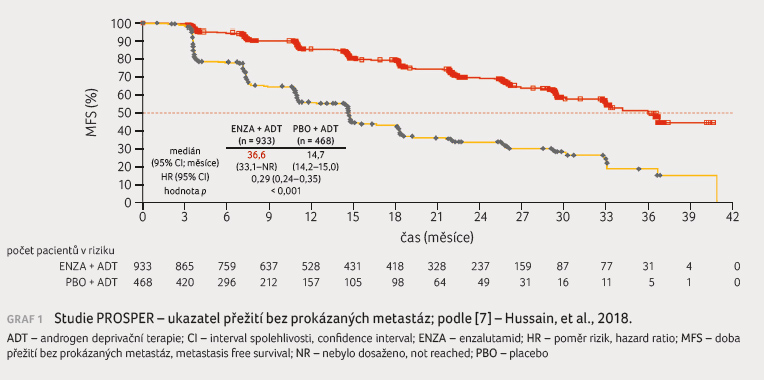 času
do úmrtí z jakékoliv příčiny. Sekundární cíle
představovaly OS, čas do progrese PSA, míra odpovědi PSA
(definovaná jako snížení o více než 50 % od vstupní
hodnoty PSA), čas do první chemoterapie, zhodnocení kvality
života a bezpečnosti léčby. Medián MFS ve skupině
s placebem byl 14,7 měsíce ve srovnání
s 36,6 měsíce v enzalutamidové skupině, což
znamená 71% snížení rizika radiografické progrese nebo smrti
ve prospěch enzalutamidu (poměr rizik [HR] 0,29; 95% interval
spolehlivosti [CI] 0,24‒0,35;
p < 0,001), graf 1. Enzalutamid prokázal
také přínos ve všech sledovaných sekundárních cílech.
Medián doby do progrese PSA byl ve skupině
s enzalutamidem 37,2 měsíce oproti 3,9 měsíce
ve skupině s placebem (HR 0,07; 95% CI 0,05‒0,08;
p < 0,001) a medián
času do použití první antineoplastické
léčby byl v rameni s enzalutamidem 39,6 měsíce vs. 17,7
měsíce v rameni s placebem (HR 0,21; 95% CI 0,17‒0,26;
p < 0,001).
V hodnocení odpovědi P
času
do úmrtí z jakékoliv příčiny. Sekundární cíle
představovaly OS, čas do progrese PSA, míra odpovědi PSA
(definovaná jako snížení o více než 50 % od vstupní
hodnoty PSA), čas do první chemoterapie, zhodnocení kvality
života a bezpečnosti léčby. Medián MFS ve skupině
s placebem byl 14,7 měsíce ve srovnání
s 36,6 měsíce v enzalutamidové skupině, což
znamená 71% snížení rizika radiografické progrese nebo smrti
ve prospěch enzalutamidu (poměr rizik [HR] 0,29; 95% interval
spolehlivosti [CI] 0,24‒0,35;
p < 0,001), graf 1. Enzalutamid prokázal
také přínos ve všech sledovaných sekundárních cílech.
Medián doby do progrese PSA byl ve skupině
s enzalutamidem 37,2 měsíce oproti 3,9 měsíce
ve skupině s placebem (HR 0,07; 95% CI 0,05‒0,08;
p < 0,001) a medián
času do použití první antineoplastické
léčby byl v rameni s enzalutamidem 39,6 měsíce vs. 17,7
měsíce v rameni s placebem (HR 0,21; 95% CI 0,17‒0,26;
p < 0,001).
V hodnocení odpovědi P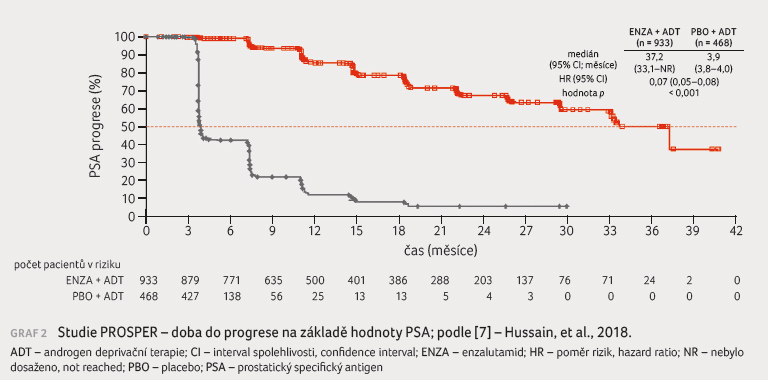 SA došlo u 76 % pacientů
ve skupině léčené enzalutamidem a pouze u 2 %
ve skupině s placebem ke snížení koncentrace PSA
o více než 50 % (graf 2).
Přínosu v OS nebylo dosud dosaženo, hodnocení kvality života
bylo stejné pro obě skupiny, a pokud jde o bezpečnost,
profil toxicity enzalutamidu byl podobný jako ve studiích u M1
CRPC. Nejčastější nežádoucí účinky představovaly hypertenze
(12 % ve skupině s enzalutamidem vs. 5 % ve skupině
s placebem), závažné nežádoucí kardiovaskulární příhody
(5 % ve skupině s enzalutamidem vs. 3 % ve skupině
s placebem), pády a nepatologické zlomeniny (17 %
ve skupině s enzalutamidem oproti 8 % ve skupině
s placebem) a poruchy duševního stavu (5 %
s enzalutamidem vs. 2 % s placebem). V hodnocení
pomocí HRQoL (Health Related Quality of Life, kvalita života
závislá na zdraví) byli respondenti PSA po enzalutamidu
(723 z 1 401 pacientů [52 %]) signifikantně méně
náchylní ke zhoršení ve všech skóre dotazníku
kvality života FACT P než pacienti bez odpovědi PSA (HR
0,56–0,82), s výjimkou fyzické pohody (HR 0,90; p = 0,244).
Většina skóre FACT P byla pro MFS prognostická (7 z 10
skóre). Každé desetibodové zvýšení celkového skóre FACT P
(tj. zlepšení) bylo spojeno se 6% snížením rizika rozvoje
metastáz (HR 0,94; 95% CI 0,88–1,00). Každé tříbodové zvýšení
fyzické pohody, emocionální pohody nebo hodnocení karcinomu
prostaty bylo spojeno se 14% (0,86 [0,81–0,92]), 12% (0,88 [0,78–
0,99]) a 9% (0,91 [0,86–0,96]) snížením rizika rozvoje
metastáz. V nepotvrzených analýzách enzalutamid oproti
placebu významně redukoval riziko klinicky významného zhoršení
v podskupině hodnotící karcinom prostaty (HR 0,82;
p < 0,05)
a emocionální pohodu (HR 0,80; p < 0,05)
[7].
SA došlo u 76 % pacientů
ve skupině léčené enzalutamidem a pouze u 2 %
ve skupině s placebem ke snížení koncentrace PSA
o více než 50 % (graf 2).
Přínosu v OS nebylo dosud dosaženo, hodnocení kvality života
bylo stejné pro obě skupiny, a pokud jde o bezpečnost,
profil toxicity enzalutamidu byl podobný jako ve studiích u M1
CRPC. Nejčastější nežádoucí účinky představovaly hypertenze
(12 % ve skupině s enzalutamidem vs. 5 % ve skupině
s placebem), závažné nežádoucí kardiovaskulární příhody
(5 % ve skupině s enzalutamidem vs. 3 % ve skupině
s placebem), pády a nepatologické zlomeniny (17 %
ve skupině s enzalutamidem oproti 8 % ve skupině
s placebem) a poruchy duševního stavu (5 %
s enzalutamidem vs. 2 % s placebem). V hodnocení
pomocí HRQoL (Health Related Quality of Life, kvalita života
závislá na zdraví) byli respondenti PSA po enzalutamidu
(723 z 1 401 pacientů [52 %]) signifikantně méně
náchylní ke zhoršení ve všech skóre dotazníku
kvality života FACT P než pacienti bez odpovědi PSA (HR
0,56–0,82), s výjimkou fyzické pohody (HR 0,90; p = 0,244).
Většina skóre FACT P byla pro MFS prognostická (7 z 10
skóre). Každé desetibodové zvýšení celkového skóre FACT P
(tj. zlepšení) bylo spojeno se 6% snížením rizika rozvoje
metastáz (HR 0,94; 95% CI 0,88–1,00). Každé tříbodové zvýšení
fyzické pohody, emocionální pohody nebo hodnocení karcinomu
prostaty bylo spojeno se 14% (0,86 [0,81–0,92]), 12% (0,88 [0,78–
0,99]) a 9% (0,91 [0,86–0,96]) snížením rizika rozvoje
metastáz. V nepotvrzených analýzách enzalutamid oproti
placebu významně redukoval riziko klinicky významného zhoršení
v podskupině hodnotící karcinom prostaty (HR 0,82;
p < 0,05)
a emocionální pohodu (HR 0,80; p < 0,05)
[7].
Apalutamid v léčbě M0 CRPC
Apalutamid je nový nesteroidní antiandrogen, který působí
jako inhibitor androgenního receptoru (AR). Váže se na stejné
vazebné místo ligandu jako bikalutamid, ale má sedmkrát až
desetkrát zvýšenou afinitu k AR receptoru. Působí podobným
mechanismem účinku jako enzalutamid, ale bylo prokázáno, že má
větší protinádorovou aktivitu než enzalutamid (na myším
modelu) [8]. První studie fáze II týkající se apalutamidu byla
multicentrickým hodnocením u mužů s vysoce rizikovým
M0 CRPC (PSA ≥ 9 ng/ml nebo PSA-DT ≤ 10 měsíců)
s kastračními hodnotami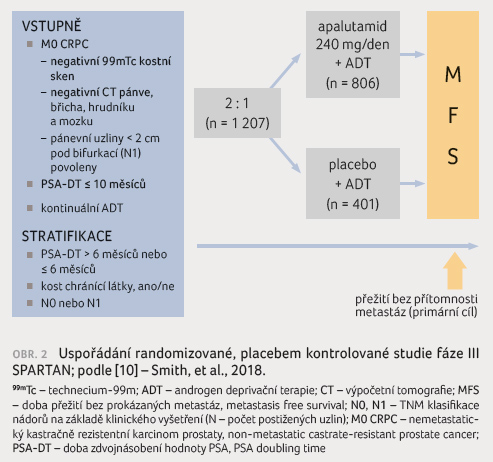 testosteronu (< 50 ng/dl).
Primárním cílem studie bylo stanovení dvanáctitýdenní odpovědi
PSA a sekundárními cíli čas do progrese PSA (time to
progression, TTP) a přežití bez metastáz (MFS). Při mediánu
sledování 26,9 měsíce byl medián snížení PSA oproti výchozím
hodnotám 85 %, přičemž 89 % pacientů dosáhlo snížení PSA
o 50 %. Medián TTP byl 24 měsíců a v době
analýzy nebylo MFS dosaženo [9]. Následovala studie fáze III
SPARTAN, která zařadila 1 207 mužů s M0 CRPC
a s dobou PSA-DT kratší než 10 měsíců do dvou
ramen, apalutamid jako aktivní rameno a placebo jako kontrolní
rameno [10] (obr. 2).
Apalutamid byl podáván v dávce 240 mg/den p.o.
s pokračující ADT nebo u nemocných byla provedena
bilaterální orchiektomie. Pacienti byli stratifikováni na základě
rozsahu lokální choroby (pozitivita regionálních uzlin ano nebo
ne), užívání přípravků pro prevenci osteoporózy a doby
do zdvojnásobení hodnoty PSA (PSA DT > 6 měsíců
nebo ≤ 6 měsíců). Primárním cílem bylo
stanovení MFS. Výsledkem bylo významné zlepšení mediánu MFS
pro apalutamid, a to 40,5 měsíce, oproti 16,2 měsíce pro
placebo (HR 0,28; 95% CI 0,23‒0,35; p < 0,001),
graf 3. U pacientů
v rameni s apalutamidem byla zaznamenána 94%
redukce rizika progrese na základě PSA.
Dlouhodobé sledování studie SPARTAN pomůže odpovědět na další
otázku, zda existuje celkový přínos pro přežití spojený
s použitím apalutamidu v terapii M0 CRPC, ačkoliv
současné údaje vyp
testosteronu (< 50 ng/dl).
Primárním cílem studie bylo stanovení dvanáctitýdenní odpovědi
PSA a sekundárními cíli čas do progrese PSA (time to
progression, TTP) a přežití bez metastáz (MFS). Při mediánu
sledování 26,9 měsíce byl medián snížení PSA oproti výchozím
hodnotám 85 %, přičemž 89 % pacientů dosáhlo snížení PSA
o 50 %. Medián TTP byl 24 měsíců a v době
analýzy nebylo MFS dosaženo [9]. Následovala studie fáze III
SPARTAN, která zařadila 1 207 mužů s M0 CRPC
a s dobou PSA-DT kratší než 10 měsíců do dvou
ramen, apalutamid jako aktivní rameno a placebo jako kontrolní
rameno [10] (obr. 2).
Apalutamid byl podáván v dávce 240 mg/den p.o.
s pokračující ADT nebo u nemocných byla provedena
bilaterální orchiektomie. Pacienti byli stratifikováni na základě
rozsahu lokální choroby (pozitivita regionálních uzlin ano nebo
ne), užívání přípravků pro prevenci osteoporózy a doby
do zdvojnásobení hodnoty PSA (PSA DT > 6 měsíců
nebo ≤ 6 měsíců). Primárním cílem bylo
stanovení MFS. Výsledkem bylo významné zlepšení mediánu MFS
pro apalutamid, a to 40,5 měsíce, oproti 16,2 měsíce pro
placebo (HR 0,28; 95% CI 0,23‒0,35; p < 0,001),
graf 3. U pacientů
v rameni s apalutamidem byla zaznamenána 94%
redukce rizika progrese na základě PSA.
Dlouhodobé sledování studie SPARTAN pomůže odpovědět na další
otázku, zda existuje celkový přínos pro přežití spojený
s použitím apalutamidu v terapii M0 CRPC, ačkoliv
současné údaje vyp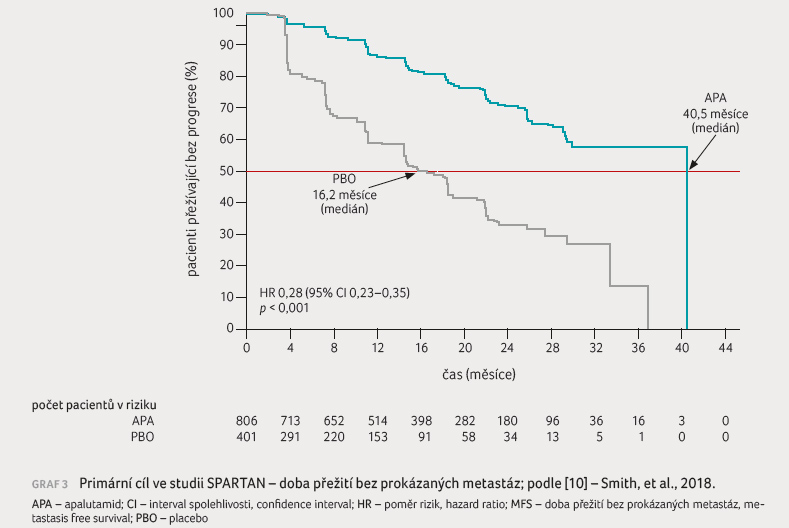 adají slibně (nedosaženo vs. 39,0; HR 0,7;
95% CI 0,47‒1,04; p = 0,07).
Také můžeme získat data o optimální sekvenci jednotlivých
přípravků v léčbě CRPC. Doba
adají slibně (nedosaženo vs. 39,0; HR 0,7;
95% CI 0,47‒1,04; p = 0,07).
Také můžeme získat data o optimální sekvenci jednotlivých
přípravků v léčbě CRPC. Doba 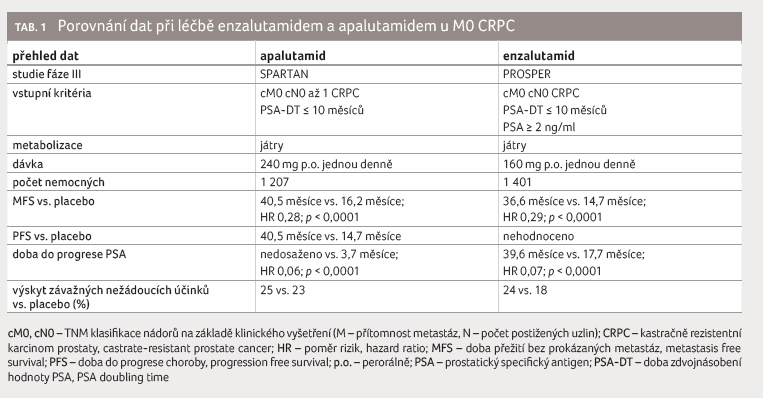 do symptomatické
progrese byla u apalutamidu významně delší než u placeba
(HR 0,45; 95% CI 0,32‒0,63; p < 0,001).
Míra nežádoucích účinků, které vedly k ukončení
sledování, činila 10,6 % u skupiny s apalutamidem
a 7,0 % u skupiny s placebem. Následující
nežádoucí účinky se vyskytly u apalutamidu ve vyšší
míře než u placeba: vyrážka (23,8 % vs. 5,5 %),
hypotyreóza (8,1 % vs. 2,0 %) a zlomeniny (11,7 % vs.
6,5 %). Porovnání MFS, PFS a doby do progrese PSA
u obou přípravků, enzalutamidu a apalutamidu, uvádí
tabulka 1.
do symptomatické
progrese byla u apalutamidu významně delší než u placeba
(HR 0,45; 95% CI 0,32‒0,63; p < 0,001).
Míra nežádoucích účinků, které vedly k ukončení
sledování, činila 10,6 % u skupiny s apalutamidem
a 7,0 % u skupiny s placebem. Následující
nežádoucí účinky se vyskytly u apalutamidu ve vyšší
míře než u placeba: vyrážka (23,8 % vs. 5,5 %),
hypotyreóza (8,1 % vs. 2,0 %) a zlomeniny (11,7 % vs.
6,5 %). Porovnání MFS, PFS a doby do progrese PSA
u obou přípravků, enzalutamidu a apalutamidu, uvádí
tabulka 1.
Závěr
Nemetastatický CRPC je definován vzrůstající hodnotou PSA navzdory kastrační koncentraci testosteronu, bez průkazu kostních, viscerálních nebo vzdálených extrapelvických nodálních metastáz u mužů s histologicky potvrzeným adenokarcinomem prostaty. Tito pacienti jsou při probíhající ADT často pouze sledováni až do radiografické progrese onemocnění, kdy je pro léčbu metastatického CRPC schváleno několik možností. Díky výsledkům studie PROSPER s enzalutamidem a SPARTAN s apalutamidem jsme získali významnou léčebnou modalitu pro nemocné s M0 CRPC a s krátkým časem zdvojnásobení hodnoty PSA (< 6 měsíců), kteří mají vyšší riziko vývoje metastáz. Jak apalutamid, tak enzalutamid prokazují podstatné přínosy v přežití do vzniku metastáz. V České republice však v současné době chybí úhrada pro alespoň jeden z těchto přípravků v uvedené indikaci.
Seznam použité literatury
- [1] Mateo J, Fizazi K, Gillessen S, et al. Managing Nonmetastatic Castration‑resistant Prostate Cancer. Dostupné na: https://doi.org/10.1016/j.eururo.2018.07.035
- [2] Mottet N, Bellmunt J, Briers E, et al, Cancer EEESGoP. EAU–ESTRO–ESUR–SIOG guidelines on prostate cancer. In: Office EG, editor. Dostupné na: https://uroweborg/guideline/prostate‑cancer/2018
- [3] Crawford ED, Stone NN, Yu EY, et al. Challenges and recommendations for early identification of metastatic disease in prostate cancer. Urology 2014; 83: 664–669.
- [4] Smith MR, Kabbinavar F, Saad F, et al. Natural history of rising serum prostate‑specific antigen in men with castrate nonmetastatic prostate cancer. J Clin Oncol 2005; 23: 2918–2925.
- [5] Tran C, Ouk S, Clegg NJ, et al. Development of a second‑generation antiandrogen for treatment of advanced prostate cancer. Science (New York, NY) 2009; 324: 787–790.
- [6] Penson DF, Armstrong AJ, Concepcion R, et al. Enzalutamide versus bicalutamide in castration‑resistant prostate cancer: the STRIVE trial. J Clin Oncol 2016; 34: 2098–2106.
- [7] Hussain M, Fizazi K, Saad F, et al. Enzalutamide in men with nonmetastatic, castration‑resistant prostate cancer. N Engl J Med 2018; 378: 2465–2474.
- [8] Clegg NJ, Wongvipat J, Joseph JD, et al. ARN‑509: a novel antiandrogen for prostate cancer treatment. Cancer Res 2011; 72: 1494–1503.
- [9] Smith MR, Antonarakis ES, Ryan CJ, et al. Phase 2 Study of the safety and antitumor activity of Apalutamide (ARN‑509), a potent androgen receptor antagonist, in the high‑risk onometastatic castration‑resistant prostate cancer cohort. Eur Urol 2016; 70: 963‒970.
- [10] Smith MR, Saad F, Chowdhury S, et al. Apalutamide treatment and metastasis‑free survival in prostate cancer. N Engl J Med 2018; 378: 1408–1418.