Léčebné možnosti relabujícího karcinomu ovaria
Karcinom ovaria patří mezi gynekologickými nádory k onemocněním s nejvyšší úmrtností, kdy až u 75 % pacientek dojde po léčbě k relapsu a úmrtí na toto nádorové onemocnění. První skupinou pacientek, u nichž je podezření na relaps nemoci, jsou pacientky s elevací tumorózního markeru Ca 125, u nichž v současnosti není zahájení chemoterapie doporučováno. U pacientek s klinicky nebo radiologicky prokázanou recidivou nemoci je nejvýznamnějším faktorem časový interval mezi ukončením chemoterapie 1. linie a objevením se recidivy nemoci. Za platina-rezistentní je považována nemoc s progresí do 6 měsíců po ukončení léčby. Sem patří taktéž primárně refrakterní nemoc, situace, kdy k progresi nádorového onemocnění dojde během cytostatické léčby 1. linie, nebo situace, kdy nádor není léčbou ovlivněn. Při progresi nemoci později než za 6 měsíců je onemocnění považováno za platina-senzitivní. Léčebný záměr při aplikaci chemoterapie při relapsu nemoci je, s výjimkou zařazení chirurgické intervence s kompletním odstraněním metastatických ložisek, paliativní, jeho cílem je prodloužení intervalu bez nemoci (disease-free interval, DFI) a prodloužení celkového přežití (overall survival, OS) – s oddálením symptomů nemoci a zvýšením kvality života.
U platina-refrakterních nebo platina-rezistentních nádorů je doporučována chemoterapie 2. linie založená na monoterapii neplatinovým derivátem. U platina-senzitivních nádorů je doporučována chemoterapie s platinovým derivátem většinou v kombinaci s jiným cytostatikem, jehož výběr závisí na spektru nežádoucích účinků. Při vyčerpání možnosti cytostatické léčby je možné doporučit hormonální léčbu založenou na antiestrogenním antiproliferativním působení hormonů. Nově je v léčbě recidivujícího karcinomu ovaria využívána cílená molekulární terapie, která je založena na blokování neoangiogeneze jakožto hlavní podmínky nádorového růstu. Pacientky s karcinomem ovaria by měly být léčeny v komplexních onkologických centrech, disponujících jak erudovanými onkochirurgy, kteří jsou schopni provést radikální operaci bez ponechání nádorového rezidua, tak erudovanými klinickými onkology, kteří jsou schopni posoudit vhodnost jednotlivých léčebných modalit s ohledem na léčebné výsledky a kvalitu života.
Úvod
Karcinom ovaria je mezi gynekologickými nádory nejčastější příčinou úmrtí. Celosvětově je ročně diagnostikováno 166 000 případů a 101 000 úmrtí, v EU bylo v roce 2008 zaznamenáno 45 299 případů a 28 840 úmrtí. Incidence karcinomu ovaria v ČR byla ve stejném roce 21,9 a mortalita 12,8. V důsledku anatomické lokalizace ovarií ve volné dutině břišní, kdy je nádorový růst ovarií dlouhodobě asymptomatický, a vzhledem k nepřítomnosti vhodného screeningového vyšetření je 70 % nádorů ovaria diagnostikováno v pokročilých stadiích FIGO III–IV. Z těchto příčin se u pacientek, a to i pacientek optimálně léčených, objeví po určité době relaps nemoci, jehož riziko je v přímé úměře ke stadiu nemoci. Bez ohledu na pokroky v chirurgické léčbě a poměrně vysokou míru odpovědi na kombinovanou chemoterapii platinovým derivátem a taxany [1–3] patří karcinom ovaria mezi gynekologickými nádory k onemocněním s nejvyšší úmrtností, se střední dobou bez progrese 15,4 měsíce a s 5letým intervalem přežití mezi 25–35 % [4]. Až u 75 % pacientek s odpovědí na chemoterapii 1. linie dojde k relapsu a k úmrtí na toto nádorové onemocnění [4, 5].
Chemoterapie ovariálního karcinomu
Standardem léčby pokročilých ovariálních karcinomů je v současnosti chirurgická léčba následovaná 6 cykly kombinované chemoterapie platina–paklitaxel a následná dispenzarizace pacientek se stanovením léčebného plánu až při prokázáné rekurenci nemoci. Kromě stadia nemoci existují další negativní prognostické faktory ovlivňující relaps nemoci:
- nepříznivý histologický typ nádoru,
- nízký stupeň diferenciace,
- diseminovaný proces s přítomností ascitu při primární diagnostice,
- špatný celkový stav pacientky.
Za posledních 15 let, kdy byl do primární cytostatické léčby karcinomu ovaria zařazen paklitaxel a kdy v roce 2004 GCIG (Gynecologic Cancer InterGroup) stanovila paklitaxel v dávce 175 mg/m2 v kombinaci s karboplatinou v dávce 5–6 AUC standardním a komparativním režimem, byly prováděny studie ve snaze o prodloužení intervalu bez progrese (PFI, progression-free interval) a celkového přežití (OS, overall survival). Studie byly zaměřeny na záměnu paklitaxelu v základním dubletu, zavádění tripletů cytostatik, aplikace „dose-density“ režimů, změny způsobu aplikace a aplikace konsolidační nebo udržovací chemoterapie.
Žádná ze studií při hodnocení účinnosti s ohledem na nežádoucí účinky neprokázala ve srovnání s aplikací 6 cyklů kombinované chemoterapie platina–paklitaxel přínos pro pacientky. Studie SCOTROC s docetaxelem [6] a studie MITO-2 s lipozomálním pegylovaným doxorubicinem (PLD) [7] prokázaly shodnou četnost odpovědí, stejné přežití bez progrese (progression-free survival, PFS) a OS. Studie SWOG 9701 [8], zařazující konsolidační monoterapii paklitaxelem, prokázala mírně vyšší PFS a stejné OS. Konsolidační chemoterapie, spočívající v krátkodobé limitované aplikaci cytostatik, ani udržovací chemoterapie, aplikovaná až do prokázání progrese nemoci, nevedly ke zlepšení léčebných výsledků. Přestože byly publikovány studie fáze II, které naznačovaly, že konsolidační či udržovací léčba mají určitý význam v oddálení nebo prevenci rekurencí nemoci, v současnosti neexistuje studie fáze III, která by prokázala prodloužení OS [9–11]. Bylo provedeno šest studií zařa-zujících do léčby triplety s přidáním gemcitabinu, topotekanu, PLD a epirubicinu k základnímu dubletu. Žádná neprokázala zlepšení léčebných výsledků [12–17].
Studie GOG-172 [18] prokázala delší PFI při intraperitoneálním podání, avšak s výrazným snížením kvality života. Studie JGOG NOVEL [19] se zvýšením dávkové intenzity paklitaxelu v týdenním režimu prokázala zvýšení PFI, ale za cenu výrazného nárůstu hematologické toxicity.
Na čtvrté konsenzuální konferenci ovariálního karcinomu v roce 2011 připouští GCIG do kontrolního ramene klinických studií s primární chemoterapií intraperi-toneální chemoterapii (jako ve studii GOG-0172) [18, 20], paklitaxel podávaný v tý-denním režimu (jako ve studii JGOG NOVEL) a bevacizumab (jako ve studii GOG-0218) [21]. Poslední konsenzuální konference ovariálního karcinomu GCIG a společné setkání expertů FDA (Food and Drug Administration), ASCO (American Society of Clinical Oncology) a AACR (American Association of Cancer Research) definovaly PFS jako validní ukazatel pro chemoterapii 2. linie u platina-senzitivních ova-riálních karcinomů [22, 23]. Výhodou stanovení PFS jakožto primárního ukazatele je, že odráží zmenšení nádoru a stabilizaci nemoci v souvislosti s léčebným schématem a nezapočítává následující léčbu, což se projeví v ukazateli OS.
Relaps karcinomu ovaria
První skupinou pacientek s podezřením na recidivu onemocnění jsou pacientky, u nichž nejsou přítomny klinické ani radiologické známky relapsu nemoci, ale u nichž dochází k elevaci tumorózního markeru Ca 125. Tato situace se nazývá sérologický relaps a při opakovaných a vzrůstajících hodnotách předbíhá radiologický či klinický relaps o několik měsíců. Důležitost časné diagnostiky relapsu je v současnosti nejasná, neboť nebyla prokázána výhoda časného zahájení léčby u asymptomatických pacientek a u pacientek s průkazem relapsu nemoci zobrazovacími metodami. Studie MRC OV05/EORTC 55955 [24] randomizovala pacientky se sérologickým relapsem na skupinu, u níž byla léčba zahájena ihned (medián 0,8 měsíce), a na skupinu, u níž byla léčba zahájena až při vzniku symptomů (medián 5,6 měsíce). Nebyl shledán signifikantní rozdíl v OS (medián 36 měsíců s rozdílem 0,1 %.) Vzhledem k tomu, že neexistují studie, které by prokázaly přínos časného zahájení léčby, není u pacientek se sérologickým relapsem chemoterapie doporučována. Určitou roli může u této skupiny nemocných hrát hormonální léčba tamoxifenem podávaným v dávce dvakrát denně 20 mg s popisovanou objektivní odpovědí 0–38 %.
Při průkazu recidivy nemoci klinickým vyšetřením a zobrazovacími metodami by léčba měla být pečlivě zvažována a při jejím výběru by se měl brát v potaz charakter a místo recidivy. V první řadě je nutno stanovit, zda je recidiva chirurgicky řešitelná, kdy podmínkou indikace chirurgické léčby je předpoklad dosažení nulového rezidua nádoru, tedy situace, kdy dochází k vytvoření málo četných ohraničených metastatických ložisek v dutině břišní nebo v oblasti regionálních lymfatických uzlin. Tuto indikaci splňuje pouze 15–20 % pa-cientek, mnohem častější jsou recidivy manifestující se přítomností ascitu při diseminaci nádorového procesu na serózách parietálního a viscerálního peritonea, recidivy s vícečetnými metastázami v parenchymatózních orgánech, u nichž není chirurgická léčba s předpokladem odstranění veškerých nádorových ložisek možná. Při zvažování možnosti chirurgické léčby recidivy využíváme kromě klinického vyšetření expertní transvaginální a transabdominální sonografické vyšetření pánve a dutiny břišní prováděné erudovaným onkogynekologickým sonografistou. Z dalších vyšetřovacích metod lze využít počítačovou tomografii (CT), magnetickou rezonanci, endoskopické vyšetřovací metody, pozitronovou emisní tomografii (PET), eventuálně kombinované PET-CT vyšetření a laboratorní vyšetření nádorových markerů. Této diagnostice musí být věnována velká pozornost, neboť chirurgická léčba recidivy s dosažením nulového rezidua poskytuje pacientce v tomto případě možnost podání chemoterapie 2. linie s kurativním záměrem. Ve většině případů chemoterapie 2. linie nabízí efektivní paliativní léčbu, jen výjimečně má však kurativní potenciál.
Chemoterapie
V případě nemožnosti chirurgické léčby je chemoterapie podávána jako paliativní léčba, jejímž cílem je navodit stav remise a co nejdelšího období bez přítomnosti nemoci (DFI, disease-free interval). Účinnost chemoterapie dalších linií závisí na mnoha faktorech, na:
- charakteru recidivy,
- velikosti nádorových ložisek,
- hladině tumorových markerů,
- celkovém stavu pacientky,
- přítomnosti nežádoucích účinků chemoterapie 1. linie.
Nejvýznamnějším faktorem, který je rozhodujícím pro výběr režimu cytostatické léčby a který nejvíce predikuje účinnost chemoterapie, je objektivní odpověď na léčbu 1. linie a časový interval mezi ukončením chemoterapie 1. linie a objevením se recidivy či progrese nemoci. DFI, PFI nebo interval od ukončení léčby platinovým derivátem (PFI, platinum-free interval) je zásadní pro výběr cytostatické léčby, pro účinnost chemoterapie a pro prognózu nemoci. Podle délky DFI nebo PFI je stanovena senzitivita nádoru k platinovému derivátu jako k nejdůležitějšímu cytostatiku léčby ovariálního karcinomu 1. linie.
Za platina-rezistentní je považována nemoc s progresí do 6 měsíců po ukončení léčby a stejně je kvalifikována taktéž primárně refrakterní nemoc – situace, kdy k progresi nádorového onemocnění dojde během cytostatické léčby 1. linie, nebo situace, kdy nádor není léčbou ovlivněn. Při progresi nemoci později než za 6 mě-síců je onemocnění považováno za platina-senzitivní a do léčby je možné zařadit platinový derivát. Při intervalu s progresí mezi 6.–12. měsícem po ukončení chemoterapie 1. linie je někdy onemocnění označováno jako parciálně chemosenzitivní.
Léčebný záměr podávání chemoterapie při relapsu nemoci je, s výjimkou zařazení chirurgické intervence s kompletním odstraněním metastatických ložisek, palia-tivní. Jeho cílem je prodloužení DFI a OS s oddálením symptomů nemoci a zvýšením kvality života.
Platina-refrakterní karcinom
Pacientky s platina-refrakterním nádorem nereagují na léčbu založenou na platině – během této léčby dojde k progresi nemoci nebo nádor není léčbou ovlivněn. Prodloužení OS je za současného stavu vědění prakticky nemožné. V léčbě je možno zvažovat cytostatikum, které není s platinovými deriváty zkříženě rezistentní. Při indikaci této záchranné léčby však musíme vycházet z celkového zdravotního stavu pacientky a nežádoucích účinků zvažovaných cytostatik, aby tato léčba s limitovanou účinností nebyla pro pacientky zbytečnou zátěží a snižováním kvality života. Také načasování záchranné léčby musí u této prognosticky nepříznivé skupiny pacientek sledovat hlavní léčebný cíl, kterým je zmírňování příznaků nemoci nebo jejich oddálení v případě, že nejsou ještě přítomny. Rozhodování je často obtížné, neboť časné zahájení záchranné chemoterapie může bezpříznakového pacienta vystavit nežádoucím účinkům léčby a snížit kvalitu života. Logicky se tedy u bezpříznakových pacientů nabízí, při sledování hlavního cíle, kterým je v tomto případě kvalita života, možnost vyčkávací, která však musí vzejít z dialogu lékaře s plně informovanou pacientkou a její rodinou. V případě rozhodnutí o aplikaci chemoterapie je doporučována monoterapie neplatinovým derivátem.
Platina-rezistentní karcinom
Další prognosticky nepříznivou skupinou jsou pacientky, u nichž byla v průběhu 1. linie chemoterapie zaznamenána úplná odpověď (CR, complete response) nebo částečná odpověď (PR, partial response), ale do 6 měsíců od ukončení léčby došlo k recidivě nemoci. U těchto pacientek je doporučována chemoterapie 2. linie založená na monoterapii neplatinovým derivátem. Celková míra odpovědi (overall re-sponse rate, ORR) se pohybuje ve většině studií mezi 6–25 %.
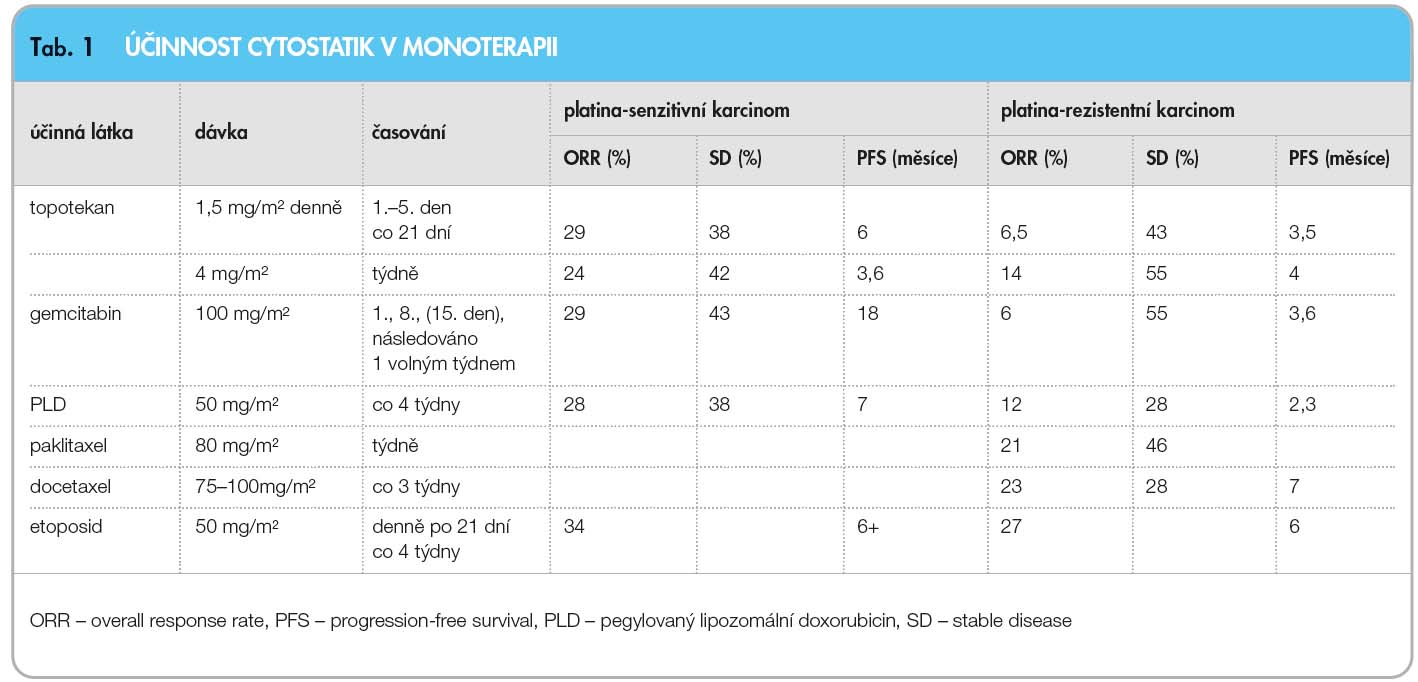 V úvahu přichází léčba topotekanem, gemcitabinem, PLD, paklitaxelem, docetaxelem nebo perorálním etoposidem (tab. 1). Při zhoršeném celkovém stavu pacientek v důsledku progrese nemoci při anorexii, přítomnosti ascitu a fluidothoraxu dochází vzhledem k hypoalbuminemii a snižování renálních a hepatálních funkcí k nárůstu toxicity chemoterapie a k možnosti vzniku závažných, život ohrožujících nežádoucích účinků.
V úvahu přichází léčba topotekanem, gemcitabinem, PLD, paklitaxelem, docetaxelem nebo perorálním etoposidem (tab. 1). Při zhoršeném celkovém stavu pacientek v důsledku progrese nemoci při anorexii, přítomnosti ascitu a fluidothoraxu dochází vzhledem k hypoalbuminemii a snižování renálních a hepatálních funkcí k nárůstu toxicity chemoterapie a k možnosti vzniku závažných, život ohrožujících nežádoucích účinků.
Topotekan je nejčastěji podáván ve 30minutové infuzi cyklicky v třítýdenním intervalu v dávce 1,5 mg/m2 1.–5.den nebo v týdenním režimu 4 mg/m2 1., 8. a 15. den ve 28denním intervalu. Nejzávažnějším a často limitujícím nežádoucím účinkem topotekanu je hematologická toxicita, kdy se neutropenie III.–IV. stupně objevuje až v 80 % případů. Lepší profil hematologické toxicity má týdenní režim nebo snížená dávka 1,25 mg v cyklickém režimu nebo snížená týdenní dávka v cyklickém režimu s aplikací 2 mg/m2 1.–3. den [32]. Bokkel Huinink a kol. randomizovali 235 pacientek do skupiny léčené topotekanem a do skupiny léčené paklitaxelem a prokázali, že první skupina má lepší výsledky projevující se vyšší ORR a delší PFI [33].
Gemcitabin je nejčastěji aplikován ve 30minutové infuzi v dávce 750–1000 mg/m2 1., 8. a 15. den v intervalu 3–4 týdnů.
Gemcitabin je cytostatikum, které je často používáno v kombinovaných režimech. U platina-rezistentních nádorů představuje poměrně účinnou a dobře tolerovatelnou alternativu kombinace s PLD podávaným v den 1 v dávce 30 mg/m2 a gemcitabinem v dávce 650 mg/m2 1. a 8. den. Výhodou tohoto cytostatika je jeho příznivý profil nežádoucích účinků bez neurotoxicity, s reverzibilní a dobře předvídatelnou myelosupresí a málo častou alopecií.
Pegylovaný lipozomální doxorubicin je nejčastěji aplikován ve čtyřtýdenním intervalu v dávce 50 mg/m2. Randomizovaná studie fáze III, publikovaná Gabriellou Ferrandinou, porovnávající účinnost PLD a gemcitabinu u pacientek s relapsem do 12 měsíců prokázala u PLD 16% míru odpovědi a medián přežití 56 týdnů oproti 29% míře odpovědi a 51týdennímu mediá-nu přežití při podávání gemcitabinu [27]. Jeho výhodou je nízká hematotoxicita a neurotoxicita i fakt, že nezpůsobuje alopecii. Nejzávažnějším nežádoucím účinkem je tzv. hand-foot syndrom se vznikem kožních projevů na ploskách a dlaních. PLD má oproti konvenčnímu doxorubicinu delší dobu cirkulace v krevním řečišti a při nižších hladinách v krvi umožní zvýšení koncentrace v nádoru 4–11krát [34, 35]. Alopecie, nauzea, zvracení a hematologická toxicita jsou méně časté a kardiotoxicita se objevuje výjimečně [36, 37].
Paklitaxel je možno aplikovat jak v tří-týdenním režimu v dávce 135–175 mg/m2 podané v tříhodinové infuzi, tak v týdenním režimu v dávce 60–80 mg/m2 v jednohodinové infuzi; týdenní režim má při stejné účinnosti asi o 20 % méně nežádoucích účinků. Nevýhodou je možnost recidivy nebo progrese senzomotorické neuropatie.
Stejnou účinnost, ale jiné spektrum nežádoucích účinků má druhý z taxanů – docetaxel, který je nejčastěji aplikován v dávce 75–100 mg/m2 v třítýdenním intervalu. Oproti paklitaxelu je léčba docetaxelem spojena s menší neurotoxicitou, ale s vyšší hematotoxicitou, může způsobovat retenci tekutin a změny na nehtových ploténkách.
Alternativou je perorální podávání 25–50 mg/m2 etoposidu 1.–14. den v třítýdenním intervalu. Nejzávažnějším nežádoucím účinkem je hematologická a gastrointestinální toxicita.
Účinnou možností je u diseminovaného procesu s tvorbou ascitu a neobjemným nádorovým reziduem intraperitoneální aplikace platinového derivátu, jejíž výhodou je několikrát vyšší koncentrace účinné látky v dutině břišní.
Platina-senzitivní karcinom
Prognosticky příznivější skupinu pacientek s rekurencí ovariálního karcinomu představují nemocné s platina-senzitivním nádorem, u nichž došlo k relapsu nemoci později než za 6 měsíců od ukončení léčby. U této skupiny pacientek hraje větší úlohu načasování chemoterapie, neboť pozdní zahájení chemoterapie může snížit pravdě-podobnost účinnosti cytostatik i pravděpodobnost, že pacientka zamýšlenou léčbu zvládne. Odpověď na chemoterapii závisí nejen na celkovém stavu pacientky, ale také na objemu nádoru, jeho rozložení a charakteru metastatického šíření.
Nejpříznivější skupinou pacientek (ve smyslu prodloužení ORR, ne vyléčení) je skupina s platina-senzitivním nádorem s relapsem po 12 měsících, kde je pravděpodobnost dočasného ovlivnění nádoru vysoká. Tyto pacientky mají největší pros-pěch z časného zahájení cytostatické léčby, jejíž účinnost je v přímé úměře k DFI a PFI s největší účinností při recidivě za déle než dva roky [8, 38]. U pacientek s recidivou za 12 měsíců lze očekávat ORR 27 % a po 24 měsících zvýšení na 72 %. Při zvažování režimu je nutno vycházet z konkrétní situace hodnotící celkový stav pacientky s vyhodnocením nežádoucích účinků chemoterapie 1. linie a nežádoucích účinků zamýšlené chemoterapie. Podmínkou efektivní chemoterapie je celkový stav hodnocený na škále ECOG jako 0 nebo 1, předpokládaná délka života delší než 6 měsíců a interkurentní nemoci umožňující dodržet kurativní dávku cytostatik. U pacientek, u nichž přetrvávají nežádoucí účinky proběhlé chemoterapie, je možné indikovat monochemoterapii platinovým derivátem s cílem snížit nežádoucí účinky kombinované chemoterapie. Také výběr platinového derivátu se odvíjí od vyhodnocení konkrétní situace a charakteru toxicity proběhlé léčby. Publikované studie prokazují, že kombi-novaná cytostatická léčba zvyšuje oproti monoterapii celkový počet objektivních léčebných odpovědí a snižuje pravděpodobnost progrese nemoci během prvních dvou let.
Existují tři velké randomizované studie dokazující vyšší léčebnou účinnost kombinované léčby oproti monoterapii karboplatinou. Parmar a kol. ve studii ICON4/ AGO-OVAR-2.2 randomizovali pacientky do skupiny léčené kombinací platiny a paklitaxelu a do skupiny, v níž nemocné dostávaly pouze léčbu platinovým deri-vátem. Studie prokázala zlepšení PFS o 3 měsíce (12 vs. 9 měsíců, HR 0,76; 95% CI: 0,66–0,89; p = 0,0004), OS o 5 měsíců (29 vs. 24 měsíců, HR 0,82; 95% CI: 0,69–0,97; p = 0,02) a o 7 % delší dvouletý interval přežití u pacientek s platina-senzitivními nádory, jež byly léčeny kombinací platina–paklitaxel [39]. Pfisterer a kol. porovnávali ve studii AGO/NCIC/EORTC kombinovaný režim karboplatina–gemcitabin s monoterapií karboplatinou. Ve studii s mediánem follow-up 17 měsíců byla ORR o 17 % vyšší (47% vs. 30 %), medián PFS delší o 3,2 měsíce (8,6 vs. 5,8 měsíce, HR 0,72; 95% CI: 0,58–0,90; p = 0,0031) [40]. Studie SWOG S0200 publikovaná Albertem a kol. v roce 2008 porovnávala léčbu kombinací karboplatina–PLD s monoterapií karboplatinou. U kombinované léčby byla prokázána o 35 % vyšší ORR (67 % vs. 32 %), o 4 měsíce delší PFS (12 vs. 8 měsíců) a o 8 měsíců delší OS (26 vs. 18 měsíců) [41]. Z tohoto důvodu je proto vhodnější v situacích, kdy léčba není limitována z důvodu své toxicity či celkového stavu pacienta, použít kombinovaný léčebný režim.
Existuje několik velkých randomizovaných studií fáze III, jež se týkají chemoterapie 2. linie u relabujícího karcinomu ovaria a porovnávají účinnost a spektrum nežádoucích účinků, které mohou být často limitujícím faktorem. Většina těchto studií směřuje ke změně dosavadních léčebných paradigmat. Alternativou k základní kombinaci karboplatina AUC 5–6 + paklitaxel 175 mg/m2 podávané v třítýdenních intervalech do celkového počtu 6–8 jsou třítýdenní režimy s cisplatinou v dávce 75 mg/m2 v kombinaci s paklitaxelem 175 mg/m2, docetaxelem 50–100 mg/m2 nebo s cyklofosfamidem 500–800 mg/m2 a čtyřtýdenní režim s cisplatinou v dávce 75 mg/m2 nebo s karboplatinou 4 AUC v kombinaci s gemcitabinem 500–800 mg/m2 aplikovaným 1., 8. a 15 den. Potenciální kontraindikací opětovného užití taxanů u relabujícího karcinomu ovaria jsou nežádoucí účinky chemoterapie, zvláště neurotoxicita a alopecie. Proto je snaha o zařazení jiné, stejně účinné nebo účinnější kombinace, ovšem již bez závažnějších vedlejších účinků. V úvahu zde přichází kombinace platinového derivátu s PLD. Účinnost monoterapie PLD byla prokázána ve studiích fáze III srovnávajících PLD s paklitaxelem, v nichž nebyl prokázán signifikantní rozdíl v účinnosti mezi PLD a paklitaxelem bez ohledu na senzitivitu k platině či na rezistenci, s výrazně nižší neurotoxicitou a alopecií u PLD [42]. Studie publikované Gordonem a kol., které srovnávaly PLD s topotekanem, prokázaly u PLD o 3 týdny vyšší OS (63 vs. 60 týdnů), zvláště u pacientů s platina-senzitivními nádory, u nichž bylo prodloužení OS ještě vyšší (108 vs. 70 týdnů). PLD měl navíc příznivější profil nežádoucích účinků a vhodnější aplikační schéma jak u platina-senzitivních, tak u platina-rezis-tentních nádorů [43, 44]. Ferrero a kol. ve své studii prokázali, že kombinace PLD (30 mg/m2) a karboplatiny 5 AUC má vy-soké ORR (63 %), CRR (38%) a medián PFS (9,4 měsíce), který je srovnatelný s kombinací karboplatina–paklitaxel ve studii ICON4 2.2 (medián OS 32 měsíců vs. 29 měsíců, medián PFS 9,4 měsíce vs. 12 měsíců) [45].
Eric Pujade-Lauraine publikovala v roce 2010 multicentrickou, randomizovanou studii CALYPSO (Caelyx in Platinum Sensitive Ovarian patients) zahrnující 976 pa-cientek, jež je doposud největší klinickou studií relabujícího ovariálního karcinomu [46]. Během mediánu 22 měsíců byl PFS u ramene s PLD statisticky vyšší oproti rameni s paklitaxelem (11,3 vs. 9,4 měsíce, HR 0,821; 95% CI: 0,72–0,94; p = 0,005). Tato studie prokázala, že PLD v kombinaci s karboplatinou je u platina-senzitivních nádorů vysoce účinnou látkou prokazující signifikantní zlepšení PFS oproti režimu s paklitaxelem (HR 0,82; p = 0,005). Neméně důležitá je výrazně nižší toxicita, zvláště neurotoxicita, která může být limitující. Celková závažná nehematologická toxicita (36,8 % vs. 28,4 %; p = 0,01) vedoucí k přerušení léčby (15 % vs. 6 %; p = 0,001) se častěji objevila v rameni s paklitaxelem, stejně jako alopecie vyššího stupně (83,6 % vs.7 %) a alergické reakce. Hand-foot syndrom (12,0 % vs. 2,2 %), nauzea (35,2 % vs. 24,2 %) a mu-kozitida 2.–3. stupně závažnosti (13,9 % vs. 7 %) byly častější v rameni s PLD.
Studie Monka a kol. publikovaná v roce 2010 se liší od předchozích studií tím, že v léčebném schématu používá novou chemickou látku a používá režim bez platinového derivátu. Celkem 672 pacientů bylo randomizováno do skupiny léčené kombinací trabectidin–PLD a do skupiny léčené pouze PLD. Medián PFS byl 7,3 měsíce u skupiny trabectidin–PLD oproti 5,8 mě-síce u skupiny léčené PLD. U pacientek s platina-senzitivními nádory byl medián PFS 9,2 měsíce vs. 7,5 měsíce. ORR dosahovala 27,6 % pro skupinu trabectidin–PLD vs. 18,8 % pro skupinu PLD. U skupiny senzitivní vůči platině byla ORR 35,3 % vs. 22,6 %, ORR, PFS a OS u skupiny platina-rezistentní se statisticky ne-lišily [38]. Podobně jako v předchozích studiích, i zde se prokazuje nadřazenost kombinovaného režimu s ještě většími rozdíly v ORR a PFS pacientek s platina-senzitivními nádory. Žádný přínos nebyl zaznamenán u pacientek s platina-rezis-tentními nádory.
Hormonální léčba
Hormonální léčba je založena na snížení účinku estrogenů, respektive na snížení jejich předpokládaného proliferativního nádorového účinku, a to buďto vytěsněním endogenních estrogenů z vazby na receptory, nebo inhibicí syntézy endogenních estrogenů.
Z hormonálních přípravků je možné v paliativní léčbě relabujícího karcinomu ovaria po vyčerpání možností léčby cytostatiky použít antiestrogen tamoxifen, inhibitory aromatáz letrozol a anastrozol a analoga gonadoliberinů. Tamoxifen patří do skupiny selektivních modulátorů estrogenových receptorů (SERM, selective estrogen response modifiers), léčebná odpověď při dávce dvakrát denně 20 mg je udávána v rozmezí 0–38 % s mediánem trvání odpovědi 4,4 měsíce. Biologické účinky tamoxifenu jsou komplexní, nejvýznamnější je blokáda estrogenních receptorů, indukce syntézy antiproliferačních cyto-kinů (TGF beta) a inhibice stimulačních faktorů (IGF-1). Inhibitory aromatáz 3. ge-nerace letrozol a anastrozol blokují tvorbu estrogenů na úrovni aromatázy, enzymu potřebného k přeměně androstendionu na estrogeny. Léčebná odpověď dosahuje 15 %. V doporučených postupech není v České republice indikace inhibitorů aromatáz u karcinomu ovaria, na rozdíl od karcinomu prsu, uvedena. Analoga gonadoliberinů se používají vzácně, jejich účinnost je udávána v rozmezí 9–12 %.
Gestageny, dříve užívané v léčbě re-cidiv karcinomu ovaria, mají v dnešní době význam více v prevenci kachexie, doporučován je megestrol acetát v dávce 400–800 mg denně.
Biologická léčba
Cílená molekulární léčba využívá poz-natku, že nádor od velikosti 1 mm potřebuje ke svému růstu svou vlastní cévní síť a že zablokování neoangiogeneze jakožto hlavní podmínky nádorového růstu vede k zastavení růstu nádoru či k jeho regresi. Antiangiogenní účinek je způsoben regresí a snížením permeability stávající vaskulární sítě a inhibicí novotvorby cév. Angiogeneze je komplexní složitě regulovaný proces s množstvím proangiogenních a antiangiogenních faktorů vedoucí ve svém výsledku k novotvorbě cévní sítě nádoru. Ta je oproti normálním cévám vinutější, s narušenými perivaskulárními obaly a zvýšenou permeabilitou.
Nejvýznamnější úlohu v procesu neoangiogeneze má signální osa VEGF (vascular endothelial growth factor) a jeho tyrozinkinázové receptory (VEGFR). Zvýšená exprese VEGF v důsledku aktivace onkogenů a inaktivace tumor supreso-rových genů, ale i v důsledku hypoxie, acidózy či mechanického poškození, vede k mobilizaci endotelových buněk kostní dřeně a k proliferaci endotelových buněk cév. Vysoké hladiny VEGF jsou spojeny s progresí nemoci a špatnou prognózou. V biologické cílené léčbě byla prokázána účinnost bevacizumabu, monoklonální protilátky, která vazbou na VEGF zabraňuje navázání VEGF na VEGFR v endotelu cév a tím blokuje angiogenezi a zastavuje nádorový růst.
Účinnost byla prokázána ve třech studiích. Studie GOG-0218 a ICON 7 se týkaly pacientek, u nichž byla biologická terapie použita v primární léčbě, ve studii OCEANS byla biologická léčba použita u pacientek s relabujícím karcinomem ovaria [48]. Studie GOG-0218 prokázala u 1873 žen s pokročilým karcinomem ovarií po primární chirurgické léčbě, že přidání bevacizumabu v dávce 15 mg/kg k chemoterapii paklitaxel–karboplatina zvýší PFS o 3,8 ![Schéma studie OCEANS; volně podle [48] – Aghajanian, et al., 2011](https://www.remedia.cz/photo-a-28826---.jpg) měsíce (z 10,3 na 14,1 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 38 % a snížení rizika progrese nemoci a smrti o 28 %. Při dalším pokračování samotné aplikace po dobu 12 měsíců dojde ke zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 56 % a ke snížení rizika progrese nemoci a smrti o 36 %. Studie ICON 7 prokázala u 1528 žen s pokročilým karcinomem ovarií po primární chirurgické léčbě, že přidání bevacizumabu v dávce 7,5 mg/kg k chemoterapii paklitaxel–karboplatina a poté pokračování aplikace samotného bevacizumabu do celkové délky 12 měsíců zvýší PFS o 2,3 měsíce (z 16 na 18,3 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 27 % a snížení rizika progrese nemoci a smrti o 21 %. OCEANS je multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie fáze III, do níž bylo zařazeno 484 žen s platina-senzitivním prvním relapsem karcinomu ovaria (obr. 1).
měsíce (z 10,3 na 14,1 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 38 % a snížení rizika progrese nemoci a smrti o 28 %. Při dalším pokračování samotné aplikace po dobu 12 měsíců dojde ke zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 56 % a ke snížení rizika progrese nemoci a smrti o 36 %. Studie ICON 7 prokázala u 1528 žen s pokročilým karcinomem ovarií po primární chirurgické léčbě, že přidání bevacizumabu v dávce 7,5 mg/kg k chemoterapii paklitaxel–karboplatina a poté pokračování aplikace samotného bevacizumabu do celkové délky 12 měsíců zvýší PFS o 2,3 měsíce (z 16 na 18,3 měsíce), což znamená zvýšení pravděpodobnosti delšího přežívání bez zhoršení nemoci o 27 % a snížení rizika progrese nemoci a smrti o 21 %. OCEANS je multicentrická, randomizovaná, dvojitě zaslepená a placebem kontrolovaná studie fáze III, do níž bylo zařazeno 484 žen s platina-senzitivním prvním relapsem karcinomu ovaria (obr. 1).
Tato studie srovnávala dvě ramena pa-cientek, přičemž v prvním rameni byly pa-cientky s chemoterapií karboplatina–gemcitabin a aplikací bevacizumabu 15 mg/kg s pokračováním aplikace samotné bio-logické léčby až do progrese nemoci. Ve druhém srovnávacím rameni bylo namísto bevacizumabu podáváno placebo. Primárním cílem studie bylo stanovení PFS, sekundárním cílem bylo stanovení OS, ORR a bezpečnosti látky. U skupiny pacientek s cílenou léčbou došlo k prodloužení PFS o 4 měsíce (8,4 vs. 12,4 měsíce, HR 0,484), medián OS se prodloužil o 5,6 měsíce (29,9 vs. 35,5 měsíce, HR 0,751).
Bevacizumab je nejslibnější látkou uplatňující se v léčbě rekurentního karcinomu ovaria. V současnosti je registrován k léčbě pokročilého karcinomu, není však ještě hrazen ze zdravotního pojištění (podle §16 lze pro nemocné požádat revizního lékaře o úhradu). Bevacizumab v kombinaci s karboplatinou a paklitaxelem je indikován k úvodní léčbě pokročilého (stadia III B, III C a IV dle FIGO) epitelového nádoru vaječníků, vejcovodů nebo primárního nádoru pobřišnice. Podává se spolu s karboplatinou a paklitaxelem, a to až po 6 léčebných cyklů, a následně se pokračuje v samostatné léčbě bevacizumabem do progrese nemoci nebo maximálně po dobu 15 měsíců nebo do nepřijatelné toxicity, dle toho, co nastane nejdříve. Doporučená dávka bevacizumabu je 15 mg/kilogram tělesné hmotnosti podaná jedenkrát za 3 týdny ve formě intravenózní infuze [49].
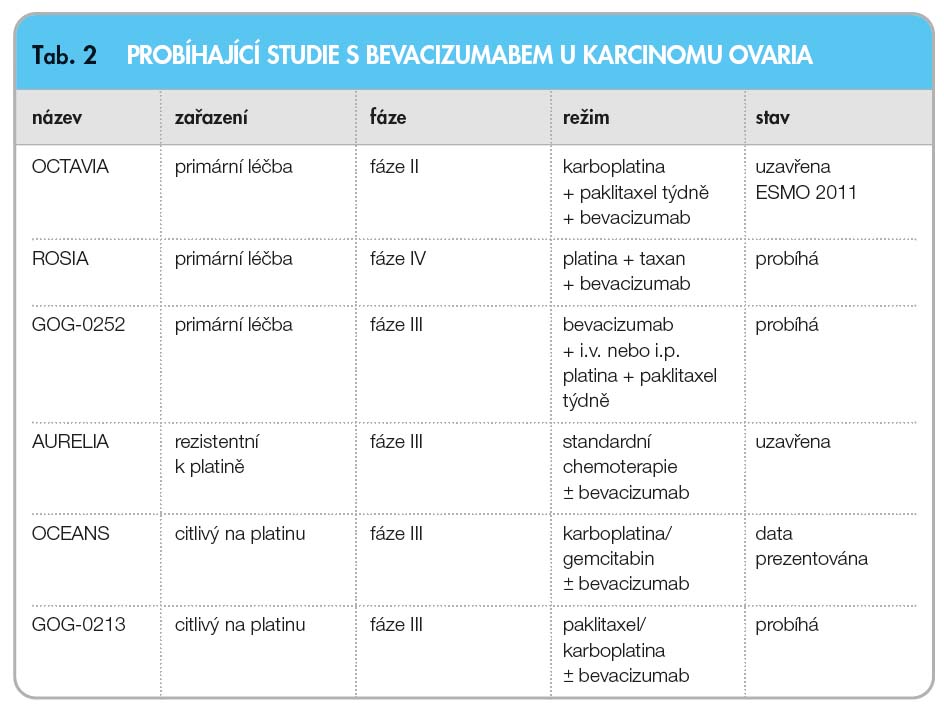 Kromě dobře definovaných nežádoucích účinků, jako jsou hypertenze, zhoršené ho-jení ran, krvácení a tromboembolismus, jsou pacientky s relabujícím karcinomem ovaria ohroženy perforací střeva, která se ve studiích pohybuje mezi 0–13 %. Rizikovou skupinou pacientek jsou pacientky s anamnézou střevní obstrukce, pacient-ky s metastázami na střevech a pacientky s více liniemi chemoterapie. V současnosti probíhají další studie, např. studie GOG-0252 s intraperitoneální chemoterapií s cyklickou intravenózní aplikací bevaci-zumabu (tab. 2).
Kromě dobře definovaných nežádoucích účinků, jako jsou hypertenze, zhoršené ho-jení ran, krvácení a tromboembolismus, jsou pacientky s relabujícím karcinomem ovaria ohroženy perforací střeva, která se ve studiích pohybuje mezi 0–13 %. Rizikovou skupinou pacientek jsou pacientky s anamnézou střevní obstrukce, pacient-ky s metastázami na střevech a pacientky s více liniemi chemoterapie. V současnosti probíhají další studie, např. studie GOG-0252 s intraperitoneální chemoterapií s cyklickou intravenózní aplikací bevaci-zumabu (tab. 2).
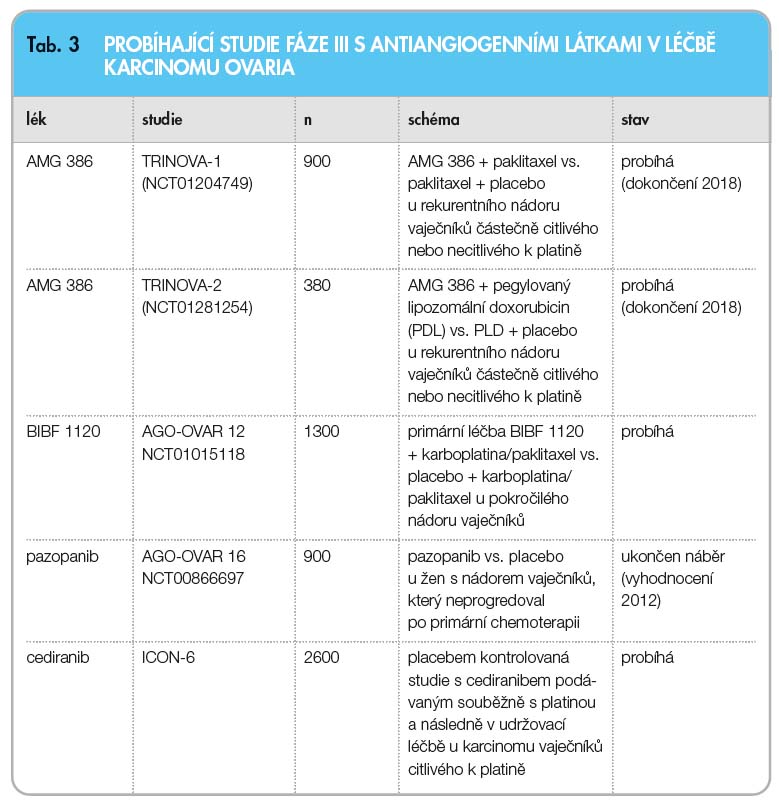 Z dalších antiangiogenních látek je zkoumán solubilní fúzní protein aflibercept (VEGF-Trap) v klinických studiích fáze I–II jak v monoterapii, tak v kombinované léčbě, který funguje jako dominantně negativní kompetitivní inhibitor VEGF receptorů. Další látkou, která je v současnosti zkoumána v multicentrické randomizované studii fáze III ICON 6, je inhibitor VEGFR2, AZD2171, dále humanizovaná monoklonální protilátka proti VEGFR2, IMC-1121B. Povzbudivé výsledky s ORR dosahující 33 % vycházejí ze studií fáze II s multikinázovým inhibitorem sorafenibem, který je doposud registrován k léčbě renálního karcinomu, v kombinaci s gemcitabinem u pacientek s recidivujícím a refrakterním karcinomem. Další studie fáze I s jiným multikinázovým inhibitorem vatanalibem probíhají v kombinaci s karboplatinou a paklitaxelem. Na podkladě slibných preklinických výsledků s duálním inhibitorem EGFR a VEGFR je připravována randomizovaná studie fáze II (tab. 3).
Z dalších antiangiogenních látek je zkoumán solubilní fúzní protein aflibercept (VEGF-Trap) v klinických studiích fáze I–II jak v monoterapii, tak v kombinované léčbě, který funguje jako dominantně negativní kompetitivní inhibitor VEGF receptorů. Další látkou, která je v současnosti zkoumána v multicentrické randomizované studii fáze III ICON 6, je inhibitor VEGFR2, AZD2171, dále humanizovaná monoklonální protilátka proti VEGFR2, IMC-1121B. Povzbudivé výsledky s ORR dosahující 33 % vycházejí ze studií fáze II s multikinázovým inhibitorem sorafenibem, který je doposud registrován k léčbě renálního karcinomu, v kombinaci s gemcitabinem u pacientek s recidivujícím a refrakterním karcinomem. Další studie fáze I s jiným multikinázovým inhibitorem vatanalibem probíhají v kombinaci s karboplatinou a paklitaxelem. Na podkladě slibných preklinických výsledků s duálním inhibitorem EGFR a VEGFR je připravována randomizovaná studie fáze II (tab. 3).
Jiným multifaktoriálním mechanismem antiangiogeneze je metronomická chemoterapie s kontinuálním podáváním nízkých dávek cytostatik ve vyšší frekvenci (většinou denně) na rozdíl od konvenční chemoterapie, kdy se podávají maximálně tolerovatelné dávky cytostatik v různých kombinacích a sekvencích. Antiangiogenní účinek byl prokázán u cyklofosfamidu, doxorubicinu, irinotekanu a dalších méně často užívaných cytostatik. Doporučovaná dávka cyklofosfamidu je 25 mg denně. V současnosti je tento způsob léčby prověřován v klinických studiích fáze II [50].
Závěr
Pacientky s karcinomem ovaria mají velice závažnou prognózu a je žádoucí, aby byly (pokud možno od počátku) léčeny v komplexních onkologických centrech, která disponují jak erudovanými onkochirurgy, kteří jsou schopni provést radikální operaci bez ponechání nádorového rezidua, tak erudovanými klinickými onkology, kteří jsou schopni posoudit vhodnost jednot-livých cytostatik s ohledem na konkrétního jedince s vyhodnocením spektra nežádoucích účinků léčby a celkového stavu pacienta. Je zapotřebí si uvědomit, že záměr léčby relabujícího karcinomu ovaria je až na výjimky paliativní a stejný důraz je nutno klást nejen na léčebný efekt, ale i na kvalitu života. U pacientek s rychle progredujícím nádo-rem, špatným celkovým stavem a malnutricí je lépe zastavit aktivní léčbu ve prospěch léčby symptomatické a podpůrné a ponechat pacienta zemřít na nemoc samotnou a ne na komplikace způsobené léčbou.
Seznam použité literatury
- [1] Eisenkop SM, Spirtos NM, Friedman RL, et al. Relative influences of tumor volume before surgery and the cytoreductive outcome on survival for patients with advanced ovarian cancer: a prospective study. Gynecol Oncol 2003; 90: 390–396.
- [2] McGuire WP, Hoskins WJ, Brady MF, et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med 1996; 334: 1–6.
- [3] Ozols RF, Bundy BN, Greer BE, et al. Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer: a Gyneco-logic Oncology Group study. J Clin Oncol 2003; 21: 3194–3200.
- [4] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006. Ca Cancer J Clin 2006; 56: 106–130.
- [5] Armstrong DK. Relapsed ovarian cancer: challenges and management strategies for a chronic disease. Oncologist 2007; 7: 20–28.
- [6] Vasey PA, Jayson GC, Gordon A, et al. Phase III randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma. J Natl Cancer Inst 2004; 96: 1682–1691.
- [7] Pignata S, Scambia G, Savarese A, et al. Carboplatin and pegylated liposomal doxorubicin for advanced ovarian cancer: preliminary activity results of the MITO-2 phase III trial. Oncology 2009; 76: 49–54.
- [8] Markman M, Liu PY, Moon J, et al. Impact on survival of 12 versus 3 monthly cycles of paclitaxel (175 mg/m2) administered to patients with advanced ovarian cancer who attained a complete response to primary platinum-paclitaxel: follow-up of a Southwest Oncology Group and Gynecologic Oncology Group phase 3 trial. Gynecol Oncol 2009; 114: 195–198.
- [9] Ozols RF. Maintenance therapy in advanced ovarian cancer: Progression free survival and clinical benefit. J Clin Oncol 2003; 13: 2451–2453.
- [10] Markman M, Liu PY, Wilezynski S, et al. Phase III randomized trial of 12 versus 3 months of maintenance paclitaxel in patients with advanced ovarian cancer after complete response to platinum and paclitaxel-based chemotherapy: A south-
- [11] Conte PF, Favalli G, Gadducci A, et al. Final results of After-6 protocol 1: A phase III trial of observation versus 6 courses of paclitaxel in advanced ovarian cancer patients in complete response after platinum-paclitaxel chemotherapy. J Clin Oncol 2007; 25: abstract 5505.
- [12] du Bois A, Weber B, Rochon J, et al. Addition of epirubicin as a third drug to carboplatin-paclitaxel in first-line treatment of advanced ovarian cancer: a prospectively randomized gynecologic
- [13] Kristensen GB, Vergote I, Start G, et al. First-line treatment of ovarian cancer FIGO stages IIb-IV with paclitaxel/epirubicin/carboplatin versus pa-clitaxel/carboplatin. Int J Gynecol Cancer 2003; 13: 172–177.
- [14] Pfisterer J, Weber B, Reuss A, et al. Randomized phase III trial of topotecan following carboplatin and paclitaxel in first-line treatment of advanced ovarian cancer: a gynecologic cancer intergroup trial of the AGO-OVAR and GINECO. J Natl Cancer Inst 2006; 98: 1036–1045.
- [15] Hoskins P, Vergote I, Cervantes A, et al. Advanced Ovarian Cancer: Phase III Randomized Study of Sequential Cisplatin-Topotecan and Carboplatin-Paclitaxel vs Carboplatin-Paclitaxel.
- [16] Bookman MA, Brady MF, McGuire WP, et al. Evaluation of New Platinum-Based Treatment Regimens in Advanced-Stage Ovarian Cancer: A Phase III Trial of the Gynecologic Cancer InterGroup. J Clin Oncol 2009; 27: 1419–1425.
- [17] du Bois A, Herrstedt J, Hardy-Bessard AC, et al. Phase III trial of carboplatin plus paclitaxel with or without gemcitabine in first-line treatment of epithelial ovarian cancer. J Clin Oncol 2010; 28: 4162–4169.
- [18] Armstrong DK, Bundy B, Wenzel L, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med 2006; 354: 34–43.
- [19] Katsumata N, Yasuda M, Takahashi F, et al. Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for advanced ovarian cancer: a phase 3, open-label, randomised controlled trial. Lancet 2009; 374: 1331–1338.
- [20] Armstrong DK, Bundy BN, Baergen R, et al.
- [21] Burger RA, Brady MF, Bookman MA, et al. Phase III trial of bevacizumab (BEV) in the primary treatment of advanced epithelial ovarian cancer (EOC), primary peritoneal cancer (PPC), or fallopian tube cancer (FTC): A Gynecologic Oncology Group study. J Clin Oncol (Meeting Abstracts) 2010; 28: 18S (LBA1).
- [22] Bast RC, Thiqpen JT, Arbuck SG, et al. Clinical
- [23] du Bois A, Quinn M, Thiqpen T, et al. 2004 consensus statements on the management of ovarian cancer: Final document of the 3rd Interna-tional Gynecologic Cancer Intergroup Ovarian Cancer Consensus Conference (GCIG OCCC 2004). Ann Oncol 2005; 16: viii7–viii12.
- [24] Rustin GJ, van der Burg ME, Griffin CL, et al.
- [25] Gordon AN, Fleagle JT, Guthrie D, et al. Recurrent epithelial ovarian carcinoma: a randomized phase III study of pegylated liposomal doxo-rubicin versus topotecan. J Clin Oncol 2001; 19: 3312–3322.
- [26] Morris R, Alvarez RD, Andrews S, et al. Topo-tecan weekly bolus chemotherapy for relapsed platinum-sensitive ovarian and peritoneal cancers. Gynecol Oncol 2008; 109: 346–352.
- [27] Ferrandina G, Ludovisi M, Lorusso D, et al. Phase III trial of gemcitabine compared with pegy-lated liposomal doxorubicin in progressive or recurrent ovarian cancer. J Clin Oncol 2008; 26: 890–896.
- [28] Mutch DG, Orlando M, Goss T, et al. Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer. J Clin Oncol 2007; 25: 2811–2818.
- [29] Gynecologic Oncology Group, Markman M,
- [30] Verschraegen CF, Sittisomwong T, Kudelka AP, et al. Docetaxel for patients with paclitaxel-resistant Müllerian carcinoma. J Clin Oncol 2000; 18: 2733–2739.
- [31] Rose PG, Blessing JA, Mayer AR, Homesley HD. Prolonged oral etoposide as second-line therapy for platinum-resistant and platinum-sensitive ovarian carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 1998; 16: 405–410.
- [32] Herzog TJ, Powell MA, Rader JS, et al. Phase II evaluation of a 3-day infusion of topotecan in patients with recurrent ovarian or primary peritoneal cancer. Gynecol Oncol 2006; 103: 637–641.
- [33] ten Bokkel Huinink W, Gore M, Carmichael J, et al. Topotecan versus paclitaxel for the treatment of recurrent epithelial ovarian cancer. J Clin Oncol 1997; 15: 2183–2193.
- [34] Martin FJ, Gabizon A, et al. Human pharmacokinetics of stealth liposomes containing doxorubicin. J Cell Biochem 1992; 50: Supplement: Keystone Symposia on Molecular & Cellular Biology, Issue S16E.
- [35] Gabizon A, Catane R, Uziely B, et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethyleneglycol coated liposomes. Cancer Res 1994; 54: 987–992.
- [36] Uziely B, Jeffers S, Isacson R, et al. Liposomal doxorubicin: antitumor activity and unique toxicities during two complementary phase I studies. J Clin Oncol 1995; 13: 1777–1785.
- [37] Berry G, Billingham M, Alderman E, et al. The use of cardiac biopsy to demonstrate reduced cardiotoxicity in AIDS Kaposi's sarcoma patients treated with pegylated liposomal doxorubicin. Ann Oncol 1998; 9: 711–716.
- [38] Gore ME, Levy V, Rustin G, et al. Paclitaxel (Taxol) in relapsed and refractory ovarian cancer: the
- [39] Parmar MK, Ledermann JA, Colombo N, et al. Paclitaxel plus platinum-based chemotherapy versus conventional platinum-based chemotherapy in women with relapsed ovarian cancer: The ICON4/AGO-OVAR-2.2 trial. Lancet 2003; 361: 2099–2106.
- [40] Pfisterer J, Plante M, Vergote I, et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum-sensitive recurrent ovarian cancer: An intergroup trial of the AGO-
- [41] Alberts DS, Liu PY, Wilczynski SP, et al. Randomized trial of pegylated liposomal doxorubicin (PLD) plus carboplatin versus carboplatin in
- [42] O'Byrne KJ, Bliss P, Graham JD, et al. A phase III study of Doxil/Caelyx versus paclitaxel in pla-tinum-treated, taxane-naive relapsed ovarian
- [43] Gordon AN, Fleagle JT, Guthrie D, et al. Recurrent epithelial ovarian carcinoma: a randomized phase III study of pegylated liposomal doxorubicin versus topotecan. J Clin Oncol 2001; 19: 3312–3322.
- [44] Gordon AN, Tonda M, Sun S, Doxil Study 30-49 Investigators. Long-term survival advantage for women treated with pegylated liposomal doxorubicin compared with topotecan in a phase 3 randomized study of recurrent and refractory epi-thelial ovarian cancer. Gynecol Oncol 2004; 95: 7–8.
- [45] Ferrero JM, Weber B, Geay JF, et al. Second-
- [46] Pujade-Lauraine E, Wagner U, Aavall-Lundqvist E, et al. Pegylated Liposomal Doxorubicin and Carboplatin Compared With Paclitaxel and
- [47] Monk BJ, Herzog TJ, Kaye SB, et al. Trabectedin Plus Pegylated Liposomal Doxorubicin in Recurrent Ovarian Cancer. J Clin Oncol 2010; 28: 3107–3114.
- [48] Aghajanian C, Finkler NJ, Rutherford T, et al. OCEANS: A randomized, double-blinded, pla-cebo-controlled phase III trial of chemothera-
- [49] Souhrn údajů o přípravku Avastin 25mg, dostupné na: http://www.medicines.org.uk/EMC/medicine/15748/SPC/Avastin, citováno 26. 2. 2012.
- [50] Scharovsky OG, Mainetti LE, Rozados VR. Metronomic chemotherapy changing the paradigm