Léčebné přípravky v ambulanci pro léčbu neplodnosti
Článek přináší přehled současných léčiv nejčastěji používaných v léčbě neplodnosti. Jedná se o léčiva určená jednak k indukci ovulace s následným pokusem o početí přirozenou cestou či s využitím intrauterinní inseminace (IUI), jednak k hyperstimulaci ovarií v rámci programu fertilizace in vitro (IVF, in vitro fertilization). Snahou je objasnit především mechanismus ovlivnění zpětnovazebného systému hypotalamo-hypofyzo-ovariální osy jednotlivými preparáty a z toho plynoucí možnosti jejich využití v konkrétních situacích.
Úvod
V dnešní době stále přibývá lidí, kteří mají problémy s početím přirozenou cestou. Udává se, že se jedná přibližně o čtvrtinu párů v reprodukčním věku, a tyto páry ve většině případů dříve či později vyhledají odbornou pomoc v některé z ambulancí pro léčbu neplodnosti. Příčina je přibližně ve 40 % na straně muže, v 50 % na straně ženy a v 10 % případů příčinu nezjistíme. Ve 20 % případů je porucha na obou stranách. Dříve byla většina těchto párů odsouzena k trvalé bezdětnosti či nucena řešit svoji touhu po rodině adopcí, ale současná lékařská věda dokáže pomoci těmto lidem až v 90 % případů [1].
Aby bylo možné mluvit o jednotlivých skupinách látek a jejich působení na ženský reprodukční systém, je nejprve třeba alespoň krátce se dotknout problematiky hormonální regulace menstruačního cyklu a ovulace, řízené systémem pozitivních a negativních zpětných vazeb.
Řízení menstruačního cyklu
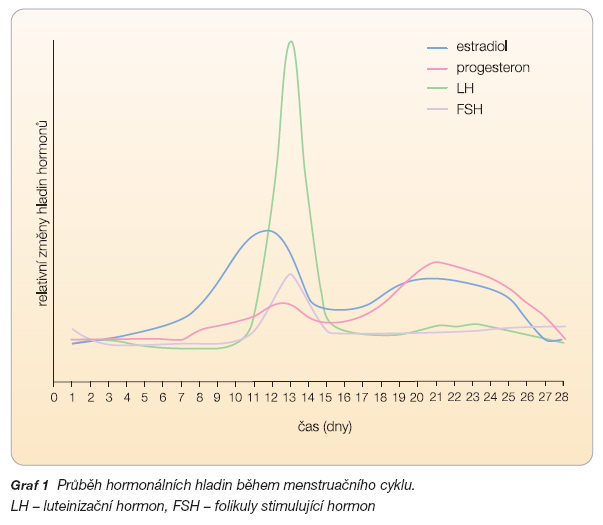
Zjednodušeně můžeme říci, že řízení menstruačního cyklu v organismu ženy se účastní hypotalamus, hypofýza a ovaria. Z hypotalamických jader dochází v dospělosti k pulzatilnímu uvolňování hormonu nazývaného gonadotropin releasing hormon (GnRH), který je transportován do předního laloku hypofýzy. Zde se váže na receptory buněk zvaných gonadotropy, ze kterých stimuluje uvolňování gonadotropinů, tj. folikulostimulačního hormonu (FSH) a luteinizačního hormonu (LH). Společné působení FSH a LH na kohortu folikulů v ovariu způsobuje růst folikulů a dozrávání oocytů.
V tento moment se začne uplatňovat regulace zpětnou vazbou. Rostoucí folikuly produkují estradiol, který tlumí sekreci FSH a LH. Z vybrané kohorty folikulů tak postupně pokračuje v růstu jen jeden, tzv. dominantní folikul, který nese nejvíce receptorů pro FSH a je schopen tak reagovat i na nižší hladiny FSH. Ostatní folikuly podléhají postupně atrézii (zániku).
Přesáhne-li hladina estradiolu v krvi určitou hranici, mění se negativní zpětná vazba na pozitivní a dochází k vyplavení velkého množství LH z hypofýzy. Po tomto náhlém vzestupu LH (tzv. peak) dochází během 36 hodin k dozrání oocytu, k jeho uvolnění z folikulu a k přeměně folikulu ve žluté tělísko (luteinizace). Žluté tělísko produkuje především progesteron, jehož hodnoty ve druhé fázi cyklu stoupají a jsou nezbytné pro prosperitu eventuálně vzniklého těhotenství. Nedojde-li k početí, žluté tělísko podléhá atrézii, hladiny hormonů v krvi klesají, a v důsledku toho dochází k odlučování děložní sliznice. Žena začíná menstruovat a celý cyklus se opakuje (graf 1) [2, 3].
Skupiny léčiv používaných v asistované reprodukci
Všimněme si jednotlivých skupin léčiv používaných v léčbě neplodnosti se zaměřením na jejich využití v metodách asistované reprodukce a na způsob, jakým ovlivňují zpětnovazebný mechanismus hypotalamohypofyzo-ovariální osy.
Antiestrogeny
Nejčastěji používaným léčivem ze skupiny antiestrogenů je klomifen citrát. V přesném slova smyslu jde vlastně o slabého agonistu estradiolu. Jedná se o nesteroidní látku (2-/4-(2 chloro-1,2-diphenylethynyl) phenoxy/ethanamin), která se váže na estrogenové receptory v hypotalamu a hypofýze a svou vazbou vytěsňuje z těchto receptorů daleko silněji působící estradiol. Narušuje tak negativní zpětnou vazbu způsobenou estradiolem, není inhibováno vylučování gonadotropinů, a tím dochází ke zvýšení jejich hladiny v krvi. Vyšší hladina FSH způsobuje vyšší stimulaci růstu folikulů. Je pochopitelné, že tento mechanismus je účinný pouze u žen, které nemají zpětnovazebný systém již primárně narušený. Dalším předpokladem dobrého efektu je normální hladina estradiolu. U primárně hypoestrinních pacientek bude efekt terapie minimální. Klomifen se podává pacientkám obvykle v dávce 50 mg 1krát denně 3.–7. den menstruačního cyklu, při nízkém efektu je možné dávku zvyšovat. Výsledkem bývá růst 1–2 folikulů.
Nevýhodou léčby klomifenem může být nedostatečná stimulace růstu děložní sliznice (právě v důsledku inhibice působení estradiolu v tomto místě) a tedy zhoršení podmínek pro nidaci vajíčka. Dále se hovoří o horší kvalitě oocytů v důsledku předčasné luteinizace – následkem narušení negativní zpětné vazby dochází kromě žádoucího zvýšení hladiny FSH rovněž k nežádoucímu zvýšení hladiny LH. K nežádoucím účinkům klomifenu může dále patřit soubor příznaků jako u perimenopauzálních žen související s jeho antiestrogenním působením [2–4].
Gonadotropiny
V lidském organismu se v předním laloku hypofýzy uvolňují dva přirozené gonadotropiny – folikulostimulační hormon (FSH) a luteinizační hormon (LH). Třetím gonadotropním hormonem je lidský choriový gonadotropin (hCG), který se tvoří v choriových buňkách placenty. Všechny gonadotropní hormony jsou glykoproteiny skládající se ze dvou podjednotek, přičemž podjednotka a je všem společná a jednotlivé látky se od sebe liší podjednotkou b.
První gonadotropiny byly izolovány z moče menopauzálních žen. Látky obsahovaly stejný poměr FSH a LH. Vývoj postupně ukazoval, že přítomnost LH při stimulaci není žádoucí, může způsobovat předčasnou luteinizaci folikulů a tím zhoršení kvality odebraných oocytů. Proto se postupně začaly vyrábět preparáty více purifikované s minimalizací obsahu LH; s rozvojem rekombinantních metod se postupně začaly využívat přípravky obsahující pouze FSH.
Nejnovější studie ovšem ukazují, že i když příliš vysoké hladiny LH kvalitu oocytů zhoršují, určitá bazální hladina LH je zřejmě nutná ke správnému růstu a maturaci folikulu [5]. FSH i LH totiž na zrajícím folikulu působí prostřednictvím svých receptorů synergicky.
Gonadotropní stimulaci folikulů lze využít ke stimulaci jak v případě plánovaných méně invazivních metod (např. indukce ovulace před intrauterinní inseminací (IUI), tak v případě potřeby hyperstimulace ovarií v rámci programu fertilizace in vitro (IVF), kdy je cílem stimulace zisk většího množství oocytů (v ideálním případě kolem deseti z jednoho ovaria). Využití gonadotropinů je rozhodně častější ve druhém případě, jedná se o léčbu náročnou jak z hlediska ekonomického, tak po stránce zátěže pro pacientku (nutnost parenterální aplikace) a vzhledem k výrazně vyšší procentuální úspěšnosti metod IVF je stimulace FSH „pouze" k provedení IUI sporná. Aplikovat FSH je vždy nutno v dostatečně vysokých dávkách, aby byla překročena jeho prahová koncentrace pro co možná nejvyšší možný počet folikulů. Naopak nedostatečné dávky gonadotropinu zůstávají bez odezvy. Obvykle se stimulace zahajuje dávkami kolem 225–300 IU FSH denně.
Poslední z klinicky používaných gonadotropinů je hCG, který indukuje vlastní ovulaci po dozrání oocytů. Po jeho aplikaci dochází přibližně za 36 hodin k ovulaci. K indukci ovulace v případě dozrávání 1–2 folikulů při pokusu o početí přirozenou cestou či o IUI se aplikuje většinou 5000 j., při aplikaci před odběrem oocytů pro IVF potom 10 000 j. parenterálně [2–4].
Agonisté a antagonisté gonadotropin releasing hormonů
Gonadotropin releasing hormon (GnRH) je dekapeptid uvolňovaný v hypotalamu, který při pulzatilním vzorci uvolňování stimuluje sekreci FSH a LH z předního laloku hypofýzy. Vývoj látek schopných ovlivňovat GnRH receptory v hypofýze ať agonisticky či antagonisticky dává do rukou nástroj umožňující zcela kontrolovat hormonální situaci během stimulovaného cyklu.
Agonisté GnRH
Bylo syntetizováno několik látek chovajících se na GnRH receptorech jako agonisté. Jedná se buď o nonapeptidy (leuprorelin, buserelin, goserelin, histerelin) nebo o dekapeptidy (nafarelin, triptorelin). V protokolech léčby sterility se využívá jejich aplikace na začátku stimulovaného cyklu, kdy dojde nejprve k masivnímu vyplavení FSH a LH z hypofýzy (tzv. flare-up fenomén) a následně naopak k úplnému útlumu sekrece gonadotropinů (down-regulace). S aplikací gonadotropinů se obvykle začíná až po bezpečném utlumení vlastní hypofyzární sekrece. U malého procenta pacientek bychom ovšem mohli neúspěch přičítat právě přílišné supresi hypofýzy, kdy hladiny LH se budou pohybovat právě pod výše zmíněnou bazální hladinou potřebnou ke správnému růstu folikulů a maturaci oocytu [5].
Výjimečně je možné využít i flare-up fenomén, kdy stimulaci gonadotropiny zahájíme ihned po aplikaci GnRH agonisty (tzv. ultrakrátký stimulační protokol). Tento protokol je využíván v případě, kdy se předpokládá u pacientky nutnost aplikace velmi vysokých dávek FSH k překonání prahových koncentrací pro růst folikulů, jak tomu může být například v případě hrozícího předčasného ovariálního selhání. Využije se takto i uvolněný FSH z hypofýzy, a sníží se tak celková spotřeba léčiv. Nevýhoda tohoto protokolu je nasnadě – současně s vyplavením FSH dochází i k vyplavení LH, což může vést k předčasné luteinizaci folikulů a k horší kvalitě získaných oocytů. Proto se tento protokol využívá jen velice zřídka.
Pokud byla srovnána účinnost v ovlivnění parametrů oplodnění ženy mezi antagonisty a agonisty GnRH, byla u těchto tzv. low-responder pacientek pozorována tendence k vyšší účinnosti při léčbě dle protokolu s následující skupinou léčiv – antagonisty GnRH [6].
Antagonisté GnRH
Jedná se rovněž o látky s peptidovou strukturou, které se ovšem od přirozených GnRH liší nikoli jen na pozici 6 a 10 jako agonisté GnRH, ale i na dalších pozicích – 1, 2, 3 a 8. Látky využitelné v medicíně byly vyvinuty až o 20 let později než agonisté. Dnes asi nejpoužívanější látkou je ganirelix. Další registrované přípravky obsahují účinné látky cetrorelix nebo abarelix. Podáním antagonistů GnRH dochází k rychlému poklesu hladin FSH a LH v krvi. Účelem jejich aplikace v cyklech IVF je zabránit předčasnému peaku LH indukovanému estradiolem uvolňovaným z rostoucích četných folikulů, a předejít tak předčasné ovulaci a luteinizaci jednotlivých folikulů, které se nacházejí v různých stupních svého vývoje. Odpadá flare-up efekt na začátku cyklu, ale na druhé straně antagonisté neumožňují tak dobrou kontrolu hormonální situace od začátku stimulovaného cyklu [2–4].
Dehydroepiandrosteron
Dehydroepiandrosteron (DHEA) je steroidní látka, hlavní androgen secernovaný kůrou nadledvin. Dále je v lidském organismu syntetizován ještě v centrálním nervovém systému a v thekálních buňkách v ovariu. V periferní tkáni je následně konvertován na účinnější androgeny a estrogen (slouží tedy jako prohormon) a dále ve fyziologických hladinách zvyšuje sérovou hladinu insuline-like growth faktoru. Nově se ukazuje možnost jeho využití v asistované reprodukci, a to u žen trpících syndromem předčasného ovariálního selhání. U těchto žen, kdy ani vysokými dávkami gonadotropinu již nejsme schopni vyvolat maturaci oocytů, totiž exogenní přívod vyšších dávek DHEA způsobuje, že dochází ke zvýšené meiotické aktivitě oocytů a ke snížení jejich atrézie [7].
Ostatní látky využívané v léčbě neplodnosti
Výše zmíněné přípravky jsou látky, které slouží jednomu cíli – dosáhnout dozrávání oocytu v ovariu a následně jeho oplodnění, a to buď přirozenou cestou či metodami umělého oplodnění. V ambulanci pro léčbu neplodných párů jsou využívány i další léčivé látky, ale zde se jedná již o cílenou léčbu konkrétních onemocnění, která mohou souviset s neplodností. Jejich podrobný výčet a popis je obsahem mnohých publikací a monografií a přesahoval by rámec tohoto sdělení. Následuje proto pouze orientační shrnutí těch nejběžnějších.
a) Hyperprolaktinémie – zvýšené hladiny prolaktinu přímo interferují s ovulací, medikamentózní léčba spočívá v aplikaci dopaminergních agonistů – dopamin je přirozený antagonista prolaktinu.
b) Poruchy štítné žlázy – dysbalance hormonů štítné žlázy může negativně ovlivňovat plodnost – situace je obvykle řešena ve spolupráci s endokrinologem.
c) Hyperandrogenní syndrom (HAS) – jedná se o komplexní metabolickou poruchu charakterizovanou zvýšenou hladinou androgenů v krvi a oligomenoreou, případně dalšími metabolickými odchylkami. Ženy s HAS obvykle neovulují; pokud je cílem léčby pouze dosažení ovulace či hyperstimulace ovarií v programu IVF, potom se léčba neliší od postupu u „zdravých pacientek". Zajímavé jsou studie zajištění stimulace perorálním antidiabetikem metforminem, jež prokazují výrazné snížení rizika hyperstimulačního syndromu [8] a snížení rizika samovolného potratu u těchto pacientek.
Závěr
V nejbližší době zřejmě nedojde k nějaké převratné změně týkající se látek ovlivňujících ovulaci, spíše se objeví na trhu postupně další léčivé látky z již známých skupin léčiv, více či méně účinné. Zdokonalování terapie se v blízké budoucnosti bude týkat spíše terapie podpůrné při vlastní stimulaci v konkrétních případech.
Seznam použité literatury
- [1] Řežábek K. Endokrinologické příčiny sterility. In: Cibula D, Henzl MR, Živný J.: Základy gynekologické endokrinologie. Praha, Grada Publishing 2002: 277–306.
- [2] Cibula D. Řízení menstruačního cyklu. In: Cibula D., Henzl M. R., Živný J.: Základy gynekologické endokrinologie. Praha, Grada Publishing 2002: 65–89.
- [3] Vande Wiele RL, Bogumil J, Dyrenfurth I. Mechanisms regulating the menstrual cycle in women. Recent Prog Horm Res 1970; 26: 63–103.
- [4] Ventruba P. Stimulace ovulace. In: Hormonální terapie v gynekologii a porodnictví. Moderní gynekologie a porodnictví 2000; 3: 485–498.
- [5] Toporcerová S, Hredzák R, Ostró A, et al. Vplyv sérových hladín luteinizačného hormónu počas kontrolovanej ovariálnej hyperstimulácie na výsledky cyklu IVF. Česká gynekologie 2005; 4: 247–253.
- [6] Fasouliotis JS, Laufer N, Sabbagh-Ehrlich S, et al. Gonadotropin-Releasing Hormone (GnRH)-Antagonist Versus GnRH-Agonist in Ovarian Stimulation of Poor Responders Undergoing IVF. Journal of Assisted Reproduction and Genetics 2003; 11: 455–460.
- [7] Barad DH, Gleicher N. Increased oocyte production after treatment with dehydroepiandrosteron. Fertility and sterility 2005; 3: 756 (e1–e3).
- [8] Višňová H, Ventruba P, Crha I, Žáková J. Význam senzitizace inzulinových receptorů pro prevenci ovariálního hyperstimulačního syndromu. Česká gynekologie 2003; 3: 155–162.