Lékové interakce statinů, jejich klinická závažnost a management
Statiny patří k hojně užívaným lékům, o jejichž terapeutickém přínosu máme dostatek kvalitních důkazů. Lékové interakce mohou zásadním způsobem změnit terapeutickou hodnotu interagujících léčiv. Některé lékové interakce statinů mohou být velmi závažné a máme i doklady o tom, že mohou vést k těžkým stavům až k úmrtí pacientů. I když se takto závažné stavy vyskytují zřídka, musíme je mít na paměti a snažit se jim předcházet. V následujícím článku budou rozebrány nejčastější a nejzávažnější lékové interakce statinů a bude nastíněn i jejich management v klinické praxi.
Úvod
Lékové interakce jsou při dnešním přístupu k farmakoterapii všudypřítomné. Jejich opomíjení však může vyústit až v reálné poškození zdraví pacienta. Kolik pacientů je lékovými interakcemi postiženo, je v praxi velmi obtížné stanovit. V praxi je citována řada definic lékových interakcí. Jedna z těch obecnějších považuje za lékovou interakci takové podávání dvou nebo více léčiv, při kterém dojde ke změně účinku některého z nich. Stejně jako naše pracoviště pokládají mnohá další výsledek lékové interakce za nežádoucí účinek léku. Důsledky interakcí pak mohou být žádoucí i nežádoucí. Lékové interakce mohou vznikat i při kombinaci s potravou nebo doplňky stravy [1, 2].
Podle převažujících interakčních mechanismů se interakce rozdělují na farmakodynamické (k interakci dochází na cílovém recepčním místě v biologickém systému nebo se jinak ovlivňují farmakodynamické účinky léčiv), farmakokinetické (reakce mezi léčivy se uskutečňuje v biologickém systému při jejich cestě k cílovému místu účinku a při případné eliminaci) a farmaceutické. Právě poslední skupina, pro kterou se vžil termín „inkompatibility“ a je některými autory označována jako „nepravá“ interakce, spočívá ve vzájemné interakci mezi jednotlivými léčivými látkami např. v rámci jedné lékové formy (infuze). Neprávem je ale v praxi někdy podceňována.
Hypolipidemika, obzvláště statiny, jsou v současnosti jednou z nejpoužívanějších skupin léčiv, které prokazatelně snižují mortalitu a morbiditu pacientů. Spotřeba léčiv ovlivňujících hladinu krevních lipidů byla v roce 2010 v České republice téměř 334 milionů doporučených denních dávek (DDD), což je 87 DDD/1000 obyvatel/den [3, 4].
Statiny
Statiny jsou nejčastěji indikovanou skupinou hypolipidemik. Jejich přínos v léčbě a prevenci kardiovaskulárních onemocnění je dobře dokumentován množstvím velkých klinických studií. V České republice bylo v roce 2010 expedováno 268 milionů DDD statinů, což je 70 DDD/1000 obyvatel/ den (uvažováno bez kombinace simvastatin + ezetimib a atorvastatin + amlodipin) [4]. Statiny farmakologicky působí inhibici enzymu 3-hydroxy-3-methylglutaryl-koenzym A (HMG-CoA) reduktázy, která katalyzuje klíčový krok v syntéze cholesterolu. Farmakodynamické interakce této skupiny léčiv jsou méně pravděpodobné. Příčin je několik. Předně HMG-CoA reduktáza je vysoce selektivní enzym, dále dosud nejsou známy žádné jiné receptory pro tento enzym a nakonec statiny inhibují tento enzym velmi selektivně. [5]. Valná většina interakcí statinů je interakcemi farmakokinetickými. Protože statiny náleží mezi substráty izoenzymů cytochromu P450, dochází u nich k lékovým interakcím zejména na úrovni metabolismu.
Interakce statinů s léky ovlivňujícími jejich metabolismus
Lékové interakce statinů s léky ovlivňujícími jejich metabolismus mohou být klinicky velmi závažné. Zodpovědné mohou být až za téměř 60 % případů rhabdomyolýz při užívání statinů [6]. Léky, jež mohou interagovat se statiny na úrovni metabolismu, jsou buď inhibitory anebo induktory enzymů CYP450. Statiny jsou metabolizovány převážně dvěma různými izoformami P450 – CYP3A4 a CYP2C9. Lovastatin, simvastatin a atorvastatin jsou metabolizovány izoformou 3A4, která metabolizuje více než 50 % všech léčiv [7], přičemž lovastatin a simvastatin jsou velmi závislé na tomto cytochromu. Atorvastatin je metabolizován tímto cytochromem pouze z 20 %. Fluvastatin je metabolizován izoenzymem 2C9; pravastatin, rosuvastatin a pitavastatin jsou vylučovány především v nezměněné formě stolicí a močí. Pravastatin je též částečně rozkládán v žaludku a metabolizován non-CYP enzymy; 10 % rosuvastatinu je pak metabolizováno CYP2C9 [8]. Na farmakokinetických interakcích statinů se mohou podílet ještě interakce na úrovni glukuronidace a membránových transportérů (OATP1B1, OATP2B1 – organic anion transporting polypeptide; MDR1 – multidrug resistance protein 1, P-glyco-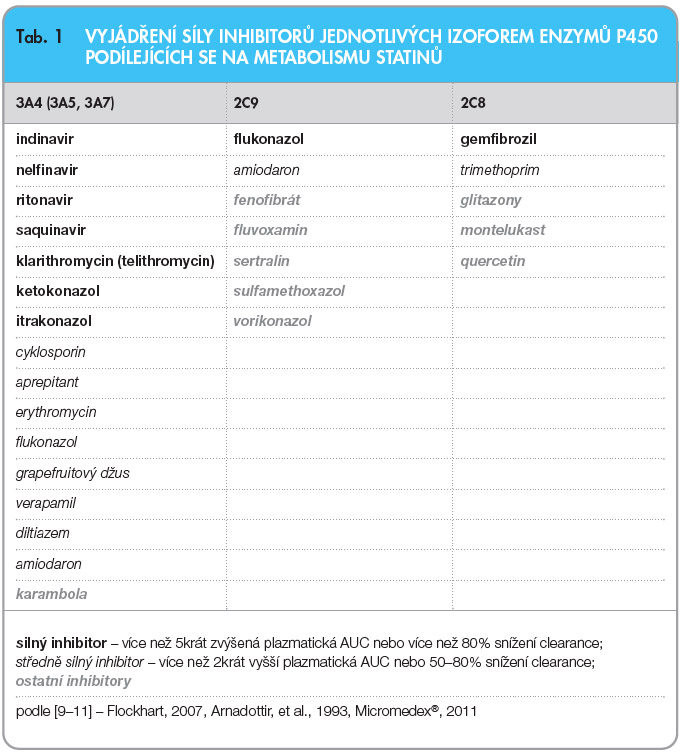 protein; MRP2 – multidrug resistance associated protein 2).
protein; MRP2 – multidrug resistance associated protein 2).
Inhibitory jednotlivých izoforem P450 mohou zvyšovat koncentrace těch statinů, které jsou substráty dané izoformy. Výsledkem těchto interakcí může být až několikanásobné (až 30krát) zvýšení plochy pod křivkou (area under curve, AUC) statinů [8]. Toto zvýšení koncentrace může vést k častějšímu výskytu nežádoucích účinků statinů, z nichž nejzávažnější je jejich svalová toxicita zahrnující myopatie a rhabdomyolýzu. Klinická závažnost dané interakce je pak závislá na síle jednotlivých inhibitorů, na tom, jak kvantitativně jsou jednotlivé statiny danou izoformou metabolizovány, na dávce užívaného statinu a na věku i fyzickém stavu pacienta. Porovnání síly jednotlivých inhibitorů naznačuje tab. 1.
Klinicky nejzávažnější interakce vykazují zejména statiny, které jsou metabolizovány přes CYP3A4. Tedy simvastatin a lovastatin, v menší míře pak i atorvastatin. Klinicky méně závažné interakce pozorujeme u fluvastatinu, pravastatinu, rosuvastatinu a pitavastatinu.
Management lékových interakcí
Lékové interakce jsou dnes spolu s ostatními riziky farmakoterapie řazeny mezi tzv. lékové problémy („drug related problems“ – DRPs) [12]. I když se může řešení lékových interakcí v klinické praxi jevit jako poměrně jednoduché, ve skutečnosti tomu tak jistě není. Situaci v případě lékových interakcí značně komplikuje fakt, že stále nemáme dostatek relevantních informací o samotné existenci, mechanismu nebo klinickém významu mnoha z nich. Zejména ambulantně poskytovaná péče se i nadále potýká s nedostatečnou komunikací mezi zdravotníky a pacienty a neúplným sdílením informací mezi samotnými zdravotníky. Pacienti stále více preferují samoléčbu, nebo dokonce bez dohledu odborníka vyhledávají rozmanité doplňky stravy a fytofarmaka. To vše výrazně ztěžuje řešení nejen lékových interakcí. Nevhodné kombinace léčiv jsme sice schopni např. pomocí softwarových nástrojů DRPs poměrně dobře identifikovat už při jejich preskripci, popř. při dispenzaci v lékárně, předpokladem je však přehled o pacientově užívané terapii. V ostatních případech nezbývá než buď spoléhat na náhodný screening, nebo případné rizikové kombinace předvídat. Obezřetnost je na místě zejména u léčiv s velkým interakčním potenciálem či úzkým terapeutickým rozmezím – u léčiv s život ohrožujícími důsledky v případě změn jejich účinku (vystupňovaný efekt nebo riziko neúčinku). Je nezbytné aktivně vyhledávat velmi závažné nebo kontraindikované kombinace. Pozornost dále vyžadují kombinace ovlivňující zejména vnitřní prostředí v organismu, krevní oběh a stav vědomí nebo vykazující vysoké riziko orgánové toxicity. Statiny jako předmět tohoto sdělení splňují mnohá z výše uvedených kritérií. V tuto chvíli nebudeme zabíhat do detailů, ale všichni víme, jak závažnou chybou by mohlo být už podcenění stravovacích návyků pacienta.
Teoretický podklad interakcí, tzn. dobrá znalost mechanismů a možných rizik, je však nedostačující a bohužel pouze naznačuje možný dopad do klinické praxe. Každou kombinaci léčiv musí odpovědný zdravotník posuzovat v kontextu pacienta. Tzn. např. zohlednit dávku, délku podávání a způsob aplikace konkrétního léčivého přípravku, místo setkání obou léků v těle pacienta, dále i genotyp pacienta nebo jeho vnímavost, resp. compliance. Na paměti je třeba mít záměr, pro který jsou daná léčiva pacientovi podávána, a konečně zodpovědně zvážit poměr rizika a přínosu léčby danou kombinací [13, 14].
Potřeba zvýšit efektivitu v boji s riziky farmakoterapie vedla současně k tvorbě mnoha pomocných algoritmů (SOAP, DADER apod.), které mají pomáhat zdravotníkovi identifikovat, analyzovat a řešit DRPs [12]. Za účelem řešení lékových interakcí byl na našem pracovišti vytvořen a publikován algoritmus SAZE (signál, analýza signálu, změření rizika, eliminace rizika). Primárně je určen pro lékárníky, ale autoři se domnívají, že může být dobrým pomocníkem všem, kteří chtějí minimalizovat klinickou manifestaci potenciálních lékových interakcí. Jako optimální se jeví i využití renomovaných biomedicínských databází orientovaných na lékové interakce, které mohou být vhodným zdrojem relevantních informací užitečných při rozhodování zdravotníka.
Při posuzování rizika u konkrétního pacienta jsme nezřídka postaveni před situaci, kdy pacient obě léčiva potřebuje, protože z nich bude mít značný prospěch. Za relativně bezpečné, resp. tolerované, jsou považovány i poměrně závažné interakce, které však můžeme spolehlivým způsobem kontrolovat nebo monitorovat. Sledování nežádoucích účinků, jež může kombinace vyvolat, však nemusí být dostačující. Spolehlivější je monitorování biochemických, fyzikálních nebo jiných parametrů odrážejících např. stav srdeční činnosti, poměry ve vnitřním prostředí nebo míru srážlivosti krve. Někdy si však vystačíme s naprosto jednoduchým opatřením, které vychází z dobré znalosti farmakokinetiky a spočívá v dostatečném časovém odstupu mezi podáváním rizikových léčiv nebo potravy, a tak zamezíme jejich přímému kontaktu v lidském těle [13, 14].
Interakce statinů s jednotlivými léky a doplňky stravy a jejich management
Statiny a makrolidová antibiotika
V klinické praxi se jedná pravděpodobně o nejčastější interakce statinů. Nejzávažnější interakce mají dle výše uvedeného simvastatin a lovastatin s klarithromycinem, erythromycinem, popřípadě s u nás málo používaným telithromycinem. Menší je klinická závažnost interakce s josamycinem a roxithromycinem, které jsou středně silnými inhibitory CYP3A4 [1]. V menší míře než simvastatin a lovastatin interaguje s danými antibiotiky i atorvastatin. Interakce s azithromycinem je klinicky nezávažná, protože azithromycin není fakticky inhibitorem CYP3A4. Lékař, jenž předepisuje pacientovi makrolidové antibiotikum, by měl aktivně pátrat po tom, zda pacient neužívá statin. Zcela jistě by se měl vyhnout kombinaci simvastatin, resp. lovastatin a klarithromycin. Pokud pacient užívá simvastatin či lovastatin, měl by lékař zvážit předepsání jiného makrolidu než klarithromycinu (azithromycin), popř. dle citlivosti k patogenu indikovat zcela odlišné antibiotikum. Zvážit lze i výměnu statinu. U kardiovaskulárně stabilizovaných pacientů je volbou i přerušení léčby simvastatinem (lovastatinem) po dobu užívání klarithromycinu. V každém případě by měl být pacient, který užívá statin s makrolidovým antibiotikem, poučen o možném riziku myopatie a měl by znát symptomy, kterými se může tento nežádoucí účinek projevit (bolesti svalů, slabost, popřípadě zabarvení moči). Kombinace atorvastatinu s klarithromycinem (erythromycinem) není kontraindikována. Přesto je doporučena zvýšená opatrnost, obzvláště pokud pacient užívá denní dávky atorvastatinu překračující 20 mg. Mezi makrolidy a fluvastatinem, rosuvastatinem a pravastatinem se lékové interakce neočekávají. Přesto by pacienti užívající tyto kombinace měli být poučeni a měly by se u nich sledovat symptomy myopatie [1].
Obdobně by měli postupovat i lékárníci při výdeji léčiv v lékárně. Pacienta, kterému vydávají makrolidové antibiotikum, a obzvláště klarithromycin, by se měli aktivně ptát, zda neužívá některý ze statinů. Kombinace klarithromycin – simvastatin (lovastatin) by neměla být v lékárně vydána. Měl by být kontaktován lékař s návrhem na změnu antibiotika, popř. statinu, či s návrhem neužívat simvastatin po dobu užívání klarithromycinu. V případě, že je lékař nedostupný, musí být pacientovi doporučeno, pokud netrpí některou z akutních forem kardiovaskulárního onemocnění, aby neužíval simvastatin po dobu užívání klarithromycinu. O této skutečnosti by měl být lékař co nejdříve informován lékárníkem nebo pacientem. Při užívání jiných statinů v kombinaci s klarithromycinem by měl být pacient poučen nejen o symptomech myalgie, ale také o tom, co dělat, jestliže se u něho tyto symptomy objeví. Na toto by měli být upozorněni všichni pacienti užívající statin a makrolidové antibiotikum.
Statiny a kalciové blokátory
Kalciové blokátory, nejvíce diltiazem a verapamil, jsou inhibitory CYP3A4. Inhibují také P-glykoprotein, čímž mohou zvyšovat dostupnost statinů [15]. Uvádí se, že mohou zvyšovat AUC simvastatinu a lovastatinu 3–8krát [8, 16, 17]. Amlodipin a další dihydropyridiny též inhibují CYP3A4, ale tyto interakce jsou méně závažné [1, 18]. Pokud je nutné společně podávat simvastatin a diltiazem nebo verapamil, neměly by, dle SPC originálního přípravku, dávky simvastatinu překročit 20 mg při kombinaci s verapamilem a 40 mg při kombinaci s diltiazemem [19]. Dle SPC téhož přípravku platného v USA by dávka simvastatinu při společném užívání s verapamilem a diltiazemem neměla překročit 10 mg a pacient by měl být poučen a sledován pro možnost myopatie. Pokud pacient užívá vysoké dávky simvastatinu a je potřebná léčba diltiazemem či verapamilem, je vhodné převést pacienta na léčbu jiným statinem (fluvastatin, rosuvastatin, atorvastatin). I když SPC v České republice neuvádějí interakci mezi amlodipinem a simvastatinem, zahraniční zdroje doporučují při nutnosti podávat simvastatin v dávce přesahující 20 mg s amlodipinem raději zaměnit simvastatin za jiný statin s menším interakčním potenciálem [11]. Obdobně je tomu u lovastatinu, kde by dávky do kombinace s verapamilem a diltiazemem neměly překročit 40 mg [11], popřípadě by měla být zvážena záměna statinu. Při kombinaci atorvastatinu s diltiazemem je doporučeno u pacienta důsledně monitorovat příznaky rhabdomyolýzy.
Statiny a inhibitory HIV proteázy
Lidé s HIV infekcí mohou mít zvýšené riziko rozvoje kardiovaskulárních onemocnění, protože již samotné onemocnění je doprovázeno chronickým zánětlivým stavem, který přispívá k rozvoji aterosklerózy; a tito pacienti se také díky účinnější farmakoterapii dožívají vyššího věku, v němž se mohou kardiovaskulární onemocnění častěji manifestovat. Opomenout však nelze ani fakt, že se může jednat o nežádoucí účinky antiretrovirové terapie [20]. Inhibitory HIV proteáz (v České republice dostupné – sachinavir, indinavir, ritonavir, nelfinavir, lopinavir, fosamprenavir, atazanavir, darunavir [21]) jsou silnými inhibitory CYP3A4. Bylo například prokázáno až 30násobné zvýšení AUC simvastatinu při užívání ritonaviru potencovaného saquinavirem [22]. Simvastatin a lovastatin jsou proto kontraindikovány při užívání inhibitorů proteáz. V případě atorvastatinu se jedná o relativní kontraindikaci [23]. Lze jej podat jen v malých dávkách (do 10 mg), předpokladem je však pečlivý monitoring a náležité poučení pacienta [1]. Fluvastatin a pravastatin (mimo kombinace s darunavirem, kdy nevyjasněným mechanismem dochází až k pětinásobnému zvýšení hladiny pravastatinu) mohou být užívány beze změn v dávkování, nicméně potřeba monitorovat a informovat pacienty platí i pro tyto kombinace [1, 20]. Dvě farmakokinetické studie rosuvastatinu ukazují, že ritonavir potencovaný lopinavirem zvyšuje jeho hladinu obdobně, jako je tomu u atorvastatinu [20, 24, 25]. U rosuvastatinu doporučuje European AIDS Clinical Society zahájit terapii nízkými dávkami a pacienta sledovat [23]. Američtí výrobci doporučují užívat v kombinaci s inhibitory proteáz maximálně 10 mg rosuvastatinu. Britští výrobci pak společné užívání nedoporučují [1]. Recentní data ukazují, že kombinace atazanavir/ritonavir, ale ne kombinace fosamprenavir/ritonavir, zvyšuje plazmatickou koncentraci rosuvastatinu – pravděpodobně zvýšením biologické dostupnosti. Kombinace rosuvastatinu a inhibitorů proteáz by měly být užívány s opatrností, dokud nebudou k dispozici aktuální data z rozsáhlejších studií [26].
Statiny a azolová antimykotika
Azoly (ketokonazol, itrakonazol, flukonazol) patří k potentním inhibitorům CYP3A4. Při současném užívání simvastatinu a lovastatinu společně s ketokonazolem či itrakonazolem se zvyšuje jejich hladina několikanásobně (až 20krát). Proto je vhodnější se společného užívání vyvarovat. Pokud pacient potřebuje užívat ketokonazol či itrakonazol, je doporučeno přerušit po tuto dobu užívání simvastatinu či lovastatinu. Obdobně by se mělo postupovat v případě posakonazolu (informace výrobců) [1]. Při současném podávání atorvastatinu s itrakonazolem byla zaznamenána 3krát vyšší AUC atorvastatinu. Z tohoto důvodu by bylo lepší po dobu užívání itrakonazolu či ketokonazolu přerušit podávání atorvastatinu, i když někteří výrobci jeho užívání do dávek 40 mg připouštějí [1]. Naproti tomu hladiny fluvastatinu, pravastatinu a rosuvastatinu nejsou při současném podávání itrakonazolu ovlivněny, popř. jen velmi málo (do 1,5násobku) [8], a proto nejsou nutné žádné klinické intervence. Obdobně by se postupovalo u flukonazolu, který je slabším inhibitorem CYP3A4. V tab. 1 je flukonazol uveden jako silný inhibitor CYP2C9. Fluvastatin je převážně meta-bolizován přes tento cytochrom. Léková interakce flukonazol – fluvastatin je hodnocena některými databázemi jako interakce málo klinicky závažná, přesto je u pacientů užívajících 80 mg fluvastatinu denně nutná zvýšená opatrnost [27]. Při podávání vorikonazolu je doporučeno snížit dávky simvastatinu, lovastatinu a atorvastatinu za souběžného monitoringu pacientů [1].
Statiny a cyklosporin
Riziko dyslipidemie a kardiovaskulárních onemocnění je vysoké u pacientů po transplantacích (nežádoucí účinky imunosupresivní léčby). Statiny jsou účinné léky pro léčbu u těchto pacientů. Mezi cyklosporinem a statiny však může dojít k interakcím, které mohou mít za následek zvýšení hladiny statinů až rozvoj rhabdomyolýzy, ale může též dojít ke snížení účinku cyklosporinu. K těmto interakcím pravděpodobně dochází prostřednictvím několika mechanismů – inhibicí CYP3A4 (intestinální i hepatální), P-glykoproteinu, membránových transportérů (OATP1B1, OATP2B1, MRP2) [8, 26, 28].
Cyklosporin zvyšuje až 7krát AUC rosuvastatinu. Na této interakci se pravděpodobně podílí cyklosporinem inhibované hepatální vychytávání rosuvastatinu pomocí OATP1B1 [26]. Společnému podávání rosuvastatinu a cyklosporinu bychom se měli vyhnout, podle některých zdrojů je považováno za nepřípustné, jiné připouští při zvýšené opatrnosti podávat maximálně 5 mg rosuvastatinu denně [1]. Cyklosporin zvyšuje plazmatické hladiny i ostatních statinů. Společné užívání by mělo být velmi dobře monitorováno a pacient by měl být dostatečně poučen. Tolerováno je obvykle maximálně 10 mg simvastatinu (dle některých odborníků je podání kontraindikováno) nebo atorvastatinu užívaného společně s cyklosporinem [11]. V případě lovastatinu nebo pravastatinu lze dle doporučení užít ještě o 10 mg za den více [1].
Zdá se, že hladinu cyklosporinu ovlivňují pouze dva ze statinů, a to simvastatin a atorvastatin (ovlivnění hladiny nebylo pozorováno u fluvastatinu, lovastatinu a pravastatinu). Tyto statiny mohou snižovat hladinu cyklosporinu v plazmě a zvyšovat jeho clearance. Klinický význam této interakce je nejasný. Přesto můžeme uzavřít tvrzením, že u statinů je doporučeno přísněji monitorovat hladinu cyklosporinu [1, 6].
Statiny a amiodaron
Amiodaron je inhibitorem CYP3A4 i formy CYP2C9, a proto interaguje se statiny metabolizovanými těmito izoformami cytochromu P450. Klinicky nejzávažnější interakci s amiodaronem vykazují simvastatin a lovastatin. Je doporučeno užívat maximálně 20 mg simvastatinu (někteří výrobci doporučují maximálně 10 mg simvastatinu a někteří považují současné užívání za kontraindikaci) a 40 mg lovastatinu. Při indikaci vyšších dávek se doporučuje přejít na podávání „bezpečnějšího“ statinu (rosuvastatinu, fluvastatinu, pravastatinu). Atorvastatin je CYP3A4 metabolizován v menší míře, proto není tato interakce natolik klinicky závažná. Jako dostačující se jeví poučení pacienta a monitoring rizik rhabdomyolýzy. I když je amiodaron zároveň inhibitorem CYP2C9, není jeho společné užívání s fluvastatinem považováno za klinicky závažnou interakci. V literatuře se rovněž objevila jedna kazuistika popisující zvýšení hladin jaterních enzymů při společném užívání amiodaronu a rosuvastatinu. Je proto doporučeno při společném užívání monitorovat hladiny jaterních enzymů a symptomů myopatie [1, 11, 19, 29].
Statiny a warfarin
Statiny mohou interagovat s warfarinem. Uvažované mechanismy se liší podle typu statinu: kompetice o metabolismus na CYP3A4 (v případě simvastatinu), inhibice metabolismu S-warfarinu na CYP2C9 (fluvastatin) nebo mechanismus není plně objasněn (rosuvastatin). Výsledkem interakce může být zvýšení INR i zvýšení rizika myopatie. Klinicky není tato interakce velmi závažná. V kohortové studii vedlo přidání 20 mg simvastatinu pacientům užívajícím warfarin ke zvýšení INR o 27 % a ke snížení dávky warfarinu o 9 %. U dalších statinů pak byly publikovány spíše ojedinělé kazuistiky anebo malé klinické studie často s rozporuplným výsledkem. Je doporučeno pečlivě monitorovat INR, kreatinkinázu (CK) a symptomy myopatie při zahajování, ukončování nebo jakékoli změně léčby warfarinem nebo simvastatinem (popř. i jiným statinem) u pacientů, kteří užívají jejich kombinace [1, 26, 30].
Statiny a ostatní hypolipidemika
Fibráty se v dnešní době používají stále častěji do kombinační léčby se statiny, zejména u skupiny diabetiků a pacientů s vysokou hladinou triglyceridů. Tato kombinace zvyšuje riziko myopatie, která byla většinou pozorována v prvních 12 týdnech společného podávání [28]. V současné době se předpokládá vliv více mechanismů. Tyto mechanismy mohou být na farmakodynamickém (synergie), ale i na farmakokinetickém podkladě (ovlivnění glukuronidace statinů fibrátem – gemfibrozilem), vliv na receptory aktivované peroxizomovým proliferátorem (peroxisome proliferator activated receptors, PPAR receptory), které následně ovlivňují CYP regulaci) [28, 31]. Gemfibrozil snižuje též renální clearance pravastatinu (kompetice o transportní protein) a zvyšuje koncentraci pravastatinu a rosuvastatinu snižováním jejich biliární exkrece [28]. Za nejvíce závažné jsou považovány interakce s gemfibrozilem, který však již není v ČR dostupný. Podle některých databází je společné podání gemfibrozilu a některých statinů kontraindikováno. Ostatní fibráty též nejsou prosty interakcí se statiny. Případy rhabdomyolýz byly popsány vedle kombinací se statiny též při samostatném užívání bezafibrátu, klofibrátu i fenofibrátu. Pokud jsou užívány se statiny, předpokládáme aditivní myotoxický potenciál. Fenofibrát měl incidenci rhabdomyolýzy 0,58 případu/106 receptů kombinací s jiným statinem než cerivastatinem. Tato incidence byla 15krát nižší než v případě kombinace gemfibrozil – statin (kromě cerivastatinu) a 8000krát nižší než při kombinaci gemfibrozil – cerivastatin [31]. Pokud je indikována kombinace statin – fibrát, měl by být v našich podmínkách preferován fenofibrát. Samozřejmostí je poučení pacienta o symptomech myotoxicity a pravidelné kontroly, obzvláště na začátku kombinační léčby.
I když byly publikovány kazuistiky popisující výskyt rhabdomyolýzy při kombinaci statinů s niacinem [33], je kombinace statin – niacin považována za méně rizikovou než kombinace statin – fibrát a na základě dnešních dat nepůsobí klinicky závažnější myopatie než samotné užívání statinů. Obdobně je tomu při i kombinační léčbě ezetimib – statin [28, 34].
Statiny a grapefruit (pomelo)
Grapefruit a grapefruitový džus jsou silnými inhibitory CYP3A4. Uvádí se, že jedna sklenice (200 ml) džusu anebo jedna polovina grapefruitu dostačuje k tomu, aby snížila aktivitu CYP3A4 na polovinu (a zvýšila se AUC simvastatinu 3–4krát). Efekt přetrvává minimálně 24 hodin [35, 36]. Obdobný účinek jako grapefruit má i pomelo či sevillský pomeranč. Proto pacienti užívající simvastatin, lovastatin nebo atorvastatin, jež jsou přednostně metabolizovány CYP3A4, by se měli vyhnout konzumaci grapefruitu, pomela nebo jejich džusů. Alternativou pro tyto pacienty je převedení na léčbu statiny, které nejsou metabolizovány přes CYP3A4, a tím pádem nejsou současným příjmem těchto druhů ovoce ovlivněny (fluvastatin, rosuvastatin, pitavastatin, pravastatin). Další možností je vzdát se konzumace grapefruitového a pomelového džusu a nahradit jej džusem pomerančovým, který obsahuje též vitamin C, ale pravděpodobně nepůsobí na metabolismus statinů. Dle studií in vitro též karambola a džusy z černé moruše, divokých hroznů, granátového jablka a černých malin ovlivňují metabolismus CYP3A4 [1, 37, 38].
Statiny a kyselina fusidová
Objevují se kazuistiky popisující rozvoj rhabdomyolýzy při současném užívání atorvastatinu nebo simvastatinu společně s kyselinou fusidovou. Dosud není úplně jasné, jakým mechanismem tato interakce vzniká. Pravděpodobně se jedná o inhibici glukuronidace, i když někteří autoři připouštějí i aktivitu na CYP3A4. Přesto bychom se společnému užívání měli vyhnout. Mělo by být zváženo přerušení léčby statinem, pokud je kyselina fusidová podávána jinak než lokálně. V případě, že je společné užívání nevyhnutelné, je vhodné vyvarovat se kombinací s atorvastatinem nebo simvastatinem a monitorovat příznaky myopatie [1, 39, 40].
Enzymové induktory a statiny
Enzymové induktory (rifampicin, karbamazepin, fenytoin, třezalka, barbituráty) mohou snižovat AUC statinů. Nejvyšší snížení bylo pozorováno u simvastatinu, lovastatinu a atorvastatinu. Je připisováno indukci CYP3A4. Snížení AUC, i když ne tak velké, bylo zaznamenáno i u jiných statinů (fluvastatinu a pravastatinu) a předpokládá se i u rosuvastatinu a pitavastatinu, protože rifampicin a karbamazepin indukují též OATP1B1, MDR1, MRP1. Pokud se užívají společně statiny a enzymové induktory, je doporučeno sledovat účinnost statinů a popřípadě zvýšit jejich dávku. Lze též zvážit terapeutické možnosti tak, abychom se užívání induktoru, zvláště pokud by měl být podáván dlouhodobě, vyhnuli (třezalka). V případě třezalky můžeme pravděpodobně vyloučit riziko u rosuvastatinu nebo fluvastatinu [1, 8].
Závěr
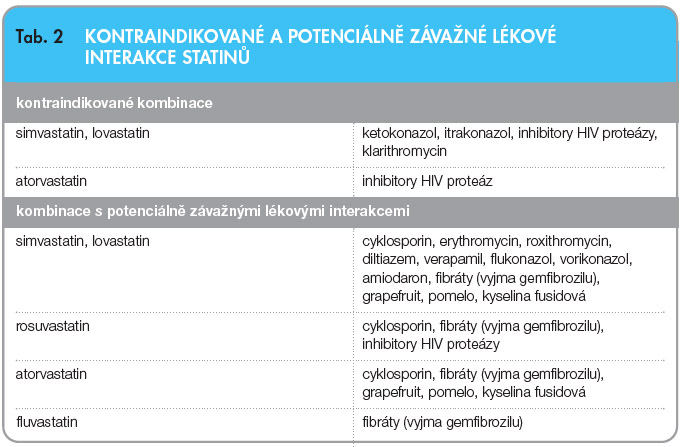 Lékové interakce komplikují léčbu a svými důsledky mohou ohrozit zdraví pacienta. Chceme-li účinně zvyšovat bezpečnost používaných léčiv, musíme aktivně přistupovat i k problematice lékových interakcí. Větší pozornost je třeba věnovat zejména léčivům s velkým interakčním potenciálem. Statiny, dnes hojně předepisovaná léková skupina, jsou poměrně výrazně zatíženy řadou lékových interakcí (tab. 2). Naštěstí se v riziku lékových interakcí jednotliví zástupci značně liší. U dnes preferovaných zástupců je interakční potenciál méně výrazný. Nejrizikovější jsou simvastatin a lovastatin, protože jejich metabolismus je nejvíce závislý na CYP3A4. Klinicky méně závažné interakce jsou popsány u atorvastatinu. K nejbezpečnějším pak náleží fluvastatin, rosuvastatin a pravastatin, které jsou metabolizovány přes P450 pouze v minimální míře.
Lékové interakce komplikují léčbu a svými důsledky mohou ohrozit zdraví pacienta. Chceme-li účinně zvyšovat bezpečnost používaných léčiv, musíme aktivně přistupovat i k problematice lékových interakcí. Větší pozornost je třeba věnovat zejména léčivům s velkým interakčním potenciálem. Statiny, dnes hojně předepisovaná léková skupina, jsou poměrně výrazně zatíženy řadou lékových interakcí (tab. 2). Naštěstí se v riziku lékových interakcí jednotliví zástupci značně liší. U dnes preferovaných zástupců je interakční potenciál méně výrazný. Nejrizikovější jsou simvastatin a lovastatin, protože jejich metabolismus je nejvíce závislý na CYP3A4. Klinicky méně závažné interakce jsou popsány u atorvastatinu. K nejbezpečnějším pak náleží fluvastatin, rosuvastatin a pravastatin, které jsou metabolizovány přes P450 pouze v minimální míře.
Nejrizikovějšími léky z hlediska interakcí se statiny jsou některé makrolidy, inhibitory HIV proteázy, cyklosporin, verapamil, diltiazem a amiodaron. Dále bychom měli být obezřetní a pacienty užívající statiny upozorňovat na riziko, které jim může přinášet konzumace grapefruitu nebo pomela.
Práce byla podpořena grantem Univerzity Karlovy v Praze (SVV-2011-263-005).
Seznam použité literatury
- [1] Baxter K. Stockley’s Drug Interactions, pocket companion. 1. vyd. London: Pharmaceutical Press, 2010, 495 s.
- [2] Květina J, Grundmann M. Farmakologické interakce. Klin Farmakol Farm 2003; 1: 17–21.
- [3] Hodnocení dodávek distribuovaných léčivých přípravků za rok 2010. Státní ústav pro kontrolu léčiv. Dostupné na http: //www.sukl.cz/hodnoceni-dodavek-distribuovanych-lecivych-pripravku-za-rok. Citováno 9. 8. 2011.
- [4] Spotřeby léčiv za rok 2010: C10. MV – AISLP, verze 2011.2 – 1.4.2011.
- [5] Bottorff MB. Statin Safety and Drug Interactions: Clinical Implications. Am J Cardiol 2006; 97: 27C–31C.
- [6] Thompson PD, Clarkson P, Karas RH. Statin-associated myopathy. JAMA 2003; 28: 1681–1690.
- [7] Fernandes E, Perez R, Hernandez A, et al. Factors and Mechanism for Pharmacokinetics Differences between Pediatric Population and Adult. Pharmaceutics 2011; 3: 53–72.
- [8] Neuvonen PJ, Niemi M, Backman JT. Drug interactions with lipid-lowering drugs: Mechanism and clinical relevance. Clinical Pharmacology and Therapeutics 2006; 80: 565–581.
- [9] Flockhart DA. Drug Interactions: Cytochrome P450 Drug Interaction Table. Indiana University School of Medicine (2007). Dostupné na http:// medicine.iupui.edu/clinpharm/ddis/table.aspx. Accessed 10. 9. 2011.
- [10] Arnadottir M, Eriksson LO, Thysell H, et al. Plasma concentration profiles of simvastatin 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase inhibitory activity in kidney transplant recipients with and without ciclosporin. Nephron 1993; 65: 410–413.
- [11] Micromedex® Healthcare Series [Internet database]. Greenwood Village, Colo: Thomson Reuters (Healthcare) Inc. Updated periodically.
- [12] Vlček J, Fialová D, et al. Klinická farmacie I. 1. vyd. Praha: Grada, 2010, 368 s.
- [13] Vlček J. Lékové interakce z pohledu klinického farmaceuta. Practicus 2009; 8: 10–15.
- [14] Vlček J. Řešení lékových interakcí metodou SAZE. [online]. Solutio 2003/2004. Dostupné na . Citováno 20. 8. 2010.
- [15] Choi DH, Chung JH, Choi JS. Pharmacokinetics interaction between oral lovastatin and verapamil in healthy subjects: role of P-glycoprotein inhibition by lovastatin. Eur J Pharmacol 2010; 66: 285–290.
- [16] Kantola T, Kivistö KT, Neuvonen PJ. Erythromycin and verapamil considerably increase serum simvastatin and simvastatin acid concentrations. Clin Pharmacol Ther 1998; 64:177–182.
- [17] Azie NE, Brater DC, Becker PA, et al. The interaction of diltiazem with lovastatin and pravastatin. Clin Pharmacol Ther 1998; 64: 369–377.
- [18] Nishio S, Watanabe H, Kosuge K, et al. Interaction between amlodipine and simvastatin in patients with hypercholesterolemia and hypertension. Hypertens Res 2005; 28: 223–227.
- [19] MIKRO-VERZE AISLP – ČR. Verze 2011.2 – 1.4.2011 pro MS Windows. (SPC Zocor, Merck Sharp & Dohme B.V. Haarlem, Nizozemsko).
- [20] Aberg JA. Lipid management in patients who have HIV and are receiving HIV therapy. Endocrinol Metab Clin North Am 2009; 38: 207–222.
- [21] MV – AISLP, verze 2011.2 – 1.4.2011.
- [22] Fichtenbaum CJ, Gerber JG, Rosenkranz SL, et al. Pharmacokinetic interactions between protease inhibitors and statins in HIV seronegative volunteers: ACTG Study A5047. AIDS 2002; 16: 569–577.
- [23] Lundgren JD, Battegay M, Behrens G, et al. European AIDS Clinical Society (EACS) guidelines on the prevention and management of metabolic diseases in HIV. HIV Med 2008; 9: 72–81.
- [24] van der Lee M, Sankatsing R, Schippers E, et al. Pharmacokinetics and pharmacodynamics of combined use of lopinavir/ritonavir and rosuvastatin in HIV-infected patients. Antivir Ther 2007; 12: 1127–1132.
- [25] Kiser JJ, Gerber JG, Predhomme JA, et al. Drug/ drug interaction between lopinavir/ritonavir and rosuvastatin in healthy volunteers. J Acquir Immune Defic Syndr 2008; 47: 570–578.
- [26] Kostapanos MS, Milionis HJ, Elisaf MS. Rosuvastatin-associated adverse effects and drug-drug interactions in the clinical setting of dyslipidemia. Am J Cardiovasc Drugs 2010; 10: 11–28.
- [27] Kantola T, Backman JT, Niemi M, et al. Effect of fluconazole on plasma fluvastatin and pravastatin concentrations. Eur J Clin Pharmacol 2000; 56: 225–229.
- [28] Chatzizisis YS, Koskinas KC, Misirli G, et al. Risk factors and drug interactions predisposing to statin-induced myopathy: implications for risk assessment, prevention and treatment. Drug Saf 2010; 33: 171–187.
- [29] Merz T. Elevated serum transaminase levels resulting from concomitant use of rosuvastatin and amiodarone. Am J Health Syst Pharm 2007; 64: 1818–1821.
- [30] Hickmott H, Wynne H, Kamali F. The effect of simvastatin comedication on warfarin anticoagulation response and dose requirements. Thromb Haemost 2003; 89: 949–950.
- [31] Schoonjans K, Staels B, Auwerx J. Role of the peroxisome proliferator-activated receptor (PPAR) in mediating the effects of fibrates and fatty acids on gene expression. J Lipid Res 1996; 37: 907–925.
- [32] Jones PH, Davidson MH. Reporting rate of rhabdomyolysis with fenofibrate + statin versus gemfibrozil + any statin. Am J Cardiol 2005; 95: 120–122.
- [33] Reaven P, Witztum JL. Lovastatin, nicotinic acid, and rhabdomyolysis. Ann Intern Med 1988; 109: 597–598.
- [34] Simard C, Poirier P. Ezetimibe-associated myopathy in monotherapy and in combination with a 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor. Can J Cardiol 2006; 22: 141–144.
- [35] Keshari KJ, Kumar A, Kumar S, et al. Drug Interactions: Reactions with Grapefruit and Related Citrus Fruits. The Pharma Research 2009; 1: 1–14.
- [36] Suchopár J, a kol. Kompendium lékových interakcí Infopharm® 2011. Infopharm, a. s., 2011.
- [37] Robb-Nicholson C. By the way, doctor. I've been advised not to take my statin drug, simvastatin, with grapefruit juice. But is it safe to take the medication at night and then drink grapefruit juice in the morning? Harv Womens Health Watch 2010; 18: 8.
- [38] Lee T. Ask the doctor. I avoid grapefruit juice because my doctor says it affects how my body handles the Lipitor I take for my cholesterol. Should I also stay away from pomelo? Harv Heart Lett 2010; 21: 7.
- [39] Magee CN, Medani SA, Leavey SF, et al. Severe rhabdomyolysis as a consequence of the interaction of fusidic acid and atorvastatin. Am J Kidney Dis 2010; 56: e11–15.
- [40] Teckchandani S, Robertson S, Almond A, et al. Rhabdomyolysis following co-prescription of fusidic acid and atorvastatin. J R Coll Physicians Edinb 2010; 40: 33–36.