Lokální hemostatika
Zástava krvácení (hemostáza) je složitý proces skládající se ze tří základních propojených kroků: vazokonstrikce, činnost krevních destiček a tvorba nerozpustného fibrinu jako výsledek kaskády krevního srážení. Pro minimalizaci krevních ztrát může být fyziologický proces hemostázy podpořen aplikací lokálně působících hemostatik, jež lze rozdělit na tzv. biologická lepidla, tedy preparáty s obsahem některých koagulačních faktorů (např. fibrin, trombin), a na materiály, jež neobsahují hemokoagulační faktory (kolagen, želatina, oxidovaná celulosa, kyanoakrylát, polyethylenglykol, albumin s glutaraldehydem, adsorbenty atd.).
Proces zástavy krvácení je jedním ze základních mechanismů zachování integrity organismu. Jedná se o složitý komplexní děj zahrnující tři hlavní kroky. Prvním z nich je vazokonstrikce, reflexní odpověď poškozené cévy, jejímž cílem je omezit průtok krve poškozeným místem. Dále se do procesu zapojuje činnost krevních destiček v podobě jejich adheze, změny tvaru, agregace a uvolňování působků. Tento proces je odstartován obnažením subendotelového pojiva v poškozeném místě. Třetím krokem je spuštění kaskády krevního srážení, sledu enzymatických reakcí, jejichž výsledkem je přeměna fibrinogenu na nerozpustný fibrin schopný spojovat volně agregované destičky dočasné zátky do podoby definitivního trombu.
![Obr. 1 Schéma hemokoagulační kaskády (modře vnitřní dráha, hnědě vnější dráha); podle [1] a [2] – Murray, et al., 1993.](https://www.remedia.cz/photo-a-28003---.jpg)
Hemokoagulační kaskádu ( obr. 1 ) lze schematicky rozdělit na dvě vzájemně úzce propojené cesty. Vnitřní dráha je za fyziologických podmínek spouštěna kontaktem krve s kolagenem poškozené cévní stěny. Aktivace této dráhy je pomalejší a její význam spočívá v dlouhodobějším udržování tvorby krevní sraženiny. S druhou, tzv. vnější dráhou se spojuje ve společném kroku, kterým je aktivace faktoru srážení X na Xa. Vnější dráha je iniciována uvolněním tkáňového faktoru z místa poškození. Koncová společná část obou drah začíná faktorem Xa, který štěpí neaktivní protrombin v aktivní trombin; ten je schopen měnit fibrinogen na fibrin-monomer spontánně agregující za vzniku fibrinové polymerní zátky, jež je dále zesíťována působením faktoru XIIIa [1, 2].
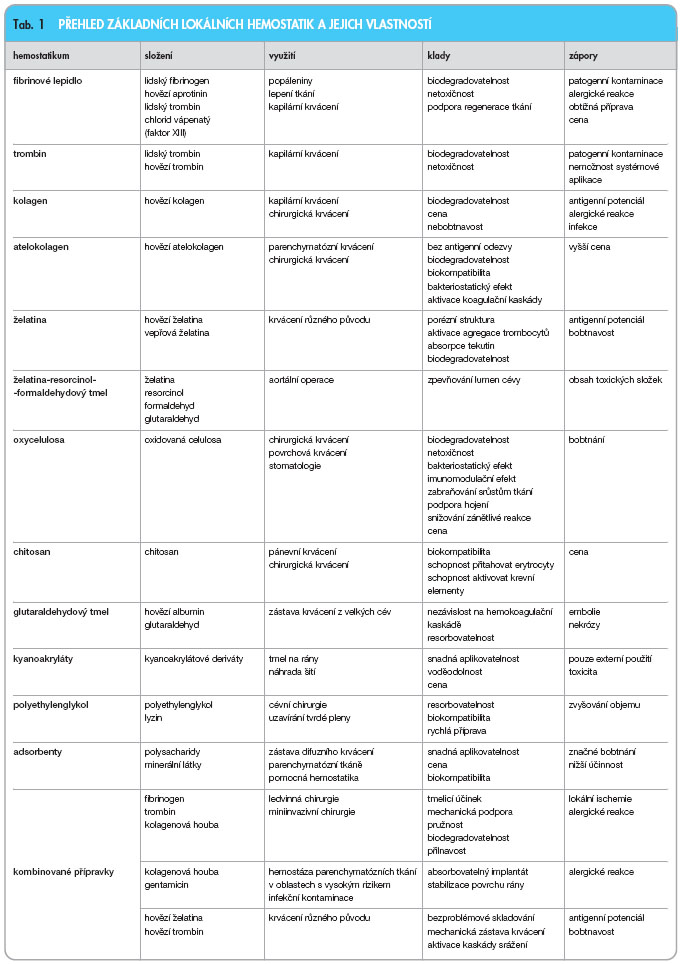 V současné době se z důvodu minimalizace krevních ztrát při chirurgických výkonech nebo při povrchových poraněních, kdy není možno čekat, až se rozvinou přirozené mechanismy hemostázy (aktivace krevních destiček a faktorů srážení, kontrakce cév), nebo tyto mechanismy nejsou dostatečné, používají tři základní techniky podpory krevního srážení. Metody ligace (podvaz cévy) nebo kauterizace (uzávěr cévy místním působením vysoké teploty) mohou být v některých případech nepoužitelné s ohledem na charakter krvácející tkáně [3]. V takových případech je možno použít lokálně hemostaticky působící látky [4, 5]. Tato skupina látek (tab. 1) přírodního nebo syntetického původu může vyvolávat hemostázu různými mechanismy:
V současné době se z důvodu minimalizace krevních ztrát při chirurgických výkonech nebo při povrchových poraněních, kdy není možno čekat, až se rozvinou přirozené mechanismy hemostázy (aktivace krevních destiček a faktorů srážení, kontrakce cév), nebo tyto mechanismy nejsou dostatečné, používají tři základní techniky podpory krevního srážení. Metody ligace (podvaz cévy) nebo kauterizace (uzávěr cévy místním působením vysoké teploty) mohou být v některých případech nepoužitelné s ohledem na charakter krvácející tkáně [3]. V takových případech je možno použít lokálně hemostaticky působící látky [4, 5]. Tato skupina látek (tab. 1) přírodního nebo syntetického původu může vyvolávat hemostázu různými mechanismy:
-
zásahem do procesu krevního srážení
-
aktivací agregace krevních destiček
-
mechanickou kompresí
-
absorpcí tekutiny, čímž dochází ke zvyšování koncentrace faktorů krevního srážení.
V odborné literatuře neexistuje jednotné pravidlo rozdělení hemostatických přípravků. Pro přehlednost je možné použít jejich dělení na tzv. biologická lepidla (fibrinové lepidlo, trombinové lepidlo), tedy preparáty připravené z některých koagulačních faktorů (např. fibrinu, trombinu), jež se při aplikaci vzájemně sloučí a vytvoří adhezivní disperzi svým složením podobnou přirozené krevní sraženině [6]. Podobně jako přirozená krevní sraženina rychle přilnou k okolním tkáním a ztuhnou. Druhou skupinou jsou materiály, jež neobsahují hemokoagulační faktory (kolagen, želatina, oxidovaná celulosa, kyanoakryláty, polyethylenglykol, albumin s glutaraldehydem, adsorbenty atd.). Další rozdělení může být podle původu na přírodní, polosyntetické a syntetické.
-
bezpečnost – preparáty používané k zástavě krvácení by neměly být antigenní, infekční, mutagenní a po opakované aplikaci by neměly způsobovat komplikace;
-
účinnost – u různých chirurgických výkonů je požadován různý typ a vlastnosti hemostatického materiálu. Například ve vaskulární chirurgii jsou užívány rychle polymerizující materiály vedoucí k rychlé zástavě krvácení, avšak v plastické chirurgii, kde se klade důraz na přesnost a preciznost, jsou požadavky opačné;
-
využitelnost – manipulace s materiálem by měla být snadná a pohodlná, což může zajistit i vhodný typ aplikátoru;
-
cenová dostupnost, bezproblémová skladovatelnost a dostatečně dlouhá doba použitelnosti.
V následujícím textu jsou charakterizovány nejdůležitější užívané hemostatické materiály.
Fibrinové lepidlo
Užití samotného fibrinu jako hemostatika bylo poprvé vyzkoušeno již v roce 1909. Od roku 1940 byla dostupná kombinace fibrinu spolu s trombinem ve formě pěny, popř. sterilní houby, které se používaly ke zlepšení adheze kožních transplantátů u vážně popálených vojáků. Z důvodů možné patogenní kontaminace lidské plazmy, ze které se trombin získával, byl po válce nahrazen trombinem hovězím, ale i tento materiál vytvářel riziko přenosu patogenů, především prionů z hovězího dobytka, a tak byl opět nahrazen trombinem lidským [4, 7].
Fibrinové lepidlo patří do skupiny tkáňových adheziv, která vyvolávají hemostázu tvorbou fibrinových koagulů v místě aplikace. Je původem z lidské plazmy, skládá se z vysoce koncentrovaného lidského fibrinogenu (Fibrinogenum humanum) s aprotininem hovězího původu v jednom aplikačním systému a z trombinu (Thrombinum humanum) s chloridem vápenatým v druhém odděleném aplikačním systému. Někdy může obsahovat i faktor srážení XIII. Jde o netoxický biodegradovatelný materiál schopný podporovat růst tkáně v okolí poranění a její regeneraci. Spíše než jako hemostatikum se používá k lepení tkání. Hemostaticky působí pouze u kapilárního krvácení. Potenciálním rizikem použití je možná patogenní kontaminace; toto nebezpečí může být sníženo úpravou krve ultrafiltrací nebo tepelným ošetřením. Dalším rizikem je přenos infekčních chorob (především hepatitid) a možnost alergické až anafylaktické reakce, která je podmíněna přítomností aprotininu hovězího původu. Nevýhodou je obtížný způsob přípravy před použitím, nutnost aplikace na suchou resekční plochu a vyšší cena [8–12].
Trombinové lepidlo
Trombinové lepidlo patří do skupiny tkáňových adheziv. Trombin je důležitý faktor krevního srážení nutný ke konverzi rozpustného fibrinogenu na nerozpustný fibrin. Při této konverzi nejprve dochází k odštěpení fibrinopeptidu A a B z molekuly fibrinogenu za vzniku fibrinových monomerů; ty se posléze spojují a vytvářejí fibrinové polymery, u nichž dochází dalším síťováním ke vzniku konečného produktu – fibrinové zátky, základu krevní sraženiny [7]. Nejčastěji se používá trombinové lepidlo ve formě topického preparátu s obsahem humánního nebo hovězího trombinu, určeného k zástavě krvácení z drobných cév. Není určen k systémové aplikaci, neboť může vést ke vzniku trombózy [13, 14].
Většinou se však nepoužívá trombin samotný, ale v kombinaci s želatinou hovězího, popř. vepřového původu nebo v kombinaci s kolagenem.
Kolagen
Mikrofibrilární kolagen je přírodní, nedenaturovaný, resorbovatelný hemostatický materiál získaný z hovězí kůže a šlach; díky svému složení vykazuje určitý antigenní potenciál, a může tudíž způsobovat problémy po aplikaci. Působí mechanismem komprese cév a bobtná na základě absorpce tělních tekutin, navíc při kontaktu s krví aktivuje agregaci krevních destiček. Hemostáza se spouští, když krev přichází do kontaktu s tkáňovými faktory a je vystavena kontaktu s kolagenovými vlákny, čímž kolagen dodávaný do oblasti rány podporuje agregaci krevních destiček a akceleruje proces koagulace. Resorbuje se do tří měsíců. Může být používán samostatně, ale častěji v kombinaci s tkáňovými adhezivy, a to ve formě houby nebo prášku [4, 8, 9, 15, 16].
Atelokolagen je název užívaný pro kolagen zbavený telopeptidů majících funkci antigenních determinant, při současném zachování jeho trojhelikální konformace, jež zajistí zablokování zbývající vnitřní antigenní oblasti. Vyrábí se v podobě čistého, nativního vstřebatelného bovinního sterilního atelokolagenu. Výhody tohoto materiálu spočívají v nejvyšším stupni biokompatibility, ve výborné toleranci živou tkání a vstřebatelnosti hemostatika po implantaci. Hemostatika tohoto typu navíc nepodporují růst mikroorganismů a jsou použitelná i do infikovaných ran nebo u medicínsky kompromitovaných pacientů. Působí i mírně bakteriostaticky. Zásadní je také skutečnost, že aktivují kaskádu nativních koagulačních faktorů v krvi zcela přirozeným způsobem a tím výrazně urychlují celý proces zástavy krvácení [17].
Kombinované přípravky
Nejčastěji používané kombinované přípravky jsou tvořeny fibrinogenem a trombinem v podobě suchého potahu na kolagenové houbičce, která při kontaktu s tělní tekutinou uvolňuje léčivé složky potahu na povrch rány. Jedná se o sterilní vstřebatelnou chirurgickou záplatu užívanou k lokální aplikaci při operaci, např. malých ledvinných tumorů v chirurgii, zvláště u pacientů s resekcí jedné ledviny, kde je velmi důležité zachování ledvinného parenchymu [18]. V této indikaci se jedná o hodnotnou alternativu ve srovnání se standardním hemostatickým materiálem, jehož použití je spojeno s rizikem lokální ischemie, která může vést k nekróze ledviny a úbytku aktivního ledvinného parenchymu. Jde o materiál pružný, roztažný, biodegradovatelný, v přítomnosti tělních tekutin dostatečně přilnavý, a proto se může použít jak při otevřené operaci, tak i v miniinvazivní chirurgii. Využívá se především tmelicího účinku fibrinu a mechanické podpory kolagenu [8, 18].
V současné době je dostupný rovněž přípravek v podobě absorbovatelného implantátu, který se používá k lokální zástavě krvácení parenchymatózní tkáně v oblastech s vysokým rizikem infekce. Je tvořen kombinací kolagenové houby s antibiotikem gentamicinem [19].
Želatina
Želatina je přírodní, resorbovatelný hemostatický materiál získaný částečnou hydrolýzou kolagenu – základního stavebního materiálu pojivových a vazivových tkání. Nejčastěji se vyrábí v podobě sterilní houby používané v suchém stavu nebo namočené do fyziologického roztoku. Porézní struktura tohoto materiálu při kontaktu s krví aktivuje trombocyty k produkci látek usnadňujících jejich agregaci. Je schopna absorbovat tělní tekutiny do několikanásobku své hmotnosti. Doba resorpce závisí na použitém množství a místě aplikace. Většinou se resorbuje za 3–6 týdnů. Může být rovněž použita ve formě pěny, popř. prášku. V USA se používá od roku 1945, v Evropě až od roku 1960. Po celou dobu užívání želatiny jako hemostatika dochází k neustálému zdokonalování preparátů s jejím obsahem [8, 15, 20–24].
Kombinované přípravky
Na trhu jsou dnes dostupné přípravky složené z hovězí želatiny a trombinu. Želatina mechanicky zastavuje krvácení a vystavuje ránu vysoké koncentraci trombinu, který následně aktivuje srážecí kaskádu za tvorby krevních koagulů. Na ránu se aplikuje v podobě krému, který do dvou minut po aplikaci polymerizuje a vytváří pevný povlak. Výhodou je jeho relativní odolnost proti smývání proudem krve ve srovnání s fibrinovým lepidlem. Uchovává se při pokojové teplotě [10].
Želatina-resorcinol-formaldehydový tmel
Želatina-resorcinol-formaldehydový tmel je užíván jako hemostatikum např. při operaci aortální disekce, neboť usnadňuje zpevnění křehkých separovaných lumen aorty. Je složen z adhezivního materiálu – želatiny a resorcinolu umístěného v tubě a z polymerujícího materiálu – formaldehydu a glutaraldehydu v tmavé skleněné lahvičce. Aplikuje se pomocí speciálně navržené stříkačky umožňující přesné nanesení polymerizující látky. V některých zemích je tento preparát nedostupný, neboť obsahuje cytotoxicky působící formaldehyd. Pokud se však použije přiměřené množství aktivní substance (formaldehydu a glutaraldehydu), škodlivé působení formaldehydu se neprojeví. Bylo zjištěno, že optimální koncentrace aktivní substance je 8 % [9, 25].
Oxycelulosa
Základní a stěžejní využití oxidované celulosy (OC) již od 60. let minulého století vychází z její vlastnosti chovat se jako degradovatelné hemostatické agens. Kyselé skupiny tohoto polymeru jsou schopny v oblasti ran, parenchymatózních orgánů i kostí podporovat krevní srážení. Značné nabobtnání této látky při styku s tělními tekutinami vede ke vzniku mechanické zátky podporující zástavu krvácení [26, 27], k níž přispívá i koagulace krevních globulinů a albuminu nízkým pH vznikajícím v místě aplikace. Krevní srážení ovlivňované působením oxycelulosy vyplývá z její blíže nespecifikované interakce s krevními destičkami. Oxycelulosa způsobuje zvýšení adhezivity a urychlení agregace trombocytů nativní venózní krve a jejich vazbu na své vláknité částice, takže dochází ke vzniku kombinovaného trombu způsobujícího zástavu kapilárního krvácení. Z tohoto hlediska lze vysvětlit hemostatickou účinnost oxycelulosy i u pacientů s poruchami krevní koagulace [28]. Listy oxidované celulosy bývají rovněž vkládány do prostorů mezi poškozenými tkáněmi po chirurgických výkonech, a to jako bariéra zabraňující srůstům během hojení, která se po několika týdnech sama rozkládá. Dnes dostupné moderní aplikační systémy jsou schopné dodávat velmi jemný prášek samotné oxycelulosy nebo její směsi s práškovaným léčivem (velikost částic do 100 mm) pomocí proudícího plynu a vhodného aplikátoru s tryskou přímo na místo krvácení či rány, které nejsou běžně dostupné pro manipulaci s jinými formami krytí [29]. Z oxycelulosy lze připravit i modifikovaný hemostatický materiál, například smícháním s vodným roztokem pojiva. Po vysušení směsi se získává plošný nebo trojrozměrný materiál, který může být přídavkem dostatečného množství polárního změkčovadla (např. glycerolu, polyethylenglykolů) převeden na plastický tvarovatelný materiál používaný jako kostní tmel s hemostatickými účinky [28]. Oxycelulosa je dobře snášena, má baktericidní vlastnosti na široké spektrum patogenních mikroorganismů, na povrchu rány snižuje možnost vzniku zánětu či svědění a podporuje hojení poškozené tkáně. Mechanickým oddělením jednotlivých tkání a zásahem do produkce prozánětlivých cytokinů snižuje výskyt pooperačních srůstů, které jsou velice častou komplikací např. gynekologických operací a mohou vést k bolestem, střevním obstrukcím až k neplodnosti [30, 31]. Při pH krve je OC biodegradovatelná, v organismu se rozkládá z 80 % do čtrnácti dnů [32–40].
Chitosan
Chitosan je přírodní, biodegradovatelný, biokompatibilní, neantigenní, netoxický polysacharid získaný deacetylací chitinu – základní stavební jednotky kostry hmyzu. Vyznačuje se mukoadhezivními vlastnostmi a antimikrobiální aktivitou. Díky pozitivnímu náboji přitahuje červené krvinky. Významné je jeho užití jako hemostatického materiálu, např. při zástavě pánevního krvácení. Dříve se používal pouze zevně, ale jelikož byla prokázána jeho bezpečnost při vnitřním užití, používá se dnes jako absorbovatelný hemostatický materiál při chirurgických zákrocích a vyznačuje se dokonce větší schopností aktivovat krevní elementy než želatinová houba nebo oxycelulosa. Díky adhezivním vlastnostem vytváří na povrchu rány pevný, odolný a nepropustný povlak, který je rovněž bariérou pro infekční agens [41–43].
Glutaraldehydový tmel
Glutaraldehydový tmel je tvořen kombinací purifikovaného hovězího sérového albuminu a glutaraldehydu obsaženého v dvoukomorové injekční stříkačce. Při kontaktu s porušenou tkání dochází v průběhu třiceti sekund k vytváření vazeb mezi molekulami albuminu a glutaraldehydu za vzniku pružné, mechanicky pevné zátky nezávislé na kaskádě krevního srážení. Je používán k zástavě krvácení z velkých cév – aorty, femorální a karotické arterie. Resorbuje se za několik měsíců. V mikrovaskulární chirurgii bylo zaznamenáno několik případů embolie při použití tohoto materiálu. Jeho nadměrné užívání může způsobit nekrózu tkáně v oblasti aplikace [10, 15, 44].
Kyanoakryláty
Kyanoakrylát je silným tkáňovým adhezivem schváleným k externímu užití k uzavření řezných poranění, kde vytváří ochrannou bariéru proti vniknutí patogenních organismů. Jelikož samotný kyanoakrylát je toxický a způsobuje iritaci okolní tkáně, používají se jeho deriváty, které mohou být substituovány různě dlouhými řetězci. Se zvyšující se délkou řetězce klesá toxicita derivátů. Používá se např. butyl-2-kyanoakrylát nebo ethyl-2-kyanoakrylát, který vykazuje největší schopnost přilnutí ke tkáni. Mechanismus hemostatického účinku není zcela objasněn, ale předpokládá se, že při kontaktu s povrchem rány dojde k vytvoření kapalné polymerní membrány, která se absorpcí malého množství vlhkosti zpevňuje až do vzniku pevné a silné zátky. Je snadno aplikovatelný, vodotěsný, bakteriostatický, biodegradovatelný, stálý při pokojové teplotě a nenákladný, což zvýhodňuje jeho použití [45, 46]. Může být podáván v tekuté formě vytvářející pevný, přizpůsobitelný a vodotěsný tmel na rány [47]. Lze použít jako rychlá a bezbolestná alternativa uzavření rány místo sešívání, zvláště u dětí, ale i u pacientů užívajících perorální antikoagulancia [10, 46].
Polyethylenglykol
Polyethylenglykol (PEG) je ve vodě rozpustný polymer užívaný jako pomocná látka ve farmaceutickém průmyslu. Bylo zjištěno, že polyethylenglykol o molekulové hmotnosti 4000 g/mol a v koncentraci 14–20 % je schopen v přítomnosti CaCl2 urychlit přeměnu protrombinu na trombin [48].
Preparáty s obsahem PEG jsou dostupné ve dvou variantách – jako syntetický kopolymer PEG v podobě biokompatibilního hydrogelu užívaný jako hemostatikum v cévní chirurgii, který se resorbuje do šesti týdnů. Po aplikaci vytvoří do jedné minuty gel. Za 24 hodin je schopen zvětšit svůj objem až čtyřnásobně. Výhodou tohoto preparátu je rychlá příprava nevyžadující rozmrazování nebo zahřívání, popř. aktivaci [10, 29]. Druhý preparát je tvořen PEG spojeným s molekulou lyzinu. Je biodegradovatelný za 4–8 týdnů a skladuje se při pokojové teplotě. V USA je schválen v indikaci uzavření tvrdé pleny (dura mater) [10, 49].
Adsorbenty organického a anorganického původu
Do této skupiny patří látky, které díky své struktuře rychle adsorbují vodu z krve, čímž zvyšují koncentraci krevních elementů (krevních destiček, červených krvinek a koagulačních faktorů) v krvácející ráně, a nastartují tak proces fyziologického srážení. Výhodou je jejich snadná aplikovatelnost, biologická nezávadnost a nízká cena [11]. Často se jedná o polysacharidové hemostatické systémy rostlinného původu (škroby, algináty) složené z absorbovatelných, modifikovaných polymerů. Při kontaktu s krví se mění na gel, který dobře přilne ke tkáni a vytváří tak mechanickou bariéru, která absorbuje krev nebo vznikající exsudáty z poraněného místa a podporuje tím proces zástavy krvácení i následného hojení [50]. Absorpce je závislá na množství použitého přípravku a velikosti ošetřené plochy [51, 52].
Z tohoto pohledu lze použít i preparáty anorganického původu složené z inertních minerálních látek. Mechanismus účinku je obdobný jako u preparátů uvedených výše. Absorpcí molekul vody z krve zvyšuje koncentraci krevních elementů zajišťujících tvorbu krevních sraženin [53].
Seznam použité literatury
- [1] www.lfhk.cuni.cz/rezacovam/HEMOKOAG/koagul.htm, staženo 5. 6. 2010.
- [2] Murray RK, Granner DK, Mayes PA, Rodwell VW. Harperova biochemie. 23. vyd. East Norwalk: Appleton & Lange, a Publishing division of Prentice-Hall International Inc., 1993, 872 s.
- [3] Maisano F, Kjaergard HK, Bauernschmitt R, et al. TachoSil surgical patch versus conventional haemostatic fleece material for control of bleeding in cardiovascular surgery: a randomised controlled trial. Eur J Cardio-Thorac Surg 2009; 36: 708–714.
- [4] Matula ChW, Steiger ChN. Hemostasis and Fleece-Bound Sealing in Neurosurgery. Georg Thieme Verlag 2005, 1–15.
- [5] www.zdn.cz/clanek/sestra-priloha/principy-lokalni-hemostazy-v-chirurgii-274019, staženo 26. 2. 2010.
- [6] www.baxter.cz/terapie/biologicke_lepeni/laik.html, staženo 5. 6. 2010.
- [7] Spotnitz WD, Burks SG, Prabhu R. Fibrin-Based Adhesives and Hemostatic Agents, In: Quinn JV. Tissue adhesives in clinical medicine, 2. vyd. New York: Decker Inc., 2005, 77–103.
- [8] Hemostatické preparáty, www.bloodless.wz.cz/ cz/ot.hemost.koag.htm, staženo 26. 2. 2010.
- [9] Ünlü Y, Vural Ü, Kocak H, et al. Comparison of the topical haemostatic agents for the prevention of suture hole bleeding. An Experimental Study. Eur J Vasc Endovasc Surg 2002; 23: 441–444.
- [10] Spotnitz WD. Active and mechanical hemostatic agents. Surgery 2007; 142: 34–38.
- [11] Hora M, Eret V, Ürge T, et al. Možnosti využití tkáňových lepidel při ledvinu šetřících výkonech u tumorů ledvin. Czech Urol 2007; 11: 147–153.
- [12] Souhrn údajů o přípravku: Artiss, Artiss Lyo, Evicel, Tissel, Tissel Lyo, www.sukl.cz/modules/ medication/search.php, staženo 26. 2. 2010.
- [13] www.ethicon360.com/products/evithrom-thrombin-topical-human, staženo 17. 3. 2010.
- [14] www.thrombin-jmi.com/pdf/PI-0111Thrombin-PID1.pdf, staženo 17. 3. 2010.
- [15] Torre RA, Bachman SL, Wheeler AA, et al. Hemostasis and hemostatic agents in minimally invasive surgery. Surgery 2007; 142: 39–45.
- [16] www.integra-ls.com/PDFs/Helitene.pdf, staženo 17. 3. 2010.
- [17] www.hypro.cz/hyRubrIn.aspx?intRubrKis=1211 &intLang=0, staženo 5. 6. 2010.
- [18] Siemer S, Lahme S, Altziebler S, et al. Efficacy and Safety of TachoSil as Haemostatic Treatment versus Standard Suturing in Kidney Tumour Resection: A Randomised Prospective Study. Eur Urol 2007; 52: 1156–1163.
- [19] www.gelitamedical.com, staženo 17. 3. 2010.
- [20] www.curamedical.nl/cms/page/161, staženo 17. 3. 2010.
- [21] www.gelitamedical.com, staženo 17. 3. 2010.
- [22] www.pfizer.com/files/products/uspi_gelfoam_ sponge.pdf, staženo 17. 3. 2010.
- [23] www.ethicon360emea.com/products/surgiflo-hemostatic-matrix, staženo 17. 3. 2010.
- [24] Schonauer C, Tessitore E, Barbagallo G, et al. The use of local agents: bone wax, gelatin, collagen, oxidized cellulose. Eur Spine J 2004; 13: 89–96.
- [25] Kunihara T, Iizuka K, Sasaki S, et al. Optimal proportions of gelatin-resorcin-formalin components in aortic surgery. Eur J Cardio-Thorac Surg 2009; 36: 962–966.
- [26] Brandon GJ. A Delivery system for control bleed-ing skin wounds. World Patent WO2006006140, 2006.
- [27] Santar I, Kiss F, Briestensky J. Cellulose derivatives. World Patent WO9833822, 1998.
- [28] Možíšek M, Černý P, Možíšková J, et al. Hemostatický materiál. Český patent CS253042, 1988.
- [29] CoSeal, goliath.ecnext.com/coms2/gi_0199-1330109/Cohesion-Technologies-Launches-CoSeal-R.html, staženo 15. 3. 2010.
- [30] Gago LA, Saed GM, Wang RX, et al. Effects of oxidized regenerated cellulose on the expression of extracellular matrix and transforming growth factor-b1 in human peritoneal fibroblasts and mesothelial cells. Amer J Obstet Gynecol 2003; 189: 1620–1625.
- [31] Reddy S, Santanam N, Reddy PP, et al. Interaction of Interceed oxidized regenerated cellulose with macrophages: A potential mechanism by which Interceed may prevent adhesions. Amer J Obstet Gynecol 1997; 177: 1315–1321.
- [32] Dimitrijevich SD, Tatarko M, Gracy RW, et al. In vivo degradation of oxidized, regenerated cellulose. Carbohyd Res 1990; 198: 331–341.
- [33] Stillwell RL, Marks MG, Saferstein L, Wiseman DM. Oxidized cellulose: Chemistry, processing and medical applications, In: Domb AJ, Kost J, Wiseman DM. Handbook of Biodegradable Polymers, Harwood Academic Publishers, Netherlands, 1997, 291–306.
- [34] Kumar V, Yang T. HNO3/H3PO4-NANO2 mediated oxidation of cellulose preparation and characterization of bioabsorbable oxidized celluloses in high yields and with different levels of oxidation. Carbohyd Polym 2002; 48: 403–412.
- [35] Bertocchi C, Konowicz P, Signore S, et al. Synthesis and characterization of polyglucuronan. Carbohyd Polym 1995; 27: 295–297.
- [36] Dimitrijevich SD, Tatarko M, Gracy RW. Biodegradation of oxidized regenerated, celulose. Carbohyd Res 1990; 195: 247–256.
- [37] Jelínková M, Briestenský J, Santar I, et al. In vitro and in vivo immunomodulatory effects of microdispersed oxidized cellulose. Int Immunopharmacol 2002; 2: 1429–1441.
- [38] Zimnitsky DS, Yurkshtovich TL, Bychkovsky PM. Multilayer adsorption of amino acids on oxidized celulose. J Colloid Interface Sci 2005; 285: 502–508.
- [39] Saferstein L, Wolf S, Kamp L, et al. Process for preparing a neutralized oxidized cellulose product and its method of use. European Patent EP0437095, 1991.
- [40] Henry MCW, Tashjian DB, Kasowski H, et al. Postoperative paraplegia secondary to the use of oxidized cellulose (Surgicel). J Pediat Surg 2005; 40: 9–11.
- [41] Morrison JJ, Mountain AJC, Galbraith KA, et al. Clasper: Penetrating pelvic battlefield trauma: Internal use of chitosan-based haemostatic dressings. Injury 2010; 41: 239–241.
- [42] Gu R, Sun W, Zhou H, et al. The performance of a fly-larva shell-derived chitosan sponge as an absorbable surgical hemostatic agent. Biomaterials 2010; 31: 1270–1277.
- [43] Englehart MS, Cho SD, Tieu BH, et al. A Novel Highly Porous Silica and Chitosan-Based Hemostatic Dressing Is Superior to HemCon and Gauze Sponges. J Trauma 2008; 65: 884–892.
- [44] www.cryolife.com/products/bioglue-surgical-adhesive, staženo 26. 2. 2010.
- [45] Fan Y, Sun H, Pei G, et al. Haemostatic efficacy of an ethyl-2-cyanoacrylate based aerosol in combination with tourniquet application in a large wound model with an arterial injury. Injury 2008; 39: 61–66.
- [46] Al-Belasy FA, Amer MZ. Hemostatic Effect of n-Butyl-2-Cyanoacrylate (Histoacryl) Glue in Warfarin-Treated Patients Undergoing Oral Surgery. J Oral Maxillofac Surg 2003; 61: 1405–1409.
- [47] www.dermabond.com/product/about-dermabond.html, staženo 16. 2. 2010.
- [48] Kaetsu H, Mizuguchi J, Hamamoto T, et al. Large-Scale Preparation of Human Thrombin: Polyethylene Glycol Potentiates the Factor Xa-Media-ted Activation of Prothrombin. Thromb Res 1998; 90: 101–109.
- [49] www.durasealspine.com/imageServer.aspx?contentID= 15306&contenttype=application/pdf, staženo 15. 3. 2010.
- [50] www.aveflor.cz/akutol_spray.php, staženo 5. 6. 2010.
- [51] www.starchmedical.com/perclot.htm, staženo 15. 3. 2010.
- [52] www.accessdata.fda.gov/cdrh_docs/pdf5/ P050038c.pdf, staženo 15. 3. 2010.
- [53] www.z-medica.com/quikclot/index.asp, staženo 15. 3. 2010.