Maligní melanom – současné přístupy k léčbě
Souhrn:
Standardní léčba pokročilého maligního melanomu se v posledních čtyřech letech změnila. Ipilimumab, protilátka anti CTLA 4, dokázal jako první prodloužit celkové přežití nemocných s maligním melanomem a přibližně u 20 % pacientů umožnil dlouhodobou kontrolu onemocnění. Druhým léčivem prodlužujícím přežití byl inhibitor BRAF vemurafenib a následně další inhibitor BRAF dabrafenib a inhibitor MEK trametinib. Na obzoru jsou ale další perspektivní přípravky z oblasti imunoterapie (nivolumab, pembrolizumab) a cílené léčby (cobimetinib, binimetinib, selumetinib). Velké naděje jsou dnes vkládány do kombinací a sekvencí těchto léčiv. Hlavním cílem je dále zvyšovat počty léčebných odpovědí a dlouhodobou kontrolu onemocnění bez zásadního zhoršení závažné toxicity.
Key words: melanoma, immunotherapy, targeted therapy, BRAF inhibitors, MEK inhibitors, c KIT inhibitors, anti CTLA 4 antibodies, anti PD 1 antibodies.
Summary:
The standard treatment of advanced malignant melanoma has changed during the last 4 years. The anti CTLA 4 monoclonal antibody ipilimumab prolonged, as the first agent ever, the overall survival, offering approximately 20% long term disease control rate. Other survival prolonging agents followed: the BRAF inhibitor vemurafenib and, more recently, another BRAF inhibitor dabrafenib and MEK inhibitor trametinib. There are many new perspective drugs at sight, coming from modern immunotherapy (nivolumab, pembrolizumab) and targeted therapy (cobimetinib, binimetinib, selumetinib) fields. Great hopes are now placed in combinations and sequences of these therapeutic agents. The main objective is to further increase response rates and long term disease control, without substantial increase of severe toxicity.
Úvod
Maligní melanom patří k nejzávažnějším kožním nádorům a jeho incidence celosvětově i v ČR rychle roste [1]. Prognóza pacientů s pokročilým onemocněním byla před zavedením moderní léčby velmi špatná, s mediánem přežití v rozmezí 6–10 měsíců. Nejhorší prognózu měli pacienti s mimoplicními viscerálními metastázami (postižení M1c) a současnou elevací hodnot laktátdehydrogenázy (LDH). U těchto pacientů se pravděpodobnost jednoletého přežití pohybovala kolem 33 % [2]. K průlomu v negativní prognóze dochází až v posledních čtyřech letech, a to díky novým léčivům, která vznikla na základě několikaletého intenzivního výzkumu v oblasti molekulární biologie, genetiky a imunologie. Těmto znalostem vděčíme za to, že dnes lépe rozumíme pochodům uvnitř buňky vedoucím k jejímu malignímu fenotypu a regulačním mechanismům imunitního systému. V současnosti jsme tak schopni cíleněji zasahovat do patologicky aktivovaných signálních drah a pozitivně stimulovat protinádorovou imunitu.
K dnešnímu datu jsou v zemích Evropské unie registrovány k léčbě pokročilého melanomu čtyři moderní léčivé přípravky (ipilimumab, vemurafenib, dabrafenib, trametinib) a další na schválení čekají (nivolumab, pembrolizumab). Velké naděje se také vkládají do lékových kombinací (např. ipilimumab + nivolumab, dabrafenib + trametinib, vemurafenib + cobimetinib). V dalším textu bude věnována pozornost jak léčivům již standardně používaným, tak i vysoce perspektivním moderním přípravkům.
Cílená léčba
Klinický výzkum na genové a molekulární úrovni umožnil vývoj léčiv, jež známe pod pojmem cílená léčba. Dnes se do této oblasti řadí především tzv. malé molekuly (nejčastěji tyrosinkinázové inhibitory). Obecným principem této léčby je cílený zásah do patologicky aktivované signální dráhy, která je příčinou maligního chování takto postižené buňky. Nejvíce zkušeností máme s inhibitory mutovaných proteinových kináz BRAF, MEK a c‑KIT.
Inhibitory BRAF
Vemurafenib
Vemurafenib je první selektivní inhibitor kinázy BRAF (BRAFi). Dle výsledků registrační studie BRIM‑3, která porovnávala léčbu vemurafenibem v dávce 960 mg per os (p.o.) 2× denně s léčbou dacarbazinem v dávce 1 000 mg/m2 podávaným intravenózně (i.v.) jednou za 3 týdny u nepředléčených pacientů s pokročilým maligním melanomem s mutací BRAF V600, byl počet léčebných odpovědí (kompletní nebo parciální remise) v rameni s vemurafenibem 48 %, v rameni s dacarbazinem jen 5 %. Medián doby bez progrese onemocnění (progression free survival, PFS) byl 6,9 měsíce oproti 1,6 měsíce a medián celkového přežití (overall survival, OS) 13,6 měsíce oproti 9,7 měsíce (p < 0,001). Výhodou vemurafenibu byl rychlý nástup účinku (kolem šesti týdnů). K nejčastějším toxickým nežádoucím účinkům 3. a 4. stupně patřily kožní spinocelulární karcinom (19 %), keratoakantom (10 %), rash (9 %) a elevace hodnot jaterních testů (11 %) [3,4].
Běžné klinické praxi se nejvíce blíží výsledky z velké otevřené multicentrické bezpečnostní studie s vemurafenibem, v níž bylo sledováno 3 226 pacientů s metastatickým melanomem. Do této studie byli zařazeni i pacienti s horší prognózou (8 % pacientů ve věku 75 let a starších, 23 % pacientů s mozkovými metastázami). Dle publikovaných výsledků třetí předběžné analýzy byl medián PFS 5,6 měsíce a medián OS 12 měsíců. Horší výsledky z hlediska přežití (PFS i OS) byly zjištěny u pacientů s mozkovými metastázami, diseminací M1c, elevací hodnot LDH a s horším stavem výkonnosti (Performance Status, PS) – stupně 2 dle ECOG (Eastern Cooperative Oncology Group). Častější nežádoucí příhody 3. a 4. stupně se vyskytly u starší populace (≥ 75 let; vyšší výskyt kožních spinocelulárních karcinomů a keratoakantomů a prodloužení intervalu QTc na EKG) [5].
Dabrafenib
Dabrafenib je další selektivní inhibitor BRAF. Svojí účinností se podobá vemurafenibu. V registrační studii III. fáze BREAK‑3, která srovnávala dabrafenib podávaný v dávce 150 mg p.o. 2× denně s dacarbazinem v dávce 1 000 mg/m2 i.v. podávaným jednou za 3 týdny, byl také zaznamenán výrazně vyšší počet léčebných odpovědí (50 % vs. 6 %) i signifikantně delší medián PFS (6,9 měsíce vs. 2,7 měsíce, p < 0,001). Medián OS byl také delší při léčbě dabrafenibem (18,2 měsíce vs. 15,6 měsíce), data jsou však ovlivněna léčbou po progresi onemocnění [6]. Charakter nežádoucích účinků byl podobný jako při podávání vemurafenibu, až na nižší četnost výskytu kožní fotosenzitivity, kožních spinocelulárních karcinomů a hepatotoxicity. Nově se však objevuje zvýšená teplota nejasné etiologie. Stejně jako u vemurafenibu je výhodou dabrafenibu průnik přes hematoencefalickou bariéru a potenciální účinek u pacientů s mozkovými metastázami [7].
Inhibitory MEK
Trametinib
Trametinib je reverzibilní selektivní inhibitor mitogenem aktivované proteinové kinázy (MEK) označované jako MEK 1 a 2. Účinnost léčiva byla potvrzena ve studii III. fáze METRIC srovnávající trametinib v dávce 2 mg p.o. 1× denně s chemoterapií (dacarbazinem nebo paclitaxelem). V rameni s trametinibem byl zaznamenán vyšší počet léčebných odpovědí ve srovnání s chemoterapií (22 % vs. 8 %) i signifikantně delší medián PFS (4,8 měsíce vs. 1,5 měsíce), údaje o celkovém přežití zatím nejsou k dispozici. K nejčastějším nežádoucím účinkům patřila papulopustulární vyrážka (makulopapulární při podávání inhibitoru BRAF), průjem, hypertenze, periferní otoky a únava. Nově byly pozorovány chorioretinopatie (1 %) a přechodný pokles ejekční frakce levé srdeční komory (7 %) [8]. Vzhledem k nižší četnosti léčebných odpovědí ve srovnání s podáváním inhibitoru BRAF bude trametinib patrně indikován za situací, kdy je inhibitor BRAF kontraindikován nebo není tolerován. Druhou a pravděpodobně častější indikací bude po schválení registrace trametinibu kombinace tohoto přípravku s dabrafenibem (duální blokáda signální dráhy MAPK – mitogen‑activated protein kinase).
Binimetinib
U 15–20 % kožních melanomů je příčinou zvýšené aktivity signální dráhy MAPK mutace onkogenu NRAS, mutace BRAF u této skupiny pacientů není přítomna. Inhibitory BRAF jsou v daném případě neúčinné a dráhu MAPK je nutno blokovat až na úrovni MEK. Zatím jsou k dispozici pouze výsledky studie II. fáze s binimetinibem u předléčených pacientů. Četnost léčebných odpovědí se pohybovala kolem 20 %, medián PFS byl čtyři měsíce, data o celkovém přežití zatím nejsou známa [9]. V současné době probíhá studie III. fáze u nepředléčených pacientů.
Cobimetinib
Podobně jako trametinib bude zřejmě hrát svoji roli v kombinovaných režimech s inhibitorem BRAF cobimetinib. Aktuálně je tento přípravek zkoušen v kombinaci s vemurafenibem.
Kombinace inhibitorů BRAF a MEK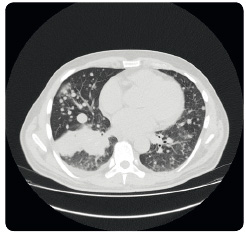
Původním záměrem duální blokády signální dráhy MAPK bylo zvýšit účinnost léčby inhibitorem BRAF a oddálit časně vznikající rezistenci. Prvním pozitivním signálem byly výsledky klinické studie II. fáze s kombinovanou léčbou dabrafenibem a trametinibem srovnávanou s monoterapií dabrafenibem, které byly prezentovány již v roce 2012. Tato studie prokázala nejen vyšší účinnost kombinace – počet odpovědí 76 % oproti 54 % a medián PFS 9,4 měsíce oproti 5,8 měsíce, ale také její dobrou toleranci. Z nežádoucích účinků byl patrný nižší výskyt kožní toxicity včetně nižšího výskytu spinocelulárních karcinomů, častěji se však objevovaly teploty [10]. Následně 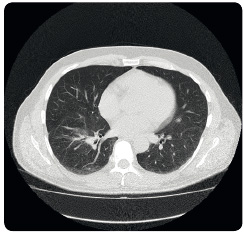 přicházejí další klinické studie srovnávající kombinaci inhibitorů BRAF s inhibitory MEK oproti monoterapii inhibitory BRAF; tyto studie dospěly až do III. fáze klinického zkoušení (studie COMBI‑d, COMBI‑v, CoBRIM) a všechny potvrdily vyšší četnost odpovědí na léčbu kombinací inhibitory BRAF s inhibitory MEK (60–70 %), signifikantně delší medián PFS (11–12 měsíců) a pokles kožní toxicity, ale na druhou stranu vzestup kardiotoxicity (reverzibilní pokles ejekční frakce levé srdeční komory) a vyšší výskyt serózní retinopatie. Předběžná data o celkovém přežití z výše uvedených studií také svědčí pro přínos léčby kombinacemi [11–13]. Zkušenosti s kombinacemi máme pouze z klinických studií a ze specifického léčebného programu s dabrafenibem a trametinibem (obr. 1 2 3).
přicházejí další klinické studie srovnávající kombinaci inhibitorů BRAF s inhibitory MEK oproti monoterapii inhibitory BRAF; tyto studie dospěly až do III. fáze klinického zkoušení (studie COMBI‑d, COMBI‑v, CoBRIM) a všechny potvrdily vyšší četnost odpovědí na léčbu kombinací inhibitory BRAF s inhibitory MEK (60–70 %), signifikantně delší medián PFS (11–12 měsíců) a pokles kožní toxicity, ale na druhou stranu vzestup kardiotoxicity (reverzibilní pokles ejekční frakce levé srdeční komory) a vyšší výskyt serózní retinopatie. Předběžná data o celkovém přežití z výše uvedených studií také svědčí pro přínos léčby kombinacemi [11–13]. Zkušenosti s kombinacemi máme pouze z klinických studií a ze specifického léčebného programu s dabrafenibem a trametinibem (obr. 1 2 3).
Inhibitory c‑KIT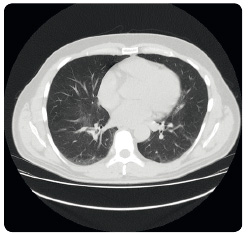
Slizniční melanomy, akrolentiginózní melanomy a melanomy vznikající v kůži chronicky poškozované UV zářením – lentigo maligna melanoma – se vyznačují vyšší incidencí mutace a amplifikace v genu c‑KIT [14]. V případě lentigo maligna melanoma dosahuje četnost mutací asi 20 %, u akrolentiginózních melanomů až 40 %. U těchto jednotek probíhají klinické studie s inhibitory c‑KIT (imatinib, nilotinib), dosud jsou známy jen výsledky studií II. fáze převážně u předléčených pacientů. Četnost odpovědí se pohybuje kolem 20–30 %, medián PFS v rozmezí 3–4 měsíců a medián OS v rozmezí 9–12 měsíců [15–17]. Inhibitory c‑KIT zatím nejsou v EU registrovány k léčbě c‑KIT‑pozitivních melanomů, bude nutné vyčkat výsledků studií III. fáze.
Moderní imunoterapie
Hlavními představiteli imunoonkologické léčby jsou monoklonální protilátky proti receptoru cytotoxických T‑lymfocytů CTLA‑4 (cytotoxic T‑lymphocyte antigen‑4, cytotoxický antigen asociovaný s T‑lymfocyty) a proti koinhibičnímu receptoru na aktivovaných T‑lymfocytech PD‑1 (programmed death‑1, membránový protein programované buněčné smrti).
Protilátka anti‑CTLA‑4
Ipilimumab
Ipilimumab je plně humánní monoklonální protilátka IgG1, která se selektivně váže na antigen CTLA‑4 nacházející se na povrchu T‑lymfocytů. Inhibicí těchto kontrolních bodů (checkpointů) můžeme sekundárně docílit vyšší aktivity buněk imunitního systému a tím i zesílení vlastní protinádorové imunity. Nežádoucím účinkem mohou být autoimunitní reakce (dermatitida, kolitida, hepatitida, hypofyzitida, thyreoiditida a další).
Ipilimumab podávaný v monoterapii nebo v kombinaci s chemoterapií (dacarbazin) dokázal signifikantně prodloužit celkové přežití ve dvou randomizovaných klinických studiích III. fáze, a to jak u předléčených, tak u nepředléčených pacientů s pokročilým melanomem [18,19]. Četnost léčebných odpovědí se pohybovala kolem 10–15 % a stabilizací nemoci bylo dosaženo kontroly onemocnění přibližně u 30 % pacientů. Ve srovnání s cílenou léčbou nastupuje účinek podávání ipilimumabu později, s odstupem několika týdnů až měsíců, někdy i po přechodném zhoršení zdravotního stavu pacienta. V případě ipilimumabu je ale zásadní dlouhodobé trvání léčebné odpovědi. Dle Kaplanových‑Meierových křivek přežití je zřejmé, že po třech letech nastává fáze plateau. Recentně publikovaná metaanalýza 12 klinických studií a specifických léčebných programů se 4 846 pacienty doložila, že tříletého přežití dosahuje přibližně 21 % pacientů, částečně příznivějších výsledků bylo docíleno u nepředléčených pacientů a při podávání dávky 10 mg/kg [20].
V nejbližších letech bude třeba vyřešit řadu otázek týkajících se potenciálně účinnější kombinace s protilátkami anti‑PD‑1 nebo s cílenou léčbou. Limitující může být vyšší toxicita kombinací, v případě inhibice dvou kontrolních bodů (checkpointů) jde především o autoimunitní projevy, při podávání kombinace ipilimumabu s vemurafenibem je úskalím hepatotoxicita [21]. Významným problémem moderní imunoterapie je absence prediktoru léčebné odpovědi.
Protilátky anti‑PD‑1
Nivolumab
Velká pozornost je nyní věnována protilátkám anti‑PD‑1. Receptor PD‑1 na T‑lymfocytech je další z inhibičních regulačních molekul; její cílenou blokádou pomocí nivolumabu (lidská monoklonální protilátka IgG4) můžeme sekundárně dosáhnout zesílení efektorové složky protinádorové imunity přímo v nádorové tkáni. V klinické studii I. fáze se 107 pacienty nepředléčenými ipilimumabem, jimž byl podáván nivolumab v různých dávkách, byla zaznamenána celková léčebná odpověď u 32 % pacientů a medián OS 17,3 měsíce. Pravděpodobnost jednoletého, dvouletého a tříletého přežití byla 63 %, 48 % a 41 %. Imunitně podmíněné nežádoucí účinky 3. a 4. stupně se vyskytly pouze u 5 % pacientů, nebylo zaznamenáno žádné úmrtí [22,23].
Aktuálně byly publikovány předběžné výsledky klinických studií III. fáze u předléčených i nepředléčených pacientů. Studie CheckMate 037 srovnává nivolumab podávaný v dávce 3 mg/kg i.v. každé 2 týdny oproti chemoterapii (dacarbazin nebo paclitaxel s carboplatinou) u pacientů s progresí po monoterapii ipilimumabem nebo po léčbě kombinací ipilimumabu a inhibitoru BRAF s mutací BRAF V600. Při mediánu sledování 8,4 měsíce byla zaznamenána léčebná odpověď na podávání nivolumabu ve 31,7 %, léčebné odpovědi na chemoterapii bylo docíleno v 10,6 % případů, data týkající se přežití jsou zatím „nezralá“ [24]. Druhá studie III. fáze CheckMate 066 s nivolumabem podávaným v dávce 3 mg/kg intravenózně jednou za 2 týdny oproti léčbě dacarbazinem probíhá u nepředléčených pacientů bez mutace BRAF V600 (první linie léčby). Dle publikovaných výsledků je podobně jako v předchozí studii nivolumab lepší jak z pohledu účinnosti, tak toxicity. Četnost odpovědí představuje 40,0 % vs. 13,9 %, medián PFS 5,1 měsíce vs. 2,2 měsíce (p < 0,001) a jednoleté přežití 72,9 % vs. 42,1 % (p < 0,001) [25].
Pembrolizumab
Pembrolizumab je další lidská monoklonální protilátka IgG4 proti receptoru PD‑1. K dispozici jsou data z klinické studie I. fáze, do které bylo zahrnuto celkem 411 pacientů s pokročilým melanomem – 221 předléčených ipilimumabem (IPI‑T) a 190 nepředléčených (IPI‑N). Pembrolizumab byl podáván ve dvou různých dávkách a intervalech (v dávce 10 mg/kg i.v. jednou za 2 týdny nebo jednou za 3 týdny a v dávce 2 mg/kg i.v. jednou za 3 týdny). Četnost léčebných odpovědí dle kritérií RECIST 1.1 dosáhla ve skupině pacientů označené jako IPI‑T 28 % a ve skupině IPI‑N 40 %. Mediánu OS zatím nebylo docíleno, jednoroční přežití činilo 69 % (74 % v kohortě IPI‑N, 65 % v kohortě IPI‑T). Vážné nežádoucí účinky 3. a 4. stupně byly zaznamenány u 12 % pacientů, bez případu úmrtí [26,27]. Následující analýza expanzivní kohorty IPI‑T pacientů léčených dávkou 2 mg/kg i.v. jednou za 3 týdny ve srovnání s dávkou 10 mg/kg i.v. jednou za 3 týdny (celkem 173 pacientů) ukázala stejnou účinnost obou dávek – četnost odpovědí dosahovala 26 %, profil toxicity byl podobný [28].
Aktuálně probíhá v ČR specifický léčebný program s dávkou 2 mg/kg i.v. jednou za 3 týdny u pacientů s mutací BRAF, u nichž selhala léčba ipilimumabem a inhibitorem BRAF (obr. 4 a 5). Recentně publikované předběžné výsledky studie III. fáze KEYNOTE‑006 srovnávající pembrolizumab 10 mg/kg i.v. podávaný jednou za 2 týdny nebo jednou za 3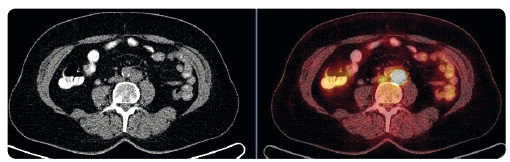 týdny (léčba do progrese onemocnění nebo do projevů závažné toxicity) versus ipilimumab 3 mg/kg i.v. podávaný jednou za 3 týdny (čtyři aplikace) v první a druhé linii léčby u 834 pacientů s pokročilým melanomem poukazují na superioritu protilátky anti‑PD‑1. Jde tak o první přímé srovnání protilátky anti‑CTLA‑4 a anti‑PD‑1. Pembrolizumab zaznamenal signifikantně vyšší četnost léčebných odpovědí (33 % vs. 12 %), lepší šestiměsíční PFS a jednoroční OS při n
týdny (léčba do progrese onemocnění nebo do projevů závažné toxicity) versus ipilimumab 3 mg/kg i.v. podávaný jednou za 3 týdny (čtyři aplikace) v první a druhé linii léčby u 834 pacientů s pokročilým melanomem poukazují na superioritu protilátky anti‑PD‑1. Jde tak o první přímé srovnání protilátky anti‑CTLA‑4 a anti‑PD‑1. Pembrolizumab zaznamenal signifikantně vyšší četnost léčebných odpovědí (33 % vs. 12 %), lepší šestiměsíční PFS a jednoroční OS při n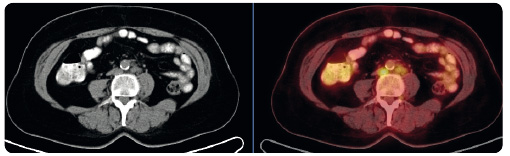 ižším výskytu závažné toxicity [29]. Zajímavá budou jistě „zralá“ data týkající se celkového přežití, nicméně již tyto výsledky budou pravděpodobně důvodem ke schválení pembrolizumabu pro první linii léčby pacientů s pokročilým melanomem.
ižším výskytu závažné toxicity [29]. Zajímavá budou jistě „zralá“ data týkající se celkového přežití, nicméně již tyto výsledky budou pravděpodobně důvodem ke schválení pembrolizumabu pro první linii léčby pacientů s pokročilým melanomem.
Kombinace protilátek anti‑CTLA‑4 a anti‑PD‑1
Dle výsledků klinické studie I. fáze s 53 pacienty byla při podávání kombinace ipilimumabu a nivolumabu prokázána léčebná odpověď u 40 % pacientů, často s výraznou redukcí nádorové masy (až 17 % kompletních remisí), jednoletého a dvouletého přežití bylo dosaženo u 85 % a 79 % pacientů [30,31]. Nedávno byly publikovány výsledky studie II. fáze srovnávající léčbu kombinací nivolumabu a ipilimumabu s monoterapií ipilimumabem u 142 nepředléčených pacientů s pokročilým melanomem, z nichž vyplývá, že u 109 pacientů nebyla mutace BRAF (wtBRAF) detekována a 33 pacientů vykazovalo pozitivitu mutace BRAF. Dle této studie byl v rameni s podáváním kombinace u pacientů ze skupiny wtBRAF zaznamenán vyšší počet odpovědí na léčbu (61 % vs. 11 %), ve 22 % se jednalo o kompletní remisi. Pacienti s mutací genu BRAF měli výsledky podobné. Stejně jako ve studii I. fáze byla v kombinovaném rameni prokázána vyšší četnost závažné toxicity 3. a 4. stupně (54 % vs. 24 %) [32]. Všichni nyní očekávají výsledky klinické studie III. fáze u nepředléčených pacientů s pokročilým melanomem srovnávající monoterapii ipilimumabem a monoterapii nivolumabem s léčbou kombinací těchto léčiv (CheckMate 067).
Aktuální možnosti systémové léčby pokročilého melanomu v ČR
Vemurafenib, dabrafenib a trametinib jsou v EU registrovány pro první a další linii systémové léčby u pacientů s neresekovatelným nebo metastatickým melanomem s pozitivní mutací V600 genu BRAF. V ČR má zatím stanovenu úhradu jen pro první linii léčby vemurafenib a dabrafenib. Ipilimumab je v EU schválen k léčbě pacientů s neresekabilním nebo pokročilým melanomem v první a další linii léčby, bez ohledu na stav mutace BRAF. V ČR je zatím hrazen pouze u předléčených pacientů.
Před zahájením systémové léčby bychom měli znát stav mutace BRAF. Testování na přítomnost mutace c‑KIT a NRAS je zatím diskutabilní, mimo klinické studie není u těchto mutací schválena cílená léčba. U pacientů bez aktivační mutace BRAF V600 léčbu nyní zahajujeme paliativní chemoterapií a ve druhé linii podáváme ipilimumab; pokud dojde k selhání léčby ipilimumabem, máme v současnosti v komplexních onkologických centrech možnost specifického léčebného programu s pembrolizumabem. U pacientů s přítomnou mutací BRAF V600 je možno léčbu zahájit inhibitorem BRAF (vemurafenibem nebo dabrafenibem v monoterapii), při progresi onemocnění je podávána chemoterapie a následně u vybraných pacientů s pomalu progredujícím onemocněním zvažujeme ipilimumab, případně po něm ještě pembrolizumab. Pokud jde o postižení menšího rozsahu, je možné u pacienta s pozitivní mutací BRAF začít podávat chemoterapii s příslibem podání ipilimumabu a následně protilátky anti‑PD‑1. Ve srovnání s cílenou léčbou nabízí imunoterapie větší šanci na dlouhodobou kontrolu onemocnění. Výše uvedený postup je ovlivněn řadou faktorů – celkovým stavem a preferencemi pacienta, rozsahem a symptomy onemocnění, laboratorními ukazateli, aktuálními pravidly úhrady péče a dostupností klinických studií.
Závěr
Léčba pacientů s pokročilým maligním melanomem se v posledních čtyřech letech zásadně změnila. Paliativní chemoterapie je nahrazována účinnější imunoterapií a cílenou léčbou. V oblasti imunoterapie se již standardní léčbou stal ipilimumab, brzy očekáváme příchod nivolumabu a pembrolizumabu. Předběžné výsledky z velkých klinických studií naznačují, že protilátky anti‑PD‑1 budou mít své místo již v první linii léčby. Ze skupiny cílených přípravků dnes standardně používáme inhibitor BRAF vemurafenib nebo dabrafenib v monoterapii. Velké naděje jsou nyní vkládány do lékových kombinací (protilátky anti‑CTLA‑4 s protilátkami anti‑PD‑1, inhibitory BRAF s inhibitory MEK).
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Seznam použité literatury
- [1] Dusek L, Muzik J, Kubasek M, et al. Epidemiology of malignant tumours in the Czech Republic [online]. Masaryk University, Brno (Czech Republic) 2005. Dostupné na: http://www.svod.cz/?sec=analyzy Navštíveno 4. 5. 2015.
- [2] Balch C, Gershenwald J, Soong S, et al. Final version of 2009 AJCC Melanoma Staging and Classification. J Clin Oncol 2009; 27: 6199–6206.
- [3] Chapman PB, Hauschild A, Robert C, et al. BRIM 3 Study Group. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011; 364: 2507–2516.
- [4] McArthur GA, Chapman PB, Robert C, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation positive melanoma (BRIM 3): extended follow up of a phase 3, randomised, open label study. Lancet Oncol 2014; 15: 323–332.
- [5] Larkin J, Del Vecchio M, Ascierto PA, et al. Vemurafenib in patients with BRAF(V600) mutated metastatic melanoma: an open label, multicentre, safety study. Lancet Oncol 2014; 15: 436–444.
- [6] Hauschild A, Grob J, Demidov L, et al. An update on BREAK 3, a phase III, randomized trial: Dabrafenib (DAB) versus dacarbazine (DTIC) in patients with BRAF V600E positive mutation metastatic melanoma (MM). J Clin Oncol 2013; 31 (Suppl.): abstract 9013. Dostupné na: http://meetinglibrary.asco.org/content/110742 132. Navštíveno 4. 5. 2015.
- [7] Long GV, Trefzer U, Davies MA, et al. Dabrafenib in patients with Val600Glu or Val600Lys BRAF mutant melanoma metastatic to the brain (BREAK MB): a multicentre, open label, phase 2 trial. Lancet Oncol 2012; 13: 1087–1095.
- [8] Flaherty KT, Robert C, Hersey P, et al. METRIC Study Group. Improved survival with MEK inhibition in BRAF mutated melanoma. N Engl J Med 2012; 367: 107–114.
- [9] Ascierto PA, Schadendorf D, Berking C, et al. MEK162 for patients with advanced melanoma harbouring NRAS or Val600 BRAF mutations: a non randomised, open label phase 2 study. Lancet Oncol 2013; 14: 249–256.
- [10] Flaherty KT, Infante JR, Daud A, et al. Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N Engl J Med 2012; 367: 1694–1703.
- [11] Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014; 371: 1877–1888.
- [12] Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372: 30–39.
- [13] Larkin J, Ascierto PA, Dréno B, et al. Combined vemurafenib and cobimetinib in BRAF mutated melanoma. N Engl J Med 2014; 371: 1867–1876.
- [14] Curtin JA, Busam K, Pinkel D, et al. Somatic activation of KIT in distinct subtypes of melanoma. Clin Oncol 2006; 24: 4340–4346.
- [15] Guo J, Si L, Kong Y, et al. Phase II, open label, single arm trial of imatinib mesylate in patients with metastatic melanoma harboring c Kit mutation or amplification. J Clin Oncol 2011; 29: 2904–2909.
- [16] Hodi FS, Corless CL, Giobbie Hurder A, et al. Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun damaged skin. J Clin Oncol 2013; 31: 3182–3190.
- [17] Carvajal RD, Lawrence DP, Weber J, et al. Phase II Study of Nilotinib in Melanoma Harboring KIT Alterations Following Progression to Prior KIT Inhibition. Clin Cancer Res 2015; 21: 2289–2296.
- [18] Hodi FS, O´Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711–723.
- [19] Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011; 364: 2517–2526.
- [20] Schadendorf D, Hodi FS, Robert C, et al. Pooled Analysis of Long Term Survival Data From Phase II and Phase III Trials of Ipilimumab in Unresectable or Metastatic Melanoma. J Clin Oncol 2015; 33: 1889–1894.
- [21] Ribas A, Hodi F, Callahan M, et al. Hepatotoxicity with combination of vemurafenib and ipilimumab. N Engl J Med 2013; 368: 1365–1366.
- [22] Topalian S, Sznol M, McDermott D, et al. Survival, durable tumor remission, and long term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32: 1020–1030.
- [23] Hodi FS, Sznol M, Kluger HM, et al. Long term survival of ipilimumab naive patients (pts) with advanced melanoma (MEL) treated with nivolumab (anti PD 1, BMS 936558, ONO 4538) in a phase I trial. J Clin Oncol 2014; 32:(suppl; abstr 9002). Dostupné na: http://meeting.ascopubs.org/cgi/content/abstract/32/15_suppl/9002 Navštíveno 4. 5. 2015.
- [24] Weber JS, D‘Angelo SP, Minor D, et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti CTLA 4 treatment (CheckMate 037): a randomised, controlled, open label, phase 3 trial. Lancet Oncol 2015; 16: 375–384.
- [25] Robert C, Long GV, Brady B, et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320–330.
- [26] Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (Anti PD 1) in melanoma. N Engl J Med 2013; 369: 134–144.
- [27] Ribas A, Hodi FS, Kefford R, et al. Efficacy and safety of the anti PD 1 monoclonal antibody MK 3475 in 411 patients (pts) with melanoma (MEL). J Clin Oncol 2014; 32: (suppl; abstr LBA9000^). Dostupné na: http://meeting.ascopubs.org/cgi/content/abstract/32/18_suppl/LBA9000?sid=717d611e 96f2 4423 b166 11c12725a9af Navštíveno 4. 5. 2015.
- [28] Robert C, Ribas A, Wolchok JD, et al. Anti programmed death receptor 1 treatment with pembrolizumab in ipilimumab refractory advanced melanoma: a randomised dose comparison cohort of a phase 1 trial. Lancet 2014; 384: 1109–1117.
- [29] Robert C, Schachter J, Long GV, et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015; Apr 19; Dostupné na: http://dx.doi.org/10.1056/NEJMoa1503093 Navštíveno 4. 5. 2015.
- [30] Wolchok JD, Kluger H, Callahan MK, et al. Nivolumab plus ipilimumab in advanced melanoma. N Engl J Med 2013; 369: 122–133.
- [31] Sznol M, Kluger HM, Callahan MK, et al. Survival, response duration, and activity by BRAF mutation (MT) status of nivolumab (NIVO, anti PD 1, BMS 936558, ONO 4538) and ipilimumab (IPI) concurrent therapy in advanced melanoma (MEL). J Clin Oncol 2014; 32: (suppl; abstr LBA9003^). Dostupné na: http://meeting.ascopubs.org/cgi/content/abstract/32/18_suppl/LBA9003?sid=96f27b34 e1a8 4ea7 8851 21476aa16fcf Navštíveno 4. 5. 2015.
- [32] Postow MA, Chesney J, Pavlick AC, et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 2015; 372: 2006–2017.