Management vybraných symptomů v onkologické paliativní péči
Souhrn:
Nádorová anorexie a kachexie je multiorgánový, multifaktoriální a často ireverezibilní syndrom postihující mnoho pacientů s nádory. Nádorová kachexie je charakterizována poklesem tělesné hmotnosti, hlavně ztrátou svalové hmoty a tukové tkáně, vedoucí ke zhoršení kvality života. Léčebné možnosti nádorové kachexie jsou omezené. Přístup je multimodální a zahrnuje léčbu sekundárních gastrointestinálních symptomů, nutriční podporu, léky a nefarmakologické postupy. Nutriční poradenství a fyzická aktivita jsou vhodné k oddálení nebo k prevenci rozvoje anorexie a kachexie. Nicméně tyto postupy jsou z hlediska účinnosti omezené a neexistuje lék, který by zcela potlačil jednotlivé komponenty syndromu. V tomto přehledu je nastíněna patofyziologie syndromu anorexie a kachexie, možnosti a efektivita léčby.
Key words: anorexia – cachexia – inflammation – pathophysiology – therapy − palliative care.
Summary:
Cancer cachexia is a multi‑organ, multifactorial and often irreversible syndrome affecting many patients with cancer. Cancer cachexia is invariably associated with weight loss, mainly from loss of skeletal muscle and body fat, conditioning a reduced quality of life. Treatment options for treating cancer cachexia are limited. The approach is multimodal and may include: treatment of secondary gastrointestinal symptoms, nutritional treatments, drug, and non‑drug treatments. Nutritional counselling and physical training may be beneficial in delaying or preventing the development of anorexia‑cachexia. However, these interventions are limited in their effect, and no definitive pharmacological treatment is available to address the relevant components of the syndrome. In this review we examine the pathophysiology of cancer anorexia cachexia syndrome and potential therapeutic options and their effectivity.
Syndrom nádorové anorexie a kachexie
Nádorová anorexie a kachexie je multifaktoriální syndrom (SNAK, syndrom nádorové anorexie a kachexie) charakterizovaný nedobrovolnou ztrátou tělesné hmotnosti vedoucí k progresivnímu zhoršení funkčního stavu, který není zpravidla odstranitelný pouze konvenční nutriční podporou [1]. Nádorová anorexie a kachexie komplikuje protinádorovou léčbu a její intenzitu, snižuje kvalitu života a celkové přežití. Přibližně 25−30 % onkologických pacientů umírá v souvislosti s kachexií, nikoliv na progresi nebo komplikace nádorového onemocnění.
Incidence je nejvyšší u nádorů horní části gastrointestinálního traktu (jícen, žaludek, pankreas), nádorů v oblasti hlavy a krku a u karcinomu plic. Obecně je SNAK přítomen u 70−90 % pacientů s pokročilými nádory. Anorexie a kachexie patří spolu s únavou, nevolností, dušností, bolestí, polymorbiditou a špatným stavem výkonnosti mezi nezávislé negativní prognostické faktory [2].
Patofyziologie
Anorexie a kachexie je
charakterizována proinflamatorním stavem s komplexními
změnami metabolismu (inzulinová a ghrelinová rezistence) se
zvýšenou proteolýzou a lipolýzou, snížením jejich
syntézy, které vedou ke ztrátě svalové a tukové
tkáně. Rozvíjí se i přes kalorickou suplementaci a často
je zvýše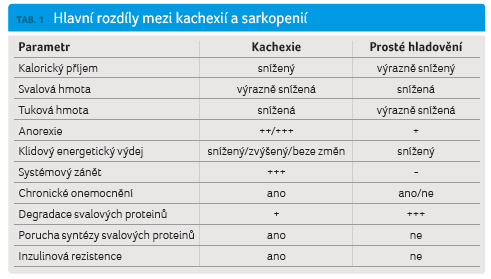 n klidový energetický výdej. Hlavní rozdíly mezi
kachexií a prostým hladověním jsou přiblíženy v tabulce 1.
n klidový energetický výdej. Hlavní rozdíly mezi
kachexií a prostým hladověním jsou přiblíženy v tabulce 1.
Primární anorexie a kachexie vzniká působením nádoru a jeho produktů s aktivací imunitního systému pacienta (proinflamatorní stav). U pacientů s nádory může být anorexie a kachexie kombinována s hladověním, pokud jsou přítomny příčiny (nutritional impact symptoms, NIS) vedoucí ke sníženému příjmu výživy − časná sytost, nevolnost, zvracení, dysfagie, dysgeuzie, průjmy, zácpa, mukozitida, xerostomie, bolest, dušnost, úzkost, deprese, střevní obstrukce (sekundární anorexie a kachexie) [3].
Dělení na primární a sekundární anorexii a kachexii je užitečné pro základní klinické zhodnocení a léčebnou rozvahu, například časná sytost může být vyvolána anorexigenním působením cytokinů, autonomní dysfunkcí (gastroparéza), organomegalií (jaterní metastázy) a těžkou zácpou.
Patofyziologie anorexie a kachexie
je komplexní a v popředí je vystupňovaná
proinflamatorní reakce organismu zprostředkovaná cytokiny
(interleukiny − IL 1, IL 6, tumor nekrotizující
faktor alfa − TNFα, interferon gama − IFNγ),
dysfunkce endokrinní a autonomního nervového systému, NIS
a specifické nádorové faktory, tj. lipidy mobilizující
faktor (LMF) a proteolýzu indukující faktor (PIF) [4], obrázek 1. Hlavní místa dysregulace se nacházejí na centrální
úrovni (hypotalamus) a na periferní úrovni (svaly
a tuková tkáň) [5]. I přes multifaktoriální etiologii
je proinflamatorní reakce na chronické onemocnění
dominujícím mechanismem se škodlivým vlivem na buněčný
metabolismus, proteosyntézu, endokrinní homeostázu a autonomní
nervový systém [6].![OBR. 1 komplexní patofyziologie syndromu nádorové anorexie a kachexie; podle [4] − del Fabbro, et al., 2014. iFnγ – interferon gama; il‑6 – interleukin 6; lMF – lipidy mobilizující faktor; piF – proteolýzu indukující faktor; TnFα – tumor nekrotizující faktor alfa * Snížená chuť k jídlu, nauzea, časná sytost a dysgeuzie.](https://www.remedia.cz/photo-a-31230---.jpg)
Svalová tkáň je zvýšeně degradována ubikvitin proteazomovým systémem (vliv IL 6) a sníženě syntetizována inhibicí nukleárního transkripčního faktoru MyoD (vliv TNFα, IFNγ) [7]. Lipolýza je zvýšena vlivem cytokinů působících na různé druhy lipáz (adipose triglyceride lipase, ATL).
Výše zmíněné PIF a LMF jsou faktory produkované nádorovými buňkami a hrají důležitou roli v rozvoji syndromu. Proteolýzu indukující faktor ovlivňuje koncentrace ionizovaného intracelulárního kalcia ve svalech a signální cesty vedoucí ke snížení proteosyntézy a ke zvýšení proteinové degradace. Lipidy mobilizující faktor přímo ovlivňuje adipocyty a vyvolává uvolnění volných mastných kyselin a glycerolu do krevního oběhu, zvyšuje senzitivitu k lipolytickým stimulům a indukuje hydrolýzu triglyceridů v adipocytech.
Zvýšená produkce cytokinů v hypotalamu podporuje produkci anorexigenních působků (melanocyty stimulující hormon – MSH, proopiomelanokortin − POMC) a snižuje produkci působků orexigenních (agouti related protein – AGRP, neuropeptid Y − NPY). Experimentální zvýšení koncentrací NPY a blokáda melanokortinového systému vedly k prevenci kachexie. Neuropeptidy a centrální řízení příjmu potravy představují v současnosti jeden z hlavních směrů výzkumu v oblasti SNAK, jedná se o základní mechanismus řízení pocitu hladu a sytosti, který může při pozitivním ovlivnění znamenat revoluci v léčbě anorexie.
Vliv na syntézu cytokinů mají periferně produkovaný anorexigenní leptin (tuková tkáň) a orexigenní ghrelin (žaludek) [8]. Cytokiny mohou působit také cestou časné sytosti (IL 1) nebo deprese (IL 6) [9].
Patofyziologický podíl má také dysfunkce autonomního nervového systému (zvýšená aktivita sympatiku a snížená aktivita parasympatiku), která prohlubuje proinflamatorní stav a kachektizaci [10]. Cytokiny podporují katabolismus a omezují anabolismus zvýšenou rezistencí k inzulinu, ghrelinu, androgenům, zvýšenou produkcí volných kyslíkových radikálů, proteinů akutní fáze a zvýšeným klidovým energetickým výdejem.
Ghrelin je orexigenní peptid produkovaný žaludeční sliznicí, zvyšuje motilitu GIT a působí protiinflamatorně. Jeho koncentrace inverzně koreluje s indexem tělesné hmotnosti (BMI), je vysoká u kalorické restrikce a nádorové kachexie [11]. V hypotalamu snižuje expresi anorexigenního POMC/CART (kokainem a amfetaminem regulovaný transkript) a zvyšuje expresi orexigenního NPY/AGRP. Ghrelin snižuje expresi receptoru pro IL 1, inhibuje produkci proinflamatorních cytokinů (IL 1α, IL 6, TNF) a zvyšuje produkci antiinflamatorního IL 10. V játrech zvyšuje syntézu inzulinu podobného růstového faktoru 1 (IGF 1), což zvyšuje ochranu a tvorbu svalové hmoty, a v mozku stimuluje lipogenní syntetické cesty.
Androgeny mají přímý účinek na růst svalové hmoty, nepřímo fungují cestou antiglukokortikoidní a vlivem na růstový hormon/IGF 1. U pacientů s nízkými sérovými koncentracemi testosteronu dochází k většímu úbytku tělesné hmotnosti, nemocní přežívají kratší dobu, mají horší kvalitu života a trpí větší únavou [12].
Inzulin vykazuje periferní anabolický efekt na svaly a tuk. Zvýšené sérové koncentrace inzulinu vedou ke snížení svalové degradace cestou ubikvitin/proteazomového komplexu [13]. Syndrom nádorové anorexie a kachexie je spojen s inzulinovou rezistencí a aplikace inzulinu vede ke zlepšení přežití a kvality života [14].
Všechny patofyziologické mechanismy mohou být cílem léčebného ovlivnění. Relativně vyšší úspěšnost mají multimodální intervence zasahující na více úrovních [15].
Diagnostika a klasifikace
Předpokladem úspěšné léčby kachexie je její včasné zjištění; stupeň kachexie přímo koreluje s přežitím. Rozvinutá kachexie je rezistentní k léčebným intervencím. Základní diagnostický ukazatel představuje ztráta více než 5 % tělesné hmotnosti v posledních 6 měsících bez zjevné přítomnosti prostého hladovění. Kachexii dělíme na prekachexii, kachexii a refrakterní kachexii. Prekachexii charakterizují anorexie, porucha glukózové tolerance, elevace C reaktivního proteinu (CRP) a ztráta hmotnosti nepřesahující 5 %. Kachexie je definována ztrátou více než 5 % tělesné hmotnosti (> 2 % u BMI < 20 kg/m2). Pacienti s refrakterní kachexií vykazují těžce poškozený stav výkonnosti (performance status dle škály ECOG 3−4) a rezistenci ke komplexním léčebným intervencím [3].
Základem je fyzikální vyšetření se zhodnocením hmotnosti a tělesné stavby (obezita, svalová hmota), anamnéza zaměřená na množství, složení stravy, důvody možného omezení příjmu a detekce komorbidních metabolických abnormalit (hypogonadismus, hypotyreóza, deficit vitaminu B12 a D).
V klinickém vyšetření přináší největší obtíže určení tělesné kompozice. Pacienti se stejným BMI mohou mít velice odlišné poměry mezi svaly a tukovou tkání. Hodnocení je tak vždy orientační a poslouží hlavně k odhadu trendů vývoje. Nejjednodušší je stanovení svalové plochy ve středu paže. Bioimpedanční analýza, duální rentgenové měření absorpce (dual energy X ray absorptiometry, DEXA) nebo výpočetní tomografie (CT) se využívají spíše v klinických studiích.
Energetickou potřebu většinou odhadujeme na 30−35 kcal/kg tělesné hmotnosti denně. Kalorimetrii nebo Harrisovu–Benedictovu rovnici využíváme spíše ve výzkumu. Pro zhodnocení metabolických abnormalit poslouží základní vyšetření (hodnoty testosteronu, TSH, vitaminu B12 a D, CRP, albuminu, prealbuminu, hemoglobinu, hematokritu, leukocytů, fibrinogenu). Hodnocení CRP je u pacientů s pokročilými malignitami problematické, protože jeho hodnota je zvýšená nezávisle na přítomnosti kachexie.
Management
Vzhledem k multifaktoriální patofyziologii musí být efektivní intervence vždy komplexní s multimodálními farmakologickými (tab. 2) a nefarmakologickými postupy, individualizovaná pro každého pacienta [16]. Z hlediska farmakoterapie se jedná o léky na zlepšení chuti k jídlu, antiinflamatorní léky, hormony, inzulin a další. Ze systematického přehledu studií farmakoterapie SNAK mají pouze kortikoidy a progestageny dostatečnou podporu dat o účinnosti, ostatní skupiny mají data kontroverzní, slabá nebo negativní [17]. Studie, které zahrnovaly intervence na více úrovních, prokázaly efekt na zlepšení chuti k jídlu, výkonnosti, spontánní fyzické aktivity a svalové hmoty [18]. Ve vstupní rozvaze musíme brát vždy v potaz ovlivnitelnost a prognózu nádorového onemocnění a aktuální celkový klinický a funkční stav pacienta (cíle péče). U pacientů stabilních, funkčně lehce omezených a s prognózou přežití delší než 2−3 měsíce je smysluplná komplexní nutriční intervence (kalorický příjem, cvičení, antiinflamatorní léčba a chuťová korigencia). Pro pacienty ležící, s progredujícím onemocněním a s výhledem 2−3 měsíců života je vhodná kvalitní symptomatická léčba a podávání kortikoidů.
Základní součástí managementu SNAK
jsou záchyt a léčba sekundárních příčin a metabolických
abnormalit, nutriční intervence, chuťová stimulancia
a antiinflamatorní léčba (obr. 2).![OBR. 2 Multimodální management léčby anorexie a kachexie; podle [4] − del Fabbro, et al., 2014.](https://www.remedia.cz/photo-a-31231---.jpg)
Léčba sekundárních příčin a metabolických abnormalit
Hlavní příčiny sníženého příjmu stravy souvisejí s komplikacemi v oblasti sliznic dutiny ústní a jícnu (radioterapie, chemoterapie), časté jsou nevolnost, zvracení, dysfagie (tumory, mukozitida), zácpa, průjem, časná sytost, dušnost a dysgeuzie.
Časná sytost je nejčastěji řešena prokinetiky, metoklopramid v dávce 10 mg podávaný 4−6× denně představuje obvyklou a účinnou terapii. Časná sytost souvisí s celkovým stavem, prohlubuje se u ležících pacientů, při zácpě a autonomní dysfunkci.
Depresivita může být opomíjenou příčinou sníženého příjmu potravy. Optimální antidepresiva představují mirtazapin a olanzapin, jež mají i vlastní antiemetické účinky. Mirtazapin navíc cestou agonismu receptorů 5 HT4 podporuje žaludeční vyprazdňování [19].
U pacientů s těžkou dysgeuzií můžeme zkusit terapeutický experiment se zinkem, studie se u různých populací neshodují, ale jedná se o dobře tolerovanou a netoxickou léčbu.
Inzulin má periferní anabolický efekt, zvláště v tukové tkáni. Obvyklá počáteční dávka je 4 IU dlouhodobého inzulinu aplikovaná jednou denně se zvyšováním po 2 IU/den do obvyklé dávky 10−16 IU/den [14].
Nízká koncentrace testosteronu je spojena se sníženou chutí k jídlu a s přežitím. Zatím neproběhly randomizované klinické studie se zevní aplikací testosteronu a jeho analog [20]. Nesteroidní selektivní modulátory androgenního receptoru enobosarm a oxandrolon jsou charakterizované vysokou anabolickou aktivitou s minimem nežádoucích androgenních účinků na jiné orgány. Randomizované studie fáze II prokázaly zvýšení netučné tělesné hmotnosti, fyzické aktivity, výkonnosti a chuti k jídlu po jejich podávání u pacientů s pokročilými malignitami. Použití anabolik přináší optimální výsledky, pokud se zachová základní tělesná aktivita [21].
Část pacientů se SNAK má zvýšený metabolický výdej a tonus sympatiku. Proběhly pouze malé nerandomizované studie s použitím betablokátorů s pozitivním efektem na kachexii, výsledky je nutné potvrdit randomizovanými studiemi [22].
Úprava životního stylu
Fyzická aktivita prokazuje dle Cochranovy databáze jasný přínos ve zmírnění únavy u onkologických pacientů, zlepšuje kvalitu života, spánek a zvyšuje pocit hladu. Fyzická aktivita by měla být součástí komplexního přístupu u pacientů v paliativní péči. Forma odpovídá stavu a prognóze pacientů, u pacientů v dobrém stavu můžeme doporučit lehké formy aerobního cvičení, jinak postačí běžné procházky. U pacientů špatně pohyblivých nebo ležících jsou vhodné formy protahování a aktivního nebo pasivního cvičení na lůžku.
Nutriční poradenství a podpora
Kalorický příjem sám o sobě nezlepší svalovou hmotu a fyzickou aktivitu, toho se podaří dosáhnout pouze spolu s dalšími součástmi managementu SNAK [23]. Většina pacientů má tendenci nadhodnocovat svůj kalorický příjem a kvalitu složení stravy. Průměrný kalorický příjem onkologických pacientů stanovujeme přibližně na 30−35 kcal/kg t.hm./den. Strava by měla být výrazně bílkovinná, doporučuje se 1,5−2 g/kg t.hm./den, kombinujeme živočisné a rostlinné bílkoviny.
Ideální je komplexní vyšetření nutričním terapeutem, který zhodnotí podle deníku stravy její kalorickou hodnotu a složení a doporučí optimalizaci. Množství a složení stravy musí zohledňovat specifické situace onkologických pacientů (dysfagie, střevní obstrukce, průjmy, zácpa). Při nedostatku kalorií a bílkovin v běžné stravě je nejvhodnější jejich doplnění pomocí tekutých perorálních nutričních doplňků (specific oral nutritional supplement, SONS, tzv. sipping).
Chuťová stimulancia
Progestageny (megestrol acetát, medroxyprogesteron) mají potvrzený účinek na zlepšení chuti k jídlu, tělesné hmotnosti, zmírnění únavy a nevolnosti. Výsledky potvrdila celá řada klinických studií, jejich systematických přehledů a Cochranovy metaanalýzy [24−26]. Počáteční dávka megestrol acetátu je 160 mg/den s postupnou titrací do 800 mg/den. Obvyklá účinná dávka, při které je dosaženo optimálního poměru přínosu a rizik, je 480 mg/den. Mezi nejčastější nežádoucí účinky patří hypertenze, hyperglykemie, tromboembolismus, otoky, hypogonadismus a hypokortikalismus.
Kortikoidy mohou stimulovat chuť k jídlu, mírnit nauzeu, únavu, slabost a zlepšovat celkový pocit (well being) v horizontu několika týdnů. Jejich efekt je zprostředkován supresí inflamatorních působků a přímým vlivem na chuťové centrum v hypotalamu. Vzhledem k přechodnému efektu a nežádoucím účinkům (hypertenze, hyperglykemie, myopatie, imunosuprese, retence tekutin) by jejich podávání v této indikaci mělo být limitováno na pacienty s délkou přežití 6−8 týdnů. Jejich použití je vhodné u pacientů s dalšími symptomy, které mohou být kortikoidy zmírněny (bolest, nevolnost, slabost, únava, obstrukce GIT). Dále je volba kortikoidů vhodná při kontraindikaci progestagenů (tromboembolismus), protože podle klinických studií je účinek obou skupin srovnatelný z hlediska orexigenního [27]. Obvyklá denní dávka je 4−8 mg dexametazonu nebo jeho ekvivalentu.
Anamorelin je perorální agonista ghrelinového receptoru, vyvolává neuroendokrinní a antiinflamatorní účinky jako ghrelin s pozitivním vlivem na chuť k jídlu a metabolismus, vede ke zvýšení tělesné hmotnosti a svalové hmoty. Ve studiích ROMANA 1 a 2 vedlo 12týdenní užívání anamorelinu k signifikantnímu zvýšení netukové a celkové tělesné hmotnosti a ke zlepšení funkčního stavu, zatímco při podávání placeba došlo k jejich poklesu, rozdíl v síle stisku ruky nebyl signifikantní [28]. Studie ROMANA 3 byla extenzí původních studií a zkoumala efekt a toleranci přidání dalších 12 týdnů terapie anamorelinem. Došlo k dalšímu signifikantnímu zvýšení tělesné hmotnosti a ke zmírnění symptomů SNAK bez vlivu na sílu stisku ruky u pacientů užívajících anamorelin [29].
Dronabinol, syntetický kanabinoid, je registrován k léčbě anorexie u AIDS a chemoterapií indukované nevolnosti a zvracení. Velká multicentrická studie u pacientů s nádory a anorexií neprokázala jeho přínos oproti placebu ke zlepšení parametrů SNAK [30].
Antiinflamatorní léčba
Nesteroidní protizánětlivé léky (NSAID) jsou často studovány spolu s dalšími komponentami multimodálního přístupu k anorexii a kachexii. Prospektivní randomizovaná studie s ibuprofenem (1 200 mg/den) a megestrolem prokázala zvýšení svalové hmoty a zlepšení kvality života oproti samotnému megestrolu [31]. Studie se selektivním inhibitorem cyklooxygenázy 2 (COX 2) celekoxibem prokázaly zvýšení čisté tělesné hmotnosti, síly stisku ruky, kvality života, výkonnostního stavu, zvýšení prognostického skóre dle Glasgowské škály a snížení koncentrací TNFα. Zatím chybějí prospektivní studie fáze III k potvrzení výsledků [32]. Podávání ibuprofenu nebo indometacinu spolu s chuťovými korigencii představuje současný standard managementu SNAK. Efekt terapie hodnotíme po 3−4 týdnech, v případě pozitivního vlivu v léčbě pokračujeme. Pokud nedochází ke kýženému efektu, zvýšíme dávky léků na maximum a opět zhodnotíme za 3−4 týdny.
Talidomid má imunomodulační a protiinflamatorní účinky, snižuje koncentrace cytokinů (TNFα, IL 6), inhibuje aktivaci NFkB, blokuje COX 2 a prostaglandin E2. Jeho podávání může zmírňovat celou řadu symptomů (nechutenství, nevolnost, nespavost, svědění). Časné studie přinesly nadějné výsledky [33], které se nepotvrdily v systematickém přehledu randomizovaných studií [34].
Eikosapentaenová kyselina patří mezi polynenasycené mastné kyseliny (PUFA) s dlouhým řetězcem (n 3). Její účinky jsou v experimentu a v klinické praxi protizánětlivé. Randomizované studie a jejich systematické přehledy přinesly rozporuplné výsledky a v současnosti je nedostatečná podpora užití EPA v managementu kachexie pacientů s nádory [35,36]. Pro pacienty s protinádorovou léčbou, byť s paliativním záměrem, může být přínosné souběžné podávání EPA z hlediska zvýšení tělesné hmotnosti a svalové hmoty [37]. Doporučuje se dávka EPA 1,5−2 g/den ve formě kapslí nebo obohacených SONS.
Léky ve výzkumu
Vzhledem k patofyziologii SNAK je budoucností terapie cílená na neuropeptidy, systémovou zánětlivou reakci organismu a cytokiny.
Jedním ze zkoumaných léků je melatonin, který v menších studiích prokázal přínos v parametrech zlepšení chuti k jídlu s minimem nežádoucích účinků, placebové studie však chybějí. Pacienti s metastatickými nádory léčení symptomaticky měli po třech měsících léčby melatoninem menší hmotnostní úbytek, méně deprese a lepší stav výkonnosti. V další studii vykazovali pacienti s terapií melatoninem méně kachexie, slabosti, anorexie a deprese [38].
Monoklonální protilátky proti IL 1 a IL 6 prokázaly určitý možný přínos v předchozích malých studiích. Velké placebem kontrolované studie s etanerceptem a infliximabem, protilátkami proti TNF, nepotvrdily zlepšení chuti k jídlu, zvýšení tělesné hmotnosti, zlepšení kvality života a přežití u pacientů s nádory [39,40]. Vysvětlení je takové, že komplexnost patofyziologie vyžaduje zásah na více úrovních a úspěšné jsou pouze intervence kombinující více modalit.
Kachexie na konci života
Pacienti v závěru života ve většině případů trpí progresivní ztrátou tělesné hmotnosti, výraznou anorexií a dalšími symptomy pokročilého nádorového onemocnění. Právě kachexie a nízký příjem stravy patří mezi nejvíce stresující situace pro pacienta a jeho blízké [41]. Rodina a blízcí pacienta jsou často frustrováni neúspěchem ve snaze zvýšit perorální příjem, který dávají do přímé souvislosti s urychleným umíráním. Je potřeba klidně a empaticky vysvětlit, že ztráta chuti k jídlu a malý perorální příjem jsou důsledkem nemoci, nikoliv přičinou pacientova zhoršení. Vysvětlit, že nejlepší je pro pacienta příjem dle chuti, a to v množství i druhu a složení stravy. Naopak, že snaha o maximální příjem stravy vede k nevolnosti, zvracení, bolestem břicha a nevede ke zvratu kachektizace. Komunikačně se jedná o jednu z nejnáročnějších fází paliativní péče a péče o pacienty na konci života. Vyžaduje klid, rozvahu, empatii a opakované ujišťování o správnosti péče.
Shrnutí managementu SNAK
Syndrom nádorové anorexie a kachexie je multifaktoriální ve své patofyziologii, účinná léčba musí být vždy komplexní. Zahrnuje řešení sekundárních příčin sníženého příjmu stravy, nutriční poradenství, cvičení, chuťová korigencia a antiinflamatorní léčbu. Jediné léky s potvrzeným účinkem na SNAK jsou progestageny a kortikoidy. Z novějších přípravků získal dobrá data ze studií anamorelin, agonista ghrelinu. Antiinflamatorní léčbu realizujeme nesteroidními antiflogistiky (ibuprofen, indometacin). Základem účinného řešení SNAK je jeho prevence, včasný záchyt a intervence. V terminálních fázích nádorového onemocnění se orientujeme na dobrou symptomatickou léčbu, kortikoidy a komplexní paliativní péči.
Seznam použité literatury
- [1] Fearon K, Strasser F, Anker SD, et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011; 12: 489−495.
- [2] Hauser CA, Stockler MR, Tattersall MH. Prognostic factors in patients with recently diagnosed incurable cancer: a systematic review. Support Care Cancer 2006; 14: 999−1011.
- [3] Del Fabbro E, Hui D, Dalal S, et al. Clinical outcomes and contributors to weight loss in a cancer cachexia clinic. J Palliat Med 2011; 14: 1004−1008.
- [4] Del Fabbro E. Anorexia/Weight Loss. In: Berger AM, Shuster JL, Von Roenn JH, eds. Principles and Practice of Palliative Care and Supportive Oncology, 4th ed. Lippincot Williams and Wilkins 2014, 123−141.
- [5] Braun TP, Marks DL. Pathophysiology and treatment of inflammatory anorexia in chronic disease. J Cachex Sarcopenia Muscle 2010; 1: 135−145.
- [6] Andersson U, Tracey KJ. Neural reflexes in inflammation and immunity. J Exp Med 2012; 209: 1057−1068.
- [7] Chamberlain JS. Cachexia in cancer – zeroing in on myosin. N Engl J Med 2004; 114: 2124−2125.
- [8] Kalra SP, Ueno N, Kalra PS. Stimulation of appetite by ghrelin is regulated by leptin restraint: Peripheral and central sites of action. J Nutr 2005; 135: 1331−1335.
- [9] Inui A. Cancer anorexia‑cachexia syndrome: current issues in research and management. CA Cancer J Clin 2002; 52: 72−91.
- [10] Straub RH, Cutolo M, Buttgereit F, Pongratz G. Energy regulation and neuroendocrine‑immune control in chronic inflammatory diseases. J Intern Med 2010; 267: 543−560.
- [11] Wren AM, Seal LJ, Cohen MA, et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab 2001; 86: 5992.
- [12] Del Fabbro E, Hui D, Nooruddin ZI, et al. Associations among hypogonadism, C‑reactive protein, symptom burden, and survival in male cancer patients with cachexia: A preliminary report. J Pain Symptom Manage 2010; 39: 1016−1024.
- [13] Honors MA, Kinzig KP. The role of insulin resistance in the development of muscle wasting during cancer cachexia. J Cachexia Sarcopenia Muscle 2012; 3: 5−11.
- [14] Lundholm K, Korner U, Gunnebo L, et al. Insulin treatment in cancer cachexia: Effects on survival, metabolism, and physical functioning. Clin Cancer Res 2007; 13: 2699.
- [15] Tisdale MJ. Mechanisms of cancer cachexia. Physiol Rev 2009; 89: 381−410.
- [16] Del Fabbro E. More is better: a multimodality approach to cancer cachexia. Oncologist 2010; 15: 119−121.
- [17] Yavuzsen T, Davis MP, Walsh D, et al. Systematic review of the treatment of cancer‑associated anorexia and weight loss. J Clin Oncol 2005; 23: 8500−8511.
- [18] Mantovani G, Maccio A, Madeddu C, et al. Randomized phase III clinical trial of five different arms of treatment in 332 patients with cancer cachexia. Oncologist 2010; 15: 200−211.
- [19] Kast RE, Foley KF. Cancer chemotherapy and cachexia: mirtazapine and olanzapine are 5‑HT3 antagonists with good antinausea effects. Eur J Cancer Care 2007; 16: 351−354.
- [20] Garcia JM, Li H, Mann D, et al. Hypogonadism in male patients with cancer. Cancer 2006; 106: 2583−2591.
- [21] Dobs AS, Boccia RV, Croot CC, at al. Effects of enobosarm on muscle wasting and physical function in patients with cancer: a double‑blind, randomized controlled phase 2 trial. Lancet Oncol 2013; 14: 335−345.
- [22] Hyltander A, Daneryd P, Sandstrom R, et al. Beta‑adrenoceptor activity and resting energy metabolism in weight losing cancer patients. Eur J Cancer 2000; 36: 330−334.
- [23] Baldwin C, Spiro A, Ahern R, Emery PW. Oral nutritional interventions in malnourished patients with cancer: A systematic review and meta‑analysis. J Natl Cancer Inst 2012; 104: 371−385.
- [24] Berenstein EG, Ortiz Z. Megestrol acetate for the treatment of anorexia‑cachexia syndrome. Cochrane Database Syst Rev 2005; (2): CD004310.
- [25] Maltoni M, Nanni O, Scarpi E, et al. High‑dose progestins for the treatment of cancer anorexia‑cachexia syndrome: a systematic review of randomized clinical trials. Ann Oncol 2001; 12: 289−300.
- [26] Pascual Lopez A, Roque i Figuls M, Urrutia Cuchi G, et al. Systematic review of megestrol acetate in the treatment of anorexia‑cachexia syndrome. J Pain Symptom Manage 2004; 27: 360−369.
- [27] Loprinzi CL, Kugler JW, Sloan JA, et al. Randomized comparison of megestrol acetate versus dexamethasone versus fluoxymesterone for the treatment of cancer anorexia/cachexia. J Clin Oncol 1999; 17: 3299.
- [28] Esposito A, Criscitiello C, Gelao L, Pravettoni G, et al. Mechanism of anorexia‑cachexia syndrome and rational for treatment with selective ghrelin receptor agonist. Cancer Treatment Reviews 2015; 41: 793−797.
- [29] Currow D, Temel JS, Abernethy A, et al. ROMANA 3: A phase 3 safety extension study of anamorelin in advanced non‑small cell lung cancer (NSCLC) patients with cachexia. Ann Oncol 2017; May 4: doi: 10.1093/annonc/mdx192
- [30] Strasser F, Luftner D, Possinger K, et al. Comparison of orally administered cannabis extract and delta‑9‑tetrahydrocannabinol in treating patients with cancer‑related anorexia‑cachexia syndrome: a multicenter, phase III, randomized, double‑blind, placebo‑controlled clinical trial from the Cannabis‑In‑Cachexia‑Study‑Group. J Clin Oncol 2006; 24: 3394−3400.
- [31] McMillan DC, Wigmore SJ, Fearon KC, et al. A prospective randomized study of megestrol acetate and ibuprofen in gastrointestinal cancer patients with weight loss. Br J Cancer 1999; 79: 495−500.
- [32] Cerchietti LC, Navigante AH, Peluffo GD, et al. Effects of celecoxib, medroxyprogesterone, and dietary intervention on systemic syndromes in patients with advanced lung adenocarcinoma: a pilot study. J Pain Symptom Manage 2004; 27: 85−95.
- [33] Bruera E, Neumann CE, Pituskin E, et al. Thalidomide in patients with cachexia due to terminal cancer: Preliminary report. Ann Oncol 1999; 10: 857−859.
- [34] Reid J, Mills M, Cantwell M, et al. Thalidomide for managing cancer cachexia. Cochrane Database Syst Rev 2012; (4): CD008664.
- [35] Ries A, Trottenberg P, Elsner F, et al. A systematic review on the role of fish oil for the treatment of cachexia in advanced cancer: an EPCRC cachexia guidelines project. Palliat Med 2012; 26: 294−304.
- [36] Dewey A, Baughan C, Dean T, et al. Eicosapentaenoic acid (EPA, an omega‑3 fatty acid from fish oils) for the treatment of cancer cachexia. Cochrane Database Syst Rev 2007; (1): CD004597.
- [37] Murphy RA, Mourtzakis M, Chu QS, et al. Nutritional intervention with fish oil provides a benefit over standard of care for weight and skeletal muscle mass in patients with non‑small cell lung cancer receiving chemotherapy. Cancer 2011; 117: 1775−1782.
- [38] Lissoni P. Is there a role for melatonin in supportive care? Support Care Cancer 2002; 10: 110−116.
- [39] Jatoi A, Dakhil SR, Nguyen PL, et al. A placebo‑controlled double blind trial of etanercept for the cancer anorexia/weight loss syndrome: results from N00C1 from the North Central Cancer Treatment Group. Cancer 2007; 110: 1396−1403.
- [40] Wiedenmann B, Malfertheiner P, Friess H, et al. A multicenter phase II study of infliximab plus gemcitabine in pancreatic cancer cachexia. J Support Oncol 2008; 6: 18−25.
- [41] Suarez‑Almazor ME, Newman C, Hanson J, Bruera E. Attitudes of terminally ill patients about euthanasia and assisted suicide: predominance of psychosocial determinants and beliefs over symptom distress and subsequent survival. J Clin Oncol 2002; 20: 2134−2141.