Management vybraných symptomů v onkologické paliativní péči
Souhrn:
Zácpa je jedním z nejčastějších symptomů u pacientů v paliativní onkologické péči. Její vznik a etiologie jsou multifaktoriální, jako nejvýznamnější se jeví užívání opioidů, pokročilost onkologického onemocnění a imobilita. Zácpa může být vyvolána a zhoršena i dalšími faktory přítomnými u pacientů s pokročilým onkologickým onemocněním. Zároveň může zhoršovat další symptomy (nevolnost, zvracení, anorexie, dušnost a jiné). Důsledná prevence a léčba zácpy patří mezi základní postupy paliativní péče. Průjem je v paliativní péči zastoupen s výrazně menší incidencí než zácpa. Závažné jsou komplikace, které mohou průjem provázet, jako dehydratace, minerálový rozvrat a progrese kachektizace. Častější bývá chronický průjem s multimodální etiologií. Akutní průjmy bývají vyvolány infekčními agens, které u imunitně kompromitovaných pacientů mohou zapříčinit vážné a celkové komplikace. Léčba průjmu se odvíjí od jeho pravděpodobné etiologie a její nedílnou součástí je i podpůrná terapie (probiotika, rehydratace).
Key words: palliative care − supportive care – constipation – diarrhoea – prevention – therapy.
Summary:
Constipation is one of the most prevalent symptoms in patients in palliative care in oncology. Its aetiology is multifactorial, one of the most important is opioid use, oncological disease stage and immobility. Constipation can be induced and get worse as a result of other factors present in patients with advanced oncological disease. Equally, it could worsen other symptoms (nausea, vomiting, anorexia, dyspnoea, and others). Rigorous prevention and treatment is one of basic procedures in palliative care. Incidence of diarrhoea in palliative care is lower compared with constipation. Complications that are associated with diarrhoea are serious, like dehydration, mineral imbalance and progression of cachexia. Chronic diarrhoea multimodal aetiology is more frequent. Acute diarrhoea is usually caused by infectious agents that could lead to serious and septic complications in immunocompromised patients. The therapy of diarrhoea is based on probable aetiology and supportive care (probiotics, rehydration) is an integral part of it.
Zácpa
Zácpa je jedním z nejčastějších symptomů v paliativní péči s prevalencí odpovídající druhu a pokročilosti základního onemocnění, komorbiditám a medikaci. Prevalence se pohybuje v rozsahu 10−70 %, nejvyšší je u pacientů chronicky užívajících opioidy, u hospicových pacientů v době příjmu bývá kolem 50 % [1]. Zácpa působí celkové zhoršení kvality života, příjmu potravy, nevolnosti, zvracení, bolesti, dušnosti, může vyvolávat retenci moče a delirium. Z hlediska tíže distresu se vyrovná bolesti. Extrémně může vést až k těžké střevní obstrukci [2].
Střevní fyziologie
Střevní motilita je odlišná v tenkém a tlustém střevě. V tenkém střevě je tranzitní čas 2−4 hodiny, v tlustém 24−48 hodin. Může být výrazně delší, přibližně polovina hospicových pacientů má tranzitní čas 4−12 dnů. Tlusté střevo vykazuje dopřednou peristaltiku asi 6× denně se dvěma vrcholy, ranním a poledním. Peristaltika je negativně ovlivněna fyzickou inaktivitou. Hlavními neurotransmitery ovlivňujícími střevní činnost jsou acetylcholin (Ach) a vazoaktivní intestinální peptid (VIP).
Denně je do střeva uvolněno kolem 7 litrů tekutin spolu s 1,5−2 litry vody přijaté perorálně. Většina je reabsorbována v tenkém střevě, do tlustého střeva vstupuje kolem 1 litru. Obsah vody vyloučené stolicí je 200 ml denně, rozdíl mezi zácpou a průjmem v rozdílu tekutinové exkrece je kolem 100 ml. Z toho vyplývá, že k dosažení fyziologické stolice je tekutinová bilance v tlustém střevě velice precizně řízena.
Etiologie zácpy
Etiologie zácpy je u pacientů
s progredujícím onkologickým onemocněním většinou
multifaktoriální. Například pacient se sníženým perorálním
příjmem, imobilní a užívající opioidy má tři velké
rizikové faktory. Přehled nejčastějších příčin zácpy je
uveden v tabulce 1,
dva nejdůležitější p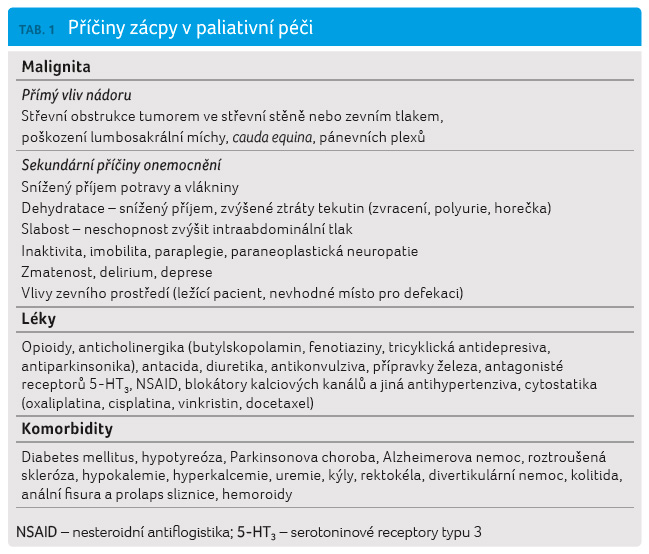 ředstavují vliv samotného pokročilého
onemocnění a užívání opioidů. Autonomní dysfunkce (AD)
je dalším častým faktorem rozvoje a zhoršení zácpy.
Etiologicky je multifaktoriální s podílem malnutrice, snížené
aktivity, diabetu, léků (tricyklická antidepresiva, opioidy,
vinkristin, cisplatina). Autonomní dysfunkce je jednou z příčin
dalších symptomů – anorexie a kachexie, časné
sytosti a chronické nevolnosti [3]. Pacienti s pokročilým
onkologickým onemocněním bývají častěji méně hydratovaní,
trpí hyperkalcemií, hypokalemií a uremií, které mohou
vyvolávat a zhoršovat zácpu. Celá řada symptomatických
léků užívaných v paliativní péči, včetně antiemetik
a antipsychotik, vykazuje anticholinergní účinky se
zpomalením peristaltiky. Opioidy vazbou na receptory ve střevě
zvyšují tonus a nepropulzivní peristaltiku, čímž
prodlužují tranzitní čas. Dále redukují sekreci tekutin
do střeva a zvyšují jejich absorpci, dochází tak
k vysušování střevního obsahu. V neposlední řadě
snižují vylučování VIP, který je významným regulátorem
střevní činnosti [4].
ředstavují vliv samotného pokročilého
onemocnění a užívání opioidů. Autonomní dysfunkce (AD)
je dalším častým faktorem rozvoje a zhoršení zácpy.
Etiologicky je multifaktoriální s podílem malnutrice, snížené
aktivity, diabetu, léků (tricyklická antidepresiva, opioidy,
vinkristin, cisplatina). Autonomní dysfunkce je jednou z příčin
dalších symptomů – anorexie a kachexie, časné
sytosti a chronické nevolnosti [3]. Pacienti s pokročilým
onkologickým onemocněním bývají častěji méně hydratovaní,
trpí hyperkalcemií, hypokalemií a uremií, které mohou
vyvolávat a zhoršovat zácpu. Celá řada symptomatických
léků užívaných v paliativní péči, včetně antiemetik
a antipsychotik, vykazuje anticholinergní účinky se
zpomalením peristaltiky. Opioidy vazbou na receptory ve střevě
zvyšují tonus a nepropulzivní peristaltiku, čímž
prodlužují tranzitní čas. Dále redukují sekreci tekutin
do střeva a zvyšují jejich absorpci, dochází tak
k vysušování střevního obsahu. V neposlední řadě
snižují vylučování VIP, který je významným regulátorem
střevní činnosti [4].
Management zácpy
Anamnéza a klinické vyšetření
Základem managementu zácpy je
podrobná anamnéza, zjišťujeme začátek obtíží, souvislost
s onkologickým onemocněním a s jeho léčbou, vliv
zácpy na pacienta, jeho distres a omezení (tab. 2). Aktivně zjišťujeme současnou i předchozí
medikaci, jakož i dřívější terapii zácpy a její
efekt. Dále vyšetřujeme základní orgánové celky a jejich
symptomy se stanovením možných sekundárních příčin zácpy. Je
nutné definovat, co pacient vnímá jako zácpu (tuhost, objem,
četnost a obtížnost defekace), a odlišit jiné obtíže
často udávané pacienty jako zácpa (břišní bolest, nadýmání,
nevolnost, zápach z úst, malátnost).
Pro hodnocení závažnosti zácpy a efektu terapie je v každodenní praxi použitelná numerická škála (0−10) nebo slovní škála (žádná, lehká, střední, těžká). Pro podrobnější hodnocení zácpy, především v kontextu klinických studií, bylo validováno několik dotazníků (např. Index funkce střev, Bowel Function Index – BFI). Tento dotazník je tvořen třemi položkami (snadnost/obtížnost defekace, pocit nekompletního vyprázdnění střev, celkové posouzení zácpy), které pacienti hodnotí na numerické stupnici (0–100).
Závažnost zácpy pro pacienta nekoreluje s frekvencí stolice, jako základ pro srovnání vždy pátráme po předchozích zkušenostech pacienta. Častá, málo objemná a řídká stolice může svědčit pro zadržení stolice. Někteří pacienti mají sice stolici každý den, tato je však velmi tuhá a působí pacientovi silný dyskomfort a je třeba ji hodnotit jako závažnou zácpu.
Klinicky se zácpa projevuje bolestí a tlaky v břiše, nevolností, zvracením, střevní obstrukcí, retencí moče, inkontinencí stolice nebo moče, průjmem při zadržení stolice a při těžké zácpě až zmateností a neklidem. Zácpu bychom měli v paliativní péči předvídat a opakovaně aktivně zjišťovat.
Per rectum lze zjistit zadržení tuhé stolice, hemoroidy, nádor, rektokélu, anální stenózu nebo insuficienci sfinkterů. Klinickým vyšetřením břicha lze stolici odlišit od tumoru tím, že při hlubší palpaci není bolestivá, je vnímán mírný krepitus a po určité době stolice změní polohu. Poslechově svědčí vysoké zvuky o střevní obstrukci a tichá obleněná peristaltika o paralýze. Anamnéza nitrobřišního nádoru, operačního zákroku v břiše, kolikovitých bolestí, nevolnosti a zvracení může svědčit o střevní obstrukci. Rozlišit u nitrobřišního tumoru, zda je přítomna střevní obstrukce, nebo distenze stěny při zácpě, je obtížné.
Vyšetřením stolice lze částečně odlišit některé situace. Malé tuhé peletky svědčí pro zpomalený tranzitní čas, stužkovitá stolice bývá u stenóz nebo hemoroidů a krev nebo hlen mohou znamenat nádor, hemoroidy nebo kolitidu.
Prostý RTG snímek břicha vestoje může odlišit původ problémů při nejistotě mezi zácpou a střevní obstrukcí. Pro posouzení závažnosti zácpy má toto vyšetření pouze orientační hodnotu. U pacientů ve specifických situacích a dle klinické a prognostické rozvahy doplníme vyšetření elektrolytů (Na, K, Ca), renálních parametrů (urea, kreatinin) a štítné žlázy (TSH, fT3, fT4).
Terapie zácpy
Terapie zácpy musí být vždy komplexní, kombinujeme režimová opatření a farmakoterapii. Byla definována základní doporučení, ale silná data ze studií často chybějí a orientujeme se hlavně podle klinického vývoje. Hlavním faktorem úspěšného managementu je snaha definovat a léčit vyvolávající příčinu, resp. příčiny, ve shodě s klinicko prognostickou rozvahou a plánem péče [5,6].
Preventivní a režimová opatření
Prevence je nejlepší terapií zácpy, snažíme se udržet co nejdéle dostatečný pohyb a aktivitu dle možností pacienta. Důležitý je pravidelný příjem tekutin k minimalizaci dehydratace. Mimo specifické situace není indikace pro parenterální hydrataci z důvodu zácpy samotné. Základem léčby je dobrá kontrola všech dalších obtěžujících symptomů (bolest, anorexie, dušnost, úzkost). Strava je neméně důležitá, měla by vyhovovat svým složením a chutí, obsahovat dostatek vlákniny, vhodné je zařadit 2−3 mléčné výrobky denně. Je nezbytné revidovat podávané léky a dle jejich potenciálu vyvolávat zácpu najít léky s výhodnějším profilem nežádoucích účinků. Posledním, ale ne nevýznamným faktorem je vlastní prostředí, ve kterém je defekace prováděna, a poloha při defekaci. Pacient by měl mít při defekaci vždy dostatek soukromí, preferovat bychom měli defekaci na toaletě nebo na defekační židli před podložní mísou či plenkovými kalhotkami. Dále musíme respektovat fyziologii pacientova vyprazdňování a přizpůsobit se jeho denním rytmům.
Farmakoterapie
I přes dobrou prevenci zácpy a režimová opatření potřebuje přibližně 80 % pacientů v paliativní a hospicové péči laxativa. Laxativa se dělí na osmotická, stimulační, objemová a změkčující. Dělení je pouze arbitrární, osmotická laxativa působí svým vlivem na zvětšení objemu stolice stimulačně na aktivitu tlustého střeva. Stimulační laxativa zvyšují sekreci tekutiny do střeva a změkčují stolici. Osmotická laxativa vyžadují současný příjem tekutin kolem 2 litrů denně, což nemusí být pacienty tolerováno. Optimální je kombinace stimulačního a osmotického/změkčujícího projímadla. Účinku dosáhneme nižšími dávkami a snižují se tak nežádoucí účinky. Jako první volbu preferujeme perorální laxativa před rektálními manipulacemi. Vždy zjišťujeme předchozí užívání laxativ, protože pozitivní zkušenost předpovídá dobrý efekt. Měli bychom dát na pacientovo přání (solidní nebo tekuté, sladké nebo méně sladké), zlepší se adherence a výsledek léčby. Cílem léčby je pohodlná a úlevná defekace, nikoliv definovaná četnost a objem stolice. Dávky laxativ titrujeme postupně podle efektu nebo do výskytu nežádoucích účinků a máme na mysli dobu nutnou pro rozvinutí plného účinku. Stejně jako u léčby bolesti nebo nevolnosti je lépe podávat laxativa pravidelně, častěji ve večerní dávce, větší dávky pak rozdělit do více denních dávek. Myslíme na to, že zácpa je většinou chronická, měli bychom podávat laxativa, která pacient dobře toleruje, přinášejí mu minimální obtíže a řeší jeho problémy se zácpou [7].
Perorální laxativa
Mezi perorálními laxativy existují
zástupci všech skupin – změkčující, objemová, osmotická
a stimulační (viz tab. 3).
Jak bylo výše uvedeno, jejich účinek je většinou kombinovaný,
v závislosti na změnách objemu tekutin ve střevě,
střevní mikroflóry a peristaltiky. Mezi nejčastěji
používaná patří osmotická (hořečnaté soli, laktulóza)
a stimulační (senna, bisakodyl). Terapii zahajujeme jedním
lék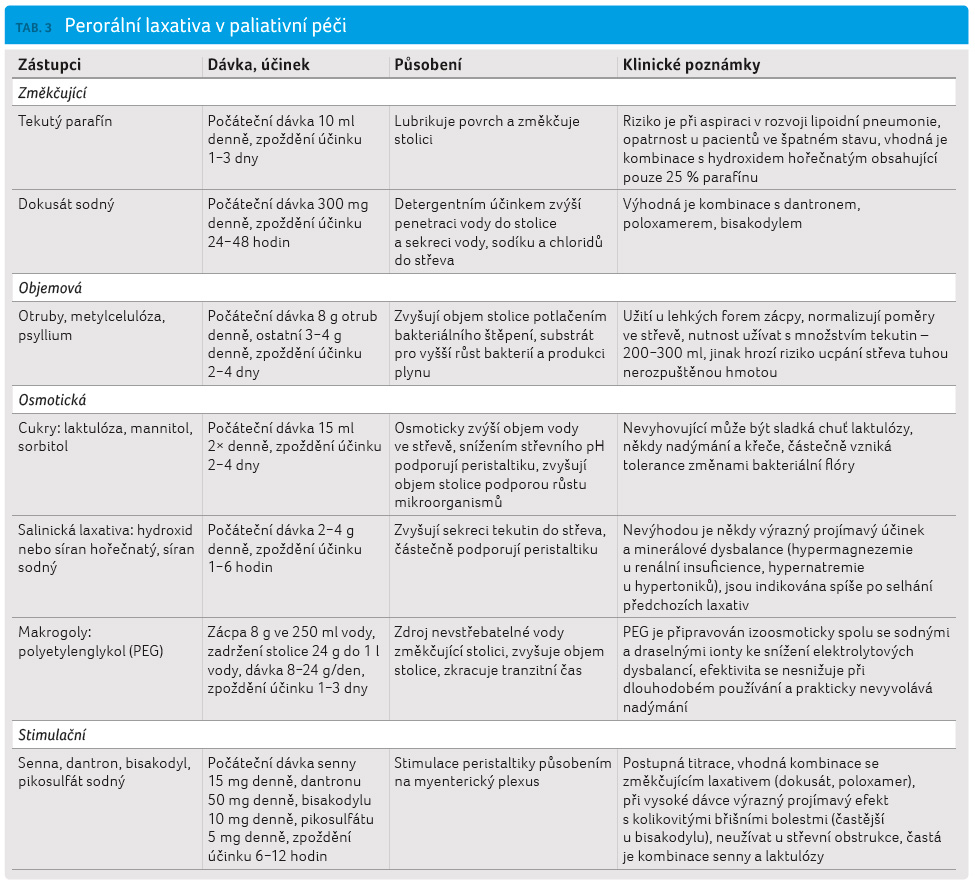 em z těchto skupin a při neúčinnosti přidáme
laxativum ze druhé skupiny. Zásadním předpokladem účinku
je dostatečný perorální příjem tekutin, zvýšení příjmu
přirozené vlákniny v potravě a dle stavu pacienta
pohyb. Pokud nevedou tyto postupy k úlevné stolici, je vhodné
zařadit aplikaci polyetylenglykolu v množství odpovídajícím
závažnosti zácpy. Teprve po selhání perorálních laxativ,
úpravě dietních zvyklostí a příjmu tekutin zařadíme
do terapie laxativa rektální.
em z těchto skupin a při neúčinnosti přidáme
laxativum ze druhé skupiny. Zásadním předpokladem účinku
je dostatečný perorální příjem tekutin, zvýšení příjmu
přirozené vlákniny v potravě a dle stavu pacienta
pohyb. Pokud nevedou tyto postupy k úlevné stolici, je vhodné
zařadit aplikaci polyetylenglykolu v množství odpovídajícím
závažnosti zácpy. Teprve po selhání perorálních laxativ,
úpravě dietních zvyklostí a příjmu tekutin zařadíme
do terapie laxativa rektální.
Rektální laxativa
Rektální laxativa mohou být aplikována ve formě čípků nebo klyzmat, používají se u zadržení stolice a po selhání perorálních laxativ. Rektální intervence vyvolává defekaci stimulací anokolického reflexu. Častá je kombinace bisakodylového a glycerinového čípku nebo klyzmatu následovaného čípky.
Mezi změkčující laxativa řadíme oleje a parafíny, které se užívají ve formě retenčního nálevu (100−150 ml) přes noc k evakuaci nebo k manuálnímu vybavení zadržené stolice, ráno je lze doplnit fosfátovým nálevem. Mezi další zástupce řadíme dokusát sodný, který je součástí klyzmatických směsí. Osmotická laxativa mohou být ve formě čípků (glycerin) nebo klyzmat (sorbitol), jejich účinek je změkčující, osmotický a lubrikační. Nástup jejich účinku je mezi 1−6 hodinami. Osmoticky působí salinická laxativa (fosfát sodný), je třeba je užívat s opatrností, rizikem je hypokalcemie a hyperfosfatemie, zvláště u geriatrických pacientů s renální insuficiencí. Bisakodyl představuje nejčastěji používané stimulační rektální laxativum. Jeho úvodní dávka je 10 mg, zpoždění účinku je kolem 15−60 minut a účinek je závislý na vstřebání rektální sliznicí, je nezbytné jej zavádět po stěně konečníku, ne do stolice.
Nová laxativa
Objev role serotoninu v modulaci aktivity gastrointestinálního traktu a objev různých serotoninových receptorů rozšířil výzkum i tímto směrem. Prucaloprid, agonista receptorů 5 HT4, je v dávce 1−2 mg denně indikován k léčbě chronické zácpy nereagující na běžná laxativa [8].
Opioidy indukovaná zácpa
Opioidy vyvolávají při dlouhodobém užívání zácpu u většiny pacientů, na rozdíl od ostatních nežádoucích účinků nedochází k jejímu zmírnění s dobou podávání opioidů. Možnosti překonání zácpy jsou, pokud situace dovolí, ve snížení dávky opioidu, v kombinaci s adjuvantními analgetiky nebo v opioidní rotaci. Přestože mezi jednotlivými opioidy nejsou významné rozdíly ve vyvolání zácpy, může být rotace úspěšná. Mezi opioidy vyvolávajícími zácpu méně patří transdermální fentanyl a metadon, obě léčiva mají vysokou lipofilitu. Obecně působí opioidy rozdílně na jednotlivé opioidní receptory s různou afinitou a aktivitou, farmakologicky tak rotace má smysl. Základem dobré praxe jsou poučení pacienta o zácpě, preventivní a režimová opatření a laxativa podávaná ještě před rozvojem obtěžující zácpy.
V posledních letech byly uvedeny do praxe opioidy kombinující aktivní látku s opioidním antagonistou naloxonem. Naloxon, který je podán perorálně, selektivně blokuje opiodní receptory ve střevě a díky významnému jaternímu metabolismu dosahuje systémové cirkulace nižší než 2 %, nedochází tak ke snížení analgetického účinku. Ve studiích bylo prokázáno významné zlepšení střevní činnosti bez ovlivnění analgezie [9]. Dalším antagonistou je metylnaltrexon, který je podáván v subkutánních infuzích. Neprostupuje hematoencefalickou bariérou a neantagonizuje centrální účinky opioidů. Je schválen pro terapii opioidy indukované zácpy u pacientů s pokročilými chorobami v paliativní péči. Z hlediska využití je v současnosti indikován u refrakterní zácpy, zvláště při opioidním střevním syndromu (narcotic bowel syndrome) [10].
Základní zásady terapie zácpy
Cílem léčby zácpy je defekace bez bolesti a dyskomfortu, nikoliv nutně pravidelná stolice předem definované konzistence.
Před zahájením léčby je potřeba vyšetřit pacienta per rectum. Při prázdné ampule je třeba myslet na možnost střevní obstrukce (zvážit RTG snímek břicha).
Při zadržení tuhé stolice v rektu je vhodné zahájit léčbu aplikací glycerinového nebo bisakodylového čípku, poté aplikovat nálev s olejem přes noc následovaný ráno fosfátovým nálevem nebo polyetylenglykol podávaný po tři dny; pokud nejsou tyto postupy účinné, lze volit manuální vybavení stolice za dostatečné analgosedace.
Při přítomnosti měkké stolice v rektu volíme laxativum stimulující peristaltiku, například sennu, někdy můžeme použít miniklyzma nebo změkčující laxativum (spíše dlouhodobě v prevenci).
Při nepřítomnosti stolice v rektu primárně volíme laxativum stimulující peristaltiku (senna), pokud je stolice tuhá, pak je vhodné je kombinovat se změkčujícím laxativem/projímadlem (laktulóza).
Pokud současně panuje podezření na významnou střevní obstrukci, doporučuje se užívat změkčující laxativa, nikoliv objemová a stimulační.
Průjem
Průjem definují časté, objemné a neformované stolice, zpravidla s urgentní defekací v počtu více než tři za 24 hodin. Průjem vzniká nerovnováhou v elektrolytové a vodní bilanci ve střevě. Je jednou z nejčastějších komplikací protinádorové léčby a u pacientů v pokročilých a terminálních fázích nádorového onemocnění. Jeho rizika spočívají v dehydrataci, elektrolytové dysbalanci, podvýživě, riziku infekcí a proleženin, ve zvýšených nárocích na pečující; průjem může vyžadovat hospitalizaci, vede k významnému dyskomfortu a ke ztrátě důstojnosti [3]. Prevalence je kolem 7−10 % pacientů v paliativní péči, více u pacientů v aktivní protinádorové léčbě a se specifickými nádory (karcinom pankreatu a žlučových cest) [11].
Mechanismy
Osmotický průjem je častý v onkologii a v paliativní péči. Vzniká nadbytkem v příjmu osmoticky aktivních nevstřebatelných látek, nejčastěji laxativ na bázi cukrů nebo magneziových a jiných solí. Dále vysokým příjmem cukrů v potravě a jejich malabsorpcí vlivem chemoterapie nebo střevní infekce.
Sekreční průjem bývá často kombinovaný s jinými mechanismy, samostatně je spíše vzácný. Jedná se o nerovnováhu v iontovém transportu střevními epiteliemi. Faktory vedoucí k sekrečnímu průjmu jsou různé. Může se jednat o bakteriální a jiné toxiny, žlučové kyseliny, hormony (neuroendokrinní nádory), ozařování, enterální výživu a léky (chemoterapie, cílená léčba, antibiotika) [12]. Průjmy během epizod lačnění (v noci) mohou ukazovat na sekreční mechanismus.
Posledním mechanismem je zrychlená peristaltika, která zkracuje kontakt intraluminálního obsahu s epiteliemi střeva. Bývá častá u stavů po operacích (postgastrektomický dumping syndrom, resekce ileocekální chlopně a ilea, totální kolektomie), u pacientů po blokádě plexus coeliacus a u autonomní dysfunkce, kde převažuje vliv parasympatiku [13].
Etiologie
Hlavní příčiny, které se mohou podílet na vzniku průjmu u pacientů v paliativní péči, uvádí tabulka 4.
Průjem perzistující déle než tři
týdny je chronický a bývá známkou vážného organického
poškození. Většina průjmů je akutních, trvajících několik
dnů, kdy příčinou bývají komunitní infekce (Campylobacter,
Shigella, viry). Nejčastější příčinou průjmů
v paliativní péči bývá nerovnováha v užívání
a v potřebě laxativ. Po jejich vysazení se průjem
upravuje během 1−2 dnů, poté se mohou začít opět podávat
v nižším dávkování. Maligní střevní ob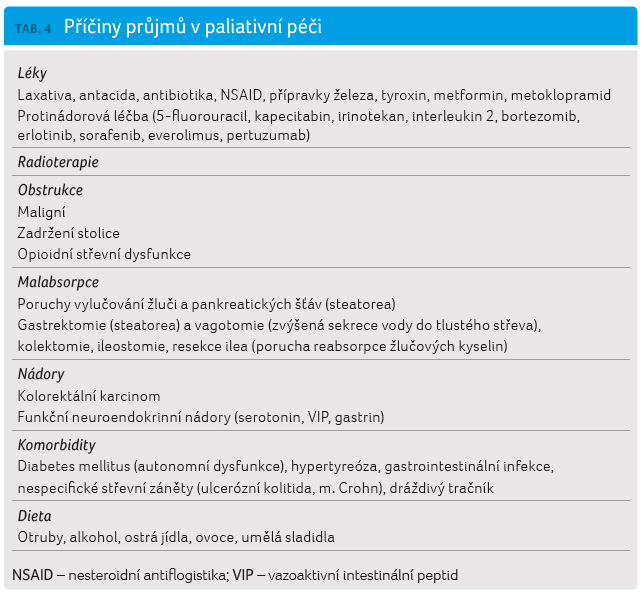 strukce
a zadržení stolice jsou dalšími častými příčinami
průjmů v paliativní péči. Parciální střevní obstrukce
je typická průjmy nebo střídáním průjmů a zácpy. Při
zadržení stolice dochází k jejímu částečnému zkvašení
vlivem bakterií a k nekontrolovatelnému úniku řídké
stolice. U geriatrických hospitalizovaných pacientů tvoří
zadržení stolice asi 55 % všech průjmů. Paliativní
chemoterapie (fluorouracil, kapecitabin, irinotekan) a malé
molekuly inhibitorů tyrozinkináz vedou k průjmům u 10−50 %
pacientů. Radioterapie břicha a pánve vede k poškození
střevní sliznice, k uvolnění prostaglandinů a k malabsorpci
žlučových kyselin, které zrychlují peristaltiku. Blokáda plexus
coeliacus může být spojena s dlouhotrvajícími
profuzními vodnatými průjmy. Stavy po gastrektomii,
pankreatektomii a resekci ilea mohou vést k selhání
exokrinní pankreatické sekrece, k malabsorpci tuků
a ke steatorei. Po resekci ilea navíc může docházet
k deficitu disacharidáz a k osmotickému průjmu při
malabsorpci cukrů. Po akutních střevních infekcích
a užívání antibiotik dochází k přechodné laktózové
intoleranci vlivem poškození střevní mikroflóry a aktivity
laktáz.
strukce
a zadržení stolice jsou dalšími častými příčinami
průjmů v paliativní péči. Parciální střevní obstrukce
je typická průjmy nebo střídáním průjmů a zácpy. Při
zadržení stolice dochází k jejímu částečnému zkvašení
vlivem bakterií a k nekontrolovatelnému úniku řídké
stolice. U geriatrických hospitalizovaných pacientů tvoří
zadržení stolice asi 55 % všech průjmů. Paliativní
chemoterapie (fluorouracil, kapecitabin, irinotekan) a malé
molekuly inhibitorů tyrozinkináz vedou k průjmům u 10−50 %
pacientů. Radioterapie břicha a pánve vede k poškození
střevní sliznice, k uvolnění prostaglandinů a k malabsorpci
žlučových kyselin, které zrychlují peristaltiku. Blokáda plexus
coeliacus může být spojena s dlouhotrvajícími
profuzními vodnatými průjmy. Stavy po gastrektomii,
pankreatektomii a resekci ilea mohou vést k selhání
exokrinní pankreatické sekrece, k malabsorpci tuků
a ke steatorei. Po resekci ilea navíc může docházet
k deficitu disacharidáz a k osmotickému průjmu při
malabsorpci cukrů. Po akutních střevních infekcích
a užívání antibiotik dochází k přechodné laktózové
intoleranci vlivem poškození střevní mikroflóry a aktivity
laktáz.
Management průjmu
Anamnéza
Základem diagnostiky je podrobná anamnéza, doba trvání, počet stolic za 24 hodin, objem, konzistence (vodnatá, steatoroická, napěněná), vzhled, zápach, barva a příměs krve nebo hlenu. Zjišťujeme aktuální medikaci, komorbidity, operační zákroky, užívání antibiotik, aktivně se ptáme na užívání laxativ [14]. Přítomnost 2−3 stolic náhle bez varování může znamenat anální inkontinenci. Objemné, vodnaté, světlé stolice bez krve a občas s příměsí nenatrávené potravy svědčí pro postižení tenkého střeva. Menší, častější porce s hlenem a někdy s krví jsou typické pro postižení tlustého střeva [3,12]. Náhlé řídké stolice po zácpě mohou ukazovat na zadržení stolice, střídání zácpy a průjmu na střevní obstrukci. Objemná, světlá a zapáchající stolice bývá při malabsorpci tuků a žlučových kyselin. Objemná, kašovitá stolice s vysokou tvorbou plynů ukazuje na možnou malabsorpci cukrů. Průjmy spolu s rudnutím v horní polovině trupu a v obličeji (flush), dušností, pocením a palpitacemi upozorňují na karcinoidový syndrom. Chronické průjmy s intolerancí tepla, palpitacemi a s úbytkem tělesné hmotnosti vyžadují doplnění odběru na hodnotu tyreostimulačního hormonu (TSH) k vyloučení možné tyreotoxikózy. Velkou pozornost bychom měli věnovat výskytu průjmů s krví a hlenem doprovázených horečkami a dehydratací, zde vždy uvažujeme o infekční etiologii. U pacientů recentně po chemoterapiích hrozí riziko neutropenie s enterokolitidou, translokací bakterií a septikemií [15].
Klinické vyšetření
Klinickým vyšetřením bychom měli vyloučit některé specifické příčiny průjmu. Rektálním vyšetřením zjišťujeme zadrženou stolici, abdominální palpací tumorové masy nebo přítomnost stolice v tračníku. Steatorea je vzhledem a zápachem typická, stejně tak meléna, která představuje akutní stav. Pacienti ambulantní nebo se vznikem průjmu do tří dnů od přijetí mohou mít komunitní infekci (Salmonela, Shigella, Campylobacter, viry). Pacienti hospitalizovaní déle, s komplikovaným průběhem, po širokospektrých antibiotikách (chinolony, cefalosporiny) mohou mít infekci Clostridium difficile s klostridiovou pseudomembranózní enterokolitidou.
Léčba průjmu
Podpůrná terapie
Základním postupem je udržení dostatečného příjmu vhodných tekutin a hydratace. Jednoznačně je preferována perorální cesta, existuje celá řada vyvážených rehydratačních roztoků. Infuzní terapie je indikována při zvracení, při významně snížené hydrataci a minerálovém rozvratu. Speciální dietní opatření jsou nutná u akutních průjmů. U chronických průjmů je třeba současně zajistit dostatečný nutričně kalorický příjem, a nelze proto v dietě zcela vylučovat tuky nebo cukry. U akutních průjmů dochází často k sekundární laktózové intoleranci, ze stravy bychom přechodně měli vyloučit mléko. Dále není vhodná zelenina s vysokým obsahem vlákniny, tučná jídla, ryby, kofein a alkohol. U lehkých forem průjmů často stačí, vedle režimových opatření, aktivní uhlí (carbo activatus) s přídavkem dezinficiens bismuthi subgallas (Carbocit) 4−5 tablet 3−4krát denně nebo diosmektit (Smecta). Probiotika jsou používána často, data o jejich prospěšnosti u paliativní populace však chybějí. Jejich efekt je jednoznačně prokázán u dysmikrobie po antibiotické terapii. V léčbě infekčních průjmů nebo při laktózové intoleranci po akutním průjmu svůj efekt neprokázala [16].
Specifická léčba
Pro konkrétní etiologické jednotky
existuje specifická léčba (tab. 5). Pankreatickou substituci titrujeme podle efektu
na zmírnění průjmů, změny barvy a konzistence
stolice, někdy je výhodné zmírnit žalud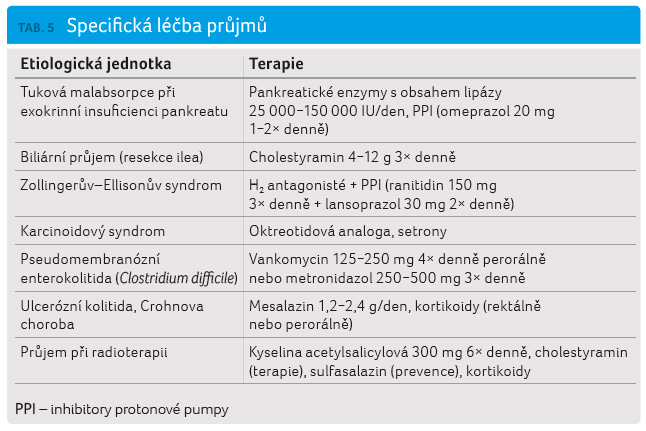 eční aciditu současným
podáváním H2 blokátorů nebo inhibitorů protonové
pumpy. Oktreotidová analoga jsou suverénní terapií průjmů
souvisejících s karcinoidovým syndromem a představují
druhou volbu u průjmů vyvolaných chemoterapií po selhání
loperamidu. Při klostridiové pseudomembranózní enterokolitidě je
nejúčinnější perorálně podávaný vankomycin, případně
metronidazol. Pacienti s terminální ileostomií ztrácejí
denně navíc 400−1 000 ml vody střevem, je proto třeba
pečlivě bilancovat, přidávat přibližně 1 000 ml tekutin
a 7 g soli denně, včetně suplementace železa a vitaminů.
eční aciditu současným
podáváním H2 blokátorů nebo inhibitorů protonové
pumpy. Oktreotidová analoga jsou suverénní terapií průjmů
souvisejících s karcinoidovým syndromem a představují
druhou volbu u průjmů vyvolaných chemoterapií po selhání
loperamidu. Při klostridiové pseudomembranózní enterokolitidě je
nejúčinnější perorálně podávaný vankomycin, případně
metronidazol. Pacienti s terminální ileostomií ztrácejí
denně navíc 400−1 000 ml vody střevem, je proto třeba
pečlivě bilancovat, přidávat přibližně 1 000 ml tekutin
a 7 g soli denně, včetně suplementace železa a vitaminů.
Farmakoterapie
Protiprůjmové léky lze dělit
na adsorbentní, inhibitory slizničních prostaglandinů,
opioidy, antipropulziva a oktreotidová analoga (viz tab. 6). Jejich použití není vhodné při infekčních
příčinách průjmů. V případě prokázané infekce nebo
při průjmech s horečkami a příměsí krve je třeba
léčit symptomaticky a podpůrnou terapií [17,18].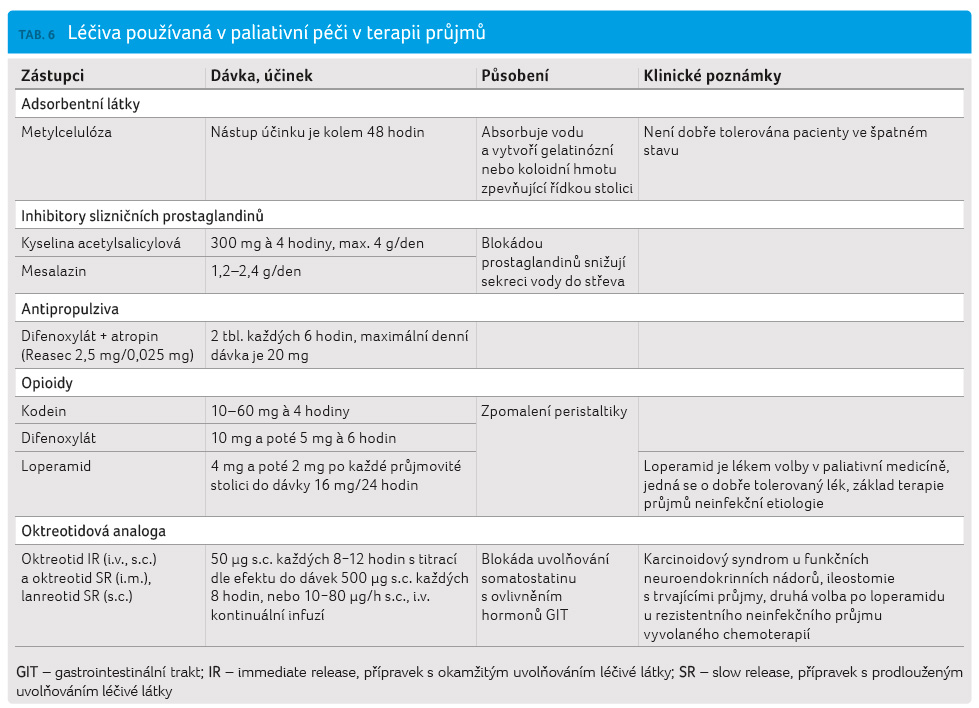
Shrnutí léčby průjmu
Předpokladem pro úspěšnou léčbu průjmů v paliativní péči je podrobná anamnéza a klinické vyšetření. Na jejich základě lze odlišit hlavní mechanismy průjmů – porucha motility, sekreční, zánětlivý a osmotický/malabsorpční. V další fázi stanovíme závažnost průjmu a dle prognózy a klinického stavu pacienta cíle péče. Podpůrná a režimová opatření představují první krok managementu − hydratace, doplnění minerálů, dieta. Specifické jednotky (tuková malabsorpce, klostridiová enterokolitida) vyžadují definovanou terapii. Lehký tranzientní průjem řešíme živočišným uhlím (carbo activatus) s přídavkem dezinficiens bismuthi subgallas (Carbocit) 4−5 tablet 3−4krát denně. Těžší a perzistující formy průjmů fixní kombinací difenoxylátu a atropinu (Reasec 2,5 mg/0,025 mg) 2 tbl. každých 6 hodin, maximální denní dávka je 20 mg, nebo loperamid vstupně 4 mg (2 tbl.) a poté 2 mg po každé neformované stolici nebo každých 2−6 hodin do efektu, maximální dávka 16 mg za 24 hodin. Sekreční neinfekční těžké formy průjmů, zvláště v souvislosti s chemoterapií, lze po vyčerpání předchozích možností léčit somatostatinovými analogy – oktreotid v dávkách 50 µg s.c. každých 8−12 hodin s titrací dle efektu do dávek 500 µg s.c. každých 8 hodin, nebo 10−80 µg/h s.c., i.v. kontinuální infuzí.
Seznam použité literatury
- [1] Sykes NP. The pathogenesis of constipation. J Support Oncol 2006; 4: 213−218.
- [2] Droney J, Ross J, Gretton S, et al. Constipation in cancer patients on morphine. Supp Care Cancer 2008; 16: 453−459.
- [3] Solomon R, Cherny N. Constipation and diarrhea in patients with cancer. Cancer J 2006; 12: 355−364.
- [4] Kurz A, Sessler D. Opioid‑induced bowel dysfunction. Pathophysiology and potential new therapies. Drugs 2003; 63: 649−671.
- [5] Librach S, Bouvette M, De Angelis C, et al. Consensus recommendations for the management of constipation in patients with advanced, progressive illness. J Pain Symptom Manage 2010; 40: 761−773.
- [6] Larkin PJ, Sykes NP, Centeno C, et al. The management of constipation in palliative care: clinical practice recommendations. Palliat Med 2008; 22: 796−807.
- [7] Ramkumar D, Rao SS. Efficacy and safety of traditional medical therapies for chronic constipation. Am J Gastroenterol 2005; 100: 936−971.
- [8] Quigley EM, Vandeplassche L, Kerstens R, Ausma J. Clinical trial: The efficacy, impact on the quality of life, and safety and tolerability of prucalopride in severe chronic constipation – A 12‑week, randomized, double‑blind, placebo‑controlled study. Aliment Pharmacol Ther 2009; 29: 315−328.
- [9] Meissner W, Leyendecker P, Mueller‑Lissner S, et al. A randomized controlled trial with prolonged‑release oral oxycodone and naloxone to prevent and reverse opioid‑induced constipation. Eur J Pain 2009; 13: 56−64.
- [10] Portenoy RK, Thomas J, Mohel Boatwright M, et al. Subcutaneous methylnaltrexone for the treatment of opioid‑induced constipation in patients with advanced illness: a double‑blind, randomized, parallel group, dose‑range in study. J Pain Symptom Manage 2008; 35: 458−468.
- [11] Komuren S, Nelson KA, Walsh D, et al. Gastrointestinal symptoms among inpatients with advanced cancer. Am J Hosp Palliat Care 2002; 19: 351−355.
- [12] Cherny N, Evaluation and management of treatment‑related diarrhea in patients with advanced cancer: a review. J Pain Symptom Manage 2008; 36: 413−423.
- [13] Schiller LR. Diarrhea. Med Clin North Am 2000; 84: 1259−1274.
- [14] Fine JD, Schiller LR. AGA technical review on the evaluation and management of chronic diarrhea. Gastroenterology 1999; 116: 1464−1486.
- [15] Kornblau S, Benson AB, Catalano R, et al. Management of cancer treatment‑related diarrhea: issues and therapeutic strategies. J Pain Symptom Manage 2000; 19: 118−129.
- [16] Saavedra J. Probiotics and infectious diarrhea. Am J Gastroenterol 2000; 95 (Suppl 1): S16−S18.
- [17] Benson AB, Afjani J, Catalano R, et al. Recommended guidelines for the treatment of cancer treatment‑induced diarrhea. J Clin Oncol 2004; 22: 2918−2926.
- [18] Mercadante S. Diarrhea in terminally ill patients: Pathophysiology and treatment. J Pain Symptom Manage 1995; 10: 298−309.