Medicínské a ekonomické aspekty optimalizace léčby dětí s hemofilií
Podle přednášky MUDr. Jana Blatného, Ph.D., z Oddělení dětské hematologie FN Brno ze dne 7. října 2015 v rámci tiskové konference k tématu Současný stav léčby hemofiliků v ČR – moderní přístupy a úhrada zpracovali Mgr. Jaroslav Hořejší a PharmDr. Kateřina Tuhá
Souhrn:
Článek se zabývá problematikou léčby hemofilie, profylaktickou léčbou, rizikem vzniku inhibitoru koagulačních faktorů a možnostmi jeho minimalizace. Sdělení rozebírá farmakokinetické profilování, které se ukazuje jako účinný nástroj k optimalizaci léčby a k efektivnímu využití nákladů na léčbu. Tento přístup k léčbě umožňuje dávku a frekvenci dávkování určit na základě farmakokinetických dat konkrétního pacienta.
Klíčová slova : hemofilie, koagulační faktor, profylaxe, farmakokinetické profilování, inhibitor.
Key words:
hemophilia – coagulation factor – prophylaxis – pharmacokinetic profiling – inhibitor.
Summary:
The article deals with the treatment of hemophilia, prophylactic treatment, risk of development of the coagulation factor inhibitor, and the options concerning its minimization. Pharmacokinetic profiling is being discussed, seeming to be an effective instrument allowing for treatment optimization and effective resource allocation. This approach makes it possible to define the dose and frequency of its application based on the pharmacokinetic data of any individual patient.
Hemofilie je geneticky podmíněné onemocnění, které se vyznačuje poruchou krevní srážlivosti. Vzniká poškozením jednoho z genů na chromosomu X, nemoc je gonosomálně recesivní, plně se projevuje pouze u mužů. Podstatou onemocnění je nedostatečná či chybějící tvorba koagulačních faktorů – faktoru VIII u hemofilie typu A, faktoru IX u hemofilie typu B, eventuálně nefunkčnost těchto faktorů. Oba faktory se účastní koagulační kaskády a při jejich deficitu nedojde ke kompletní hemostáze. Onemocnění se projevuje „spontánním“ krvácením především do kloubů, ale také do svalů a dalších orgánů. Tíže onemocnění a klinických projevů závisí na koagulační aktivitě faktorů. V České republice žije zhruba 1 000 hemofiliků, z nichž přibližně 230 je ve věku do 18 let.
Standardní léčba hemofilie a její vývoj
Je známo, že úroveň léčby hemofilie v dětském věku předurčuje celý další život hemofilika. Jestliže se pomocí moderní účinné léčby podaří zabránit poškození pohybového aparátu, získá takové dítě šanci na normální život i v dospělosti.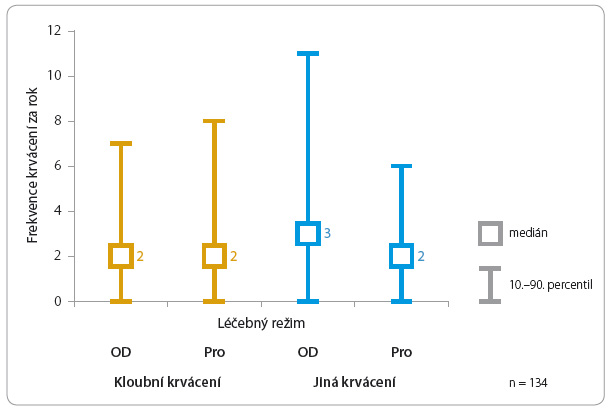
Základem léčby je injekční podávání koncentrátu koagulačního faktoru, který u nemocných s daným typem hemofilie chybí nebo je defektní (substituční léčba). Léčba by měla být individualizována podle závažnosti onemocnění, podle potřeb pacienta a s tím související aktuální plazmatické koncentrace koagulačního faktoru. U dětí s těžkou formou hemofilie je indikována profylaktická léčba – tedy pravidelná aplikace určité dávky koagulačního faktoru (obvykle 2–3krát týdně). Tato forma léčby by měla i v období, kdy nejsou patrné známky krvácení, zabránit trvalým následkům – spontánnímu krvácení do kloubů a svalů a jejich trvalému poškození (graf 1).
Pro nemocné, kteří nedostávají koncentrát koagulačního faktoru profylakticky, je určena tzv. léčba on demand – podání koncentrátu srážecího faktoru při krvácivé epizodě. Současné přístupy k léčbě shrnuje tab. 1 [1].
Jednou z nejzávažnějších komplikací hemofilie je hemofilická artropatie – poškození kloubu způsobené opakovaným krvácením, kdy reaktivně vzniká synovitida a dochází k destrukci kloubní chrupavky. U lehké a středně závažné hemofilie je méně častá, u těžké hemofilie je naopak krvácení do kloubů nejčastějším typem krvácení.
Předcházet možnému krvácení lze profylaktickým nitrožilním podáním koncentrátu chybějícího faktoru. Tato metoda byla poprvé vyzkoušena, zhodnocena a publikována ve Švédsku [2], nyní je celosvětově zlatým standardem léčby dětí s těžkou formou hemofilie (graf 1, tab. 2). Platí, že čím dříve (po prvním krvácení) je profylaxe zahájena, tím nižší je riziko vzniku artropatií [3].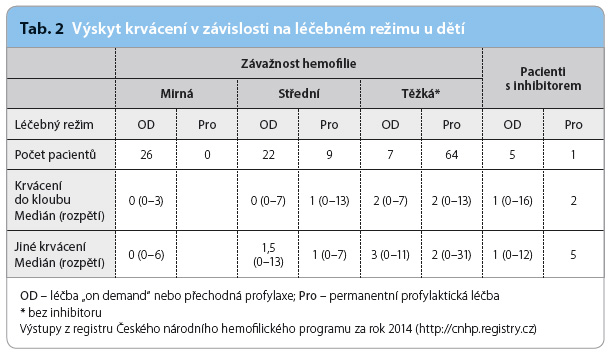
Jaké jsou výhody profylaxe u dětí s hemofilií?
Na tuto otázku se pokusila odpovědět studie ESPRIT [4], která si vytkla za cíl porovnat vliv podávání profylaktické léčby a léčby „on‑demand” na pohybový aparát dětí. Jednalo se o otevřenou, randomizovanou multicentrickou studii, do které bylo zařazeno celkem 40 dětí různého věku s těžkou hemofilií A, uspořádání studie uvádí obr. 1. Nemocní byli sledováni po dobu deseti let, medián sledování byl 82,5 měsíce. Studie hodnotila stav kloubů prostým rtg snímkem – 6 hlavních kloubů (kotníky, kolena, lokty), počet a frekvenci krvácení, kvalitu života.
![Obr. 1 Uspořádání studie ESPRIT; podle [4] – Gringeri, et al., 2011. Ve studii bylo sledováno 40 dětí různého věku s těžkou hemofi lií, medián sledování byl 82,5 měsíce.](https://www.remedia.cz/photo-a-30541---.jpg) Výsledky studie ESPRIT dokládají, že děti, kterým byla podávána profylaktická léčba, krvácely méně než děti léčené „on‑demand“ (4 krvácení/rok vs. 12 krvácení/rok; p < 0,01). Největší rozdíl byl ve skupině dětí, u nichž byla profylaxe zahájena před třetím rokem života. Kloubní postižení patrné na rtg snímku bylo významně častější u dětí bez profylaxe (74 %, Pettersonovo skóre 8, oproti 29 %, Pettersonovo skóre 5; p < 0,05). Nebyla zjištěna korelace mezi minimální plazmatickou koncentrací FVIII při profylaxi a frekvencí krvácení. Náklady na profylaktickou léčbu byly přibližně dvakrát vyšší než na léčbu „on‑demand” (80 000 eur/rok vs. 36 000 eur/rok).
Výsledky studie ESPRIT dokládají, že děti, kterým byla podávána profylaktická léčba, krvácely méně než děti léčené „on‑demand“ (4 krvácení/rok vs. 12 krvácení/rok; p < 0,01). Největší rozdíl byl ve skupině dětí, u nichž byla profylaxe zahájena před třetím rokem života. Kloubní postižení patrné na rtg snímku bylo významně častější u dětí bez profylaxe (74 %, Pettersonovo skóre 8, oproti 29 %, Pettersonovo skóre 5; p < 0,05). Nebyla zjištěna korelace mezi minimální plazmatickou koncentrací FVIII při profylaxi a frekvencí krvácení. Náklady na profylaktickou léčbu byly přibližně dvakrát vyšší než na léčbu „on‑demand” (80 000 eur/rok vs. 36 000 eur/rok).
Individualizace léčby
V uplynulých desetiletích bylo v klinické praxi užíváno jednotné dávkování stanovované dle hmotnosti pacienta. Tento přístup „one size fits all“ pomohl zásadně zlepšit péči o pacienty s hemofilií, ale podle nejnovějších poznatků je zřejmé, že mnohem účinnějším přístupem je brát v úvahu interindividuální rozdíly ve farmakokinetice, a v souladu se současným trendem tedy přizpůsobit léčbu vždy pro konkrétního jedince.
Je prokázáno, že účinnost profylaktické léčby přímo souvisí s udržením dostatečné plazmatické koncentrace koagulačního faktoru (IU/dl, resp. aktivity uváděné v %) v průběhu dávkovacího intervalu. Důležitá je doba, po kterou se plazmatická koncentrace faktoru pohybuje nad určitou hranicí, nad níž chceme pacienta udržet („trough“ plazmatická koncentrace). Ta závisí na biologickém poločasu eliminace (clearance) koagulačního faktoru.
Rychlost eliminace je ve vztahu s plochou pod křivkou plazmatické koncentrace (area under curve, AUC). Křivky plazmatické koncentrace léčiva v čase se mohou významně lišit, mění se i s věkem – u dětí je clearance koagulačního faktoru vyšší, biologický poločas eliminace je tedy kratší. Odlišná může být i hodnota in vivo recovery (IVR), která odpovídá vrcholové plazmatické koncentraci faktoru po distribuci podané dávky. V rizikových situacích je důležitá např. pro zástavu možného mikrokrvácení, které se i při profylaktické léčbě může vyskytnout. Předpoklad vzrůstu plazmatické koncentrace podle charakteristik pacienta vypovídá spíše o tom, zda indikovaná dávka zastaví krvácení, ale pro zajištění účinnosti profylaktické léčby je nutné zjištění biologického poločasu eliminace.
Biologický poločas eliminace
Od biologického poločasu eliminace koagulačního faktoru se odvíjí doba, po kterou je u pacienta přítomna dostatečná koncentrace koagulačního faktoru. Biologický poločas eliminace se může u jednotlivců poměrně zásadně lišit; rozdíl může představovat i dva dny, tedy jedno dávkovací období. V důsledku toho mohou být někteří pacienti při „standardní“ profylaktické léčbě (s dávkou určovanou na základě tělesné hmotnosti) poddávkovaní (klinicky se stav projevuje vyšším výskytem krvácení), a jiní naopak mohou dostávat zbytečně vysokou dávku.
Pro udržení plazmatické koncentrace koagulačního faktoru v optimálním terapeutickém rozmezí – tedy nad kritickou hodnotou, ale ne zbytečně vysokou – je nezbytná individualizace léčby. Aplikace koagulačního faktoru by měla sledovat vývoj jeho plazmatických koncentrací v čase. Jako minimální hodnota, pod kterou by se pacient neměl dostat, se doposud nejčastěji udávalo 1 %, v poslední době stále častěji 3 %. Pokud by se podařilo udržet hladinu faktoru nad hranicí 12 %, pak pacient nebude krvácet téměř vůbec.
Individualizace léčby s pomocí farmakokinetiky – proč a jak „ušít léčbu na míru”?
Jak již bylo uvedeno, standardní profylaktická léčba, kdy je dávka stanovena na základě tělesné hmotnosti pacienta, 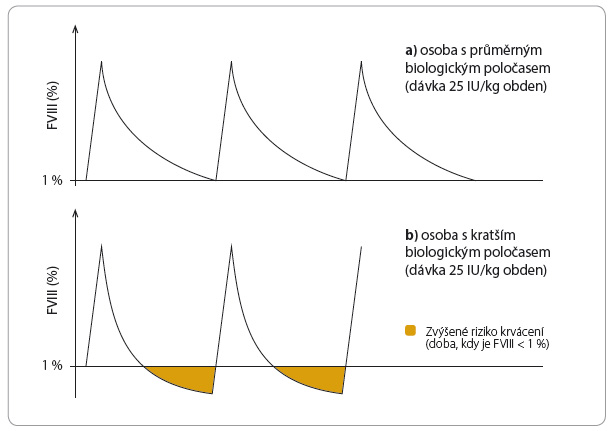 nemusí vyhovovat všem (graf 2 a, b), neboť biologický poločas podávaného léku (zejména u hemofilie A) se může u různých jedinců lišit i o více než 200 % (8–28 h). Při standardní léčbě („one size fits all”) je proto část pacientů tzv. poddávkována, a naopak část léčena dávkou zbytečně vysokou.
nemusí vyhovovat všem (graf 2 a, b), neboť biologický poločas podávaného léku (zejména u hemofilie A) se může u různých jedinců lišit i o více než 200 % (8–28 h). Při standardní léčbě („one size fits all”) je proto část pacientů tzv. poddávkována, a naopak část léčena dávkou zbytečně vysokou.
Dosavadní úpravy dávkování koagulačního faktoru byly prováděny na základě empirie – „pokud pacient krvácí, je třeba dávku zvýšit, pokud nekrvácí, dávka je správná“. Farmakokinetické profilování pacienta a využití získaných farmakokinetických údajů může napomoci tzv. ušít léčbu na míru danému pacientovi.
Mezi možné praktické překážky aplikace dávkování na základě individuálních farmakokinetických parametrů doposud patřil požadovaný počet odběrů krevních vzorků, doporučený Mezinárodní společností pro trombózu a hemostázu (International Society on Thrombosis and Haemostasis; 5 vzorků u dětí, min. 10 vzorků u dospělých), a dále absence programového vybavení (software), které by umožnilo jednoduše spočítat farmakokinetické parametry a vyvodit závěry pro následnou úpravu dávkování.
Farmakokinetické profilování umožňuje odhadnout křivku plazmatické koncentrace koagulačního faktoru (udávanou v procentech) a podle toho určit intervaly dávkování, případně dobu podání vyhovující způsobu života pacienta (tab. 3). Farmakokinetický profil je sestavován na základě výsledků série krevních odběrů – dle platných doporučení se u dospělých provádí v rozmezí 48–72 hodin jedenáct až dvanáct odběrů, u dětí pak pět až šest odběrů.
Nyní byl představen prostředek vyvinutý společností Baxter, který umožní hodnocení farmakokinetiky pacienta s hemofilií typu A jen ze dvou odběrů krevních vzorků. Jedná se o online aplikaci (zdravotnický prostředek) s názvem myPKFiT, která na základě vložených charakteristik pacienta a hodnot zjištěných ze dvou odebraných vzorků vypočte pomocí populačního farmakokinetického modelu a bayesiánské analýzy základní farmakokinetické parametry pacienta a navrhne optimální dávkovací schéma koagulačního faktoru.
Použitý populační model vznikl díky výsledkům tří klinických studií s přípravkem Advate® u pacientů se závažnou hemofilií typu A. Je založen na více než 2 000 odběrech od pacientů ve věkovém rozmezí 1–65 let (184 kompletních odběrů od 100 dospělých/dospívajících pacientů ve věku 10–65 let a 52 redukovaných odběrů od 52 dětí ve věkovém rozmezí 1–6 let).
Uvedený model založený na populační farmakokinetice dovoluje vypočítat parametry pro konkrétního pacienta při minimálním počtu odběrů krve. Snahou je i minimalizovat odchylky v odběrech vzorků krve – čím více lidí je zařazeno do populačního modelu, tím přesnější je odhad výsledku. Při dostatečném souboru a analýze farmakokinetiky pak stačí doplnit jednu až dvě naměřené hodnoty (informace) ke zjištění individuálních parametrů (bayesiánská analýza).
Farmakokinetická analýza umožňuje lékařům zjistit vhodnost indikované léčby (přijatelnost léčby pro pacienta při jejím dostatečném účinku), pacientům umožní přizpůsobit životní styl dávce nebo přizpůsobit dávku životnímu stylu. Díky znalosti farmakokinetické křivky může lékař poskytnout pacientovi srozumitelnou informaci o tom, za jak dlouho poklesne koncentrace faktoru v jeho organismu na kritické hodnoty a co to znamená pro jeho běžný každodenní život a aktivity. Na základě analýzy hodnot lze zjistit, jak optimálně nastavit léčbu – stanovit maximální interval, který si lze dovolit, aby léčba byla ještě účinná, tedy např. aby hodnota koagulačního faktoru byla u aktivního sportovce vyšší než 12 %, aniž by bylo třeba omezovat jeho aktivity. Pacient tak získává mnohem lepší kontrolu nad svou nemocí i léčbou (přesně např. ví, kdy je chráněn a kdy může např. sportovat).
Farmakokinetické profilování je součástí aktuálních doporučení hemofilických center, poskytuje informaci lékaři a také pacientovi umožňuje lépe pochopit zákonitosti; výstupem užití této metody jsou farmakokinetická data („trough“ koncentrace, maximální plazmatická koncentrace, výpočet IVR, čas, kdy jsou hodnoty koagulačního faktoru < 12 %, resp. < 3 %, < 1 %) a jejich korelace s klinickým obrazem (rizikem krvácení); cílem je objasnit pacientovi postup, jakým případně upravit denní aktivity. Zautomatizovaná metoda poskytuje vyšší bezpečnost např. v akutních situacích – při úrazu lze na základě času a předpokládané plazmatické koncentrace koagulačního faktoru stanovit, jak je třeba postupovat (ve které fázi dávkovacího intervalu se pacient v době úrazu nachází, jaká je tedy předpokládaná koncentrace koagulačního faktoru v jeho krvi).
Riziko vzniku inhibitoru srážecích faktorů
Nejzávažnější komplikací léčby hemofilie je vznik inhibitoru koagulačních faktorů. Organismus hemofilika začne vytvářet protilátky proti srážecímu faktoru, který je substituován do organismu. Protilátky se vážou na molekulu faktoru a blokují jeho funkci v hemostáze. Léčba hemofilie je tudíž neúčinná a pacient vyžaduje speciální léčebný přístup.
Riziko vzniku inhibitoru je nejvyšší u těžké hemofilie A (protilátky vznikají u 25–30 % dětí s těžkou hemofilií A, v České republice je to dle dat Českého národního hemofilického programu 26 % dětí s těžkou hemofilií A). Ke vzniku inhibitoru dochází většinou během prvních 50 dnů podávání koagulačního faktoru. Na vznik inhibitoru mají významný vliv tyto rizikové faktory:
- defekty genu pro FVIII (typ mutace),
- stav imunitního systému,
- rodinná anamnéza týkající se tvorby inhibitoru,
- etnická příslušnost (Afrika),
- tzv. nebezpečné signály, které stimulují imunitní odpověď (vakcinace, infekce, operace, akutní krvácení).
Vliv použité léčby na vznik inhibitoru
Dlouho diskutovanou otázkou bylo, do jaké míry ovlivňuje riziko vzniku inhibitoru užitý přípravek (plazmatické koncentráty versus rekombinantní přípravky). Současná data uvádějí, že nelze potvrdit větší riziko vzniku inhibitoru u žádné z obou skupin a že změny v použitém přípravku nevedou ke zvýšenému riziku vzniku inhibitoru. Studie, které uváděly jiné závěry, nebyly srovnatelné z hlediska uspořádání (různé dny expozice, retrospektivní hodnocení atd.) [5].
Další řešenou otázkou bylo profylaktické podávání koagulačních faktorů versus léčba „on demand“. Problematikou vzniku inhibitoru se zabývala v letech 1990–2000 studie CANAL (Concerted Action on Neutralizing Antibodies in severe haemophilia A), do níž bylo zařazeno 332 dětí s těžkou hemofilií A. Studie prokázala, že pravidelná profylaxe u dříve neléčených dětí s těžkou hemofilií A je spojena s 60% poklesem rizika vzniku inhibitoru ve srovnání s dětmi léčenými „on‑demand“ [6]. Profylaktická léčba je tedy kromě dalších předností vhodným přístupem pro minimalizaci rizika vzniku inhibitoru. Ideální je primární profylaktická léčba, tedy preventivní léčba, která začíná kolem prvního roku života dítěte s cílem předcházet krvácením.
Léčba s pozitivními přínosy medicínskými i ekonomickými
Jak již bylo řečeno, využití profylaxe, tedy preventivního podávání koncentrátů chybějících faktorů krevního srážení, dokáže významně zmírnit rozsah postižení pohybového aparátu, a v ideálním případě dokonce zabránit jeho rozvinutí. Hlavní charakteristiky profylaktické léčby důležité pro přístup k léčbě shrnuje tab. 4.
Pokud hemofilik díky tomuto postupu krvácí do kloubů pouze jednou či maximálně dvakrát ročně, je jeho organismus schopen tento malý počet krvácení zvládnout vlastními regeneračními mechanismy, a to bez dalších následků. Proto se za ideální považuje tzv. profylaxe primární, s níž se začíná kolem prvního roku života dítěte, často ještě před prvními významnými projevy krvácení.
Profylaxe však není jen cestou k zachování kloubního zdraví; je navíc schopna až o 60 % snížit riziko vzniku inhibitoru. Jestliže hemofilie je již sama o sobě velmi těžkou celoživotní zátěží, přídatným komplikujícím faktorem může být vznik inhibitoru srážecích faktorů. Ten je nejobávanější a také nejnákladnější komplikací hemofilické léčby. Pro děti, u nichž se inhibitor vyskytne, je sice k dispozici tzv. imunotoleranční léčba, která v 80 % případů dokáže inhibitor eliminovat, nicméně i v těchto případech platí, že prevence je vždy účinnější a levnější než léčba následků. Díky tomuto přístupu je dnes medián počtu kloubních krvácení u našich dětí dva případy ročně a populace českých dětí s hemofilií patří k těm s nižším výskytem inhibitoru v Evropě.
Na aplikaci profylaktické léčby lékaři apelují stále častěji. Podstatou tohoto přístupu je dlouhodobá, případně celoživotní aplikace koncentrátu srážecího faktoru v takových dávkách a intervalech, aby hladina faktoru nikdy nepoklesla ideálně pod 2–5 %. Rychlost poklesu srážecího faktoru je individuální, lékaři však dnes mohou využívat tzv. farmakokinetickou křivku, díky které dovedou přesně stanovit dobu, kdy je nutné aplikovat další dávku léku. Pacient tak získává lepší kontrolu nad svojí léčbou i nemocí, protože přesně ví, kdy je chráněn a může například sportovat. V současnosti se profylaktická léčba využívá standardně u dětí, má však na ni nárok i každý dospělý hemofilik. Přesto tento přístup zatím využívá jen < 50 % dospělých s těžkou formou hemofilie. Profylaktická léčba jim pomáhá předcházet krvácením, kterých může v případě těžkého hemofilika být až padesát za rok. Podle lékařů by každý z nich měl vědět o možnostech a přínosu profylaktické léčby.
Léčba hemofilie vyšla sice v loňském roce zdravotní pojišťovny na částku 676 milionů korun, nicméně touto vzácnou krevní poruchou trpí jen zhruba tisícovka Čechů a jejich počet se nezvyšuje. Preventivní léčba „šitá na míru“ může snížit počet krvácení, pacientům zvýší kvalitu života a pojišťovnám pomůže optimalizovat náklady na léčbu.
V České republice se daří rychle rozšiřovat nejen dostupnost profylaxe pro děti s těžkou formou hemofilie (88,9 %), ale též její personalizovanou formu podle farmakokinetických parametrů zjišťovaných individuálně u jednotlivých pacientů. Znalost těchto hodnot výrazně zvyšuje možnost optimalizovat jednak dávky podávaného faktoru, jednak intervaly mezi jednotlivými infuzemi (u některých pacientů se tak dávka sníží nebo se interval prodlouží a naopak). I když tedy nelze říci, že využití farmakokinetiky vede přímo k úsporám finančních prostředků, rozhodně umožňuje jejich lepší využití – při týchž nákladech na léčbu se dosahuje maximální účinnosti.
Závěr
V posledních letech se v léčbě hemofilie daří dosahovat pokroku v řadě směrů: vyšší virová bezpečnost plazmatických přípravků, důslednější prevence artropatie díky vyšší dostupnosti léčby, zkvalitnění psychologické a sociální péče, zdokonalování centralizované péče, přenosů dat a vytváření registrů. Lékaři se shodují v tom, že nejmodernější přístupy v léčbě hemofilie umožňují výrazně zvýšit kvalitu života pacientů a zároveň zefektivnit celý proces léčby. V neposlední řadě zamezí vzniku velké části nejzávažnějších komplikací onemocnění.
Třebaže nadále platí, že genetické faktory ovlivnit nelze, můžeme tím, jak léčíme, optimalizovat léčbu ekonomicky i medicínsky. Pro Českou republiku platí, že dětem, které profylaxi potřebují, se jí také dostává. Počet krvácení do kloubů u dětí s hemofilií je v ČR nízký (medián 2 ročně). Hemofilická centra nabízejí léčbu zohledňující potřeby jednotlivce (farmakokinetické profilování), která je optimální nejen po stránce medicínské, ale i nákladové (maximalizace nákladové efektivity).
Vznik inhibitorů koagulačních faktorů je nejzávažnější a nejnákladnější komplikací léčby hemofilie. Jeho incidence je v ČR u dolní hranice publikovaného rozmezí (26 % dříve neléčených pacientů s těžkou hemofilií A). Léčba těch, u nichž se inhibitor přesto vyvine, je však extrémně náročná a nákladná (až desítky milionů Kč ročně).
Je samozřejmě možné stále ještě mnohé zlepšit, nicméně již dnes lze konstatovat, že Česká republika je v oblasti profylaktické léčby a léčby hemofilie u dětí velmi úspěšná. Díky sofistikovanému systému péče o osoby s hemofilií, který představuje síť hemofilických center, multidisciplinární tým odborníků, zapojení pacientských a rodičovských organizací, úhrada léčby ze systému zdravotního pojištění atd., patří dnes ČR k těm zemím, v nichž dítě s hemofilií je prakticky k nerozeznání od dítěte zdravého. Bez tohoto komplexního přístupu a bez spolupráce lékařů a ostatních zdravotníků, pacientů a jejich rodičů, bez organizátorů, plátců a poskytovatelů zdravotní péče by tomu rozhodně takto být nemohlo. Nelze totiž zapomínat na to, že není tak daleko doba, kdy hemofilie byla onemocněním upoutávajícím postižené již v první či druhé dekádě života na invalidní vozík a mnohdy hrozícím i tím, že první krvácení bude zároveň posledním.
Profylaktická léčba u pacientů s hemofilií je účinná a s ohledem na pravděpodobnou invalidizaci pacienta profylakticky neléčeného i farmakoekonomicky výhodná. Farmakokinetická analýza je přístupem pro její další optimalizaci a personalizaci. Cílem je umožnit pacientovi, aby ze své léčby vytěžil maximum a mohl přizpůsobit své aktivity své léčbě anebo léčbu svým aktivitám. Znalost farmakokinetického „chování“ pacienta jako odpovědi na podání koagulačního faktoru je účinným nástrojem efektivního využití léčby. Farmakokinetické charakteristiky pacienta nelze odvodit jen na základě tělesné hmotnosti nebo věku, ale mohou byt určeny na základě zjištěných aktuálních hodnot koagulačního faktoru a bayesiánské analýzy. Odběry vzorků krve, jejich analýza a zjištění farmakokinetických parametrů umožňují určit dávkovací schéma koagulačního faktoru „šité na míru“ pro konkrétního pacienta a zlepšit jeho aktuální stav i vyhlídky. Současně navíc rovněž dochází k efektivnímu využití prostředků na léčbu.
Seznam použité literatury
- [1] Blatný J, Hrachovinová I, Hrdličková R, et al. Diagnostika a léčba hemofilie. Doporučený postup 2012. Český národní hemofilický program
- [2] Nilsson IM, Hedner U, Ahlberg A. Haemophilia prophylaxis in Sweden. Acta Paediatr Scand 1976; 65: 129–135.
- [3] Fisher K. Prophylaxis for adults with haemophilia: one size does not fit all. Blood Transfus 2012; 10; 169–173.
- [4] Gringeri A, Lundin B, von Mackensen S, et al.; ESPRIT Study Group. A randomized clinical trial of prophylaxis in children with hemophilia A (the ESPRIT Study). J Thromb Haemost 2011; 9: 700–710.
- [5] Peerlinck K, Jacquemin M. Characteristics of inhibitors in mild/moderate haemophilia A. Haemophilia 2006; 12 (Suppl 6): 43–47.
- [6] Gouw SC, van der Bom JG, Auerswald G, et al. Recombinant versus plasma derived factor VIII products and the development of inhibitors in previously untreated patients with severe hemophilia A: the CANAL cohort study. Blood 2007; 109: 4693–4697.