Menopauzální hormonální léčba – aktuální sta
Souhrn:
Cílem menopauzální hormonální terapie (MHT) je eliminace menopauzálních symptomů, zejména návalů horka. Mezi ostatní symptomy související s perimenopauzou a postmenopauzou, které jsou ovlivnitelné estrogenní terapií (ET), patří poruchy nálad, genitourinární syndrom a poruchy spánku spojené s návaly horka. Zdravé symptomatické ženy v pátém decenniu by měly být informovány, že absolutní riziko komplikací zdravých postmenopauzálních žen užívajících MHT po dobu pěti let je velmi nízké. Zdravým peri‑ a postmenopauzálním ženám do deseti let po menopauze ve věku do šedesáti let se středními až závažnými formami vazomotorických symptomů by měla být MHT doporučena jako léčebná metoda volby. Výjimkou jsou ženy s anamnézou karcinomu prsu, ischemickou chorobou srdeční, anamnestickou hlubokou žilní trombózou nebo s plicní embolií, cévní mozkovou příhodou, aktivním jaterním onemocněním nebo s rizikovými faktory těchto komplikací. Všechny typy a způsoby podání estrogenů jsou v léčbě návalů horka stejně účinné, transdermální přípravky vykazují nižší riziko žilní tromboembolie a vzniku cévní mozkové příhody. U žen s intaktní dělohou, které zvolí ET, musí být podána i progestagenní terapie, aby se zabránilo hyperplazii a karcinomu endometria. Jako progestin první volby je doporučován mikronizovaný progesteron, neboť je účinný v prevenci endometriální hyperplazie, je metabolicky neutrální a pravděpodobně nezvyšuje riziko karcinomu prsu a ischemické choroby srdeční. Data podporující tento předpoklad jsou však omezená. U žen netolerujících standardní perorální progestiny je alternativní možností nitroděložní systém s levonorgestrelem nebo kombinace konjugovaných estrogenů s bazedoxifenem.
Key words: menopausal hormonal therapy – estrogens – progestins – risks and benefits of hormonal therapy – endometrial hyperplasia.
Summary:
The goal of menopausal hormone therapy (MHT) is to relieve menopausal symptoms, most importantly hot flashes. Other symptoms associated with perimenopause and postmenopause that respond to estrogen therapy (ET) include mood lability, genitourinary syndrome of menopause and sleep disturbances related to hot flashes. Healthy symptomatic women in their 50s should be reassured that the absolute risk of complications for healthy, postmenopausal women taking MHT for five years is very low. For healthy, peri‑/postmenopausal women within 10 years of menopause aged < 60 with moderate‑to‑severe vasomotor symptoms, MHT should be recommended as the treatment of choice. Exceptions include women with a history of breast cancer, coronary heart disease (CHD), a previous venous thromboembolic event or stroke, active liver disease, or those at high risk for these complications. All types and routes of estrogen administration are equally effective in the treatment of hot flashes, but transdermal preparations are associated with a lower risk of venous thromboembolism and stroke. For women with an intact uterus who choose ET, progestagen therapy must be added to prevent endometrial hyperplasia and carcinoma. Micronized progesterone is recommended as the first‑choice progestin because it is effective for the prevention of endometrial hyperplasia, metabolically neutral, and does not appear to increase the risk of either breast cancer or CHD, although data are limited. For women unable to tolerate standard oral progestins, alternative approaches include a levonorgestrel‑releasing intrauterine system or the combination of conjugated estrogen with bazedoxifene.
Základní pojmy
Klimakterium je období postupného útlumu funkce vaječníků s projevy specifické symptomatologie označované jako klimakterický syndrom. Menopauza je poslední cyklické krvácení hodnocené retrospektivně, kdy po epizodě krvácení nastává absence krvácení v trvání delším než jeden rok. Období po menopauze se označuje jako postmenopauza. Perimenopauza je časový interval jeden rok před menopauzou a jeden rok po menopauze, kdy se obvykle manifestují vazomotorické symptomy a nepravidelnosti menstruačního cyklu.
Klimakterický syndrom
Jako klimakterický syndrom jsou označovány symptomy související s poklesem folikulární aktivity, s postupným snižováním sérové koncentrace estrogenů a fluktuace sérové koncentrace gonadotropinů.
Typickými příznaky jsou záchvatovité návaly horka, nespavost, přírůstek tělesné hmotnosti, otoky, změny nálad, nepravidelné krvácení z rodidel, mastodynie a bolesti hlavy. Doba trvání klimakterického syndromu je variabilní. Obvykle začíná již v premenopauze a končí 5−10 let po menopauze. Klimakterický syndrom má projevy psychosociální, vegetativní, organické, metabolické a psychické. Vegetativní poruchy jsou nejnápadnějšími a nejčastěji se vyskytujícími projevy klimakterického syndromu. Postihují až 80 % perimenopauzálních žen, z nichž 20–30 % vyhledá lékařskou pomoc. Více než 80 % žen, u kterých se návaly objeví, jimi trpí více než jeden rok. Ve většině případů vymizejí do 5 let, 9 % žen trpí návaly i po 70. roce života [1]. Organické projevy klimakterického syndromu zahrnují atrofizaci kůže a kožních adnex, sliznic s projevy suchosti a změny poševního pH v důsledku změn vaginální mikroflóry. Může se manifestovat tzv. atrofická cystitida imitující zánět močových cest. Z hlediska obecného zdraví jsou nejvýznamnější metabolické poruchy zahrnující osteoporózu a změny spektra plazmatických lipidů zvyšující riziko aterosklerózy. Do klimakterického syndromu jsou někdy řazeny i psychické poruchy. Dochází ke změnám kognitivních a afektivních funkcí. Časté jsou i poruchy spánku, které mohou přímo souviset s depresivní reakcí nebo mohou být v souvislosti s vegetativními projevy. V období klimakteria se zvyšuje výskyt depresí, který klesá krátce po menopauze [2].
Diagnostika klimakterického syndromu a menopauzy
Diagnóza klimakteria a menopauzy je u žen starších 45 let založena na typických změnách profilu menstruačního krvácení a na manifestaci obvyklých symptomů. Pro diagnózu menopauzy je určující interval 12 měsíců absence děložního krvácení. U žen ve věkové kategorii 40–45 let je třeba vyloučit i jiné endokrinní poruchy, které by mohly vést k poruchám menstruačního cyklu. U žen ve věku nižším než 40 let je stav typických změn menstruačního cyklu a manifestace klimakterického syndromu hodnocen jako předčasné ovariální selhání a je indikováno vyšetření tzv. ovariální rezervy. V diagnostice předčasného ovariálního selhání se stanovuje plazmatická koncentrace folikulostimulačního hormonu (FSH) nebo antimülleriánského hormonu (AMH). U žen užívajících hormonální antikoncepci je nutné vysadit antikoncepci alespoň jeden týden před vyšetřením FSH. Koncentrace FSH > 40 IU/l a AMH < 0,3 ng/ml jsou typické pro ovariální selhání.
Místo hormonální terapie v léčbě klimakterického syndromu
Hormonální terapie představuje velmi
účinnou modalitu v terapii symptomů tzv. klimakterického
syndromu. Používají se estrogeny buď samotné, nebo v kombinaci
s progestiny. Hormonální terapie v léčbě
klimakterického syndromu je v současné době označována
jako menopauzální hormonální terapie (MHT). Střední věk
menopauzy je 51 let, 95 % žen má menopauzu ve věku 45–55
let. Nejčastějším symptomem tzv. klimakterického syndromu jsou
návaly horka, které postihují přibližně 80 % žen v období
perimenopauzy [3]. Menopauzální hormonální terapie je účinná
též v léčbě vulvovaginální atrofie a v 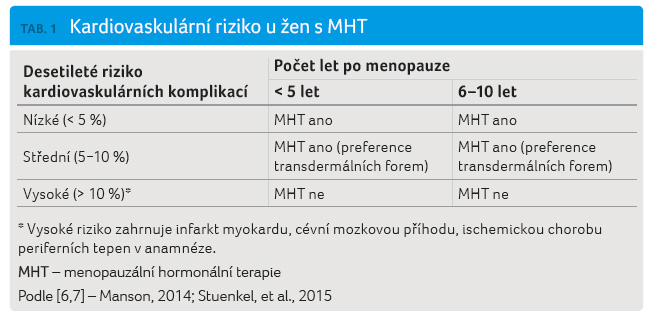 některých
případech i v léčbě psychických poruch v období
klimakteria [4]. Preskripce MHT by měla být podle posledních
vědeckých poznatků přísně individualizovaná s posouzením
rizik vzniku kardiovaskulárních komplikací, karcinomu prsu,
osteoporózy a demence. Výhody MHT převažují rizika
u většiny symptomatických žen ve věku do 60 let
a v intervalu kratším než 10 let po menopauze
(tab. 1) [5−7].
některých
případech i v léčbě psychických poruch v období
klimakteria [4]. Preskripce MHT by měla být podle posledních
vědeckých poznatků přísně individualizovaná s posouzením
rizik vzniku kardiovaskulárních komplikací, karcinomu prsu,
osteoporózy a demence. Výhody MHT převažují rizika
u většiny symptomatických žen ve věku do 60 let
a v intervalu kratším než 10 let po menopauze
(tab. 1) [5−7].
Estrogeny
Estrogeny jsou dostupné v mnoha formách, perorální, transdermální, vaginální, ve formě podkožních implantátů a vaginálních kroužků. Estrogeny ve formě podkožního implantátu a vaginálního kroužku nejsou v současné době v České republice dostupné.
Indikovaná denní dávka estrogenů je u žen léčených pro klimakterický syndrom nižší, než vyžadují ženy s předčasným ovariálním selháním.
Perorálně aplikované estrogeny vykazují vyšší first pass efekt vzhledem k jejich absorpci v tenkém střevě a vysoké koncentraci v portálním řečišti, než je tomu u transdermálních forem estrogenů. Perorálně podané estrogeny zvyšují plazmatickou koncentraci globulinu vázajícího pohlavní hormony (sex hormon binding globulin, SHBG), triglyceridů, lipoproteinů o vysoké hustotě (HDL), cholesterolu a koagulačních faktorů [8,9]. Saturace žluči cholesterolem je ovlivňována pouze perorálně podávanými estrogeny, nikoliv transdermálními přípravky [10]. Všechny dostupné estrogeny jsou v léčbě klimakterického syndromu srovnatelně účinné, zejména v ovlivnění projevů návalů horka [11]. Transdermální estrogeny jsou srovnatelně účinné s perorálními estrogeny, v prevenci redukce kostní denzity jsou zatíženy nižším rizikem výskytu hluboké žilní trombózy [8,9].
Perorální estrogeny
Konjugované equinní estrogeny obsahují zejména estron sulfát a malé množství equilin sulfátu a dihydroequilin sulfátu a jsou získávány z moči březích klisen. Syntetické konjugované estrogeny jsou získávány z rostlinných zdrojů. V České republice nejsou v současné době registrovány [12]. Perorální mikronizovaný 17β estradiol je strukturálně identickým hormonem s ovariálním estradiolem. Pro absorpci z gastrointestinálního traktu je nutná jeho mikronizace, v jiném stavu se nevstřebává. Esterifikované estrogeny vznikají z plazmatického estradiolu a estronu a jsou srovnatelné s konjugovanými estrogeny [13]. Ethinylestradiol je syntetický estrogen používaný v perorální kombinované hormonální antikoncepci. Ve srovnání s ostatními estrogeny je vysoce účinný a lze jej používat ve velmi nízkých dávkách (2,5–5 µg).
Různé estrogeny podávané perorálně mají srovnatelnou účinnost. Konjugované estrogeny a estron sulfát jsou absorbovány z gastrointestinálního traktu v biologicky inaktivní formě [14]. Perorální estradiol je konvertován na estron sulfát v játrech, ale i v jiných tkáních. Cirkulující estron sulfát představuje největší estrogenní pool v cirkulaci. Estron sulfát je dále dekonjugován a konvertován na aktivní estradiol [15]. Biologický účinek a terapeutická dávka používaných estrogenů se liší pouze minimálně.
Transdermální estrogeny
Transdermální estrogenní přípravky jsou založeny na podání 17β estradiolu formou náplastí v dávce 14–100 µg denně; 14 µg 17β estradiolu denně je nejnižší dávka, která může působit preventivně proti osteoporóze a eliminuje návaly horka. K transdermálnímu užití jsou určeny i přípravky na bázi gelu s denním dávkováním 0,52–1,0 mg estradiolu nebo spreje s denní dávkou estradiolu 1,53 mg [16−19].
Vaginální estrogeny
Vaginálně aplikované estrogeny jsou užívány zejména v léčbě vulvovaginální atrofie s užitím velmi nízkých dávek estrogenů (≤ 50 µg estradiolu denně). Vaginální aplikace estradiolu v dávce 50–100 µg je efektivní v léčbě vazomotorických symptomů klimakterického syndromu. U žen s dělohou a funkčním endometriem je nutné současné podání progestinu v prevenci hyperplazie endometria [20]. Estriol je slabý estrogen efektivní v lokální terapii vulvovaginální atrofie již v dávce 50 µg. Vede ke snížení vaginálního pH a k eliminaci symptomů vulvovaginální atrofie [21]. Estriol ve formě vaginálního krému nebo vaginálních globulí se podává v dávce 0,5–1 mg denně. Vaginální krém i vaginální globule jsou srovnatelné svým terapeutickým účinkem, farmakokinetickými vlastnostmi, výskytem nežádoucích účinků i profilem bezpečnosti [22].
Ekvivalentní dávky používaných
estrogenů jsou uvedeny v tabulce 2. Uvedené dávky estrogenů mají shodný potenciál
prevence úbytku kostní denzity a úlevy od vazomotorických
symptomů. Při léčbě vazomotorických projevů klimakterického
syndromu je vhodné začínat co nejnižší dávkou estrogenů
a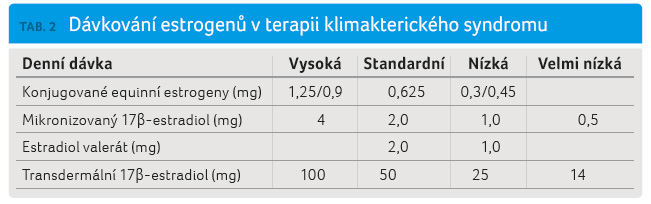 zvyšovat ji pouze tehdy, nevede li k žádoucímu
léčebnému účinku.
zvyšovat ji pouze tehdy, nevede li k žádoucímu
léčebnému účinku.
Progestiny
U žen s dělohou je nutné podávat v rámci hormonální terapie kromě estrogenů i progestiny, které jsou účinné v prevenci hyperplazie endometria.
Medroxyprogesteron acetát
Medroxyprogesteron acetát je velmi častým progestinem podávaným v rámci hormonální terapie v peri a postmenopauze. Je účinný v denní dávce 5–10 mg. Aplikace depotního medroxyprogesteron acetátu v intervalu 3 měsíce vede ke srovnatelné prevenci hyperplazie endometria jako perorálně aplikovaný medroxyprogesteron acetát, je však zatížena častějším výskytem neplánovaného a silného krvácení [23].
Progesteron
Mikronizovaný progesteron pro perorální užití je účinný v prevenci hyperplazie endometria a současně neovlivňuje negativně spektrum plazmatických lipidů. Podává se v denní dávce 200 mg [24]. Podle některých uskutečněných studií lze u žen netolerujících perorální aplikaci hormonů v rámci hormonální terapie v peri a postmenopauze použít i vaginální aplikaci progesteronu [25].
Mikronizovaný progesteron je doporučován jako přípravek první volby, neboť je vysoce účinný v prevenci hyperplazie endometria, má neutrální metabolický účinek a nezvyšuje riziko karcinomu prsu a kardiovaskulárních komplikací.
Dydrogesteron
Dydrogesteron je derivát progesteronu s výhradně progestagenním efektem. Vykazuje metabolickou neutralitu, která významně omezuje rizika MHT. Používá se v rámci kombinované MHT v denní dávce 2,5–5 mg.
Norethisteron
Norethisteron je derivát 19 nortestosteronu. Má silný progestagenní účinek, slabý androgenní a estrogenní účinek. Velmi dobře stabilizuje endometrium. Je využíván v rámci kombinované MHT v denní dávce 0,5–1 mg.
Levonorgestrel
Levonorgestrel je derivát 19 nortestosteronu. Má extrémně vysokou vazebnou kapacitu k receptorům pro progesteron, slabší afinitu k receptorům pro testosteron, mineralokortikoidy a estrogeny. V kombinované MHT se používá v denní dávce 0,15 mg.
Trimegeston acetát
Trimegeston acetát je derivát 19 norprogesteronu. Trimegeston je vysoce selektivní progestin s vysokou vazebnou afinitou k progesteronovým receptorům. Naproti tomu nevykazuje vazebnou afinitu k receptorům estrogenovým a má velice slabou afinitu k receptorům pro androgeny, glukokortikoidy a mineralokortikoidy. Používá se v kombinované MHT v denní dávce 0,25 mg [26,27]. Kombinovaný přípravek MHT s obsahem trimegeston acetátu není v současné době v České republice registrován.
Drospirenon
Drospirenon je progestin odvozený od 17α spironolaktonu, který disponuje kromě antiandrogenního účinku též významným efektem antimineralokortikoidním. V kombinované MHT se využívá jeho antimineralokortikoidní a antiandrogenní efekt. Obvyklou denní dávku představují 2 mg.
Dienogest
Dienogest je derivát 19 nortestosteronu. Má mírnou, ale vysoce selektivní afinitu k progesteronovým receptorům, která představuje 10 % vazebné afinity progesteronu. Přesto však působí velmi intenzivním progestagenním efektem, který je přibližně čtyřikrát silnější než účinek ostatních progestinů. Dienogest velmi účinně suprimuje proliferaci endometriálního stromatu. Tato vlastnost vysvětluje jeho příznivý účinek v léčbě silného děložního krvácení a endometriózy. Používá se v denní dávce 2 mg [28,29].
Cyproteron acetát
Cyproteron acetát je derivát 17 hydroxyprogesteronu, vykazuje vysokou afinitu k receptorům pro testosteron, a má tak výrazný antiandrogenní účinek. Je využíván v rámci kombinované MHT pro své antiandrogenní účinky v potlačení projevů virilizace. Je používán v denní dávce 1 mg.
Nitroděložní systém s levonorgestrelem
Nitroděložní systém s levonorgestrelem (LNG IUS) představuje kontracepční metodu, která je zároveň vysoce účinná v prevenci hyperplazie a karcinomu endometria. Lze ji tedy doporučit i pro ženy, které užívají hormonální terapii v peri a postmenopauze [30]. LNG IUS dosahuje výrazné suprese proliferace endometria při velmi nízkých systémových koncentracích levonorgestrelu. V indikaci hormonální terapie je vhodné použít LNG IUS obsahující 52 mg levonorgestrelu, který uvolňuje 20 µg levonorgestrelu denně. LNG IUS je stejně účinný v prevenci hyperplazie endometria jako systémová aplikace progestinů, nebo dokonce účinnější [31,32].
Konjugované estrogeny v kombinaci s bazedoxifenem
Bazedoxifen je selektivní modulátor estrogenových receptorů (SERM). V kombinaci s konjugovanými estrogeny je indikován k léčbě menopauzálních vazomotorických symptomů a v prevenci osteoporózy [33]. Bazedoxifen velmi účinně suprimuje proliferaci endometria a zabraňuje tak jeho hyperplazii. Léčba konjugovanými estrogeny pak nevyžaduje další progestagenní komponentu. Kombinovaná léčba konjugovanými estrogeny v dávce 0,45 mg a 2 mg bazedoxifenu pozitivně ovlivňuje kostní metabolismus, současně působí neutrálně na prsní tkáň [34]. Přípravek je vhodný pro ženy se středními a těžkými vazomotorickými symptomy, které netolerují obvyklou estro progestagenní hormonální terapii, např. pro výskyty mastodynií. Podobně jako ostatní SERM zvyšuje bazedoxifen riziko žilního tromboembolismu [35].
Tibolon
Tibolon je syntetický steroid, jehož metabolity vykazují estrogenní, progestagenní i androgenní účinek. V denní dávce 2,5 mg snižuje četnost a závažnost vazomotorických symptomů a zvyšuje hustotu kostní tkáně. V léčbě návalů je o něco méně účinný než terapie estrogeny. Tibolon zvyšuje riziko rekurence karcinomu prsu a zvyšuje též riziko ischemické mozkové příhody u žen starších šedesáti let [36].
Typy hormonální terapie
Neoponované estrogeny
Neoponované estrogeny lze použít pouze u žen po hysterektomii. Podávání samotných estrogenů u žen s dělohou se všeobecně nedoporučuje pro vysoké riziko vývoje hyperplazie endometria a endometriálního karcinomu. U žen, kterým byly aplikovány samotné estrogeny, byla pozorována sekundární amenorea v 75 % případů a u 25 % z nich nepravidelné intermitentní krvácení slabé intenzity. Profil krvácení nekoreloval s histologickým nálezem hyperplazie endometria [37].
Kombinovaná cyklická hormonální terapie
Kombinovaná cyklická hormonální terapie spočívá v kontinuální aplikaci estrogenů a v kombinaci estrogenu s progestinem po dobu 2 týdnů v každém cyklu. U 90 % uživatelek se vyskytuje cyklické krvácení po přerušení aplikace progestinu, u 25 % žen v průběhu jejich podávání. Krvácení je obvykle slabé intenzity [38].
Kombinovaná kontinuální hormonální terapie
Kontinuální aplikace spočívá v nepřetržitém podávání kombinace estrogenu s progestinem. Neplánované krvácení je velmi časté po dobu několika měsíců. Ženy, které začaly užívat hormonální léčbu za dobu delší než tři roky po menopauze, pozorovaly krvácení méně často než ženy, které zahájily léčbu krátce po menopauze [39].
Monitorování stavu endometria
Postmenopauzální krvácení je indikací k vyloučení endometriálního karcinomu, který se vyskytuje u 1–14 % případů krvácení. Při postmenopauzálním krvácení je indikováno bioptické vyšetření endometria. V rámci hormonální terapie klimakterického syndromu u žen s dělohou je nutné monitorovat stav endometria. Neoponovaná aplikace estrogenů a doba trvání podávání estrogenů zvyšuje riziko karcinomu endometria a je kontraindikována u žen s dělohou. Ochrana endometria vyžaduje adekvátní dávku a dobu aplikace progestinu. Pro dávku 2 mg estradiolu denně je odpovídající dávka 200 mg mikronizovaného progesteronu po dobu 10–14 dnů, nebo 100 mg podávaných kontinuálně. Při použití vyšších dávek estradiolu je třeba užít vyšších dávek progesteronu, to platí i pro obézní ženy [40]. Vaginální krvácení je častým symptomem u žen užívajících hormonální terapii v peri a postmenopauze. K vyloučení patologií endometria u žen s projevy krvácení je indikováno cílené ultrasonografické a bioptické vyšetření. Preventivní ultrasonografie endometria u asymptomatických žen užívajících MHT není všeobecně doporučována [41].
U žen, u kterých bylo pozorováno nepravidelné krvácení před zahájením hormonální terapie, je indikováno bioptické vyšetření endometria ještě před zahájením léčby. V prvních šesti měsících aplikace kontinuální hormonální terapie je nepravidelné krvácení slabé intenzity velmi časté a nevyžaduje bioptickou kontrolu. Pokud přetrvává déle než šest měsíců, je nutné provést ultrasonografické vyšetření, případně biopsii. Stejně tak, pokud se vaginální krvácení objeví po období sekundární amenorey [42].
Závěr
Indikace k MHT by měla být individualizována s přihlédnutím k rizikovým faktorům estrogen deficitního stavu a k možným kontraindikacím hormonální terapie. Ženy s menopauzou před 45. rokem, nebo dokonce před 40. rokem života jsou ohroženy metabolickými aspekty estrogen deficitního syndromu (kardiovaskulární morbiditou a osteoporózou) více než ženy s menopauzou v pozdějším věku. Pro ženy s předčasnou menopauzou a s předčasným ovariálním selháním je přínosná individualizovaná MHT. Poradenství v oblasti hormonální terapie je založeno na zvážení poměru rizik a výhod MHT, která by neměla být doporučena bez jasné indikace. Uživatelky by měly být dispenzarizovány nejméně v jednoročním intervalu. Pro trvání léčby neexistuje žádný daný limit, dávka a trvání se odvíjejí od indikace. Další pokračování léčby je stanoveno na základě informované dohody mezi lékařem a pacientkou. Menopauzální hormonální terapie je nejefektivnější léčebnou metodou vazomotorických symptomů klimakterického syndromu a vulvovaginální atrofie. Může vést ke zmírnění dalších obtíží, jako jsou změny nálad, bolesti kloubů a poruchy spánku. Individualizovaná MHT může příznivě ovlivnit sexuální dysfunkce a zlepšit tak sexualitu a kvalitu života. Je součástí celkové strategie zahrnující životní styl, dietní opatření, fyzickou aktivitu, vyloučení kouření a bezpečnou konzumaci alkoholu u peri a postmenopauzálních žen. Menopauzální hormonální terapie by měla být individualizována (prevence, osobní a rodinná anamnéza, preference, očekávání ženy). Rizika a výhody jsou různé v závislosti na věku a době uplynuvší od menopauzy.
Seznam použité literatury
- [1] Randolph JF Jr, Sowers M, Bondarenko I, et al. The relationship of longitudinal change in reproductive hormones and vasomotor symptoms during the menopausal transition. J Clin Endocrinol Metab 2005; 90: 6106–6112.
- [2] Cohen LS, Soares CN, Vitonis AF, et al. Risk for new onset of depression during the menopausal transition: the Harvard study of moods and cycles. Arch Gen Psychiatry 2006; 63: 385–390.
- [3] Gold EB, Colvin A, Avis N, et al. Longitudinal analysis of the association between vasomotor symptoms and race/ethnicity across the menopausal transition: study of women‘s health across the nation. Am J Public Health 2006; 96: 1226–1235.
- [4] Taylor HS, Manson JE. Update in hormone therapy use in menopause. J Clin Endocrinol Metab 2011; 96: 255–264.
- [5] Moyer VA, U.S. Preventive Services Task Force. Menopausal hormone therapy for the primary prevention of chronic conditions: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2013; 158: 47–54.
- [6] Manson JE. Current recommendations: what is the clinician to do? Fertil Steril 2014; 101: 916–921.
- [7] Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2015; 100: 3975–4011.
- [8] Chetkowski RJ, Meldrum DR, Steingold KA, et al. Biologic effects of transdermal estradiol. N Engl J Med 1986; 314: 1615–1620.
- [9] Walsh BW, Schiff I, Rosner B, et al. Effects of postmenopausal estrogen replacement on the concentrations and metabolism of plasma lipoproteins. N Engl J Med 1991; 325: 1196–1204.
- [10] Van Erpecum KJ, Van Berge Henegouwen GP, Verschoor L, et al. Different hepatobiliary effects of oral and transdermal estradiol in postmenopausal women. Gastroenterology 1991; 100: 482–488.
- [11] Stevenson JC, Cust MP, Gangar KF, et al. Effects of transdermal versus oral hormone replacement therapy on bone density in spine and proximal femur in postmenopausal women. Lancet 1990; 336: 265–269.
- [12] Baker VL. Alternatives to oral estrogen replacement. Transdermal patches, percutaneous gels, vaginal creams and rings, implants, other methods of delivery. Obstet Gynecol Clin North Am 1994; 21: 271–297.
- [13] Jurgens RW Jr, Downey LJ, Abernethy WD, et al. A comparison of circulating hormone levels in postmenopausal women receiving hormone replacement therapy. Am J Obstet Gynecol 1992; 167: 459–460.
- [14] O‘Connell MB. Pharmacokinetic and pharmacologic variation between different estrogen products. J Clin Pharmacol 1995; 35: 18S–24S.
- [15] Mashchak CA, Lobo RA, Dozono‑Takano R, et al. Comparison of pharmacodynamic properties of various estrogen formulations. Am J Obstet Gynecol 1982; 144: 511–518.
- [16] Archer DF, EstroGel Study Group. Percutaneous 17beta‑estradiol gel for the treatment of vasomotor symptoms in postmenopausal women. Menopause 2003; 10: 516–521.
- [17] Hedrick RE, Ackerman RT, Koltun WD, et al. Transdermal estradiol gel 0.1% for the treatment of vasomotor symptoms in postmenopausal women. Menopause 2009; 16: 132–140.
- [18] Buster JE, Koltun WD, Pascual ML, et al. Low‑dose estradiol spray to treat vasomotor symptoms: a randomized controlled trial. Obstet Gynecol 2008; 111: 1343–1351.
- [19] Fait T. Postavení transdermálního estrogenního spreje v léčbě klimakterického syndromu. Czech Gynaecology/Ceska Gynekologie [serial online]. February 2016; 81: 76.
- [20] Speroff L. Efficacy and tolerability of a novel estradiol vaginal ring for relief of menopausal symptoms. Obstet Gynecol 2003; 102: 823–834.
- [21] Dugal A, Hesla K, Sørdal T, et al. Comparison of usefulness of estradiol vaginal tablets and estriol vagitories for treatment of vaginal atrophy. Acta Obstet Gynecol Scand 2000; 79: 293–297.
- [22] Rueda C, Osorio AM, Avellaneda AC, et al. The efficacy and safety of estriol to treat vulvovaginal atrophy in postmenopausal women: a systematic literature review. Climacteric 2017; 16: 1−10.
- [23] Ettinger B, Selby J, Citron JT, et al. Cyclic hormone replacement therapy using quarterly progestin. Obstet Gynecol 1994; 83: 693−700.
- [24] Miller VT, LaRosa J, Barnabel V, et al. Effects of estrogen or estrogen/progestin regimens on heart disease risk factors in postmenopausal women. The postmenopausal estrogen/progestin interventions (pepi) trial. The writing group for the pepi trial. Jama 1995; 273: 199−208.
- [25] de Ziegler D, Ferriani R, Moraes LA, et al. Vaginal progesterone in menopause: Crinone 4% in cyclical and constant combined regimens. Hum Reprod 2000; 15 (Suppl 1): 149−158.
- [26] Sitruk‑Ware R, Bossemeyer R, Bouchard P. Preclinical and clinical properties of trimegestone: A potent and selective progestin. Gynecol Endocrinol 2007; 23: 310−319.
- [27] Koninckx PR, Spielmann D. A comparative 2‑year study of the effects of sequential regimens of 1 mg 17beta‑estradiol and trimegestone with a regimen containing estradiol valerate and norethisterone on the bleeding profile and endometrial safety in postmenopausal women. Gynecol Endocrinol 2005; 21: 82−89.
- [28] Köhler G, Faustmann TA, Gerlinger C, et al. A dose‑ranging study to determine the efficacy and safety of 1, 2 and 4 mg of dienogest daily for endometriosis. Int J Gynaecol Obstet 2010; 108: 21−25.
- [29] Kuhl H. Comparative pharmacology of newer progestogens. Drugs 1996; 51: 188−215.
- [30] Long ME, Faubion SS, MacLaughlin KL, et al. Contraception and hormonal management in the perimenopause. J Womens Health (2002) 2015; 24: 3−10.
- [31] Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection: A systematic review. Climacteric 2011; 14: 622−632.
- [32] Somboonporn W, Panna S, Temtanakitpaisan T, et al. Effects of the levonorgestrel‑releasing intrauterine system plus estrogen therapy in perimenopausal and postmenopausal women: Systematic review and meta‑analysis. Menopause (New York, NY) 2011; 18: 1060−1066.
- [33] Pinkerton JV, Utian WH, Constantine GD, et al. Relief of vasomotor symptoms with the tissue‑selective estrogen complex containing bazedoxifene/conjugated estrogens: a randomized, controlled trial. Menopause 2009; 16: 1116−1124.
- [34] Pinkerton JV, Harvey JA, Pan K, et al. Breast effects of bazedoxifene‑conjugated estrogens: a randomized controlled trial. Obstet Gynecol 2013; 121: 959−968.
- [35] Silverman SL, Christiansen C, Genant HK et al. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3‑year, randomized, placebo‑, and active‑controlled clinical trial. J Bone Miner Res 2008; 23: 1923–1934.
- [36] Formoso G, Perrone E, Maltoni S, et al. Short‑term and long‑term effects of tibolone in postmenopausal women. Cochrane Database Syst Rev 2016; 10: CD008536.
- [37] Schiff I, Sela HK, Cramer D, et al. Endometrial hyperplasia in women on cyclic or continuous estrogen regimens. Fertil Steril 1982; 37: 79–82.
- [38] Whitehead MI, Townsend PT, Pryse‑Davies J, et al. Effects of various types and dosages of progestogens on the postmenopausal endometrium. J Reprod Med 1982; 27 (8 Suppl): 539.
- [39] Udoff L, Langenberg P, Adashi EY. Combined continuous hormone replacement therapy: a critical review. Obstet Gynecol 1995; 86: 306–316.
- [40] Baber RJ, Panay N, Fenton A. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric 2016; 19: 109−150.
- [41] Munro MG. Investigation of women with postmenopausal uterine bleeding: Clinical practice recommendations. The Perm J 2014; 18: 55‑70.
- [42] North American Menopause Society. The 2012 hormone therapy position statement of: The North American Menopause Society. Menopause 2012; 19: 257–271.