Mepolizumab v léčbě eozinofilní granulomatózy s polyangiitidou
Souhrn
Žurková M, Jakubec P, Lošťáková V, Čtvrtlík F, Kriegová E. Mepolizumab v léčbě eozinofilní granulomatózy s polyangiitidou. Remedia 2023; 33: 66–72.
Eozinofilní granulomatóza s polyangiitidou (EGPA) je velmi vzácné multisystémové onemocnění charakterizované astmatem, hypereozinofilií v periferní krvi a histopatologickým obrazem nekrotizující vaskulitidy, extravaskulárních granulomů a tkáňové eozinofilie. Moiseev a kolektiv popsali ve své nedávné práci rozdělení pacientů s EGPA do dvou geneticky a klinicky odlišných syndromů na základě přítomnosti protilátek proti cytoplazmě neutrofilů (ANCA pozitivita). ANCA pozitivní EGPA představuje eozinofilní autoimunitní onemocnění, které sdílí podobné klinické rysy a HLA DQ asociaci s ANCA asociovanou vaskulitidou. U této skupiny je častá neuropatie a postižení ledvin – glomerulonefritida. Druhou skupinu tvoří ANCA negativní EGPA, která může mít původ v dysfunkci slizniční bariéry a dominují u ní plicní infiltráty a postižení srdce. Dále prezentujeme aktuální možnosti léčby EGPA pomocí monoklonální protilátky mepolizumab v kombinaci s kortikosteroidy, která se doporučuje v indukční terapii relabující a refrakterní EGPA. Na základě výsledků klinické studie MIRRA je u pacientů léčených mepolizumabem možné snížení dávky kortikosteroidů, což minimalizuje nežádoucí účinky dlouhodobé kortikoterapie u pacientů s EGPA.
Klíčová slova: EGPA – ANCA – mepolizumab.
Summary
Zurkova M, Jakubec P, Lostakova V, Ctvrtlik F, Kriegova E. Mepolizumab in treatment of eosinophilic granulomatosis with polyangiitis. Remedia 2023; 33: 66–72.
Eosinophilic granulomatosis with polyangiitis (EGPA) is a very rare multisystem disease characterized by asthma, hypereosinophilia in peripheral blood, and a histopathological pattern of necrotizing vasculitis, extravascular granulomas, and tissue eosinophilia. Recent work by authors Moiseevv et al. described the division of EGPA patients into two genetically and clinically distinct syndromes based on the presence of antibodies to neutrophil cytoplasm (ANCA positivity). ANCA‑positive EGPA represents an eosinophilic autoimmune disease that shares similar clinical features and HLA DQ association with ANCA‑associated vasculitis. Neuropathy and kidney damage – glomerulonephritis – are common in this group. The second group is ANCA‑negative EGPA, which may originate from mucosal barrier dysfunction and is dominated by pulmonary infiltrates and cardiac involvement. In this work, we present current treatment options for EGPA using the monoclonal antibody mepolizumab in combination with corticosteroids, which is recommended in the induction therapy of relapsed and refractory EGPA. Based on the results of the MIRRA clinical trial, the dose of corticosteroids can be reduced in patients treated with mepolizumab to minimise the adverse effects of long‑term corticosteroid therapy in patients with EGPA.
Key words: EGPA – ANCA – mepolizumab.
Úvod
Eozinofilní granulomatóza s polyangiitidou (EGPA), dříve nazývaná syndrom Churga–Straussové či alergická granulomatóza s angiitidou, je velmi vzácné multisystémové onemocnění charakterizované astmatem, hypereozinofilií v periferní krvi a histopatologickým obrazem nekrotizující vaskulitidy, extravaskulárních granulomů a tkáňové eozinofilie [1]. Incidence tohoto vzácného onemocnění se odhaduje na 0,5–6,8 nových případů na 1 milion obyvatel [2]. Prevalence EGPA se udává 10,7–13 případů na 1 milion obyvatel [3,4]. Toto onemocnění postihuje převážně dospělé, nejčastěji ve věku mezi 40 a 50 lety, lehce vyšší výskyt je u mužského pohlaví.
Jedná se o vzácné onemocnění, které se obtížně diagnostikuje. U pacientů často nacházíme v séru ANCA protilátky (protilátky proti cytoplazmě neutrofilů, antineutrophil cytoplasmic antibodies), které se vyskytují u 55–67 % případů [5]. Většinou se jedná o p‑ANCA (perinukleární protilátky proti myeloperoxidáze, MPO), méně často o typ c‑ANCA (cytoplazmatické protilátky proti proteináze) [6]. Kromě MPO+ANCA pozitivity je EGPA charakterizována několika dalšími imunologickými abnormalitami. Mezi nejvýraznější z nich patří převaha Th2 imunitní odpovědi s klinickými projevy alergie [7–10]. Nicméně lokálně v tkáních se pravděpodobně může manifestovat i Th1 imunitní odpověď s obrazem plicní angiocentrické granulomatózy. Nespecifickým laboratorním nálezem bývá vysoká sedimentace, vysoká hladina imunoglobulinu E (IgE), anémie a pozitivní revmatoidní faktor. Typickým laboratorním nálezem je eozinofilie v diferenciálním obraze přesahující 1,5 × 109/l. Vzhledem k jednotlivým orgánovým projevům je nutný laboratorní screening postižení ledvin (urea, kreatinin, cystatin, proteinurie, Hamburgerův sediment, případně clearance kreatininu). V rámci screeningu postižení srdce provádíme elektrokardiografii (EKG), EKG dle Holtera umožňující dlouhodobou registraci EKG křivky (většinou po dobu 24 hodin), magnetickou rezonanci srdce a při podezření na vaskulitidu koronárních arterií selektivní koronarografii.
Moiseev a kol. v nedávné práci rozdělují onemocnění do dvou odlišných syndromů na základě MPO+ANCA pozitivity [11] (obr. 1). Jedna skupina nemocných s EGPA má pozitivní MPO+ANCA protilátky a představuje eozinofilní autoimunitní onemocnění, které sdílí podobné klinické rysy a HLA DQ (skupina molekul hlavního histokompatibilního komplexu II) asociaci s MPO+ANCA asociovanou vaskulitidou. V této skupině pacientů se často vyskytuje neuropatie a postižení ledvin – glomerulonefritida. Druhou skupinu nemocných s EGPA tvoří pacienti MPO+ANCA negativní. Tento fenotyp EGPA může mít původ v dysfunkci slizniční bariéry a u pacientů dominují plicní infiltráty a postižení srdce.![OBR. 1 Rozdělení onemocnění podle ANCA statusu; podle [11] – Moiseev, et al., 2020. OBR. 1 Rozdělení onemocnění podle ANCA statusu; podle [11] – Moiseev, et al., 2020.](https://www.remedia.cz/1-23-67-photo-pg-952-367-392-.png)
Onemocnění typicky probíhá ve třech fázích, první fáze je charakterizována alergickými projevy, jmenovitě alergickou rinitidou s nosními polypy a bronchiálním astmatem. Nekrotické léze v oblasti horních cest dýchacích jsou neobvyklé. Ve druhé fázi se objevuje eozinofilie v krvi a ve tkáních s eozinofilními plicními infiltráty, tyto mohou vymizet spontánně nebo při léčbě kortikosteroidy. Dále bývají popisovány plicní nodulace, které nemají tendenci k rozpadu. Pleurální výpotek se objevuje v jedné třetině případů a má charakter exsudátu s vysokým počtem eozinofilů. V oblasti zažívacího traktu se může onemocnění manifestovat eozinofilní gastroenteritidou. Třetí fáze představuje stadium systémové vaskulitidy charakterizované celkovými projevy: únavností, horečkou, ztrátou hmotnosti, bolestmi kloubů, svalstva a projevy poškození jednotlivých orgánů [12] (tab. 1). Průměrný interval mezi začátkem astmatu a projevy vaskulitidy je tři roky, interval kratší se obvykle pojí s nepříznivou prognózou [6,13]. Na skiagramu hrudníku mohou být viditelné oboustranné, mnohočetné, někdy migrující infiltráty, vzácně s tvorbou dutin a s pleurálním výpotkem. Občas je skiagram hrudníku normální, přestože dle výpočetní tomografie s vysokým rozlišením (HRCT) jsou již přítomny charakteristické změny. Na HRCT plic se vyskytují ložiska opacit mléčného skla nebo kondenzace parenchymu. Objevují se ztluštění interlobulárních sept, nodulace a ztluštění stěn bronchů. Charakteristickým nálezem jsou rozšířené tepny s nepravidelnými a hvězdicovitými tvary. Tyto změny jsou podmíněny eozinofilní infiltrací přilehlých lymfatických cév. Diferenciální diagnostiku radiologického obrazu představuje eozinofilní pneumonie a granulomatóza s polyangiitidou (GPA, dříve nazývaná Wegenerova granulomatóza).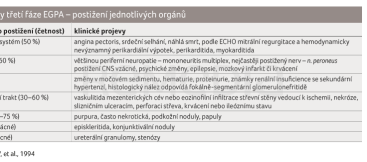
Pro funkční vyšetření nemocných s EGPA je typická reverzibilní obstrukční ventilační porucha (astma). Někteří nemocní mohou mít ireverzibilní obstrukci. Pokud je postižen plicní parenchym, dochází ke snížení vitální kapacity a usilovné vitální kapacity, v dalším průběhu můžeme zachytit také snížení difuzní kapacity plic. Vyšetření pulzní oxymetrií a vyšetření krevních plynů může pomoci zachytit poruchu výměny plynů v klidu i po zátěži. Bronchoskopie a bronchoalveolární laváž se provádějí u nemocných s nálezem infiltrátů či opacit při radiologickém vyšetření hrudníku a symptomech podezřelých z EGPA. Vyšetření bronchoalveolární laváže typicky ukazuje predilekční zastoupení eozinofilů (více než 33 %). Tyto nálezy však nejsou pro onemocnění EGPA specifické a mohou se vyskytovat i u nemocných s plicními eozinofiliemi jiné etiologie. Transbronchiální biopsie (TBB) mnohdy bývá nediagnostická. Pokud je přítomno kožní postižení či neurologické postižení, je biopsie těchto orgánů méně zatěžující a je preferována před plicní biopsií.
Pro diagnózu EGPA byla dosud platná kritéria American College of Rheumatology z roku 1990 (tab. 2)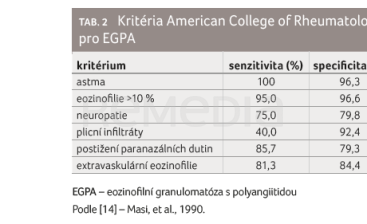 , která jsou založena na biopticky prokázané vaskulitidě z biopsie postiženého orgánu spolu se čtyřmi ze šesti kritérií: astma, eozinofilie větší než 10 %, neuropatie, plicní infiltráty, postižení paranazálních dutin a extravaskulární eozinofilie [14]. Přítomnost čtyř nebo více z těchto šesti kritérií značí diagnózu EGPA s 85% senzitivitou a 99,7% specificitou. V roce 2022 byla publikována nová klasifikační kritéria American College of Rheumatology [15] (obr. 2),
, která jsou založena na biopticky prokázané vaskulitidě z biopsie postiženého orgánu spolu se čtyřmi ze šesti kritérií: astma, eozinofilie větší než 10 %, neuropatie, plicní infiltráty, postižení paranazálních dutin a extravaskulární eozinofilie [14]. Přítomnost čtyř nebo více z těchto šesti kritérií značí diagnózu EGPA s 85% senzitivitou a 99,7% specificitou. V roce 2022 byla publikována nová klasifikační kritéria American College of Rheumatology [15] (obr. 2),![OBR. 2 Klasifi kační kritéria EGPA; podle [15] – Grayson, et al., 2022. OBR. 2 Klasifi kační kritéria EGPA; podle [15] – Grayson, et al., 2022.](https://www.remedia.cz/1-23-68b-photo-pg-950-367-318-.png) která jsou v současné době použitelná v rámci výzkumu, zatím nejsou doporučena v běžné klinické praxi a diagnostice. V současné době se ustupuje od nutnosti histologického průkazu EGPA a diagnóza je založena na klinických příznacích z postiženého orgánu – např. mononeuritis multiplex či purpura ve spojení se systémovými symptomy, jako jsou např. únavnost, ztráta tělesné hmotnosti a zvýšená teplota u nemocného s diagnózou astmatu, jsou vysoce podezřelé z diagnózy EGPA. Histopatologický nález může diagnózu EGPA podpořit, není však již striktně vyžadován. V diferenciální diagnóze syndromu EGPA je nutno odlišit ostatní vaskulitidy malých cév, a to jednak ANCA negativní imunokomplexové vaskulitidy, jako je Henochova–Schönleinova purpura, esenciální kryoglobulinemická vaskulitida, lupusová vaskulitida, vaskulitida u sérové nemoci, a parainfekční vaskulitidy [16,17].
která jsou v současné době použitelná v rámci výzkumu, zatím nejsou doporučena v běžné klinické praxi a diagnostice. V současné době se ustupuje od nutnosti histologického průkazu EGPA a diagnóza je založena na klinických příznacích z postiženého orgánu – např. mononeuritis multiplex či purpura ve spojení se systémovými symptomy, jako jsou např. únavnost, ztráta tělesné hmotnosti a zvýšená teplota u nemocného s diagnózou astmatu, jsou vysoce podezřelé z diagnózy EGPA. Histopatologický nález může diagnózu EGPA podpořit, není však již striktně vyžadován. V diferenciální diagnóze syndromu EGPA je nutno odlišit ostatní vaskulitidy malých cév, a to jednak ANCA negativní imunokomplexové vaskulitidy, jako je Henochova–Schönleinova purpura, esenciální kryoglobulinemická vaskulitida, lupusová vaskulitida, vaskulitida u sérové nemoci, a parainfekční vaskulitidy [16,17].
Posouzení aktivity nemoci a terapie EGPA
K posouzení aktivity nemoci jsou u nemocných s EGPA použitelné dva skórovací systémy: 1) skóre pěti faktorů (Five Factors Score, FFS, aktualizovaná verze r/FFS) [18], které se využívá pro hodnocení aktivity u nemocných s EGPA nejčastěji, a 2) Birmingham Vasculitis Activity Score (BVAS), používané spíše u nemocných s granulomatózou s polyangiitidou, proto tento nástroj dále neuvádíme. FFS je založeno na přítomnosti nebo absenci pěti klinických příznaků, hodnotí se věk > 65 let, postižení srdce, ledvin, gastrointestinálního traktu a postižení uší, nosu a krku (tab. 3).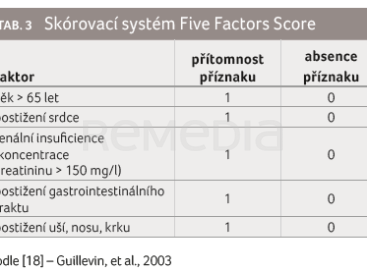 Každý příznak znamená 1 bod. FFS skóre se pohybuje v rozpětí od 0 do 2. Skóre 0 znamená, že není přítomen žádný z příznaků, skóre 1 značí jeden příznak, skóre 2 pak dva a více příznaků. Tento skórovací systém koreluje s prognózou EGPA [18]. Nemocní s FFS 0 mají pětiletou mortalitu 12 %, při FFS 1 činí 26 %, při FFS 2 dosahuje 46 %. Tento systém pomáhá identifikovat nemocné, kteří jsou ohroženi vysokým rizikem relapsu a smrti a jimž by měla být podávána agresivnější imunosupresivní terapie.
Každý příznak znamená 1 bod. FFS skóre se pohybuje v rozpětí od 0 do 2. Skóre 0 znamená, že není přítomen žádný z příznaků, skóre 1 značí jeden příznak, skóre 2 pak dva a více příznaků. Tento skórovací systém koreluje s prognózou EGPA [18]. Nemocní s FFS 0 mají pětiletou mortalitu 12 %, při FFS 1 činí 26 %, při FFS 2 dosahuje 46 %. Tento systém pomáhá identifikovat nemocné, kteří jsou ohroženi vysokým rizikem relapsu a smrti a jimž by měla být podávána agresivnější imunosupresivní terapie.
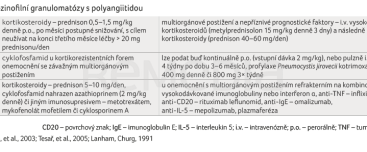
Obecně lze léčbu EGPA rozdělit na léčbu indukční, jejímž cílem je navodit remisi onemocnění, a léčbu udržovací, jejímž cílem je remisi udržet, resp. předejít vzniku relapsů onemocnění [19–21]. Relapsy onemocnění se někdy rozdělují na relapsy velké s poškozením plic (např. plicní hemoragie či infiltrace) nebo ledvin (zhoršení renálních funkcí) a na relapsy malé charakterizované např. jen teplotou, vzestupem hodnot C‑reaktivního proteinu, zvýšením titrů ANCA protilátek nebo kožními změnami. Velké relapsy jsou zpravidla léčeny přípravky používanými v indukční terapii, zatímco malé relapsy mohou být léčeny jen zvýšenými dávkami léků, které jsou používány v léčbě udržovací [20–32] (tab. 4).
Léčba mepolizumabem
Mepolizumab je humanizovaná monoklonální protilátka, která se váže na interleukin 5 (IL‑5), zodpovědný za proliferaci, aktivaci a přežívání eozinofilů, a inhibuje jeho efekt. Účinnost a bezpečnost mepolizumabu jako přídatné léčby k systémovým kortikosteroidům byla oproti placebu u EGPA hodnocena ve studii MIRRA [32]. Jednalo se o multicentrickou randomizovanou, dvojitě zaslepenou studii fáze III. Zařazujícími kritérii byly: věk ≥ 18 let, relabující (více než jednou) nebo refrakterní EGPA minimálně šest měsíců, počet eozinofilů ≥ 1,0 × 109/l, stabilní dávka perorálních (p.o.) glukokortikoidů ≥ 7,5 až ≤ 50,0 mg/den s imunosupresivní terapií podávanou nejméně čtyři týdny před randomizací nebo bez imunosupresivní terapie. Vyřazující kritéria zahrnovala GPA a/nebo mikroskopickou polyangiitidu (MPA) při screeningu, orgány nebo život ohrožující EGPA v období tří měsíců před screeningem, intravenózní (i.v.) nebo subkutánní (s.c.) glukokortikoidy podávané čtyři týdny před randomizací. Vstupní charakteristiky nemocných jsou uvedeny v tabulce 5 [32].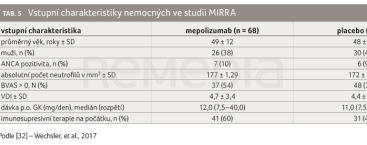 Pacienti léčení standardní terapií byli randomizováni v poměru 1 : 1 k aplikaci mepolizumabu v dávce 300 mg s.c. každé 4 týdny nebo k podávání placeba na léčebné období 52 týdnů s postupnou redukcí dávek kortikosteroidů od čtvrtého týdne. Ve studii byly hodnoceny primární cílové ukazatele: celková doba v remisi a podíl pacientů v remisi ve 36. a 48. týdnu. Mezi klíčové sekundární cílové ukazatele patřily podíl pacientů v remisi do 24. týdne přetrvávající do 52. týdne a doba do prvního relapsu při průměrné dávce p.o. kortikosteroidů ve 48.–52. týdnu.
Pacienti léčení standardní terapií byli randomizováni v poměru 1 : 1 k aplikaci mepolizumabu v dávce 300 mg s.c. každé 4 týdny nebo k podávání placeba na léčebné období 52 týdnů s postupnou redukcí dávek kortikosteroidů od čtvrtého týdne. Ve studii byly hodnoceny primární cílové ukazatele: celková doba v remisi a podíl pacientů v remisi ve 36. a 48. týdnu. Mezi klíčové sekundární cílové ukazatele patřily podíl pacientů v remisi do 24. týdne přetrvávající do 52. týdne a doba do prvního relapsu při průměrné dávce p.o. kortikosteroidů ve 48.–52. týdnu.
Studie prokázala významně delší celkové období remise při léčbě mepolizumabem vs. placebem (poměr šancí [OR] 5,91; 95% interval spolehlivosti [CI] 2,68–13,03; p < 0,001). Dále 32 % pacientů ze skupiny mepolizumabu vs. 3 % ze skupiny placeba dosáhlo remise ve 36. a 48. týdnu (OR 16,74; 95% CI 3,61–77,56; p < 0,001) [32]. Rovněž byl pozorován nižší výskyt relapsů při léčbě mepolizumabem vs. placebem. Splněny byly také sekundární cíle studie. Remise v průběhu prvních 24 týdnů studie přetrvávající až do 52. týdne dosáhlo významně více pacientů léčených mepolizumabem (19 %, 13/68) vs. placebem (1 %, 1/68) (p = 0,007), graf 1.![GRAF 1 Doba remise pacientů léčených mepolizumabem ve studii MIRRA; podle [32] – Wechsler, et al., 2017. GRAF 1 Doba remise pacientů léčených mepolizumabem ve studii MIRRA; podle [32] – Wechsler, et al., 2017.](https://www.remedia.cz/1-23-70b-photo-pg-944-367-312-.png) Mepolizumab oproti placebu významně prodloužil čas do prvního relapsu v průběhu 52 týdnů (p < 0,001). Remise trvající ≥ 24 týdnů dosáhlo 33 % (13/39) pacientů se vstupním počtem eozinofilů ≥ 1,5 × 109/l léčených mepolizumabem vs. 0 % (0/40) pacientů na placebu. Mepolizumab zajišťoval trvalé snížení počtu eozinofilů v periferní krvi oproti placebu. Byla prokázána nižší průměrná dávka p.o. glukokortikoidů ve 48.–52. týdnu při léčbě mepolizumabem vs. placebem (OR 0,20; 95% CI 0,09–0,41; p < 0,001) [32].
Mepolizumab oproti placebu významně prodloužil čas do prvního relapsu v průběhu 52 týdnů (p < 0,001). Remise trvající ≥ 24 týdnů dosáhlo 33 % (13/39) pacientů se vstupním počtem eozinofilů ≥ 1,5 × 109/l léčených mepolizumabem vs. 0 % (0/40) pacientů na placebu. Mepolizumab zajišťoval trvalé snížení počtu eozinofilů v periferní krvi oproti placebu. Byla prokázána nižší průměrná dávka p.o. glukokortikoidů ve 48.–52. týdnu při léčbě mepolizumabem vs. placebem (OR 0,20; 95% CI 0,09–0,41; p < 0,001) [32].
Mepolizumab je od roku 2015 indikován jako přídatná léčba těžkého refrakterního eozinofilního astmatu u dospělých pacientů, dospívajících a dětí ve věku od 6 let (od roku 2018 je v této indikaci i hrazen). Od 17. 11. 2021 je tato monoklonální protilátka indikována jako přídatná léčba také k intranazálním kortikosteroidům k léčbě dospělých pacientů s těžkou chronickou rinosinusitidou s nosní polypózou, u nichž léčba systémovými kortikosteroidy a/nebo chirurgický zákrok nevedou k dosažení dostatečné kontroly nad onemocněním. Dále je mepolizumab indikován jako přídatná léčba pro pacienty ve věku 6 let a starší s relabující‑remitující nebo refrakterní EGPA a pro dospělé pacienty s nedostatečně kontrolovaným hypereozinofilním syndromem bez zjistitelné nehematologické sekundární příčiny (obr. 3).![OBR. 3 Doporučení pro léčbu EGPA; podle [31] – Chung, et al., 2021. 1-23_71](https://www.remedia.cz/photo-pg-945---.png)
Léčivý přípravek je hrazen v léčbě dospělých pacientů s těžkým refrakterním eozinofilním astmatem, kteří dodržují zákaz kouření, mají v průběhu 12 měsíců před zahájením léčby dokumentováno nejméně 300 eozinofilů/μl periferní krve a nejméně čtyři těžké exacerbace astmatu v průběhu 12 měsíců před zahájením léčby, a to navzdory vysokým denním dávkám inhalačních kortikosteroidů a přidané udržovací léčbě nebo užívají p.o. kortikosteroidy v dávce ekvivalentní nejméně 5 mg prednisonu denně po dobu alespoň 6 měsíců před zahájením léčby. V případě, že pacient užívá p.o. kortikosteroidy v dávce ekvivalentní nejméně 5 mg prednisonu denně po dobu alespoň 6 měsíců před zahájením léčby, je nutný průkaz výše uvedené eozinofilie v periferní krvi v průběhu 12 měsíců před zahájením systémové kortikoterapie.
Dávkování mepolizumabu se liší podle onemocnění a věku nemocného. Dospělí a dospívající (≥ 12 let) pacienti s těžkým, refrakterním eozinofilním astmatem dostávají 100 mg s.c. jednou za 4 týdny, děti ve věku 6–11 let 40 mg s.c. jednou za 4 týdny. Dospělým pacientům s chronickou rinosinusitidou s nosní polypózou je aplikováno 100 mg mepolizumabu s.c. jednou za 4 týdny. U diagnózy EGPA dostávají dospělí a dospívající ve věku od 12 let 300 mg mepolizumabu s.c. jednou za 4 týdny, pro děti ve věku 6–11 let s tělesnou hmotností < 40 kg je určena dávka 100 mg s.c. jednou za 4 týdny, při tělesné hmotnosti ≥ 40 kg pak dávka 200 mg s.c. jednou za 4 týdny. Dávkování u dospělých pacientů s hypereozinofilním syndromem je 300 mg s.c. jednou za 4 týdny [32].
Závěr
V této práci představujeme nové rozdělení pacientů s EGPA do dvou geneticky a klinicky odlišných syndromů na základě ANCA pozitivity, jak byla nedávno klasifikována a publikována. ANCA pozitivní EGPA představuje eozinofilní autoimunitní onemocnění, které sdílí podobné klinické rysy a HLA DQ asociaci s ANCA asociovanou vaskulitidou. U této skupiny se často vyskytuje neuropatie a postižení ledvin − glomerulonefritida. Druhou skupinu tvoří ANCA negativní EGPA, která může mít původ v dysfunkci slizniční bariéry a dominují u ní plicní infiltráty a postižení srdce. Dále shrnujeme výsledky studie MIRRA, která potvrdila klinický přínos mepolizumabu jako efektivní léčebné možnosti v indukční terapii relabující a refrakterní EGPA. Tato humanizovaná monoklonální protilátka se podává v dávce 300 mg s.c. jednou za čtyři týdny u dospělých v kombinaci s kortikosteroidy. Na základě výsledků studie MIRRA byla u pacientů léčených mepolizumabem dokladována možnost snížení dávky systémových kortikosteroidů, což minimalizuje nežádoucí účinky dlouhodobé kortikoterapie.
Vzniklo za grantové podpory: IGA_LF UP_2022_011, MH CZ‑DRO (FNOL, 00098892).
Literatura
[1] Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65: 111.
[2] Mouthon L, Dunogue B, Guillevin L. Diagnosis and classification of eosinophilic granulomatosis with polyangiitis (formerly named Churg‑Strauss syndrome). J Autoimmun 2014; 48–49: 99–103.
[3] Watts RA, Lane SE, Bentham G, et al. Epidemiology of systemic vasculitis: a ten year study in the United Kingdom. Arhtritis Rheum 2000; 43: 414–419.
[4] Watts RA, Lane S, Scott DG. What is known about the epidemiology of the vasculitides? Best Pract Res Clin Rheumatol 2005; 19: 191–207.
[5] Sablé‑Fourtassou R, Cohen P, Mahr A, et al. Antineutrophil cytoplasmic antibodies and the Churg Strauss syndrom. Ann Intern Med 2005; 143: 632–638.
[6] Vašáková M, Polák J, Matěj R. Intersticiální plicní procesy. Praha: Maxdorf Jessenius 2011: p. 326–327.
[7] Tsurikisawa N, Saito H, Tsuburai T, et al. Differences in regulatory T cells between Churg‑Strauss syndrome and chronic eosinophilic pneumonia with asthma. J Allergy Clin Immunol 2008; 122: 610.
[8] Žurková M, Šterclová M, Vašáková M, et al. Eozinofilní granulomatóza s polyangiitidou – doporučený postup pro diagnostiku a léčbu. Dostupné na: http://www.pneumologie.cz/guidelines (navštíveno 21. 9. 2022).
[9] Hellmich B, Csernok E, Gross WL. Proinflamatory cytokines and autoimunity in Churg Strauss syndrome. Ann N Y Acad Sci 2004; 1051: 121–131.
[10] Guillevin L, Cohen P, Gayraud M. Churg‑Strauss syndrome. Clinical study and long‑term follow‑up of 96 patients. Medicine (Baltimore) 1999; 78: 26–37.
[11] Moiseev S, Bossuyt X, Arimura Y, et al. International Consensus on ANCA Testing in Eosinophilic Granulomatosis with Polyangiitis. Am J Respir Crit Care Med 2020; doi: 10.1164/rccm.202005‑1628SO.
[12] Bečvář R, Tesař V, Rychlík I. Vaskulitidy v klinické praxi: diagnostika a terapie. Praha: Medprint 1994: p. 90–94.
[13] Pekárek Z, Fila L, Marel M. ANCA pozitivní vaskulitidy. Stud Pneumol Phtiseol 2000; 60: 157–162.
[14] Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg‑Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33: 1094–1100.
[15] Grayson PC, Ponte C, Suppiah R, et al.; DCVAS Study Group. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis with Polyangiitis. Ann Rheum Dis 2022; 81: 309−414.
[16] Hellmich B, Agueda A, Monti S, et al. 2018 Update of the EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2020; 79: 1930.
[17] Imboden J, Hellmann D, Stone H. Current Diagnosis & Treatment: Rheumatology. McGraw Hill 2013: p. 263–265.
[18] Guillevin L, Pagnoux C, Seror R, et al. The Five‑Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort. Medicine (Baltimore) 2011; 90: 19–27.
[19] Jayne D. Current attitudes to the therapy of vaculitis. Kidney Blood Press Res 2003; 26: 231–239.
[20] Tesař V. Terapie ANCA pozitivní systémové vaskulitidy. In: Pavelka K. Farmakoterapie revmatických onemocnění. Praha: Grada Publishing 2005: p. 287–289.
[21] Lanham JG, Churg J. Churg‑Strauss syndrome. In: Churg A, Churg J, editors. Systemic Vasculitides. New York: Igaku‑Shoin 1991: p. 101–120.
[22] Assaf C, Mewis G, Orfanos CE, et al. Churg‑Strauss syndrome: successful treatment with mycophenolate mofetil. Br J Dermatol 2004; 150: 598–600.
[23] Haubitz M, Koch KM, Brunkhorst R. Cyclosporin for the prevention of disease eactivation in relapsing ANCA‑associated vasculitis. Nephrol Dial Transplant 1998; 13: 2074–2076.
[24] Mukhtyar C, Guillevin L, Cid MC, et al. EULAR recommendations for the management of primary small and medium vessel vasculitis. Ann Rheum Dis 2009; 68: 310.
[25] Ribi C, Cohen P, Pagnoux C, et al. Treatment of Churg‑Strauss syndrome without poor‑prognosis factors: a multicenter, prospective, randomized, open‑label study of seventy‑two patients. Arthritis Rheum 2008; 58: 586–594.
[26] Harper L, Morgan MD, Walsh M, et al. Pulse versus daily oral cyclophosphamide for induction of remission in ANCA‑associated vasculitis: long‑term follow‑up. Ann Rheum Dis 2012; 71: 955.
[27] Groh M, Pagnoux CH, Baldini CH, et al. Eosinophilic granulomatosis with polyangiitis (Churg–Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Inter Med 2015; 26: 545–553.
[28] Greco A, Rizzo MI, De Virgilio A, et al. Churg–Strauss syndrome. Autoimmunity Rev 2015; 14: 341–348.
[29] Steinfeld J, Bradford ES, Brown J, et al. Evaluation of clinical benefit from treatment with mepolizumab for patients with eosinophilic granulomatosis with polyangiitis. J Allergy Clin Immunol 2019; 143: 2170−2177.
[30] Mohamad AJ, Hot A, Arndt F, et al. Rituximab fot treatment of eosinophilic granulomatosis with polyangiitis (Churg‑Strauss). Ann Rheum Dis 2016; 75: 396−401.
[31] Chung SA, Langford CA, Maz M, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody‑Associated Vasculitis. Arthritis Rheumatol 2021; 73: 1366−1383.
[32] Wechsler ME, Akuthota P, Jayne D, et al.; EGPA Mepolizumab Study Team. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis. N Engl J Med 2017; 376: 1921−1932.