Metabolický syndrom a hyperglykémie
Hyperglykémie je typickou součástí metabolického syndromu (MS). V patogenezi hyperglykémie hraje nepochybnou roli inzulinová rezis-tence (IR), která se velmi pravděpodobně uplatňuje při progresivním selhávání -buněk. IR zvyšuje riziko rozvoje diabetu a riziko rozvoje kardiovaskulárních komplikací. V praxi není třeba míru IR kvantifikovat, cílové hodnoty v léčbě nejsou stanoveny a její přítomnost předpokládáme v případě, že jsou splněna ostatní diagnostická kritéria syndromu. Naproti tomu hyperglykémie je jedním z nezávislých diagnostických kritérií MS. Zahrnuje kategorie poruch glukózové homeostázy (hraniční glykémie nalačno a porucha tolerance glukózy) a diabetes mellitus. Epidemiologické studie průřezového a prospektivního charakteru dokládají, že hyperglykémie je významným samostatným rizikovým faktorem kardiovaskulárních onemocnění, který se uplatňuje u nemocných s diabetem i u osob s poruchou glukózové homeostázy. Významným prediktorem koronárních příhod jsou hodnoty glykovaného hemoglobinu, glykémie nalačno a zejména glykémie postprandiální. Intervenční mortalitní studie sledující vliv terapeutických postupů cílených na normalizaci glykémie jsou méně průkazné ve srovnání s léčbou dyslipidémie a hypertenze. Základem léčby hyperglykémie jsou režimová opatření, farmakologická intervence všech přidružených projevů MS a podávání látek s hypo-glykemizujícím účinkem u osob s diabetem. Objektivita volby určitého farmaka (inzulin, deriváty sulfonylurey, metformin, acarbosa, glitazony, glinidy) není v současné době jasně doložena studiemi sledujícími kardiovaskulární mortalitu a riziko mikrovaskulárních komplikací. Z perorálních antidiabetik je u osob s nadváhou a obezitou lékem první volby metformin či acarbosa. Přestože jsou k dispozici studie dokládající snížení incidence diabetu u osob s MS a poruchou glukózové homeostázy při léčbě farmaky, která ovlivňují inzulinovou rezistenci (thiazolidindiony, metformin) či antiobezitiky (orlistat) či dalšími perorálními antidiabetiky (acarbosa), nejsou tyto postupy zatím standardně doporučeny u osob bez manifestního diabetu.
Úvod
Metabolický syndrom (MS) je souborem klinických, biochemických a humorálních odchylek, které zvyšují riziko rozvoje aterosklerózy. Přestože definice, diagnostická kritéria, etiologie a postavení MS jako samostatné klinické jednotky jsou stále předmětem diskusí, zůstávají inzulinová rezistence (IR), hyperinzulinémie a hyperglykémie jeho nepochybnými projevy [1].
IR je řadou autorů stále chápána jako základní metabolická odchylka, která stojí v pozadí všech dalších projevů MS, ačkoli v posledních letech se obdobným způsobem dostává do popředí tuková tkáň a poruchy v její metabolické a endokrinní aktivitě. V klinické praxi není třeba míru IR kvantifikovat. Podle posledních doporučení ADA/NHLBI [2] a IDF [3] nepatří k základním diagnostickým kritériím MS a její přítomnost předpokládáme, pokud nemocný splňuje ostatní diagnostická kritéria syndromu, stejně tak jako není třeba rutinně vyšetřovat inzulinémii.
Hyperglykémie je typickou součástí MS a je také jedním z nezávislých diagnostických kritérií MS. Zahrnuje kategorie poruch glukózové homeostázy (hraniční glykémie nalačno a porucha tolerance glukózy) a diabetes mellitus [4]. Posuzujeme je na základě opakovaného stanovení glykémie ve venózní plazmě s použitím standardních laboratorních metod.
Kategorie hyperglykémie:
– ‑hraniční glykémie nalačno – glykémie nalačno ≥≥ 5,6 mmol/l a <≥ 7,0 mmol/l
– ‑porucha tolerance glukózy – glykémie ve 120. minutě orálního glukózového tolerančního testu (OGTT) ≥≥ 7,8 mmol/la <≥ 11,1 mmol/l
– ‑diabetes mellitus – viz diagnostická kritéria diabetu (tab. 1).
Role IR v rozvoji poruchy sekrece inzulinu a hyperglykémie
Glukoregulační porucha při metabolickém syndromu má logicky charakter diabetu 2. typu. Význam IR, která zodpovídá za snížené vychytávání glukózy v kosterním svalu a neschopnost inzulinu potlačit produkci glukózy v játrech, je v patogenezi diabetu nepochybný [5]. Sama IR však nestačí ke klinické manifestaci diabetu, protože porucha je zpočátku vyrovnává-na zvýšenou sekrecí inzulinu a hyperinzulinémií, která je výrazem snahy překonat IR. Porucha glukózové homeostázy či diabetes mellitus 2. typu se projeví pouze při neschopnosti b-buněk přiměřeně zvýšit sekreci inzulinu. U nemocných s diabetem 2. typu se projevuje řada odchylek v sekreci inzulinu [6], nicméně zásadní význam má pokles sekreční odpovědi na stimulaci glukózou. Selhání b-buněk je rozhodujícím faktorem, který podmiňuje progresi glukózové intolerance od normálních hodnot, přes poruchu glukoregulace až k manifestaci diabetu [8] a stojí v pozadí typického „zhoršování" klinického obrazu diabetu 2. typu. Celá řada klinických studií doložila, že právě progresivně se zhoršující sekreční defekt, který nejsme v současné době schopni ovlivnit žádným léčebným prostředkem, odpovídá za postupné prohlubování glukoregulační poruchy v průběhu diabetu 2. typu [7]. Ten zpočátku reaguje na dietu, potom přidáváme antidiabetika a nakonec u většiny nemocných převádíme na léčbu inzulinem. Teprve v nedávné době bylo zjištěno, že morfologickým podkladem úbytku sekrece inzulinu v průběhu onemocnění je apoptóza, která vede ke snížení masy b-buněk [9].
Příčin apoptózy a funkčního poškození b-buněk může být celá řada. Velmi atraktivní hypotézou, která elegantně propojuje zatím odděleně diskutované pa-togenetické odchylky při diabetu 2. typu (defekt v sekreci inzulinu a IR), je přímé poškození sekrece inzulinu navozené inzulinovou rezistencí b-buněk. Uvedenou hypotézu podporuje řada experimentálních i klinických pozorování.
Přestože transport glukózy do b-buněk není závislý na inzulinu (nepřítomnost glukózových transportérů 4), bylo zjištěno, že b-buňky obsahují všechny komponenty inzulinové signalizační kaskády [10], které jsou navíc přítomny i v membránách sekrečních granulí inzulinu [11]. Na geneticky modifikovaných experimentálních zvířatech bylo doloženo, že jejich exprese přímo ovlivňuje sekreci inzulinu [10, 11]. Hypotézu, že IR přímo v b-buňce může být pravou příčinou sekreční poruchy u nemocných s diabetem, podporují i intervenční studie, které dokládají, že podávání thiazolidindionů (TZD), což jsou farmaka, která snižují IR, vede ke zlepšení sekrece inzulinu v experimentu [12] i u člověka [13].
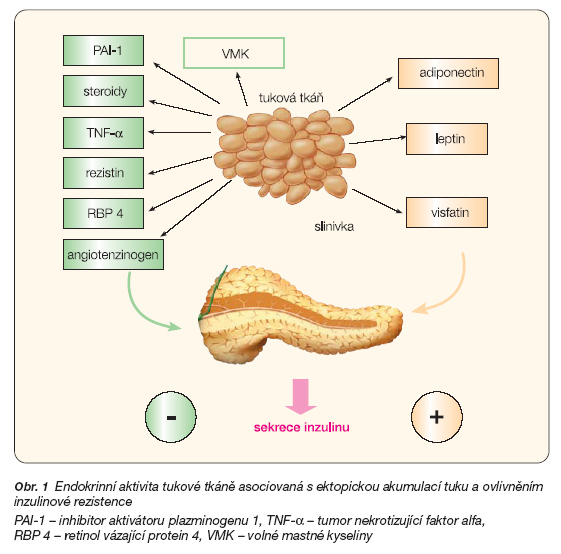
V rozvoji IR v b-buňce, stejně jako v jiných cílových tkáních inzulinu, mohou hrát roli faktory genetické či zevní. Obecně se mohou uplatňovat mechanismy, které zasahují cestou vegetativního nervstva, humorální cestou či změnami metabolického charakteru. V posledních letech je značná pozornost věnována roli lipidů a ektopické akumulaci tuku. Za fyziologických podmínek je pro ukládání zásobních triglyceridů určena tuková tkáň, která v organismu plní roli zásobárny energie. Ektopickou akumulací tuku rozumíme ukládání lipidů mimo tukovou tkáň, v nichž nadbytečný obsah tuků vede k funkčnímu a morfologickému poškození. Mechanismus, kterým se tak děje, označujeme jako lipotoxicita. Ektopická akumulace tuku byla jednoznačně prokázána například v kosterním svalu, kardiomyocytech či v jaterní tkáni, v nichž je asociována s inzulinorezistencí, a řada autorů se domnívá, že je dokonce její hlavní příčinou [14, 15]. Z pohledu sekrece inzulinu je zajímavé, že zvýšený obsah triglyceridů svázaný s poruchou sekrece inzulinu byl nalezen v Langerhansových ostrůvcích (LO) u obézních diabetických [16] i neobézních modelů inzulinové rezistence [17]. Kromě zvýšené hladiny volných mastných kyselin, která je pro stavy s IR typická, se na ektopické akumulaci tuku v LO může podílet i porucha humorální regulace intracelulární homeostázy lipidů.
Fyziologicky je v buňkách velmi pečlivě udržována rovnováha mezi oxidací tuků na jedné straně a ukládáním tuků na straně druhé. Na této regulaci se významně podílejí působky produkované tukovou tkání (adipokiny), z nichž některé jsou asociované s rozvojem inzulinorezistence a jiné mají účinky opačné (obr. 1). Bylo prokázáno, že příjem potravy, zvyšuje v adipocytech tvorbu leptinu a adiponectinu. Ty pak cestou aktivace AMP-aktivované proteinkinázy zvyšují oxidaci mastných kyselin a naopak snižují aktivitu lipogenních enzymů. Deficience leptinu či leptinová re-zistence stejně jako deficience adiponec-tinu vede naopak k ektopickému hromadění tuku. Tato regulace vedoucí k IR se uplatňuje nejen v kosterním svalu či játrech, ale byla doložena i b-buňkách Langerhansových ostrůvků [15, 16, 18]. Adiponectin a leptin navíc chrání b-buňky před cytokiny a mastnými kyselinami indukovanou apoptózou [19].
Výše uvedený přehled dokládá, že IR může být zodpovědná za relativní pokles sekrece inzulinu vedoucí k manifestaci glukoregulační poruchy a podílet se spolu s hyperglykémií na progresivním selhávání b-buněk v průběhu diabetu 2. typu.
Inzulinová rezistence, hyperinzulinémie a hyperglykémie jako rizikový faktor kardiovaskulárního onemocnění
Epidemiologické doklady
Rizikovost IR, hyperinzulinémie a hyper-glykémie potvrzuje řada epidemiologických studií průřezového či prospektivního charakteru, které dokládají, že uvedené abnormity představují nezávislé rizikové faktory kardiovaskulárních (KV) onemocnění.
Průkaz IR jako rizikového faktoru je spojen s největšími metodickými problémy, protože není jednota ve způsobu kvantifikace IR. Pro epidemiologické potřeby byla opakovaně doložena validita indexu HOMA (Homeostasis model assesment) [20]. S jeho použitím nebo pomocí minimálního modelu prokázaly průřezové studie u kohort zahrnujících diabetiky i nediabetiky významnou závislost mezi IR a subklinickou či klinicky manifestní ICHS [21, 22]. HOMA-IR byl potvrzen také jako nezávislý prediktor výskytu ICHS u nemocných s diabetem [23] a u nemocných bez diabetu po 8 letech sledování [24].
Pro rizikovost hyperglykémie, která se pohybuje již v rozmezí poruchy glukózové homeostázy, svědčí taktéž celá řada epidemiologických sledování, která jsou shrnuta v přehledných sděleních [2, 25]. KV riziko se extrémně zvyšuje, pokud jsou splněna kritéria diabetu [26], který s sebou navíc přináší rizika mikrovaskulárních komplikací (diabetická nefropatie, retinopatie a neuropatie). Kromě lačné glykémie a HbA1c je s nejvyšším KV rizikem spojována postprandiální hyperglykémie [25, 27].
Intervenční studie
Léčba hyperglykémie vede v intervenčních studiích jak u diabetiků 1. typu, tak u diabetiků 2. typu k redukci rizika mikrovaskulárních komplikací [28, 7]. Efekt na redukci rizika KV příhod je stále předmětem diskusí.
Na rozdíl od jednoznačných dokladů, které svědčí o 25–30% redukci KV rizika hypolipidemickou a antihypertenzní léčbou (viz souhrnná sdělení v tomto čísle Remedií), nejsou k dispozici přesvědčivá data z intervenčních studií, která by doložila srovnatelný efekt léčby zaměřené na snížení glykémií. Stejně tak nejsou přesvědčivé výsledky studií, které by z hlediska rizika KV a mikrovaskulárních komplikací jasně prokázaly výhodnost volby určitých hypo-glykemizujících prostředků. Charakter multicentrických kontrolovaných randomizovaných studií, které splňují kritéria evidence-based medicine, mělo 5 následujících intervenčních studií [7, 31, 33, 36].
United Kingdom Prospective Diabetes Study (UKPDS)
Tato snad nejvíce citovaná intervenční studie, do níž bylo zařazeno téměř 5 tisíc nově zjištěných nemocných s diabetem 2. typu a léčeno 10 let intenzivním nebo konvenčním režimem, neprokázala, na rozdíl od významné redukce mikrovaskulárních komplikací, významnou redukci rizika KV onemocnění. Riziko se sice snížilo o 16 %, nicméně nedosáhlo statistické významnosti [7].
Důležité je, že pouze 10–40 % nemocných v UKPDS dosahovalo cílových hodnot HbA1c. Pokud byla data podrobena epidemiologickému hodnocení [29] (graf 1), byl každý pokles HbA1c o 1 % asociován se signifikantní redukcí všech komplikací vázaných na diabetes, včetně KV příhod. Přitom nebyla nalezena prahová hodnota. Každý pokles HbA1c (z kterékoli výchozí hladiny) vedl k redukci rizika, které bylo nejnižší, pokud se HbA1c blížil normálním hodnotám kolem 6 %.
V celém souboru zahrnutém do UKPDS nebyly sledované ukazatele ovlivněny volbou hypoglykemického prostředku (deriváty sulfonylurey, metformin, inzulin). Subanalýza v podskupině, do níž byli zahrnuti pouze obézní nemocní, však ukázala na výhody metforminu, který signifikantně redukoval riziko všech sledovaných komplikací včetně KV rizika ve srovnání s konvenční léčbou, a navíc byl ve vybraných ukazatelích (přírůstky hmotnosti, redukce celkové mortality a morbidity – příhody vázané na diabetes) výhodnější než podávání sulfonylurey či inzulinu [30].
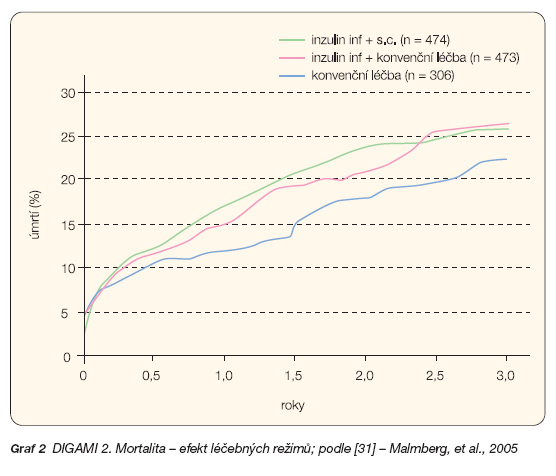
Intense Metabolic Control by Means of Insulin in Patients with Diabetes Mellitus and Acute Myocardial Infarction 2 trial (DIGAMI 2)
Studie si kladla za cíl testovat efekt různých hypoglykemizujících léčebných režimů na časnou a dlouhodobou mortalitu a další KV příhody u nemocných s diabetem 2. typu s akutním infarktem myokardu [31] a byla koncipována na základě nadějných výsledků DIGAMI 1, v níž byla léčba inzulinem provázena snížením mortality ve tříletém sledování [32]. Do DIGAMI 2 bylo zařazeno 1253 nemocných s akutním IM a léčeno a) min. 24 hodin po IM infuzí inzulinu do normalizace glykémie a následně subkutánním inzulinem, b) min. 24 hodin infuzí inzulinu a dále konvenčně s užitím perorálních antidiabetik, nebo c) konvenčně po celé sledování, které trvalo v průměru 1,94 6 1,03 let. Na rozdíl od DIGAMI 1 nebyly mezi jednotlivými léčebnými rameny zaznamenány rozdíly v úmrtích (graf 2) ani dalších KV příhodách a studie nepotvrdila očekávané výhody inzulinové léčby. Při průřezovém hodnocení studie však byla hyperglykémie významným prediktorem dlouhodobé mortality po infarktu myokardu. V interpretaci studie je důležité, že kompenzace cukrovky byla ve všech třech léčebných režimech srovnatelná a ani ve skupině léčené inzulinem nebylo dosaženo cílových hodnot (HbA1c < 7 %).
PROspective pioglitAzone Clinical Trial In macroVascular Events (PROactive)
Studie testovala efekt léčby piogliazonem, který je léčivem zařazeným do skupiny perorálních antidiabetik a který ovlivněním nukleárních receptorů PPAR-g přímo zlepšuje inzulinovou senzitivitu [33]. Zařazeno bylo 5238 nemocných s diabetem 2. typu s vysokým KV rizikem nebo makrovaskulárními komplikacemi (IM, CMP, PTCA, bypass, akutní koronární syndrom, ICHS, ICHDK) a léčených pioglitazonem, nebo placebem. Výsledky byly s netrpělivostí očekávány. Po 3 letech intervence však nebyl zaznamenán signifikantní pokles v primárním sledovaném cíli, který nebyl šťastně zvolen a zahrnoval kromě úmrtí a definovaných patologií také léčebné výkony včetně koronárních a distálních revas- kularizací a amputační výkony (RR o 10 %; p = 0,095). Pokud byl jako výstup hodnocen pouze kombinovaný výskyt IM, mozkové příhody a úmrtí, byl pokles rizika statisticky signifikantní a činil 16 %. Uvedená redukce rizika je vysvětlitelná i samotným metabolickým efektem pioglitazonu, který vedl ve srovnání s placebovou větví ke zlepšení metabolické kompenzace, tj. snížení HbA1c o 0,5 % při o 50% redukované potřebě inzulinoterapie, dále ke zvýšení HDL cholesterolu o 8,9 %, snížení krevního tlaku o 3 mmHg, snížení poměru HDL/LDL cholesterolu o 5,3 % a snížení hladin triglyceridů o 13,2 %. Efekty byly patrné, přestože obě skupiny byly srovnatelně intenzivně léčené statiny (55 % v obou skupinách) a protidestičkovými léky (88 % v obou skupinách).
EDIC/DCCT (Epidemiology of Diabetes Interventions and Complications Study)
Výsledky byly zveřejněny poprvé na kongresu Americké diabetologické asociace 2005 a byly v prosinci téhož roku publikovány v NEJM [46]. Studie není intervenční studií v pravém slova smyslu a je první vlaštovkou, která přináší povzbudivé výsledky. Do studie byli zařazeni nemocní s diabetem 1. typu, kteří ukončili DCCT (Diabetes Control and Complications Trial) [28]. Tito nemocní byli dále sledováni dalších 10 let v otevřené studii. Přestože úroveň kompenzace byla u obou skupin původně léčených intenzifikovaným (IIR), nebo konvenčním režimem zcela srovnatelná (HbA1c 8,0 %), má IIR skupina nadále méně mikrovaskulárních komplikací [34], a navíc i méně KV příhod. KV příhody byly definovány jako IM, mozková příhoda, angina pectoris, revaskularizace a KV úmrtí. Přes-tože skupiny byly zcela srovnatelné i z hlediska léčby ACEI, kyselinou acetylsalicylovou, statiny i HRT, měli nemocní ve skupině IIR o 42 % nižší riziko KV úmrtí, a dokonce o 57 % nižší riziko některé z kardiovas-kulárních příhod (IM, mozková příhoda, revaskularizace). Relativní riziko KV příhody na pacienta za rok bylo 0,38 vs 0,80 (IIR vs konvenčně léčená skupina během DCCT). Výsledky jsou v souladu s dříve publikovaným efektem na tloušťku intimy-medie jako indikátoru aterosklerotického poškození a hladiny LDL cholesterolu v séru [35]. Mechanismus ochranného vlivu, byť dočasně lepší kompenzace cukrovky během DCCT studie u intenzivně léčené skupiny nemocných, je vysvětlován tzv. glykemickou pamětí. Výsledky dokládají význam kompenzace cukrovky tentokrát ve vztahu k makrovaskulárním komplikacím.
STOP-NIDDM trial
Jde o intervenční studii, do níž bylo zařazeno 1368 nemocných s PGT a léčeno placebem, nebo acarbosou (3x denně 100 mg) [37]. Studie trvala 3,3 61,2 roků. Podávání acarbosy provázené snížením postprandiální glykémie bylo provázeno signifikantním snížením relativního rizika KV příhod o 49 % a nově vzniklé hypertenze o 34 %. Studie je zatím jedinou intervenční studií, která dokládá oprávněnost použití acarbosy u nemocných bez manifestního diabetu z důvodů redukce KV příhod.
Jak léčit hyperglykémii
Cílem léčby nemocných s MS je snížit riziko KV komplikací a snížit riziko rozvoje diabetu. Pokud je diabetes přítomen, pak je navíc cílem léčby zpomalit progresivní selhání b-buněk a snížit riziko mikrovas-kulárních komplikací.
Léčba zaměřená na ovlivnění hyperglykémie musí být vždy součástí komplexních opatření, která zahrnují léčbu ostatních projevů MS, zejména dyslipidémie, hypertenze, endoteliální dysfunkce a ovlivnění zvýšené trombogenní potence, kterým jsou věnována další sdělení tohoto čísla Remedií.
Diabetes mellitus
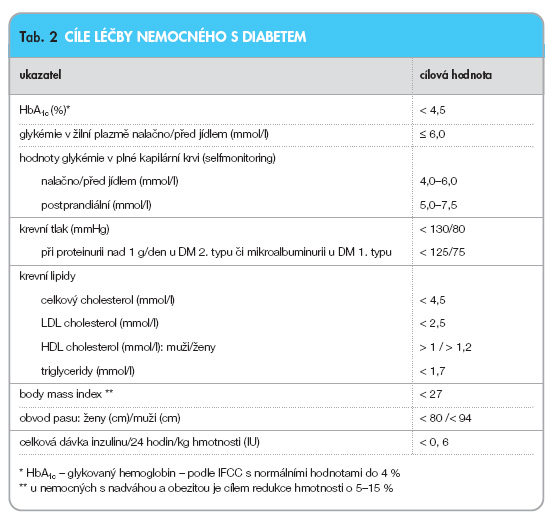
Splňuje-li nemocný diagnostická kritéria diabetu, je cílem dosáhnout doporučených hodnot preprandiálních a postprandiálních glykémií a HbA1c. Cílové hodnoty v léčbě diabetika uvádí tab. 2. Cílové hodnoty zahrnují samozřejmě i cíle léčby ostatních abnormit, nejen kompenzace cukrovky v úzkém slova smyslu.
Základním přístupem jsou režimová opatření, jimiž snižujeme inzulinovou rezistenci a všechny další výše uvedené abnormity. Protože obvykle jde o nemocné s nadváhou a obezitou, zahrnují kalorickou restrikci, změnu složení jídelníčku a zvýšení fyzické aktivity. Opatření by měla vést k mírné hmotnostní redukci, ideálně o 5–10 % během prvního roku léčby.
Jaké farmakologické prostředky volíme? Z výše uvedeného přehledu vyplývá, že v současné době nejsou doklady o rozdílech mezi používanými hypoglykemizujícími prostředky (inzulin, perorální antidiabetika) z hlediska prevence mikrovaskulárních komplikací, KV komplikací či zabránění progrese selhání b-buněk, které by odůvodnily jejich přednostní užití. Určité výhody z hlediska redukce rizika KV komplikací, které však jsou nesrovnatelné s efekty statinů či blokátorů RAS, má podávání metforminu [30], acarbosy [36] a pioglitazonu [33]. Metformin a acarbosa jsou zároveň farmaky, která vedou ve srovnání s inzulinem a deriváty SU k menším hmotnostním přírůstkům.
V praxi je u nemocného s diabetem 1. typu indikována intenzifikovaná léčba inzulinem. U nemocného diabetem 2. typu s nadváhou či obezitou je po selhání režimových opatření vhodná léčba metforminem či acarbosou. Použít můžeme řadu různých kombinací, včetně kombinací s glitazonem (který není pro monoterapii registrován), inzulinem, deriváty sulfonylurey či glinidy. Cílem je dosáhnout cílových hodnot glykémií jakýmkoli způsobem, ideálně při nepřítomnosti závažných hypoglykémií a bez hmotnostních přírůstků (případně s hmotnostním úbytkem). Pokud je použit inzulin, pak co nejnižší dávkou inzulinu [37].
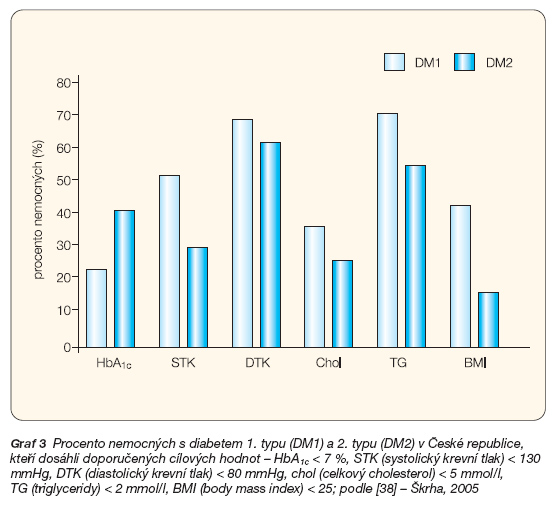
Problémem léčby cukrovky je, že při použití léčebných prostředků, které nám nabízí současná paleta, nejsme schopni ve většině případů dosáhnout cílových hodnot glykémie a HbA1c. Dokonce i při maximálně pečlivě vedené edukaci a vy-užití všech prostředků, například ve výše jmenovaných intervenčních studiích, se úspěšnost pohybuje kolem 10–40 % a obvykle klesá s trváním léčby [7, 31, 33]. Obdobná data byla získána také v rámci epidemiologického šetření, které proběhlo v České republice [38]. S účastí souhlasilo 89 z celkového počtu 142 náhodně oslovených diabetologických ordinací a data byla získána od 3626 náhodně vybraných diabetiků. Cílových hodnot HbA1c (pod 7,0 % podle DCCT) dosahovalo pouze 42 % nemocných s diabetem 2. typu a 24 % nemocných s diabetem 1. typu. Procento nemocných, kteří dosáhli doporučené cílové hodnoty, uvádí graf 3.
Hlavním limitujícím faktorem, který brání dosažení normoglykémie, jsou hypoglykémie, jejichž výskyt extrémně stoupá při dosažení hodnot HbA1c pod 6 % (podle DCCT), pokud je nemocný léčen inzulinem nebo deriváty SU.
Zvýšená glykémie nalačno a porucha tolerance glukózy
Jde o osoby se zvýšeným rizikem kardiovaskulárních komplikací a rozvoje diabetu. V léčbě jsou jasně indikována režimová opatření, u nichž bylo opakovaně potvrzeno, že redukují riziko rozvoje diabetu [39–41]. Farmakologická léčba hyperglykémie není u této skupiny standardně doporučena, přestože a) hladiny glykémie pre- i postprandiálně překračují cílové hodnoty doporučené pro diabetiky, přestože b) existují intervenční studie, které jasně dokládají sníženou incidenci diabetu u této skupiny nemocných při léčbě některými perorálními antidiabetiky, například metforminem [40], acarbosou [42] či troglitazonem [43, 44] a konečně přestože c) při léčbě acarbosou byla dokumentována dokonce redukce KV rizika a vzniku nové hypertenze [36]. Na škodu je, že také podávání antiobezitik zůstává z ekonomických důvodů omezeno na osoby s diabetem a BMI nad 35, přestože existují data, která dokládají prevenci diabetu u osob s rizikem při podávání orlistatu [45]. Farmakologická léčba nemocných s poruchou glukózové homeostázy se omezuje na intenzivní hypolipidemickou, antihypertenzní a antiagregační léčbu s použitím statinů a inhibitorů systému RAS, jejichž poten-ciál v prevenci KV onemocnění a prevenci diabetu byl v intervenčních studiích opakovaně doložen.
Práce byla podpořena grantem IGA CZ NR 7880-3.
Seznam použité literatury
- [1] Kahn R, Buse J, Ferrannini E, Stern M. Metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2005; 48: 1684–1699.
- [2] Grundy SM, Cleeman JI, Daniels SR, et al. American Heart Association; National Heart, Lung, and Blood Institute. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005; 112: 2735–2752.
- [3] International Diabetes Federation. The IDF Consensus Worldwide Definition of the Metabolic Syndrome 2005. Available at http://www.idf.org/ webdata/docs/Metabolic_syndrome_definition.pdf
- [4] Standardy péče o diabetes mellitus 2. typu. Standardy České diabetologické společnosti. Diabetologie, metabolismus, endokrinologie, výživa 2006 (v tisku), (www.diab.cz)
- [5] Yki-Jarvinen H. Insulin resistance in type 2 diabetes. In. Pickup, J.C., Williams, G.(eds): Textbook of diabetes. Third Edition, Blackwell Science, Londýn, 2003.
- [6] Pelikánová T. Patogeneze a průběh diabetu 2. typu. In: Praktická diabetologie. Bartoš, V., Pelikánová, T. (Ed), 3. rozšířené vydání. Praha, Maxdorf 2003.
- [7] UK Prospective Diabetes Study (UKPDS) Group: Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837–853.
- [8] Gastaldelli A, Ferrannini E, Miyazaki Y, et al. -cell dysfunction and glucose intolerance: results from the San Antonio metabolism (SAM) study. Diabetologia 2004; 47: 31–39.
- [9] Deng S, Vatamaniuk M, Huang X, et al. Structural and Functional Abnormalities in the Islets Isolated From Type 2 Diabetic Subjects. Diabetes 2004; 53: 624–632.
- [10] Rhodes CJ, White MF. Molecular insights into insulin action and secretion. Eur J Clin Invest 2002; 32 (Suppl 3): 3–13.
- [11] Kulkarni RN. The islet -cell. Int J Biochem Cell Biol 2004; 36: 365–371.
- [12] Kim H, Ahn Y. Role of Peroxisome Proliferator-Activated Receptor- in the Glucose-Sensing Apparatus of Liver and ß-Cells. Diabetes 2004; 53: S60–S65.
- [13] Buchanan TA, Xiang AH, Peters RK, et al. Preservation of pancreatic -cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high-risk hispanic women. Diabetes 2002; 51: 2796–2803.
- [14] Petersen KF, Shulman GI. Pathogenesis of skeletal muscle insulin resistance type 2 diabetes mellitus. Am J Cardiol 2002; 90: 11G–18G.
- [15] Unger RH. Minireview: weapons of lean body mass destruction: the role of ectopic lipids in the metabolic syndrome. Endocrinology 2003; 144: 5159–5165.
- [16] Shimabukuro M, Zhou Y-T, Levi M, Unger RH. Fatty acid-induced -cell apoptosis: a link between obesity and diabetes. Proc Natl Acad Sci U S A 1998; 95: 2498–2502.
- [17] Divišová J, Kazdová L, Hubová M, et al. Relation-ship between insulin resistance and muscle tri-glyceride content in nonobese and obese experimental models of insulin resistance syndrome. Ann N Y Acad Sci. 2002; 967: 440–445.
- [18] Seufert J. Leptin effect on pancreatic -cell gene expression and function. Diabetes 2004; 53: S152–S158.
- [19] Rakatzi I, Mueller H, Ritzeler O, et al. Adiponec-tin counteracts cytokine- and fatty acid-induced apoptosis in the pancreatic -cell line INS-1. Diabetologia 2004; 47: 249–258.
- [20] Hanson RRL, Pratley RE, Bogardus C, et al. Evaluation of simple indices of insulin sensitivity and insulin secretion for use in epidemiologic studies. Am J Epidemiol 2000; 151: 190–198.
- [21] Howard GO, Leary DH, Zaccaro D, et al., for the IRAS Investigators. Insulin sensitivity and atherosclerosis. Circulation 1996; 93: 1809–1817.
- [22] Arad Y, Newstein D, Cadet F, et al. Association of multiple risk factors and insulin resistance with increased prevalence of asymptomatic coronary artery disease by and electron-beam computed tomographic study. Arterioscler Thromb Vasc Biol 2001; 12: 20051–2058.
- [23] Bonora E, Formentini G, Calcaterra F, et al. HOMA-estimated insulin resistance is an independent predictor of cardiovascular disease. Diabetes Care 2002; 25: 1135–1141.
- [24] Hanley AJG, Williams K, Stern MP, Haffner SM. Homeostasis model assessment of insulin resisstance in relation to the incidence of cardiovascular disease. Diabetes Care 2002; 25: 1177–1184.
- [25] Pelikánová T. Ischemická choroba srdeční u nemocných s diabetem 2. typu. Je hyperglykémie samostatným rizikovým faktorem? DMEV 1999; 2: 161–169.
- [26] Nesto RW. Correlation between cardiovascular disease and diabetes mellitus: current concepts. Am J Med 2004; 116 (suppl 5A): 11S–22S.
- [27] Hanefeld M, Schaper F. Prandial hyperglycemia: is it important to track and treat? Curr Diab Rep 2005; 5: 333–339.
- [28] DCCT Research Group. The effect of intensive diabetes treatment on the development and progression of long-term complication in insulin-dependent diabetes mellitus. N Eng J Med 1993; 329: 977–986.
- [29] Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321: 405–412.
- [30] UK Prospective Diabetes Study (UKPDS) Group: Effect of intensive blood glucose control with metformin in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352: 854–865.
- [31] Malmberg K, Ryden L, Wedel H, et al. DIGAMI 2 Investigators. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26: 650–661.
- [32] Malmberg K. Prospective randomized study of intensive insulin treatment on long-term survival after acute myocardial infarction in patients with diabetes mellitus. BMJ 1997; 314: 1512–1515.
- [33] Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with typu 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366: 1279–1289.
- [34] Writing Team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Effect of intensive therapy on the microvascular complications of type 1 diabetes mellitus. JAMA 2002; 287: 2563–2569.
- [35] Nathan DM, Lachin J, Cleary P, et al. Intensive diabetes therapy and carotid intima-media thickness in type 1 diabetes mellitus. N Engl J Med 2003; 348: 2294–2303.
- [36] Chiasson JL, Josse RG, Gomis R, et al. STOP-NIDDM Trial Research Group. Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance: the STOP-NIDDM trial. JAMA 2003; 290: 486–494.
- [37] Bartoš V, Pelikánová T, et al. Praktická diabetologie. 3. rozšířené vydání. Praha, Maxdorf 2003.
- [38] Škrha J, za výbor České diabetologické společnosti. Diabetes mellitus 2002 v České republice – epidemiologická studie. DMEV 2005; 8: 5–12.
- [39] Pan XR, Li GW, Hu YH, et al. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance: the Da Qing IGT and Diabetes Study. Diabetes Care 1997; 20: 537–544.
- [40] Knowler WC, Barret-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393–403.
- [41] Tuomilehto J, Lindstrom J, Ericsson JG, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344: 1343–1350.
- [42] Chiasson JL, Josse RG, Gomis R, et al. STOP-NIDDM Trial Research Group. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomised trial. Lancet 2002; 359: 2072–2077.
- [43] Buchanan TA, Xiang AH, Peters RK, et al. Preservation of pancreatic -cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high-risk Hispanic women. Diabetes 2002; 51: 2796–2803.
- [44] Knowler WC, Hamman RF, Edelstein SL, et al. Diabetes Prevention Program Research Group. Prevention of type 2 diabetes with troglitazone in the Diabetes Prevention Program. Diabetes 2005; 54: 1150–1156.
- [45] Torgerson JS, Hauptman J, Boldrin MN, Sjorstrom L. XENical in the Prevention of Diabetes in Obese Subjects (XENDOS) Study. A randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patiens. Diabetes Care 2004; 27:155–161.
- [46] Nathan DM, Cleary PA, Backlund JY et al.; Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353: 2643–2653.