Metabolický syndrom a mozek
Metabolický syndrom je v současné době považován za prediabetický, prozánětlivý, prokoagulační a proaterogenní stav; jeho riziko pro aterosklerotické vaskulární nemoci je vyšší, než by bylo riziko vzniklé prostým součtem rizik jeho jednotlivých rizikových faktorů. Za hlavní patofyziologický podklad se považuje inzulinová rezistence. V článku je dokladována role centrálního nervového systému v patogenezi metabolického syndromu. Pozornost je věnována především centrálnímu sympatickému nervovému systému a sympatoadrenálnímu systému a jeho vztahu k metabolickým poruchám v periferních tkáních. Endokanabinoidní systém je další důležitou spojkou mezi mozkem a metabolickým syndromem. Především ovlivněním endokanabinoidních receptorů typu CB1 lze příznivě naladit energetický metabolismus a zlepšit parametry glycidového a lipidového metabolismu související s metabolickým syndromem. Receptory PPAR (peroxisome proliferator-activated receptors), nacházející se v jaderných membránách buněk všech orgánů včetně mozku, sehrávají významnou úlohu v propojenosti periferních a centrálních procesů intermediárního metabolismu. Thiazolidindiony, které stimulují PPAR-g, se využívají v klinické praxi v léčbě diabetu, neboť zlepšují glycidový a lipidový metabolismus a snižují inzulinovou rezistenci. Mozek – CNS – je řídící orgán, ale všechny procesy regulací, které se váží k intermediárnímu metabolismu, k inzulinové rezistenci a k metabolickému syndromu, nejsou ještě zcela objasněny.
Úvod
Metabolický syndrom (MS), tj. soubor řady aterogenních rizikových faktorů, představuje pro své nositele významně vysoké riziko vzniku aterosklerotických vaskulárních nemocí a diabetu 2. typu; za hlavní bezprostřední patofyziologický podklad je většinou považována inzulinová rezistence. Metabolický syndrom je v současné době považován za prozánětlivý, prokoagulační a proaterogenní stav; riziko pro vznik kardiovaskulárních nemocí je u MS vyšší, než by bylo riziko vzniklé prostým součtem rizik jeho jednotlivých rizikových faktorů. Lehký zánět endotelu a jeho dysfunkce představují první stadia aterogeneze. Současně s aterogenezí je porušená hemostáza, tzn. existuje nerovnováha mezi koagulačními a fibrinolytickými procesy. Jedinci s MS mají větší sklon k trombogenezi, ale zároveň mají sníženou fibrinolýzu; je známo, že stavy vedoucí k trombogenezi jsou spojeny s vyšším rizikem rozvoje aterotrombogenních příhod. Jedinci s MS trpí časnějšími projevy aterosklerózy, vyšším výskytem koronárních příhod, cévních mozkových příhod a mají řadu dalších, i subklinických projevů aterosklerózy.
Centrální nervový systém (CNS) bezesporu řídí všechny funkce lidských orgánů, přenáší vliv faktorů zevního prostředí, které zpracovává a předává dále. I když v mozku existuje mnoho autonomních procesů (např. řízení krevního tlaku nezávisle na systémovém krevním tlaku nebo produkce vlastního cholesterolu atd.), je mozek zároveň ovlivňován i jevy probíhajícími v periferii, tj. např. cestou zpětné vazby. Nejinak je tomu zřejmě i u inzulinové rezistence. Dnes je již jasně prokázáno z experimentálních studií, že v mozku existují receptory pro inzulin, a tedy i v mozku mohou probíhat procesy typické pro inzulinovou rezistenci. Některé experimentální práce na myších s vyřazenými inzulinovými receptory v mozku (NIRKO – neuron-specific insulin receptor knockout mice) ukazují, že mozková inzulinová rezistence by mohla hrát roli v rozvoji metabolického syndromu [1]. Kde však máme hledat společné cesty těchto patologií? Výzkum probíhá na nejrůznějších úrovních, ale jak známo, CNS je nejsložitější systém a experimenty v této oblasti jsou velmi limitovány, a proto existuje dosud mnoho nejasností.
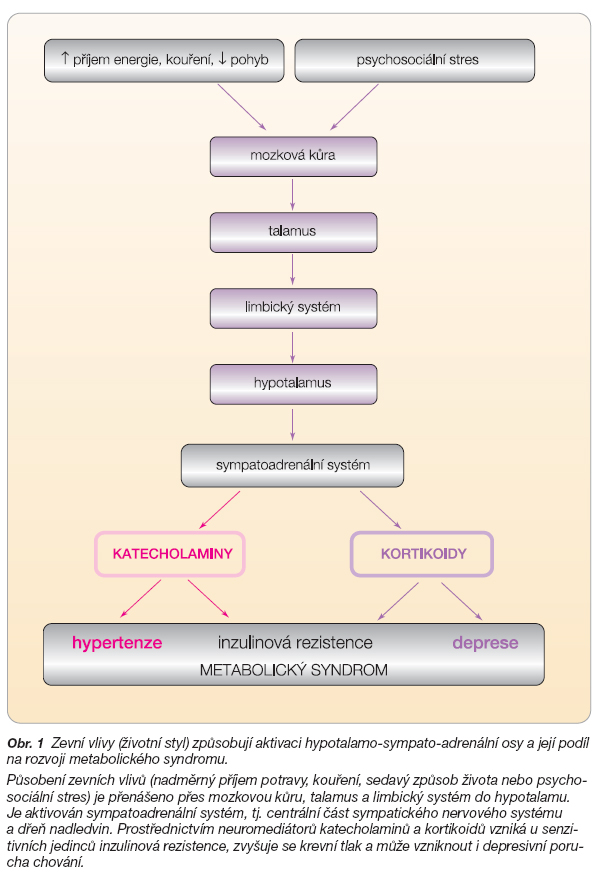
Vývoj znalostí o poruchách energetického metabolismu v posledních deseti letech ukazuje na důležitou roli mozku, resp. CNS ve fyziologii intermediárního metabolismu i v patofyziologii inzulinové rezistence, MS, abdominální obezity a diabetu 2. typu. Mozek dostává informace z periferních orgánů (z jater, slinivky, tukové tkáně, především z viscerálního tuku, ze střev a ze žaludku) cestou hormonálních a jiných signálů (např. prostřednictvím leptinu, inzulinu, glukózy, mastných kyselin aj.). Předpokládá se, že centrum této komunikace sídlí v mediobazálním hypotalamu a je bohatě propojeno s oblastmi mozkového kmene a s mezolimbickou oblastí [2]. Tuková tkáň a její hormonální činnost má v tomto procesu větší roli, než se dříve předpokládalo. Hlavní neurotransmitery mozku, které jsou involvovány do kontroly energetického metabolismu, ale také do patogeneze depresivních poruch chování, jsou serotonin a noradrenalin. Proto byl farmakologický výzkum namířen tímto směrem; snížení chuti k jídlu bylo dosaženo pomocí inhibitorů zpětného vychytávání serotoninu a noradrenalinu (sibutramin); přestože původním záměrem bylo hledání antidepresivně působící substance, byl objeven centrálně působící lék redukující chuť k jídlu. Kromě redukce hmotnosti dochází při léčbě sibutraminem k úbytku abdominální tukové tkáně, ke zlepšení inzulinové senzitivity, k redukci hladin inzulinu a ke zlepšení kontroly glykémie i lipidového metabolismu. Ovlivnit depresivní poruchy chování se podařilo inhibitorem zpětného vychytávání serotoninu (sertralin), avšak poklesu hmotnosti se dosahuje touto léčbou většinou pouze během prvních měsíců léčby deprese. Z těchto farmakologických zkušeností je možné zpětně odvodit patofyziologickou souvislost metabolických i psychických poruch, jejichž hlavními neurotransmitery jsou serotonin a noradrenalin a hlavními zevními vlivy dlouhodobý stres, nadměrné přijímání potravy, rozvoj inzulinové rezistence, metabolického syndromu a abdominální obezity. Lze proto vyslovit hypotézu, že u osob s metabolickým syndromem se může jednat o patologickou aktivaci neuroendokrinní hypo-talamo-sympato-adrenální osy, viz obr. 1 [3].
Mozek a metabolický syndrom spojují tři mechanismy, které mají návaznost na možnosti farmakologického ovlivnění: centrální sympatický nervový systém, endokanabinoidní systém a receptory PPAR.
I. Centrální sympatický nervový systém a inzulinová rezistence
Autonomní vegetativní nervstvo, tj. sympatický (SNS) a parasympatický nervový systém (PSNS), hraje v patofyziologii MS důležitou roli. Porucha rovnováhy mezi sympatickým a parasympatickým nervovým systémem je považována za důležitý patofyziologický mechanismus rozvoje některých kardiovaskulárních chorob. Převaha tonu sympatiku byla nejvíce studována v souvislosti s patogenezí hypertenze. Dnes je zvýšená aktivita sympatiku středem pozornosti v souvislosti s dalšími chorobami – s ischemickou chorobou srdeční, se srdečním nebo ledvinným selháváním, s inzulinovou rezistencí, resp. s MS, s obezitou abdominálního typu, s diabetem 2. typu a také např. s depresivní poruchou chování. O snížené aktivitě PSNS a její úloze v patogenezi chorob s vyšší aktivitou SNS existuje méně informací, i když je pochopitelné, že bez potlačení PSNS by se nemohla zvýšená aktivita SNS uplatnit.
Centrální část SNS je uložena v hypotalamu a v prodloužené míše, zatímco část periferní je představována neurony vycházejícími z jader postranních rohů míšních a přes sympatická ganglia pokračujícími k jednotlivým orgánům. V hypotalamu se nacházejí různá centra pro regulaci kardiovaskulárního systému (nucleus paraventricularis a nuclei posteriores), centra pro regulaci příjmu potravy a tekutin (centrum hladu, sytosti a žízně), ale i centra řídící tělesnou teplotu aj. Hypotalamus tedy sdružuje vegetativní řízení kardiovaskulárního systému a procesů ovlivňujících intermediární metabolismus, což by mohlo přispět k vysvětlení častého výskytu metabolických poruch u arteriální hypertenze i k objasnění vzniku abdominální obezity, která často provází jak hypertenzi, tak i MS.
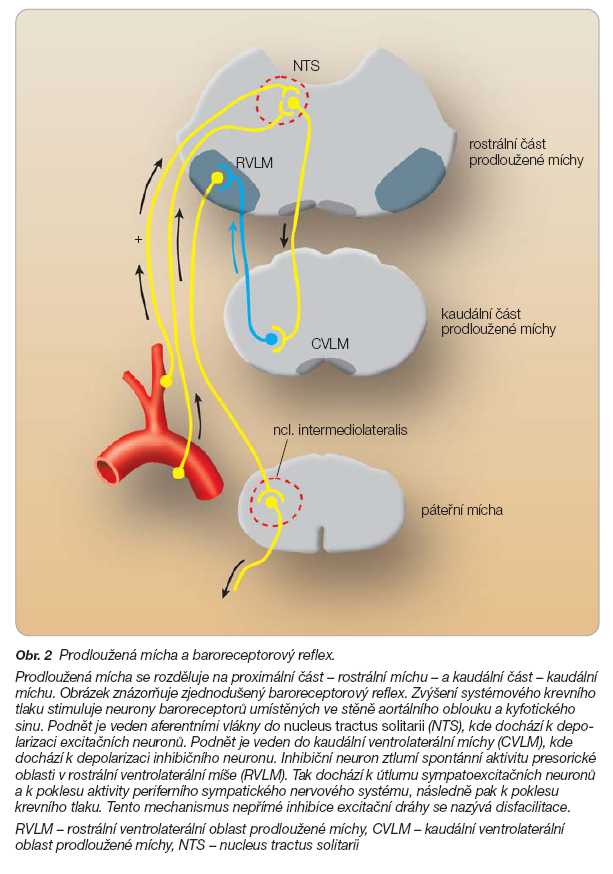
Prodloužená mícha má dvě části: horní (rostrální) a dolní (kaudální) část. V horní prodloužené míše je důležitá presorická oblast – rostrální ventrolaterální mícha (RVLM), což je spontánně sympatoexcitační oblast, která je bohatě inervována z kardiovaskulárních center hypotalamu a z limbického systému, který předává podněty z mozkové kůry a z talamu. SNS i PSNS zprostředkovávají svůj vliv na kardiovaskulární systém cestou baro- a chemosenzitivních reflexů. V dorzální části rostrální míchy se nachází nucleus tractus solitarii (NTS), který hraje důležitou roli v arteriálním baroreceptorovém reflexu. Tento reflex umožňuje tlumení spontánní aktivity presorické oblasti (RVLM) a tím snížení aktivity periferního SNS (obr. 2).
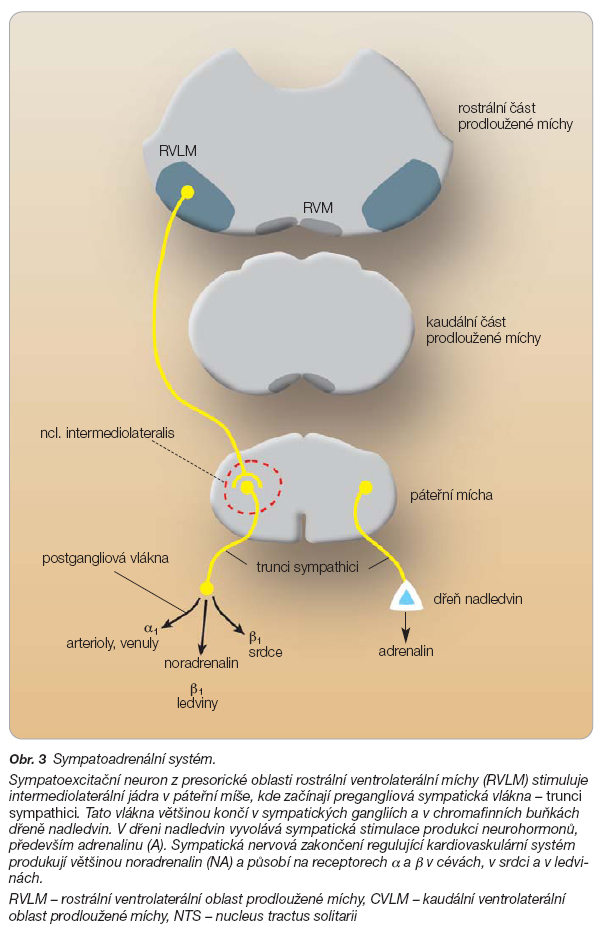
Sympatická nervová zakončení produkují převážně noradrenalin a provádějí značnou modulaci sympatické aktivity. Neuro-transmitery zprostředkovávají podněty kardiovaskulárních center SNS na periferních a1-receptorech (dochází k vazokonstrikci arteriol a venul), na b≤1-receptorech v srdci (zvyšuje se tepová frekvence) a na b≤1-receptorech v ledvinách (dochází k vazokonstrikci vas afferens a vas efferens, k hyperfiltraci a zvýšené permeabilitě glomerulů, k zadržování sodíku a vody).
Sympatoadrenální systém zahrnuje SNS a dřeň nadledvin. Dřeň nadledvin je pozůstatkem sympatického ganglia, jehož neurony ztratily axony, a tak secernují látky, původně neurotransmitery, nyní adrenalin v 85 % a noradrenalin v 15 % aj. přímo do krve, kde se uplatňují jako neurohormony. Dřeň nadledvin je stimulována pregangliovými vlákny (trunci sympathici), která přicházejí splanchnickými nervy z postranních rohů míšních (ncl. intermediolaterales), viz obr. 3.
Vzájemný vztah centrálního sympatiku a dřeně nadledvin v souvislosti s kardiovaskulárním systémem a metabolickými procesy je v disociaci, tj. při stimulaci centrálního SNS dochází k útlumu dřeně nadledvin a naopak.
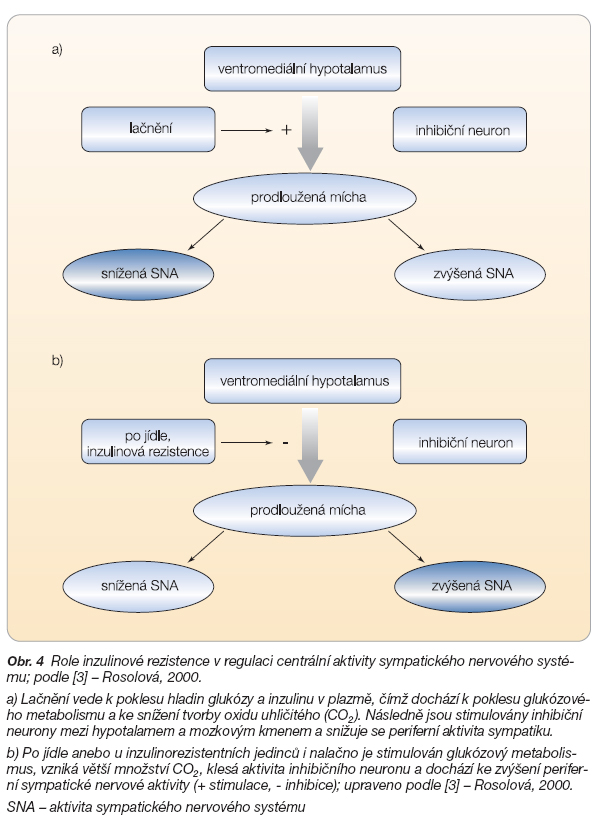
Sympatoadrenální systém je dnes považován za spojovací článek mezi inzulinovou rezistencí a vznikem rizikových faktorů typických pro MS. U zdravých jedinců vede snížený metabolismus glukózy během lačnění ke snížení aktivity centrálního SNS v hypotalamu a prodloužené míše. Snížená hladina glykémie však stimuluje aktivitu dřeně nadledvin, která vede kromě jiného i ke stimulaci lipolýzy v tukových buňkách. Po jídle se aktivace obou systémů obrací. U jedinců s inzulinovou rezistencí je aktivace obou systémů v době lačnění podobná situaci u zdravých osob po jídle, tj. aktivita centrálního SNS zůstává trvale zvýšená (obr. 4). Narušené vychytávání glukózy z plazmy vede k útlumu adrenální aktivity, a tím dochází ke snížení lipolýzy a vzniku dyslipidémie typické pro metabolický syndrom, což znamená vyšší hladinu triglyceridů a nižší hladinu HDL cholesterolu. Během jídla se tento stav stupňuje, stoupá postprandiální glykémie a hypertriglyceridémie [4].
Aktivovaný centrální SNS vede k vyšší tepové frekvenci, většímu srdečnímu výdeji, k vazokonstrikci a k větší reabsorpci sodíku a vody a to vše způsobuje zvyšování krevního tlaku. Na zvyšování krevního tlaku se podílí rovněž řada mechanismů vyvolaných hyperinzulinémií, která je kompenzatorním mechanismem inzulinové rezistence. Zároveň je SNS v interakci s řadou dalších mechanismů, jako je renin-angiotenzinový systém, metabolismus natria, vylučování vazopresinu, vztah k vazodilatačním peptidům a především k inzulinové rezistenci. Současně zvýšená aktivita renin-angiotenzinového systému vede k dalšímu zvyšování krevního tlaku a k rozvoji orgánových komplikací, především k hypertenzní remodelaci levé komory a stěn arterií. Z klinického pohledu není rozhodující, který z regulačních mechanismů je primární, zda inzulinová rezistence či SNS, je však rozhodující vybírat takové léky snižující krevní tlak, které dokáží ovlivnit nadměrnou aktivitu SNS a zároveň neporušit nebo snížit inzulinovou rezistenci.
Zvýšená aktivita SNS je v přímé asociaci nejen s kardiovaskulární, ale i s celkovou mortalitou. Tepová frekvence, jednoduchý projev sympatické aktivity, byla v přímé asociaci s úmrtností v epidemiologické studii u mužů i u žen z framinghamské populace [5]. Kvalita funkce SNS je na jedné straně dána geneticky, na druhé straně je ovlivňována celou řadou zevních faktorů. Vliv zevních faktorů zprostředkovávají hypotalamická jádra; jak se tyto vlivy odrazí na funkci SNS, závisí na individuální vulnerabilitě organismu.
Zvýšenou aktivitu SNS lze velmi úspěšně ovlivnit úpravou životního stylu, tj. nefarmakologicky. Je dostatečně prokázáno, že racionální nízkoenergetická dieta, nekouření a pravidelná pohybová aktivita významně snižují inzulinovou rezistenci a sympatickou nervovou aktivitu, a následně snižují riziko vzniku aterosklerotických vaskulárních nemocí a jejich komplikací, tj. především akutních koronárních syndromů a akutní ischemické mozkové příhody, ale také snižují riziko vzniku DM 2. Pomocí léků lze nejlépe ovlivnit zvýšenou aktivitu SNS některými antihypertenzivy. Standardní terapie hypertenze thiazidovými diuretiky a b≤-blokátory má nepříznivé metabolické účinky, a proto bychom je neměli u nemocných s MS indikovat jako léky první volby. V léčbě hypertenze s metabolickými poruchami lze indikovat metabolicky neutrální diuretikum – indapamid, který kromě mírnějšího diuretického účinku má zároveň přímý protektivní účinek na stěny arterií.
Blokátory kalciových kanálů dihydropyridinového typu s krátkodobým účinkem zvyšují aktivitu SNS, a proto se již nedoporučují v léčbě hypertenze. Dihydropyridiny s dlouhodobým účinkem by neměly zvyšovat aktivitu SNS, ale výsledky prezentované v literatuře jsou rozporuplné; velmi vhodná je proto kombinace dihydropyridinů s b-blokátory nebo s inhibitory renin-angiotenzinového systému, které také snižují aktivitu SNS. Aktivitu SNS snižují benzothiazepiny (diltiazem), a ještě více fenylalkylaminy (verapamil). Nejvhodnějšími antihypertenzivy, která mají příznivé metabolické, kardioprotektivní, vazoprotektivní a nefroprotektivní účinky nezávislé na redukci systémového krevního tlaku a zároveň snižují aktivitu SNS, jsou inhibitory renin-angiotenzinového systému, tj. inhibitory ACE a blokátory receptorů AT1 pro angiotenzin II (sartany). Tato léčiva zlepšují endotelovou dysfunkci, neovlivňují lipidový profil, ale zlepšují fibrinolýzu a zvyšují inzulinovou senzitivitu průměrně o 10–15 %, a proto jejich podávání vede při léčbě hypertenze u vysoce rizikových osob k významné redukci rizika vzniku diabetu 2. typu. Sartany patří mezi léky s nejvyšším účinkem na prevenci vzniku diabetu, jak zjistila „network meta-analysis" provedená na základě 22 klinických studií, tj. u více než 140 tisíc nemocných. Novou generaci centrálně působících antihypertenziv představují agonisté imidazolinových receptorů (moxonidin, rilmenidin). Imidazolinové receptory jsou uloženy v laterální části rostrální míchy – v nucleus reticularis lateralis – jsou více zapojeny do regulace krevního tlaku než a2-receptory. Imidazoliny, tj. látky aktivující imidazolinové receptory, dokáží mechanismem podobným baroreceptorovému reflexu snížit spontánní aktivitu sympatických center. Moxonidin a rilmenidin jsou středně účinná atihypertenziva, která snižují aktivitu sympatiku, zlepšují inzulinovou senzitivitu (cca o 25 %), a lze proto předpokládat jejich dostatečnou kardioprotektivitu. V současné době jsou doporučována především do kombinační terapie hypertenze, ale vzhledem k jejich dobré snášenlivosti nic nebrání jejich užívání v monoterapii; vhodnou indikaci imidazolinů představují hypertenze s největší aktivací SNS, tedy juvenilní hypertenze, hypertenze spojená s abdominální obezitou, s inzulinovou rezistencí, eventuálně s diabetem 2. typu.
II. Endokanabinoidní systém
Objev prvního endokanabinoidního receptoru a jedné jeho endogenní ligandy na začátku 90. let poskytl první představu o nervovém modulátoru – endokanabinoidním systému, který reguluje synaptické neurotransmise. Jeho ligandy byly nazvány endokanabinoidy; nejvíce studované ligandy – anandamid a 2-arachidonoylglycerol – jsou produkovány postsynapticky podle potřeby na různé stresové stimuly. Endokanabinoidní systém reguluje prostřednictvím dalších neurotransmiterů, mediátorů a hormonů chuť k jídlu, příjem potravy, relaxaci, vnímání bolesti, ovlivňuje paměť, ale může hrát roli u řady různých chorob, např. u roztroušené sklerózy mozkomíšní, u Parkinsonovy choroby i u některých nádorů aj. Receptory endokanabinoidního systému typu CB1 se vyskytují v mozku i v periferních orgánech (v játrech, tukové tkáni, svalech aj.) a mají vztah k regulaci energetického metabolismu. Tonická endokanabinoidní aktivita v limbické oblasti mozku je klíčovou komponentou v neurochemické regulaci chuti k jídlu a příjmu potravy. V laterálním hypotalamu se odehrává interakce mezi leptinem (ghrelinem a dalšími hormony tukové tkáně) na jedné straně a endokanabinoidy na straně druhé, čímž dochází k modulaci chuti k jídlu [6]. Vztah endokanabinoidního systému a regulace energetického metabolismu má nejblíže k patofyziologii MS.
U některých patologických stavů dochází k nadměrné aktivaci endokanabinoidního systému, např. u MS, hypertoniků, obézních atd. Potlačení zvýšené aktivity je jednou z cest, jak snížit příjem potravy a poté hmotnost, jak snížit inzulinovou rezistenci a zmírnit následné metabolické poruchy. Prvním inhibitorem CB1-receptorů endokanabinoidního systému je rimonabant, který byl testován ve studiích The Rimonabant In Obesity (RIO): RIO-Europe, RIO-Lipids, RIO-North America a RIO-Diabetes. Rimonabant ve srovnání s placebem vedl k redukci hmotnosti a ke zlepšení metabolických a kardiovaskulárních rizikových faktorů u obézních nemocných bez diabetu i u diabetiků 2. typu. Snížení aktivity endokanabinoidního systému vede tedy k úpravě energetického metabolismu, ale také prostřednictvím narušení dopaminergního přenosu v nucleus accumbens naruší závislost na některých drogách (např. závislost na nikotinu); tím dokáže snížit kardiometabolické riziko u nemocných, kterým je podáván. V současnosti je však diskutován vedlejší účinek léčby rimonabantem, tj. vznik depresivní nálady, což opět poukazuje na asociaci metabolických a psychických patologických procesů [7]. Studie SERENADE (the Study Evaluating Rimonabant Efficacy in Drug-Naive Diabetic Patients), která potvrdila účinnost rimonabantu na snížení glykémie, redukci hmotnosti i zlepšení lipidového metabolismu, však zaznamenala téměř u 6 % nemocných výskyt symptomů depresivní poruchy ve srovnání s placebovou skupinou, kde tento výskyt netvořil ani 1 %. Tento nežádoucí účinek bude bohužel omezovat indikaci rimonabantu u nemocných s metabolickým syndromem a diabetem 2. typu, neboť právě tito nemocní mají větší sklon k depresivní náladě a mají vyšší výskyt depresivních poruch [8]. Existence endokanabinoidního systému a jeho ovlivnění je tedy dalším důkazem, že mozek je involvován do vzniku metabolických poruch.
III. Peroxisome proliferator-activated receptors (PPAR)
Receptory PPAR se nacházejí v jaderných membránách buněk všech orgánů, kde působí jako transkripční faktory ovlivňující expresi genů řady různých enzymů, mediátorů a jiných látek zapojených v nejrůznějších procesech, např. v glukózovém a lipidovém metabolismu, v regulaci zánětu, imunitních dějů, v nádorovém bujení apod. Nelze vyloučit, že sehrávají i významnou úlohu v propojenosti periferních a centrálních procesů intermediárního metabolismu. Jsou známy receptory PPAR-a, PPAR-d = b a PPAR-g; PPAR-a byly popsány hlavně v játrech, tukové tkáni, v ledvinách, ve svalech a v GIT, PPAR-d = b byly my nalezeny v různých tkáních, ale hlavně v mozku, kde hrají důležitou úlohu v myelinizaci a lipidovém metabolismu mozkové tkáně, PPAR-g mají 3 izoformy (1–3) a jejich výskyt byl popsán v různých orgánech: v srdci, ve stěnách arterií, v ledvinách, nadledvinách a dokonce i v mozku. Nejvíce známá a prokázaná je jejich role v metabolismu glukózy a lipidů. Aktivace PPAR-g pomocí agonistů – thiazolidindionů (rosiglitazon nebo pioglitazon) – se využívá v klinické praxi v léčbě diabetu, neboť zvyšují koncentraci glukokinázy a snižují produkci TNF-a a rezistinu tukovými buňkami, které se mohou podílet na rozvoji inzulinové rezistence. Průkazy vlivu thiazolidindionů na inzulinovou rezistenci v mozkové tkáni však nemáme dostatečné. Experimentální práce ukazují, že ovlivněním PPAR-g pomocí thiazolidindionů dochází ke snižování oxidačního stresu, k potlačení zánětu u ischemické mozkové tkáně a k potlačení projevů autoimunitních procesů v mozku. Jiné práce ukazují na možnost ovlivnění degenerativních procesů v mozku, které mohou být podkladem Parkinsonovy nebo Alzheimerovy choroby. Dokonce byl prokázán vliv thiazolidindionů na snížení buněčné proliferace u experimentálně navozených mozkových nádorů [9]. To vše naznačuje směry možného dalšího klinického využití této skupiny léků v léčbě mozkových onemocnění. O možnostech prevence ischemických poruch mozku ovlivněním mozkových PPAR-a např. pomocí fibrátů nebo resveratrolu lze spíše spekulovat na základě experimentálních studií na myších [10]. Fibráty však mají již své klinické postavení v léčbě typické inzulinorezistentní dyslipidémie, tj. u pacientů s vyššími hladinami triglyceridů a nízkou hladinou HDL cholesterolu. Z ostatních přípravků, které ovlivňují PPAR, jsou známé novější sartany (např. telmisartan), působící také jako selektivní modulátory PPAR-g; jejich kombinační účinek na renin-angiotenzinový systém a glukózový a lipidový metabolismus by měl být výhodný právě v léčbě nemocných s MS a diabetem.
Objev nukleárních PPAR a především farmakologické ovlivnění PPAR-g má velký význam v léčbě diabetu 2. typu a metabolického syndromu. Existence PPAR v různých orgánech i v mozku je dalším důkazem, že tyto receptory jsou involvovány v asociaci procesů, které probíhají v mozku i v periferních tkáních a vedou ke vzniku MS.
Závěr
Centrální sympatický nervový systém, sympatoadrenální systém, endokanabinoidní systém a receptory PPAR jsou příklady hlavních (i když jistě ne jediných) mechanismů zapojených do rozvoje metabolického syndromu, které dokládají spojení mezi patofyziologickými procesy odehrávajícími se v oblasti mozku a v periferních tkáních. Mozek – CNS – je řídící orgán, ale všechny procesy regulací, které se váží k intermediárnímu metabolismu, nejsou ještě zcela objasněny. Výzkum v této oblasti však jistě v budoucnosti poskytne důležité směry pro vývoj nových a účinnějších léků uplatňujících se např. v prevenci vzniku obezity a metabolického syndromu i v prevenci vzniku diabetu 2. typu.
Seznam použité literatury
- [1] Goldstein BJ, Miller-Wieland D. Textbook of Type 2 Diabetes. London, Martin Dunitz 2003.
- [2] Horvath TL. The hardship of obesity: a soft-wired hypotalamus. Nat Neurosci 2005; 8: 561–565.
- [3] Rosolová H. Sympatický nervový systém a kardiovaskulární riziko. Praha, Maxdorf Jesenius 2000.
- [4] Reaven GM, Lithell L, Landsberg L. Hypertension and associated metabolic abnormalities – the role of insulin resistance and the sympathoadrenal system. N Engl J Med 1996; 334: 374–381.
- [5] Gillman MW, Kannel WB, Bekanger RB, et al. Influence of heart rate on mortality with hypertension: The Framingham Study. Am Heart J 1993; 125: 1148–1154.
- [6] Seeley RJ, York DA. Fuel sensing and the central nervous system (CNS): implications for the regulation of energy balance and the treatment for obesity. Obes Rev 2005; 6: 259–265.
- [7] Gadde KM, Allison DB. Cannabinoid-1 receptor antagonist, Rimonabant, for management of obesity and related risks. Circulation 2006; 114: 974–984.
- [8] Petrlová B, Rosolová H, Hess Z, et al. Depressive disorders and the metabolic syndrome of insulin resistance. Seminars in Vascular Medicine 2004; 4: 161–165.
- [9] Haluzík M, Svačina Š. Metabolický syndrom a nukleární receptory. Praha, Grada Publishing 2005.
- [10] Inoue H, Juany XF, Katayama T, et al. Brain protection by resveratrol and fenofibrate against stroke requires peroxisome proliferator-activated receptor alpha in mice. Neurosci Lett 2003; 352: 203–206.