Methotrexát v léčbě revmatoidní artritidy
Methotrexát (MTX) se používá v revmatologii již déle než 30 let a je mezi ostatními chorobu modifikujícími léky základním léčivem v terapii revmatoidní artritidy. Nové metaanalýzy, které se zabývají strategií léčby a monitorováním toxicity MTX, zdůrazňují potřebu intenzifikace léčby za současného dodržování adekvátních bezpečnostních postupů jak při dávkování, tak i za zvláštních životních situací, jako je perioperační období nebo gravidita. Článek připomíná nejnovější doporučení České revmatologické společnosti i evropské společnosti EULAR a poslední mezinárodní doporučení z roku 2009 vycházející z poznatků medicíny založené na důkazech.
Úvod
Methotrexát (MTX) je v rámci skupiny chorobu modifikujících léků (disease modifying antirheumatic drugs – DMARD) pro léčbu revmatoidní artritidy (RA) lékem první volby a také „kotevním“ lékem do kombinací s ostatními DMARD i s biologickými léky. Přesto, že zkušenosti s tímto léčivem jsou již delší než 30 let, nebyla dosud jasně definována pravidla pro jeho podávání. Ve snaze vyplnit tuto mezeru se objevila v posledních měsících řada publikací, které na podkladě metaanalýz navrhují základní doporučení pro léčbu RA methotrexátem.
Mechanismus účinku
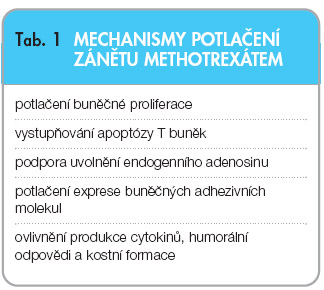 MTX má obecně antiproliferativní a imunosupresivní účinek. Jeho schopnost potlačit zánětlivý proces při RA se uplatňuje na několika známých úrovních působení. Další mechanismy účinků zůstávají nadále neobjasněny [1, 2]. Popsané způsoby potlačení zánětu MTX jsou uvedeny v tab. 1.
MTX má obecně antiproliferativní a imunosupresivní účinek. Jeho schopnost potlačit zánětlivý proces při RA se uplatňuje na několika známých úrovních působení. Další mechanismy účinků zůstávají nadále neobjasněny [1, 2]. Popsané způsoby potlačení zánětu MTX jsou uvedeny v tab. 1.
Farmakokinetika
Po perorálním podání se MTX téměř kompletně vstřebává, byly však zjištěny velké rozdíly v biologické dostupnosti v rozmezí 28–94 % v porovnání s intravenózně podanou látkou. Biologická dostupnost po intramuskulárním (i.m.) podání se udává 45–85 %. Vstřebávání je rychlé, maximální koncentrace je dosaženo v průměru za 83 minut, sérový eliminační poločas je 6–7 hodin. MTX je metabolizován především v játrech, vylučován je ze 30–80 % ledvinami a ze 3–23 % žlučí [3]. MTX obsahuje jen jednu glutamátovou doménu. Po proniknutí do buňky (např. erytrocytů) jsou pomocí enzymu folyl-polyglutamát syntetázy postupně přidávány další glutamátové domény. Enzym g-glutamyl hydroláza naopak odstraňuje terminální glutamátové molekuly a navrací MTX k jeho monoglutamátové podobě, která je rychle přenesena ven z buňky [4]. Koncentrace nitrobuněčného polyglutamátového MTX v erytrocytech je měřitelná a velmi dobře koreluje s koncentrací v jiných buňkách, jako např. v lymfocytech, a dle posledních prací také predikuje odpověď na léčbu [5]. Existuje však velmi široká interindividuální variabilita koncentrace polyglutamátového MTX u dospělých s RA. Po změně dávky je potřeba více než 6 měsíců k dosažení ustáleného stavu erytrocytární koncentrace, z čehož vyplývá, že rychlé navýšení dávky nebo parenterální podávání na začátku léčby by mohlo vést k rychlejšímu dosažení terapeutické odpovědi a mohlo by to také vysvětlit lepší účinnost parenterálních forem [6].
Dávkování a způsob podávání
Osm randomizovaných studií kontrolovaných placebem (RCT) srovnávalo perorální (p.o.) podávání MTX v různých dávkovacích schématech (3krát), intramuskulární (i.m.) podávání v různém dávkování (1krát), p.o. podávání oproti subkutání (s.c.) formě (1krát) nebo týdenní podávání oproti jinému dávkovacímu schématu (3krát).
Dalších 30 RCT hodnotilo monoterapii MTX oproti placebu (5krát), oproti jiným DMARD v monoterapii (21krát), oproti kombinované terapii (1krát) nebo oproti inhibitorům TNF-a (3krát). Výsledky metaanalýzy ukázaly, že počáteční dávka 25 mg MTX p.o. jednou týdně nebo rychlé zvyšování dávky o 5 mg měsíčně do cílové dávky 25–30 mg/týden byly spojeny s větší účinností, ale i s vyšší toxicitou ve srovnání se startovací dávkou 5–15 mg/týden nebo s pomalejším zvyšováním dávky o 5 mg za tři měsíce.
Perorální forma je pro pacienty dostupnější a celkově méně nákladná, avšak biologická dostupnost vyšších dávek je vyšší pro parenterální formy. Jedna studie prokázala, že stejná dávka podaná subkutánně je účinnější než při perorálním podání [7]. V dalších observačních studiích byl zaznamenán relaps choroby při přechodu z parenterálního na p.o. podávání ve stejné dávce, nikoli však při přechodu na p.o. dávku o 2,5–5 mg vyšší. Jiné studie prokázaly u selhávající p.o. terapie zlepšení účinnosti při přechodu na stejnou parenterální dávku [8].Perorální forma by měla mít při léčbě RA přednost. V případě nedostatečné účinnosti při nejvyšší tolerované dávce je však vhodné převedení na formu parenterální. Vzhledem k biologickému poločasu polyglutamátového MTX (3 dny) existoval předpoklad vyšší účinnosti a nižší toxicity při podávání dvakrát týdně. Jedna práce zabývající se touto možností však neprokázala výhodu oproti podávání jednou týdně, které se též ukázalo jako více praktické [9]. Proto je nadále doporučováno podávání jednou týdně s možností přechodu na dávkování jednou za 14 dní při dlouhodobé remisi.
Použití v monoterapii
V celé řadě krátkodobých i dlouhodobých randomizovaných studií kontrolovaných placebem byla prokázána vysoká účinnost i bezpečnost MTX, jakož i zpomalující vliv na rentgenovou progresi onemocnění a snížení mortality pacientů s těžkou RA. Metaanalýza studií, kterou publikoval Tugwell a kol. [10], prokázala o 26–30 % vyšší účinnost MTX ve srovnání s placebem. Vysokou účinnost a zpomalení rentgenové progrese během léčby MTX ve srovnání s ostatními DMARD potvrzuje většina srovnávacích klinických studií [11–16]. U dosud neléčených pacientů s RA má monoterapie MTX lepší poměr účinnost/toxicita než kombinovaná terapie DMARD [16].
Použití v kombinacích s ostatními DMARD a s biologickými léky
Kombinovaná léčba RA více DMARD současně byla navržena na začátku 90. let na základě zjištění, že účinnost monoterapie DMARD poměrně často selhává [17]. Nejčastější součástí kombinační terapie DMARD, ať již s léky klasickými, či s biologickými, se stal právě MTX. Od té doby proběhla řada studií kombinované léčby s MTX, ve kterých byla prokázána vyšší účinnost kombinované terapie [18–25], nebo alespoň stejná účinnost jako v monoterapii [26, 27].
Jako nejúčinnější léčba refrakterní RA se v současné době jeví kombinace MTX s inhibitorem TNF-a. Byly provedeny zásadní studie podávání všech tří inhibitorů TNF-a spolu s MTX [19–22]. Ve všech těchto studiích bylo přidání inhibitoru TNF-a velmi přínosné ve srovnání s efektem samotného MTX. Infliximab je v terapii RA dokonce určen k podávání výhradně v kombinaci s MTX. Kromě výhody synergického účinku je tento postup bezpečnější, protože snižuje imunogenicitu infliximabu [21]. Etanercept i adalimumab lze podávat v monoterapii, ale výsledky ukazují, že kombinace s MTX je účinnější [28]. Na základě studie fáze II, ve které byl srovnán rituximab v monoterapii oproti kombinaci s MTX a kde byla zaznamenána lepší odpověď pacientů s RA na kombinovanou léčbu, se rituximab podává rovněž současně s MTX [29].
Nežádoucí účinky
Významnou práci o toxicitě DMARD publikoval Felson a kol. [30] formou metaanalýzy, ve které byl MTX shledán druhým nejméně toxickým lékem po antimalarikách. Poměr účinnost/toxicita měl MTX nejpříznivější. Nicméně je nutno konstatovat, že některé nežádoucí účinky MTX se mohou projevit až po dlouhodobé léčbě a mohou být potenciálně závažné. Problémem bývá hepatotoxicita, ale při respektování návodů k monitorování bezpečnosti léčby je výskyt závažných hepatopatií velmi vzácný. Dalšími nežádoucími účinky bývají myelotoxicita, methotrexátová pneumonitida, nauzea, stomatitida, průjem a defluvium.
Prevence nežádoucích účinků
Metaanalýza devíti RCT ukázala, že kyselina listová snižuje výskyt gastrointestinální a hepatální toxicity, aniž by snížila účinnost MTX [31]. Rozdíl mezi kyselinou listovou a kyselinou folinovou ve schopnosti zabránit nežádoucím účinkům nebyl prokázán [32]. Vzhledem k desetinásobně vyšší ceně kyseliny folinové je výhodnější podávat Acidum folicum v tabletě po 10 mg jednou týdně než Calciumfolinat 15 mg v jedné tabletě nebo Leucovorin v ampulích po 10 mg nebo 25 mg. Britská revmatologická společnost akceptuje požívání alkoholických nápojů během léčby MTX „v rámci národních norem“. Vzhledem k tomu, že národní normy a jejich definice mohou být v různých zemích velmi odlišné, bude vhodnější držet se instrukcí z SPC (Summary of Product Characteristics), kde se pití alkoholu během užívání MTX nedoporučuje.
Použití ve vyšším věku
K rizikovým faktorům vzniku dřeňového útlumu během léčby MTX patří kromě současné terapie jinými léky s antifolátovým působením a deficitu kyseliny listové také renální insuficience s následným zpomalením vylučování léčiva. MTX je totiž převážně eliminován ledvinami, a i když jeho vlastní nefrotoxický potenciál je jen minimální (snížení kreatininové clearance o 11 % u pacientů užívajících 7,5 mg MTX týdně po dobu 6 měsíců) [33], může každé zhoršení renálních funkcí (jak je často pozorováno ve vyšším věku) zvýšit jeho sérové hladiny, a tím potencovat riziko nežádoucích účinků.
V populační studii publikované v minulém roce byl vyšší věk spojen s výraznější tendencí k přerušení léčby MTX u pacientů s nově diagnostikovanou RA [34]. Vyšší věk a zejména renální insuficience by měly být důvody k bedlivému monitorování bezpečnosti léčby, ke snížení úvodní dávky a k pomalejší titraci dávky dle laboratorních výsledků.
Perioperační období během léčby
Od začátku éry MTX v revmatologii bylo zvykem léčbu přerušit několik týdnů před plánovanou chirurgickou intervencí a opět zahájit se souhlasem chirurga po definitivním zhojení operační rány. Tato praxe však nebyla podložena poznatky medicíny založené na důkazech. Od roku 1993 vzniklo celkem 5 konzistentních prací, které se zabývaly touto problematikou. V první ze dvou RCT nebyl prokázán rozdíl ve výskytu pooperačních komplikací mezi pacienty, kteří se léčili MTX nepřetržitě nebo podávání přerušili [35], ve druhé vedlo pokračování v léčbě k nižšímu výskytu relapsů RA [36]. Ani třetí práce neprokázala asociaci mezi léčbou MTX a zhoršením hojení, byl naopak zaznamenán menší počet relapsů základního revmatologického onemocnění [37]. Též pětiletá retrospektivní studie Jaina z roku 2002 neprokázala statisticky významný rozdíl ve vzniku infekce u pacientů užívajících během operace MTX, kortikoidy nebo oba léky současně [38]. Prospektivní kohortová studie prokázala 30% výskyt infekčních komplikací při nepřetržitém podávání ve srovnání s nulovým výskytem, pokud byla léčba MTX přerušena, a to bez relapsů RA [39].
Přehled všech studií (celkem 8) zabývajících se léčbou MTX u pacientů, kteří podstoupili plánované ortopedické výkony, byl publikován v roce 2008. Autoři konstatují, že léčbu MTX tolerují pacienti perioperačně dobře a že jeho nepřetržité užívání pomáhá ke snížení výskytu opětovného vzplanutí (relapsu) RA [40].
Plánovaná gravidita
MTX je prokázaný teratogen – indukuje aborty a malformace plodu. V období gravidity a laktace je přísně kontraindikován a je nutno přerušit jeho podávání ženám minimálně tři měsíce před plánovanou koncepcí. Nebyly však publikovány studie, které by potvrdily stejný vliv MTX při léčbě otce nebo infertilitu muže či ženy [41].
Doporučení pro použití v terapii RA
Česká revmatologická společnost
Česká revmatologická společnost publikovala v roce 2007 doporučení pro léčbu RA [42] a v roce 2009 doporučení pro monitorování bezpečnosti DMARD [43]. Počáteční léčba MTX je zde doporučována u pacientů s vysokou 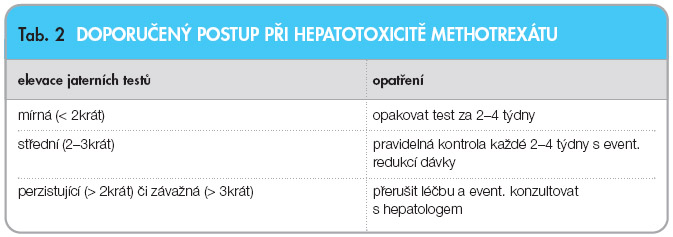 aktivitou onemocnění, s polyartritidou, s přítomností negativních prognostických faktorů a s rychlým rozvojem kloubních erozí, většinou u pacientů s definitivní diagnózou RA. Monitorovací schémata a postupy při nejčastějších projevech hepatální toxicity jsou uvedeny v tab. 2.
aktivitou onemocnění, s polyartritidou, s přítomností negativních prognostických faktorů a s rychlým rozvojem kloubních erozí, většinou u pacientů s definitivní diagnózou RA. Monitorovací schémata a postupy při nejčastějších projevech hepatální toxicity jsou uvedeny v tab. 2.
Evropská doporučení
Doporučení EULAR (European League Against Rheumatism) pro léčbu časné artritidy uvádějí, že mezi léčivy ze skupiny DMARD je MTX považován za kotevní lék a měl by být použit jako první volba u pacientů s rizikem rozvoje perzistujícího onemocnění, a to i před stanovením definitivní diagnózy RA [44].
Mezinárodní doporučení
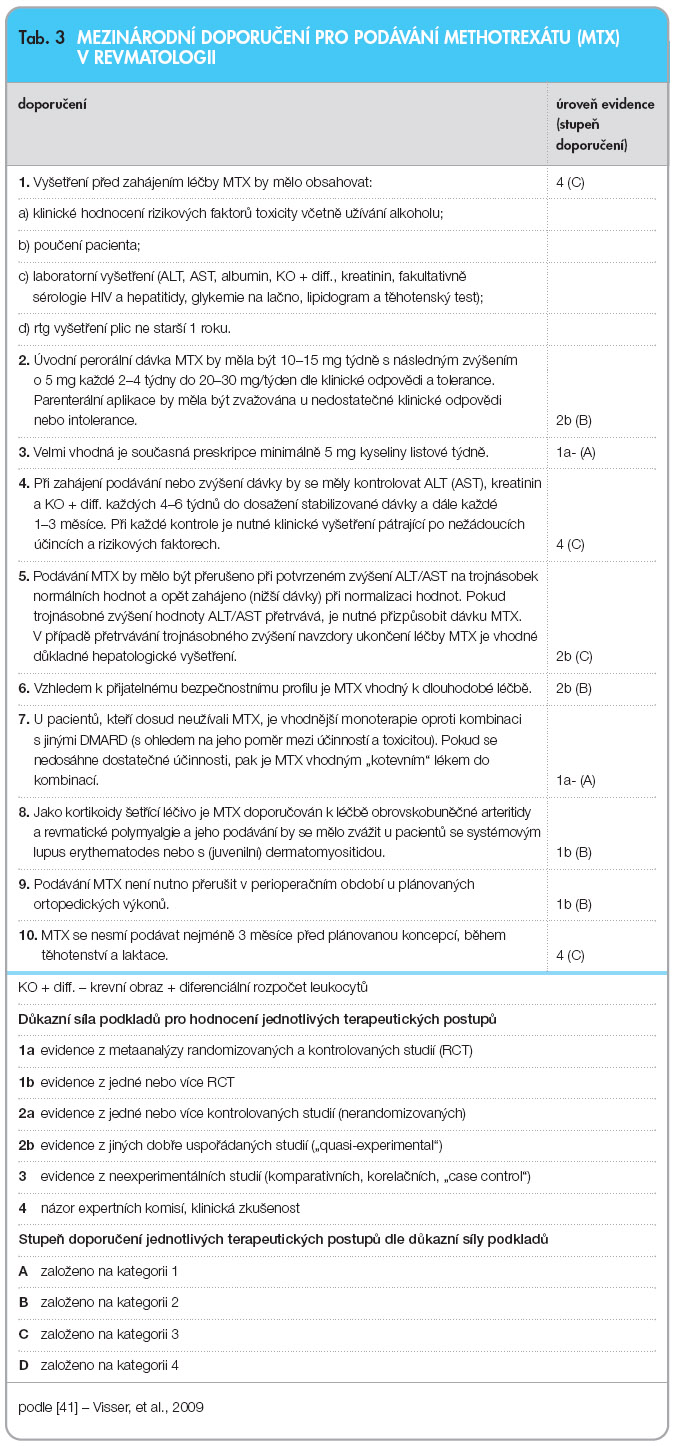
V červenci 2009 byla publikována doporučení pro léčbu MTX pro denní klinickou revmatologickou praxi vycházející z medicíny založené na důkazech [41], viz tab. 3.
Závěr
 Methotrexát je nejdůležitějším chemickým lékem pro léčbu revmatoidní artritidy a kotevním lékem do všech kombinací, a to jak s ostatními chemickými léčivy, tak i s biologickými léky. Jeho použití je široké, od časné, ještě nediferencované artritidy, až po dlouholetou etablovanou revmatoidní artritidu, a nachází své uplatnění i v terapii jiných systémových revmatických onemocnění.
Methotrexát je nejdůležitějším chemickým lékem pro léčbu revmatoidní artritidy a kotevním lékem do všech kombinací, a to jak s ostatními chemickými léčivy, tak i s biologickými léky. Jeho použití je široké, od časné, ještě nediferencované artritidy, až po dlouholetou etablovanou revmatoidní artritidu, a nachází své uplatnění i v terapii jiných systémových revmatických onemocnění.
Třicet let od zavedení MTX do revmatologické praxe prověřilo jeho výborný poměr účinnosti a tolerance a přineslo dostatek zkušeností pro široké použití v klinické praxi. Přesto se stále setkáváme s nesprávným zacházením s tímto lékem a především s podáváním v nedostatečných dávkách u pacientů s aktivním onemocněním. Tento článek chce proto přispět k rozšíření nejmodernějšího přístupu k MTX mezi širokou lékařskou veřejnost.
Seznam použité literatury
- [1] Wessels JA, Huizinga TW, Guchelaar HJ. Recent insights in the pharmacological actions of methotrexate in the treatment of rheumatoid arthritis. Rheumatology (Oxford) 2008; 47: 249–255.
- [2] Kremer JM. Methotrexate treatment of rheumatic diseases: can we do better? Arthritis Rheum 2008; 58: 3279–3282.
- [3] Lebbe C, Beyler CH, Gerber N. Intraindividual variability of the bioavailability of low dose methotrexate after oral administration in RA. Ann Rheum Dis 1994; 53: 475–477.
- [4] Dalrymple JM, Stamp LK, O'Donnell JL, et al. Pharmacokinetics of oral methotrexate in patients with rheumatoid arthritis. Arthritis Rheum 2008; 58: 3299–3308.
- [5] Braun J, Rau R. An update on methotrexate. Curr Opin Rheumatol 2009; 21: 216–223.
- [6] Braun J, Kästner P, Flaxenberg P, et al; MC-MTX.6/RH Study Group. Comparison of the clinical efficacy and safety of subcutaneous versus oral administration of methotrexate in patients with active rheumatoid arthritis: results of a six-month, multicenter, randomized, double-blind, controlled, phase IV trial. Arthritis Rheum 2008; 58: 73–81.
- [7] Visser K, van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systemic review of the literature. Ann Rheum Dis 2009; 68: 1094–1099.
- [8] Rozin A, Schapira D, Balbir-Gurman A, et al. Relapse of rheumatoid arthritis after substitution of oral for parenteral administration of methotrexate. Ann Rheum Dis 2002; 61: 756–757.
- [9] Pandya S, Aggarwal A, Misra R. Methotrexate twice weekly v.s. once weekly in rheumatoid arthritis: a pilot double-blind, controlled study. Rheumatol Int 2002; 22: 1–4.
- [10] Tugwell P, Bennet K, Bell M, et al. Methotrexate in RA. Ann Intern Med 1989; 110: 581–583.
- [11] Bathon JM, Martin RW, Fleischmann RM, et al. A comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. N Engl J Med 2000; 343: 1586–1593.
- [12] Drosos AA, Tsifetaki N, Tsiakou EK, et al. Influence of methotrexate on radiological progression in rheumatoid arthritis: a sixty-month prospective study. Clin Exp Rheumatol 1997; 15: 263–267.
- [13] Jeurissen ME, Boerbooms AM, van de Putte LB, et al. Influence of methotrexate and azathioprine on radiological progression in rheumatoid arthritis. A randomized, double-blind study. Ann Intern Med 1991; 114: 999–1004.
- [14] Emery P, Breedveld FC, Lemmel EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford) 2000; 39: 655–665.
- [15] Aletaha D, Smolen JS. Effectiveness profiles and dose dependent retention of traditional disease modifying antirheumatics drugs for rheumatoid arthritis. An observational study. J Rheumatol 2002; 29: 1631–1638.
- [16] Strnad V, Cohen S, Sheriff M, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch Intern Med 1999; 159: 2542–2550.
- [17] Wilske KA, Healy LA. Remodelling the pyramid – a concept whose time has come. J Rheumatol 1989; 16: 565–567.
- [18] Tugwell P, Pincus T, Jocum D, et al. Combination therapy with cyclosporine and methotrexate in severe rheumatoid arthritis. N Engl J Med 1995; 333: 137–141.
- [19] Weinblatt ME, Kremer JM, Bankhurst AD, et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein in patients with rheumatoid arthritis receiving methotrexate. N Engl J Med 1999; 340: 253–259.
- [20] Kremer JM, Caldwell JR, Cannov GW, et al. The combination of leflunomide and methotrexate in patients with active rheumatoid arthritis who failing on MTX treatment alone. Arthritis Rheum 2000; 43 (Suppl.): 224.
- [21] Lipsky PE, van der Heijde DM, St Clair EW, et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med 2000; 343: 1594–1602.
- [22] Weinblatt ME, Keystone EC, Furst D, et al. Adalimumab, a fully human anti-tumor necrosis factor alpha-monoclonal antibody, for the treatment of rheumatoid arthritis in patients taking metho-trexate. The ARMADA trial. Arthritis Rheum 2003; 48: 35–45.
- [23] O’Dell JO, Haire CE, Eriksson N, et al. Treatment of rheumatoid arthritis with methotrexate alone sulphasalazine and hydroxychloroquine, or a combination of three medications. N Engl J Med 1996; 334: 1287–1291.
- [24] Boers M, Verhoeven AC, Markusse HM, et al. Randomised comparison of combined step-down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis. Lancet 1997; 350: 309–318.
- [25] Proudman SM, Conaghan PG, Richardson C, et al. Treatment of poor prognosis early rheumatoid arthritis. Arthritis Rheum 2000; 43: 1809–1819.
- [26] Möttönen T, Hanonen P, Leirisalo-Repo M, et al. Comparison of combination therapy with single therapy in early rheumatoid arthritis. Lancet 1999; 353: 1568–1573.
- [27] Dougados M, Combe B, Cantagrel A, et al. Combination therapy in early rheumatoid arthritis. Ann Rheum Dis 1999; 58: 220–225.
- [28] Furst D, Breedveld FC, Kalden JR, et al. Updated consensed statement on biological agents for the treatment of rheumatoid arthritis and other immune mediated inflammatory diseases (May 2002). Ann Rheum Dis 2003; 62: (Suppl. II): ii2–ii19.
- [29] Edwards JC, Szczepanski L, Szechinski J, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350: 2572–2581.
- [30] Felson DT, Anderson JJ, Meenan RF, et al. Use of short-term efficacy/toxicity tradeoffs to select second-line drugs in rheumatoid arthritis. A meta-analysis of published clinical trials. Arthritis Rheum 1992; 35: 1117–1125.
- [31] Katchamart W, Ortiz Z, Shea B, et al. Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis (an update systematic review and meta-analysis). Arthritis Rheum 2008; 58 (suppl.) S473.
- [32] Prey S, Paul C. Effect of folic or folinic acid supplementation on methotrexate-associated safety and efficacy in inflammatory disease: a systematic review. Br J Dermatol 2009; 160: 622–628.
- [33] Kremer JM, Petrillo GF, Hamilton RA. Pharmacokinetics and renal function in patients with rheumatoid arthritis receiving a standard dose of oral methotrexate: association with significant decreases in creatine clearance and renal clearance of the drug after 6 month of therapy. J Rheumatol 1995; 22: 38–40.
- [34] Bernatsky S, Ehrmann Feldman D. Discontinuation of methotrexate therapy in older patients with newly diagnosed rheumatoid arthritis: analysis of administrative health databases in Québec, Canada. Drugs Aging 2008; 25: 879–884.
- [35] Sany J, Anaya JM, Canovas F, et al. Influence of methotrexate on the frequency of postoperative infectious complications in patients with rheumatoid arthritis. J Rheumatol 1993; 20: 1129–1132.
- [36] Grennan DM, Gray J, Loudon J, Fear S. Methotrexate and early postoperative complications in patients with rheumatoid arthritis undergoing elective orthopaedic surgery. Ann Rheum Dis 2001; 60: 214–217.
- [37] Murata K, Yasuda T, Ito H, et al. Lack of increase in postoperative complications with low-dose methotrexate therapy in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Mod Rheumatol 2006; 16: 14–19.
- [38] Jain A, Witbreuk M, Ball C, et al. Influence of steroids and methotrexate on wound complications after elective rheumatoid hand and wrist surgery. J Hand Surg Am 2002; 27: 449–455.
- [39] Carpenter MT, West SG, Vogelgesang SA, Casey Jones DE. Postoperative joint infections in rheumatoid arthritis patients on methotrexate therapy. Orthopedics 1996; 19: 207–210.
- [40] Pieringer H, Stuby U, Biesenbach G. The place of methotrexate perioperatively in elective orthopedic surgeries in patients with rheumatoid arthritis. Clin Rheumatol 2008; 27: 1217–1220.
- [41] Visser K, Katchamart W, Loza E, et al. Multinational evidence-based recommendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis: integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E Initiative. Ann Rheum Dis 2009; 68: 1086–1093.
- [42] Bečvář R, Vencovský J, Suchý D, Procházková L, Pavelka K. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby. Čes Revmatol 2007; 2: 73–90.
- [43] Šedová L, Štolfa J, Horák P, Pavelka K. Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy. Čes Revmatol 2009; 17: 4–15.
- [44] Combe B, Landewe R, Lukas C, et al. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2007; 66: 34–45.