Mobilizace kmenových krvetvorných buněk
Transplantace krvetvorby jsou již řadu let neodmyslitelnou a standardní součástí léčby zejména hematologických malignit. Základní metodologie odběrů krvetvorných buněk a jejich transplantací byly sice vypracovány již před 40 lety, ale dlouho bránilo masivnějšímu využití této léčebné modality především komplikované získávání transplantátů pomocí odběrů kostní dřeně. Za masivním rozšířením autologních transplantací v 90. letech minulého století tak stojí především využití mobilizace a sběru krvetvorných buněk (HSC, hematopoietic stem cells) z periferní krve. Mobilizace a odběry HSC z periferní krve dnes mají ve schématech onkologické léčby pevnou pozici, přičemž standardem mobilizace je již více než 10 let podávání G-CSF (granulocyte-colony stimulating factor): buď samostatně, nebo po mobilizační chemoterapii. Bohužel, 10–15 % pacientů, označovaných termínem „poor mobilizers“, nevyplavuje HSC v množství dostatečném pro odběr transplantátu, a vysokodávkovaná terapie tak u nich není možná. Nárůst znalostí o procesu mobilizace však v současnosti přináší nové preparáty, které působí synergisticky s G-CSF a jejichž mobilizační potenciál je velmi vysoký. Plerixafor je první takovou látkou, která se nyní dostává do klinické praxe. Tento antagonista receptoru CXCR4 dokáže s minimálními vedlejšími účinky navodit dostatečnou mobilizaci i u pacientů, které jinak řadíme do skupiny tzv. poor mobilizerů. V blízké budoucnosti můžeme s využitím plerixaforu a podobných látek očekávat celkové zjednodušení a urychlení procesu mobilizace a odběru HSC.
Historie
Úvodem si připomeňme objevy a práce, které vedly k dnes standardnímu využití krvetvorných buněk získávaných z krve. V roce 1962 Goodmanová a Hodgson přinesli důkaz o přítomnosti HSC (hematopoietic stem cells) v krvi myší [1] a v roce 1971 byl podobný objev učiněn u člověka [2]. Už v roce 1964 byla publikována práce o úspěšné obnově krvetvorby u letálně ozářených psů, kterým byl aplikován koncentrát zamrazených autologních leukocytů periferní krve [3]. V roce 1976 došlo k objevu výrazného zvýšení koncentrace krvetvorných buněk v krvi u pacientů po chemoterapii v době normalizace krevního obrazu [4], přičemž se autoři v závěru práce zamýšlejí nad možností odběru těchto buněk v době jejich maximálního vyplavování pomocí aferézy a nad výhodami tohoto postupu oproti odběrům kostní dřeně. První práce zabývající se odběry HSC z krve metodou aferézy byla publikována už o rok později; autoři přitom již tenkrát prokázali lineární vztah mezi koncentrací progenitorů krvetvorby v krvi a množstvím těchto buněk získaných aferézou [5]. Na konci 70. a během 80. let 20. století byla sice provedena řada odběrů koncentrátů leukocytů z periferní krve a jejich následných transplantací, tyto postupy však stále zůstávaly spíše na úrovni experimentu. Situace se začala měnit na konci 80. let minulého století, kdy se při testování růstového faktoru pro granulocyty (G-CSF) a pro granulocyty-makrofágy (GM-CSF) ukázalo, že po jejich několikadenním podávání dramaticky vzrostla koncentrace cirkulujících HCS [6, 7]. Také se ukázalo, že podávání GM-CSF a G-CSF po cytotoxické chemoterapii vede k ještě výraznějšímu vzestupu koncentrace HSC v krvi oproti samostatnému použití růstových faktorů [8–10]. Tyto objevy spolu s dalšími podmínkami, mezi které můžeme zařadit dostupnost růstových faktorů a řady vyspělých separátorů krevních elementů, zavedení flowcytometrie, a tedy i rychlé kvantifikace HSC jako populace CD34+ buněk, rozvoj podpůrné léčby, vedly během 90. let 20. století k ojedinělému rozvoji zejména autologních transplantací krvetvorných buněk.
Autologní transplantace, mobilizace a odběry krvetvorných buněk
Jak už bylo uvedeno, autologní transplantace krvetvorných buněk po vysokodávkované chemoterapii jsou standardní součástí léčby především u pacientů s mnohočetným myelomem a s vysoce rizikovými lymfomy, respektive chemosenzitivními relapsy lymfomů. Úspěšnost procedury a její mortalita jsou velmi významně ovlivněny kvalitou autotransplantátu, a tedy množstvím reinfundovaných krvetvorných buněk. Zdá se, že vyšší dávky transplantovaných krvetvorných buněk nejenom zlepšují parametry obnovy krvetvorby, ale rovněž prodlužují celkovou dobu přežití pacientů [11].
Klíčem k získání kvalitního transplantátu je mobilizace krvetvorných buněk, tzn. jejich vyplavení či vyplavování do periferní krve, kde se jejich koncentrace zvyšuje o 2–4 řády. V současnosti se mobilizací rozumí nejenom vlastní vyplavování progenitorů do krve, ale tento pojem zahrnuje celý proces začínající prvním podáním mobilizační léčby a končící posledním odběrem PBSC (peripheral blood stem cells) čili krvetvorných kmenových buněk periferní krve. Cílem mobilizace, a tedy základním předpokladem úspěšného odběru PBSC, je dosažení určité minimální koncentrace progenitorových buněk krvetvorby v krvi na takovou dobu, aby bylo možné odebrat pomocí aferézy kvalitní nebo alespoň bezpečný transplantát. Za nejnižší koncentraci CD34+ buněk, při níž se doporučuje zahájit odběr, se považuje 15 CD34+ buněk v jednom mikrolitru krve, i když za určitých okolností jsou aferézy prováděny i při nižších koncentracích. Pokud pacient nebo i dárce nedosáhnou tohoto limitu vyplavování progenitorů krvetvorby, pak jej označujeme anglickým termínem „poor mobilizer“ neboli skromný či chudý vyplavovač.
Transplantát považujeme za bezpečný v tom případě, že jeho podání po myeloablativní terapii zajistí plnou a trvalou obnovu krvetvorby ve všech řadách buněk během přiměřené doby, tj. přibližně za 20 dní od transplantace. Přitom se do jisté míry toleruje pomalejší normalizace trombopoezy, kdy dosažení koncentrace krevních destiček vyšší než 50 x 109/l může trvat poněkud déle. Díky určitému sjednocení metod kvantifikace CD34+ buněk, včetně různých programů mezilaboratorních kontrol apod., je za bezpečný považován autologní transplantát PBSC v případě, že obsahuje více než 2 x 106 CD34+ buněk/kg hmotnosti pacienta. S vyšším počtem CD34+ buněk se doba do obnovy krvetvorby (do přihojení) může poněkud zkrátit, ale tento efekt mizí při dávce přibližně 4–6 x 106 CD34+ buněk/kg a dávky vyšší již rychlost přihojení a ani jeho kvalitu dále neovlivní.
Kromě dosažení minimální koncentrace CD34+ buněk v krvi existují i další podmínky úspěšného sběru transplantátu. Koncentrace vyplavených krvetvorných buněk totiž musí být nejenom dostatečně vysoká, ale vyplavování musí také trvat dostatečně dlouhou dobu. Hovoříme o tzv. odběrovém oknu (harvest window), během kterého je možné či smysluplné aferézy provádět. Délka odběrového okna musí být dostatečně dlouhá zejména v případech, kdy je dosažená koncentrace CD34+ buněk nízká, a je proto nutné provést více aferéz ve více dnech. Odběrové okno musí být také do jisté míry předvídatelné, protože v opačném případě nemusíme ideální okamžik pro zahájení odběru zachytit, a pokud je okno krátké a mobilizace slabší, nemusí být získání bezpečného transplantátu úspěšné. Vyplavování krvetvorných buněk během odběrového okna by také mělo být setrvalé, jinými slovy, CD34+ buňky odebírané z krve při aferéze by se měly z poolu v kostní dřeni průběžně doplňovat, protože v opačném případě dochází opět k výraznému snížení výtěžnosti odběru. Jak je zřejmé, je na mobilizaci kladeno nemálo nároků. A navíc, optimální mobilizace má být dostatečně účinná i u starších a předléčených pacientů.
V praxi se dosud uplatňovaly téměř výhradně dvě základní strategie mobilizace: 1) mobilizace pomocí aplikace cytokinů, bez použití chemoterapie, 2) podání tzv. mobilizační chemoterapie s následnou aplikací cytokinů. Ostatní přístupy se používaly zcela ojediněle nebo se z různých příčin příliš neosvědčily.
Zlatým standardem mobilizace pomocí samotných cytokinů je podávání G-CSF, nejčastěji v dávce 10 mg/kg/den 1krát denně ráno. K maximálnímu vyplavení HSC dochází 5. a 6. den od zahájení podávání G-CSF. Existují různé modifikace tohoto postupu, například rozdělení denní dávky na ranní a večerní podání, přičemž je dosahováno vyšších koncentrací CD34+ buněk v krvi, a tedy i vyšších výtěžností sběrů. Tento postup je vyvážen o něco výraznějšími nežádoucími účinky G-CSF, projevujícími se zejména bolestmi skeletu, hlavy a svalů [12]. Další běžnou modifikací je vyšší dávka G-CSF (12–16 mg/kg/den), která se obvykle indikuje u více předléčených pacientů, případně u starších alogenních dárců.
Zlatým standardem mobilizace pomocí chemoterapie je podání střední dávky cyklofosfamidu (2–5 g/m2) následované každodenní podkožní aplikací 5–10 mg/kg/den G-CSF v jedné denní ranní dávce. Rozdělení vyšší denní dávky G-CSF (10 mg/kg/ den) do dvou aplikací přibližně po 12 hodinách (ráno a večer) opět dále zvýší mobilizační potenciál tohoto postupu. Podobně vyšší dávka cyklofosfamidu mobilizuje lépe než dávka nižší [13]. Mobilizační potenciál metody s využitím cyklofosfamidu a G-CSF je prokazatelně a zřetelně vyšší než při podávání samotného G-CSF [14]. Tento princip platí obecně a lze říci, že výtěžnost sběru PBSC při mobilizaci pomocí myelosupresivní chemoterapie (nejčastěji cyklofosfamidu, etoposidu, antracyklinů či paklitaxelu) s následným podáváním G-CSF je přibližně 2,5krát vyšší v porovnání se samotným G-CSF [15].
Na rozdíl od podávání samotného G-CSF, kdy je odběrové okno předem přesně známo, je pro správné načasování zahájení odběrů u mobilizace pomocí chemoterapie a G-CSF velmi vhodné denně monitorovat ranní krevní obraz v době vzestupu leukocytů z tzv. nadiru. Vzestup koncentrace CD34+ buněk obvykle sleduje vzestup koncentrace leukocytů a vyplavování progenitorů vrcholí většinou 2. až 3. den vyplavování, kdy jejich koncentrace v krvi dosahuje maxima. Schopnost mobilizace je velmi různorodá a interindividuální rozdíly v dosahovaných koncentracích progenitorů v krvi mohou být obrovské. Obvyklá koncentrace CD34+ buněk v krvi se sice pohybuje řádově v desítkách na mikrolitr, ale sami jsme opakovaně zaznamenali hodnoty přes 1000/ml. Problémy samozřejmě nepřináší situace, kdy pacient či dárce vyplavuje nezvykle velké množství progenitorů, ale naopak situace, kdy je vyplavení nedostatečné a pacient, eventuálně dárce, patří do skupiny tzv. poor mobilizerů.
Biologická podstata mobilizace
Krvetvorné buňky se z kostní dřeně vyplavují v malé míře trvale a po nějaké době cirkulace v krvi se do stejného kompartmentu opět vrací. Tento celoživotní proces má pravděpodobně určitý fyziologický význam nejenom ve smyslu regenerace a repopulace krvetvorby v případě jejího poškození, ale pravděpodobně se podílí na procesech hojení a regenerace i jiných tkání, než je tkáň krvetvorná. Není jistě náhodou, že ke zvýšení koncentrace progenitorů v krvi dochází např. po infarktu myokardu, při sepsi, ale také při velké tělesné zátěži a při stresu [16]. Krvetvorné buňky jsou součástí mikroprostředí kostní dřeně, které se skládá z matrix (kolagen, fibronektin, proteoglykany apod.) a z buněčné složky (stromální buňky, endoteliální buňky, osteoblasty, fibroblasty atd.). Celý systém je velmi komplexní a jednotlivé komponenty včetně krvetvorných buněk a vyzrávajících krevních elementů spolu široce interagují a mají vzájemné vazby, obvykle založené na systému různých povrchových molekul, ať už vazebných, či signálních, a jejich receptorů. Zejména progenitorové a kmenové buňky krvetvorby exprimují řadu receptorů a adhezních molekul, jimiž se váží k mikroprostředí dřeně: LFA-1 (lymphocyte function-associated antigen 1), VLA-4 (very late antigen 4), CXCR4 a CXCR2 (chemokinové receptory), c-kit receptor, glykoproteiny CD44 a CD62L. Ze strany mikroprostředí kostní dřeně se interakcí a vazeb zúčastňují zejména SDF-1 (stromal-derived factor 1) a dále CXC chemokin GRO-b (growth regulated oncogen beta), nově označovaný jako CXCL2, VCAM-1 (vascular cell adhesion molecule 1), kit ligand, ICAM-1 (inter-cellular adhesion molecule 1) a kyselina hyaluronová [17]. Z řady preklinických a experimentálních studií víme, že významné narušení alespoň jedné z vazeb, které poutají krevní progenitory v mikroprostředí kostní dřeně, vede ke zvýšenému uvolňování krvetvorných buněk do periferní krve čili k jejich mobilizaci.
Mobilizace s použitím cytokinů
GM-CSF představuje první cytokin používaný k mobilizaci krvetvorných buněk. Tento cytokin indukuje mobilizaci především stimulací proliferace a diferenciace hematopoetických progenitorů. Mobilizace samotným GM-CSF má však malou účinnost a výtěžnost odběrů CD34+ buněk je po jeho podání poměrně nízká a obvykle neuspokojivá, zejména ve srovnání s G-CSF [18]. Aplikace GM-CSF po mobilizační chemoterapii vede sice k lepšímu vyplavování CD34+ buněk než v případě použití GM-CSF v monoterapii, ale ve srovnání s G-CSF je mobilizace stále zřetelně horší. GM-CSF má přitom více nežádoucích účinků, které jsou ve srovnání s G-CSF navíc závažnější [19, 20]. Z těchto důvodů se v současnosti GM-CSF pro mobilizaci prakticky nepoužívá.
Aplikace G-CSF vede ke kvalitní mobilizaci jak při použití v monoterapii, tak v návaznosti na myelosupresivní chemoterapii. Mechanismy mobilizace při podávání G-CSF jsou přitom nepřímé. V kostní dřeni se zvyšuje počet progenitorů zadaných do granulocytární linie, a tedy i počet vyzrávajících granulocytárních prekurzorů, postupně i granulocytů. Z těchto buněk se v mikroprostředí krvetvorby uvolňují různé enzymy, zejména elastáza a různé proteázy, včetně matrix-metaloproteinázy 9 a katepsinu D. Výsledkem je vystupňovaná degradace adhezních molekul (hlavně VCAM-1, c-kit, CXCR4 a SDF-1), a tedy snížení adheze hematopoetických progenitorů ke stromatu kostní dřeně, což vede k jejich mobilizaci do periferní krve. G-CSF navíc snižuje aktivitu osteoblastů a expresi SDF-1 a na druhé straně zvyšuje aktivitu osteoklastů. Výsledkem je opět vystupňovaná mobilizace progenitorů krvetvorby do periferní krve [11, 21]. Účinnost G-CSF byla prokázána v řadě prací, vedlejší účinky jsou vcelku mírné, i když časté, a G-CSF se tak stal právem standardně používanou mobilizační látkou jak u pacientů, tak u zdravých dárců.
Variantou použití G-CSF je aplikace jeho pegylované formy, kterou je pegfilgrastim. Výhodou pegfilgrastimu je aplikace pouze jedné podkožní injekce, mobilizace je tak pro pacienta jednodušší a pohodlnější. Přitom sérová hladina G-CSF je díky velmi pomalé eliminaci dostatečná po celou dobu, od podání až do restituce granulopoezy. Využití pegfilgrastimu pro mobilizaci a sběr PBSC bylo testováno u pacientů s mnohočetným myelomem [22] i s lymfomy [23], výsledky byly uspokojivé a odběrové okno předvídatelné. Zdá se, že pegfilgrastim by mohl nalézt uplatnění zejména u pacientů, kteří mají problém s aplikací podkožních injekcí, mají sníženou compliance apod. Ostatní cytokiny se pro účely mobilizace příliš neprosadily. Erytropoetin nemá uspokojivý mobilizační potenciál a ani jeho použití v kombinaci s G-CSF pravděpodobně nepřináší zásadnější výhody [24]. Stem cell factor (SCF, c-kit ligand) také patří mezi komerčně dostupné cytokiny. Podávání SCF v kombinaci s G-CSF vyvolalo lepší mobilizaci, která navíc trvala delší dobu. Hlavním cílem využití SCF byla mobilizace výrazně předléčených pacientů nebo remobilizace pacientů, u nichž první a standardní mobilizace nevedla k získání uspokojivého transplantátu, tedy tzv. poor mobilizerů. Podávání SCF je však zatíženo poměrně výraznými nežádoucími účinky, z nichž nejobávanějšími a ne právě raritními jsou těžké anafylaktoidní reakce. Proto se používání SCF nikdy výrazně neprosadilo i přes jeho relativně dobrou účinnost [11, 25]. Dalším cytokinem, který zesiluje mobilizační efekt G-CSF, je trombopoetin (TPO). Bylo publikováno několik prací, v nichž byla pro mobilizaci PBSC použita kombinace rekombinantního TPO a G-CSF. Výsledky vypadaly nadějně, ukázalo se, že TPO působil podobně jako SCF nejméně aditivním či synergistickým efektem v kombinaci se standardním G-CSF [26]. Nicméně ani tento postup nedosáhl širšího uplatnění, přestože nežádoucí účinky nebyly nijak výrazné. Na druhé straně se při používání TPO mohou vyvinout protilátky způsobující zejména dlouhodobou trombocytopenii [27].
Mobilizace pomocí antagonistů adhezních molekul a specifických protilátek
Základním a nejdůležitějším zástupcem této skupiny je plerixafor, známý také pod starším označením AMD3100. Plerixafor je reverzibilní antagonista, či spíše parciální agonista, receptoru CXCR4 (obr. 1). Tento receptor je důležitým koreceptorem umožňujícím vstup HIV do CD34+ lymfocytů a plerixafor byl vlastně původně vyvíjen pro prevenci a léčbu HIV. Z pohledu fyziologie a mobilizace je CXCR4 především specifickým receptorem pro SDF-1, a jak už bylo uvedeno výše, vazebná interakce mezi SDF-1 a CXCR4 hraje jednu z nejdůležitějších úloh při udržování hematopoetických progenitorů a kmenových buněk krvetvorby v mikroprostředí kostní dřeně. Blokáda této vazby vede k rychlé a poměrně masivní mobilizaci krvetvorných buněk. Plerixafor představuje derivát bicyklamu s malou molekulou. Podání plerixaforu v 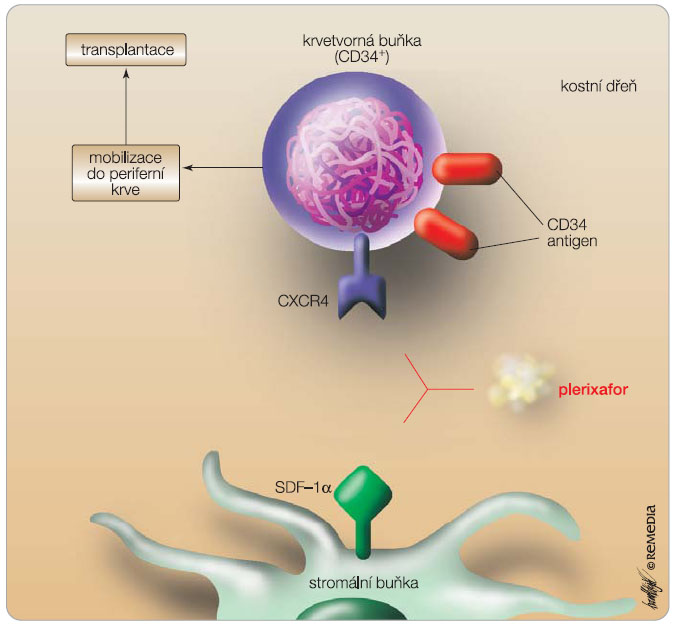 monoterapii vede k mírné leukocytóze a vyplavení CD34+ buněk [28]. Ve studiích fáze II byl plerixafor podáván již spolu s G-CSF a ukázalo se, že dochází k velmi dobré mobilizaci CD34+ buněk jak u pacientů s lymfomy, tak u pacientů s mnohočetným myelomem [29, 30]. Nejcennější je podání plerixaforu u tzv. poor mobilizer pacientů, u nichž obvyklá mobilizace s použitím G-CSF nebo chemoterapie a G-CSF selhala. Druhá mobilizace ve schématu G-CSF 10 mg/kg/den v jedné ranní denní dávce podávané ode dne 1 do ukončení sběru v kombinaci s plerixaforem v dávce 240 mg/kg/den podávaným ode dne 4 v jedné denní dávce aplikované okolo 22. hodiny vede k dostatečnému vyplavení CD34+ buněk, a tedy ke sběru bezpečného transplantátu PBSC u více než 75 % pacientů, u nichž první standardní mobilizace selhala [31, 32].
monoterapii vede k mírné leukocytóze a vyplavení CD34+ buněk [28]. Ve studiích fáze II byl plerixafor podáván již spolu s G-CSF a ukázalo se, že dochází k velmi dobré mobilizaci CD34+ buněk jak u pacientů s lymfomy, tak u pacientů s mnohočetným myelomem [29, 30]. Nejcennější je podání plerixaforu u tzv. poor mobilizer pacientů, u nichž obvyklá mobilizace s použitím G-CSF nebo chemoterapie a G-CSF selhala. Druhá mobilizace ve schématu G-CSF 10 mg/kg/den v jedné ranní denní dávce podávané ode dne 1 do ukončení sběru v kombinaci s plerixaforem v dávce 240 mg/kg/den podávaným ode dne 4 v jedné denní dávce aplikované okolo 22. hodiny vede k dostatečnému vyplavení CD34+ buněk, a tedy ke sběru bezpečného transplantátu PBSC u více než 75 % pacientů, u nichž první standardní mobilizace selhala [31, 32].
Použití plerixaforu je velmi slibné i v případě první mobilizace. Současný standardní model mobilizace u většiny pacientů zahrnuje podání mobilizační chemoterapie, která je provázena různými nežádoucími účinky, zejména pancytopenií a infekčními komplikacemi. Odběrové okno se u jednotlivých pacientů obvykle poněkud liší a odběry není možno předem načasovat, proto je nutné provádět pravidelné laboratorní kontroly. To ve svém důsledku s sebou nese prodloužení hospitalizací a sekundární náklady. Navíc standardní model mobilizace (chemoterapie + G-CSF) stále asi u 5–15 % pacientů selhává a tito pacienti by nakonec měli být remobilizováni právě s použitím plerixaforu. V poslední době také narůstá podíl tzv. poor mobilizerů, protože se v hojnější míře používají látky, které s mobilizací interferují a snižují šanci na kvalitní vyplavení progenitorů krvetvorby při běžně používaných postupech. Mezi tyto látky lze zařadit především thalidomid a lenalidomid [33, 34]. Ze starších léků negativně ovlivňujících mobilizaci uveďme především busulfan a melfalan, které se však již v primoléčbě pacientů připravovaných na autologní transplantaci nepoužívají, a dále BCNU, prokarbazin a především fludarabin, jenž se hojně používá u pacientů s lymfomy [35]. První studie zkoumající účinnost G-CSF v kombinaci s plerixaforem jako primární mobilizace jsou již k dispozici a dosažené výsledky jsou velmi dobré [36, 37]. Širšímu využití plerixaforu při mobilizacích nyní spíše brání poměrně vysoká cena tohoto přípravku, již registrovaného i v České republice.
Do skupiny antagonistů adhezních molekul a specifických protilátek řadíme dále látku SB-251353 (analog GRO-b), jejíž podání vede k rychlé a velmi kvalitní mobilizaci. Zatím byla tato látka s úspěchem otestována na zvířecím modelu včetně opic a prvního klinického zkoušení se jistě brzy dočkáme [38]. Dalšími nadějnými kandidáty jsou peptidy CTCE-0021 [39] a T-140 [40], které opět působí v místě vazebné interakce CXCR4/SDF-1, a látka BIO5192, což je malá molekula inhibující vazbu VCAM-1/VLA-4. Kombinací BIO5192, G-CSF a plerixaforu se dosahuje 17násobně vyšší mobilizace než při použití samotného G-CSF, což do budoucnosti skýtá naději na získání kvalitního transplantátu i u těch pacientů, u nichž selhává dokonce i kombinace G-CSF a plerixaforu [41].
Shrnutí a závěr
Seznam použité literatury
- [1] Goodman JW, Hodgson GS. Evidence for stem cells in the peripheral blood of mice. Blood 1962; 19: 702–714.
- [2] McCredie KB, Hersh EM, Freireich EJ. Cells capable of colony formation in the peripheral blood of man. Science 1971; 171: 293–294.
- [3] Cavins JA, Scheer SC, Thomas ED, Ferrebee JW. The recovery of lethally irradiated dogs given infusions of autologous leukocytes preserved at -80 °C. Blood 1964; 23: 38–43.
- [4] Richman CM, Weiner RS, Yankee RA. Increase in circulating stem cells following chemotherapy in man. Blood 1976; 47: 1031–1039.
- [5] Weiner RS, Richman CM, Yankee RA. Semicontinuous flow centrifugation for the pheresis of immunocompetent cells and stem cells. Blood 1977; 49: 391–397.
- [6] Dührsen U, Villeval JL, Boyd J, et al. Effects of recombinant human granulocyte colony-stimulating factor on hematopoietic progenitor cells in cancer patients. Blood 1988; 72: 2074–2081.
- [7] Socinski MA, Cannistra SA, Elias A, et al. Granulocyte-macrophage colony stimulating factor expands the circulating haemopoietic progenitor cell compartment in man. Lancet 1988; 1: 1194–1198.
- [8] Siena S, Bregni M, Brando B, et al. Circulation of CD34+ hematopoietic stem cells in the peripheral blood of high-dose cyclophosphamide-treated patients: enhancement by intravenous recombinant human granulocyte-macrophage colony-stimulating factor. Blood 1989; 74: 1905–1914.
- [9] Gianni AM, Siena S, Bregni M, et al. Granulocyte-macrophage colony-stimulating factor to harvest circulating haemopoietic stem cells for autotransplantation. Lancet 1989; 2: 580–585.
- [10] Schwartzberg LS, Birch R, Hazelton B, et al. Peripheral blood stem cell mobilization by chemotherapy with and without recombinant human granulocyte colony-stimulating factor. J Hematother 1992; 1: 317–327.
- [11] Bensinger W, DiPersio JF, McCarty JM. Improving stem cell mobilization strategies: future directions. Bone Marrow Transplant 2009; 43: 181–195.
- [12] Carrión R, Serrano D, Gómez-Pineda A, Diez-Martin JL. A randomised study of 10 mg/kg/day (single dose) vs 2 x 5 mg/kg/day (split dose) G-CSF as stem cell mobilisation regimen in high-risk breast cancer patients. Bone Marrow Transplant 2003; 32: 563–567.
- [13] Hiwase DK, Bollard G, Hiwase S, et al. Intermediate-dose CY and G-CSF more efficiently mobilize adequate numbers of PBSC for tandem autologous PBSC transplantation compared with low-dose CY in patients with multiple myeloma. Cytotherapy 2007; 9: 539–547.
- [14] Koc ON, Gerson SL, Cooper BW, et al. Randomized cross-over trial of progenitor-cell mobilization: high-dose cyclophosphamide plus granulocyte colony-stimulating factor (G-CSF) versus granulocyte-macrophage colony-stimulating factor plus G-CSF. J Clin Oncol 2000; 18: 1824–1830.
- [15] Bensinger W, Appelbaum F, Rowley S, et al. Factors that influence collection and engraftment of autologous peripheral-blood stem cells. J Clin Oncol 1995; 13: 2547–2555.
- [16] Barrett AJ, Longhurst P, Sneath P, Watson JG. Mobilization of CFU-C by exercise and ACTH induced stress in man. Exp Hematol 1978; 6: 590–594.
- [17] Winkler IG, Lévesque JP. Mechanisms of hematopoietic stem cell mobilization: when innate immunity assails the cells that make blood and bone. Exp Hematol 2006; 34: 996–1009.
- [18] Gazitt Y. Comparison between granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor in the mobilization of peripheral blood stem cells. Curr Opin Hematol 2002; 9: 190–198.
- [19] Arora M, Burns LJ, Barker JN, et al. Randomized comparison of granulocyte colony-stimulating factor versus granulocyte-macrophage colony-stimulating factor plus intensive chemotherapy for peripheral blood stem cell mobilization and autologous transplantation in multiple myeloma. Biol Blood Marrow Transplant 2004; 10: 395–404.
- [20] Weaver CH, Schulman KA, Wilson-Relyea B, et al. Randomized trial of filgrastim, sargramostim, or sequential sargramostim and filgrastim after myelosuppressive chemotherapy for the harvesting of peripheral-blood stem cells. J Clin Oncol 2000; 18: 43–53.
- [21] Lévesque JP, Takamatsu Y, Nilsson SK, et al. Vascular cell adhesion molecule-1 (CD106) is cleaved by neutrophil proteases in the bone marrow following hematopoietic progenitor cell mobilization by granulocyte colony-stimulating factor. Blood 2001; 98: 1289–1297.
- [22] Fruehauf S, Klaus J, Huesing J, et al. Efficient mobilization of peripheral blood stem cells following CAD chemotherapy and a single dose of pegylated G-CSF in patients with multiple myeloma. Bone Marrow Transplant 2007; 39: 743–750.
- [23] Isidori A, Tani M, Bonifazi F, et al. Phase II study of a single pegfilgrastim injection as an adjunct to chemotherapy to mobilize stem cells into the peripheral blood of pretreated lymphoma patients. Haematologica 2005; 90: 225–231.
- [24] Perillo A, Ferrandina G, Pierelli L, et al. Cytokines alone for PBPC collections in patients with advanced gynaecological malignancies: G-CSF vs G-CSF plus EPO. Bone Marrow Transplant 2004; 34: 743–744.
- [25] Stiff P, Gingrich R, Luger S, et al. A randomized phase 2 study of PBPC mobilization by stem cell factor and filgrastim in heavily pretreated patients with Hodgkin's disease or non-Hodgkin's lymphoma. Bone Marrow Transplant 2000; 26: 471–481.
- [26] Somlo G, Sniecinski I, ter Veer A, et al. Recombinant human thrombopoietin in combination with granulocyte colony-stimulating factor enhances mobilization of peripheral blood progenitor cells, increases peripheral blood platelet concentration, and accelerates hematopoietic recovery following high-dose chemotherapy. Blood 1999; 93: 2798–2806.
- [27] Basser RL, O'Flaherty E, Green M, et al. Development of pancytopenia with neutralizing antibodies to thrombopoietin after multicycle chemotherapy supported by megakaryocyte growth and development factor. Blood 2002; 99: 2599–2602.
- [28] Reddy GK, Grawford J, Jain VK. The Role of Plerixafor (AMD3100) in Mobilizing Hematopoietic Progenitor Cells in Patients with Hematologic Malignancies. Support Cancer Ther 2006; 3: 73–76.
- [29] Flomenberg N, Devine SM, DiPersio JF, et al. The use of AMD3100 plus G-CSF for autologous hematopoietic progenitor cell mobilization is superior to G-CSF alone. Blood 2005; 106: 1867–1874.
- [30] Devine SM, Flomenberg N, Vesole DH, et al. Rapid mobilization of CD34+ cells following administration of the CXCR4 antagonist AMD3100 to patients with multiple myeloma and non-Hodgkin's lymphoma. J Clin Oncol 2004; 22: 1095–1102.
- [31] Fowler CJ, Dunn A, Hayes-Lattin B, et al. Rescue from failed growth factor and/or chemotherapy HSC mobilization with G-CSF and plerixafor (AMD3100): an institutional experience. Bone Marrow Transplant 2009; 43: 909–917.
- [32] Calandra G, McCarty J, McGuirk J, et al. AMD3100 plus G-CSF can successfully mobilize CD34+cells from non-Hodgkin's lymphoma, Hodgkin's disease and multiple myeloma patients previously failing mobilization with chemotherapy and/or cytokine treatment: compassionate use data. Bone Marrow Transplant 2008; 41: 331–338.
- [33] Popat U, Saliba R, Thandi R, et al. Impairment of filgrastim-induced stem cell mobilization after prior lenalidomide in patients with multiple myeloma. Biol Blood Marrow Transplant 2009; 15: 718–723.
- [34] Kumar S, Giralt S, Stadtmauer EA, et al. Mobilization in myeloma revisited: IMWG consensus perspectives on stem cell collection following initial therapy with thalidomide-, lenalidomide-, or bortezomib-containing regimens. Blood 2009; 114: 1729–1735.
- [35] Janikova A, Koristek Z, Vinklarkova J, et al. Efficacious but insidious: a retrospective analysis of fludarabine-induced myelotoxicity using long-term culture-initiating cells in 100 follicular lymphoma patients. Exp Hematol 2009; 37: 1266–1273.
- [36] DiPersio JF, Stadtmauer EA, Nademanee A, et al. Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 2009; 113: 5720–5726.
- [37] DiPersio JF, Micallef IN, Stiff PJ, et al. Phase III prospective randomized double-blind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem-cell mobilization and transplantation for patients with non-Hodgkin's lymphoma. J Clin Oncol 2009; 27: 4767–4773.
- [38] Pelus LM, Fukuda S. Peripheral blood stem cell mobilization: the CXCR2 ligand GRObeta rapidly mobilized hematopoietic stem cells with enhanced engraftment properties. Exp Hematol 2006; 34: 1010–1020.
- [39] Pelus LM, Bian H, Fukuda S, et al. The CXCR4 agonist peptide CTCE-0021, rapidly mobilizes polymorphonuclear neutrophils and hematopoietic progenitor cells into peripheral blood and synergizes with granulocyte colony-stimulating factor. Exp Hematol 2005; 33: 295–307.
- [40] Abraham M, Biyder K, Begin M, et al. Enhanced unique pattern of hematopoietic cell mobilization induced by the CXCR4 antagonist 4F-benzoyl-TN14003. Stem Cells 2007; 25: 2158–2166.
- [41] Ramirez P, Rettig MP, Uy GL, et al. BIO5192, a small molecule inhibitor of VLA-4, mobilizes hematopoietic stem and progenitor cells. Blood 2009; 114: 1340–1343.