Molekulárně cílená léčba nemalobuněčného karcinomu plic – standard a vybrané novinky
Souhrn:
Skřičková J. Molekulárně cílená léčba nemalobuněčného karcinomu plic – standard a vybrané novinky. Remedia 2021; 31: 223–231.
Karcinom plic patří k nejčastěji se vyskytujícím karcinomům na světě. V České republice ročně na toto onemocnění zemře více než 5 000 osob. Přibližně 85 % bronchogenních karcinomů představuje nemalobuněčný karcinom plic (NSCLC). Přes 70 % pacientů s NSCLC má v době diagnózy již pokročilé stadium onemocnění, kdy není indikován radikální operační výkon a prognóza je nepříznivá. Přesto bylo v posledních letech dosaženo i u pokročilých stadií NSCLC zlepšení přežití díky příchodu nových léčebných možností, mezi něž patří také cílená léčba. V roce 2020 byla publikována práce, která demonstruje využití jednoho z přípravků biologické léčby i u radikálně operovaných nemocných. Uvádíme přehled přípravků cílené biologické léčby, jejich indikací a rozsah vyšetření, která musejí být před zahájením biologické léčby provedena.
Summary:
Skrickova J. Molecular targeted therapy of non‑small cell lung cancer – the standard and selected updates. Remedia 2021; 31: 223–231.
Lung carcinoma is the most common type of cancer worldwide. In the Czech Republic, more than 5,000 people die because of this disease every year. Approximately 85% of bronchogenic carcinomas are non‑small cell lung carcinoma (NSCLC). Over 70% of patients with NSCLC are in the advanced stage of the disease at the time of diagnosis when radical surgery is not indicated and the prognosis is adverse. Despite these facts, an improvement in survival has been reached recently even in advanced stages of NSCLC thanks to the arrival of new therapeutic options, including targeted therapy. In 2020, an article was published demonstrating the use of one of the medicinal products of biologic therapy even in patients after radical surgery. We are summarizing a review of medicinal products of targeted biologic therapy, their indications and diagnostic process that must be undertaken before initiating biologic therapy.
Key words: non‑small cell lung carcinoma, advanced stages, targeted biologic therapy, EGFR inhibitors, ALK inhibitors
Úvod
Karcinom plic patří k nejčastěji se vyskytujícím karcinomům na světě. V roce 2017 byl v ČR karcinom plic nově diagnostikován u 6 593 pacientů (7,6 % všech nově zjištěných zhoubných nádorů). V souvislosti s karcinomem plic zemřelo 5 633 osob (20,4 % všech úmrtí na zhoubné novotvary) a k 31. prosinci 2017 v ČR žilo 12 107 osob se zhoubným novotvarem plic nebo s minulostí tohoto onemocnění. V posledních letech dochází k poklesu incidence u mužů, u žen naopak incidence prudce roste, ale délka přežití se prodlužuje [1,2].
Přibližně 85 % bronchogenních karcinomů představuje nemalobuněčný karcinom plic (non small cell lung carcinoma, NSCLC). Přes 70 % pacientů s NSCLC má v době diagnózy již pokročilé stadium onemocnění, tedy IIIB nebo IV, kdy téměř ve všech případech není indikován radikální operační výkon a prognóza je nepříznivá. Přibližně 20 % nádorů této skupiny je navíc diagnostikováno až pitvou nebo má nemocný tak špatný stav výkonnosti (perfor
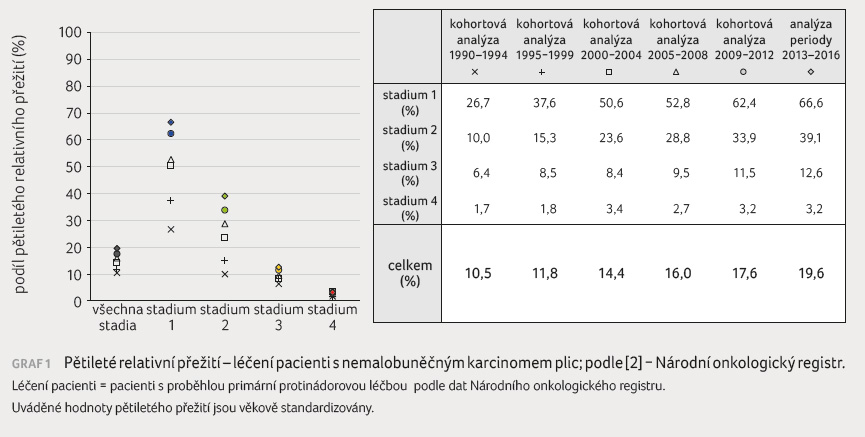
mance status, PS), že již není možné zahájit protinádorovou léčbu [1,2]. Přesto bylo v posledních letech dosaženo i u pokročilých stadií NSCLC zlepšení přežití díky příchodu nových léčebných možností, mezi něž patří také cílená léčba (graf 1).
V současné době jsou
k dispozici pro první linii léčby pokročilého NSCLC léky
ze skupiny cytostatik, léky biologicky cílené a imunoterapie.
Pro rozhodnutí o léčbě je nutná přesná morfologická
klasifikace nádoru a zařazení do jednotlivých podtypů
(adenokarcinom, skvamózní karcinom, adenoskvamózní karcinom,
blíže nespecifikovaný karcinom - not
otherwise specified, NOS), dále především u adenokarcinomu
je nutné i genetické testování (graf 2, 3) a během
stanovování diagnózy u všech typů NSCLC rovněž vyšetření
exprese ligandu receptoru programované buněčné smrti 1
(programmed cell death protein ligand 1, PD L1) [3-9].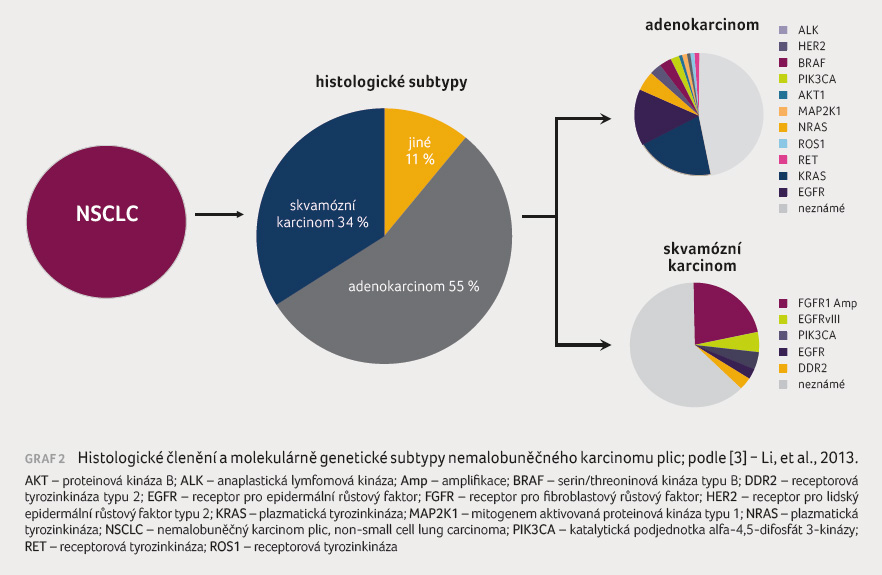
Přípravky biologické léčby působí
na nádorové buňky jiným mechanismem než standardní
chemoterapie a imunoterapie. Biologická léčba se označuje
také jako tzv. cílená molekulární terapie, protože uvedený
termín lépe vyjadřuje skutečnost, že proces zasahuje
selektivněji do intracelulárních pochodů v nádorové
buňce. Používá se též název terčová léčba, neboť je
zacílena na určitý cíl v nádorové buňce. Většinou
se jedná o nízkomolekulární látky, které vazbou například
na receptory, jež jsou ve vysokém podílu exprimovány
na povrchu nádorových buněk, blokují signální dráhy
do buněčného jádra [8,10].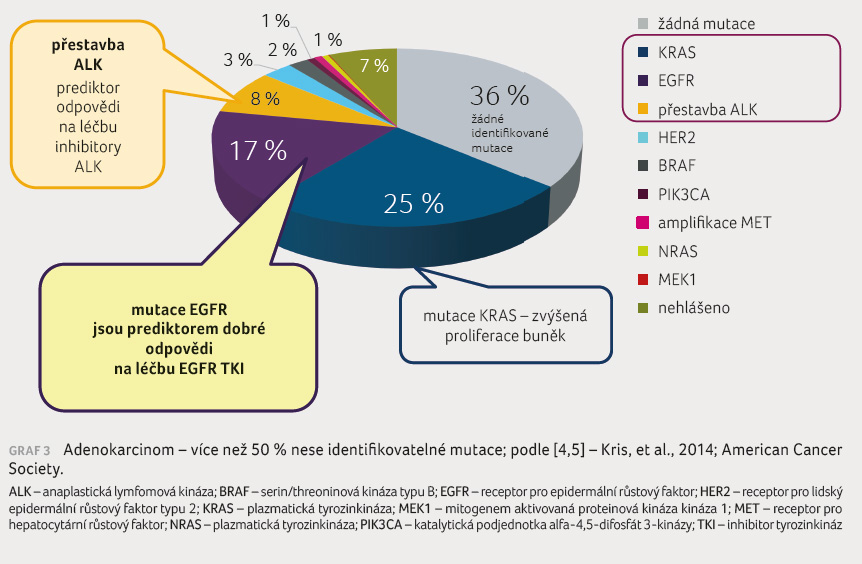
Za fyziologických podmínek je buňka závislá na stimulaci růstovými faktory, toto však neplatí pro buňku nádorovou. Ta se vyznačuje kromě změněného buněčného růstu dediferenciací buněk, jejich zvýšenou migrací a invazivitou, rezistencí vůči apoptóze a stimulací angiogeneze. Cílená léčba je tedy zaměřena právě na uvedené pochody s cílem jejich uvedení do fyziologického stavu [8,10].
Tyrozinkinázové inhibitory EGFR
Významnou skupinu přípravků cílené léčby představují tyrozinkinázové inhibitory (TKI), které jsou cíleny na receptor epidermálního růstového faktoru (epidermal growth factor receptor, EGFR). Tyrozinkinázové inhibitory jsou účinné u nemocných s NSCLC, v jejichž nádoru jsou prokázány tzv. aktivační mutace genu EGFR. Delece na 19. exonu a bodová mutace na 21. exonu (L858R) představují více než 90 % všech mutací genu EGFR. Obecně je vyšší výskyt mutací EGFR v případě průkazu adenokarcinomu, dále u žen, nekuřáků a v asijské populaci [8,10].
Tyrozinkinázové inhibitory se mohou vázat reverzibilně nebo ireverzibilně a působit specificky buď na jeden typ kinázy, nebo na více cílů současně, čímž mohou zablokovat několik procesů najednou (například angiogenezi a proliferaci). Signalizace receptoru pro EGFR je u nádorových onemocnění často deregulována, a proto inhibice samotného EGFR či navazujících signálních drah jsou terčem cílené biologické léčby [8,10].
Mutace v tyrozinkinázové doméně genu EGFR (exon 18-21) se vyskytují s frekvencí 5-10 % v kavkazské populaci a okolo 40 % v asijské populaci [10].
Testování mutačního stavu genu EGFR je v současnosti u nemocných s NSCLC již běžnou klinickou praxí a provádí se u všech nemocných s diagnózou neskvamózního NSCLC. Testování EGFR u skvamózního karcinomu je prováděno na vyžádání klinika. Metoda, kterou se testování provádí, musí detekovat aktivační i rezistentní mutace (například T790M) [9,10].
Gefitinib je perorální nízkomolekulární synteticky připravený anilinochinazolinový inhibitor EGFR. Zásadní studií byla IPASS probíhající ve východní Asii, v níž byl porovnáván léčebný efekt gefitinibu s chemoterapií karboplatinou s docetaxelem u pacientů s mutacemi EGFR. Gefitinib signifikantně prodloužil přežívání bez progrese (progression free survival, PFS; 9,5 měsíce vs. 6,3 měsíce) a navýšil podíl dosažených objektivních odpovědí (overall response rate, ORR; 71,2 % vs. 47,3 %). Prokázal také zlepšení kvality života v porovnání s chemoterapií [11]. Výsledky studie IPASS potvrdila studie IFUM, která probíhala u kavkazské populace a v níž bylo dosaženo PFS 9,7 měsíce a celkového přežití (overall survival, OS) 19,2 měsíce [12]. Gefitinib má stanovenu úhradu v České republice od roku 2011 a je stále využíván. Podává se perorálně a je indikován v monoterapii u pacientů s lokálně pokročilým nebo metastazujícím NSCLC (PS 0-2), jsou li v nádorové DNA detekovány aktivační mutace genu EGFR.
Erlotinib je dalším selektivním EGFR TKI, podává se rovněž perorálně. Účinnost a bezpečnost erlotinibu u NSCLC byla nejprve potvrzena v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii BR.21 u 731 pacientů s lokálně pokročilým nebo metastazujícím NSCLC bez průkazu aktivačních mutací po selhání alespoň jednoho režimu chemoterapie. Medián OS ve skupině léčené erlotinibem činil 6,7 měsíce versus 4,7 měsíce ve skupině, která dostávala placebo [13]. Pro indikaci erlotinibu u nemocných s aktivačními mutacemi genu EGFR byla zásadní studie EURTAC (The European Tarceva versus chemotherapy). Studie hodnotila erlotinib ve srovnání s chemoterapií v první linii léčby kavkazských pacientů s pokročilým NSCLC a s aktivačními mutacemi genu EGFR. Medián PFS byl signifikantně prodloužen u pacientů léčených erlotinibem, a to na 9,7 měsíce oproti prodloužení v délce 5,2 měsíce u pacientů léčených chemoterapií [14].
Vzhledem k tomu, že bylo prokázáno, že signální cesta vycházející z EGFR a vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF) má určité společné rysy, předpokládalo se, že inhibice jednoho z těchto systémů může pomoci inhibovat systém druhý. Toto potvrdily studie, v nichž byl erlotinib podáván s bevacizumabem a také s ramucirumabem [15-17]. Na základě zkušeností z těchto studií byly léčebné kombinace erlotinib s bevacizumabem a erlotinib s ramucirumabem schváleny Evropskou lékovou agenturou (EMA) pro pacienty s EGFR senzitivními mutacemi. V České republice pro tuto léčbu není stanovena úhrada.
Na základě výsledků výše uvedených studií je erlotinib v současnosti v ČR indikován v monoterapii k léčbě nemocných s lokálně pokročilým nebo metastazujícím NSCLC v případě, že alespoň jednou došlo k selhání předchozí chemoterapie. Úhradu v této indikaci má erlotinib od roku 2005. Dále je indikován k léčbě po stanovení diagnózy u nemocných s průkazem aktivační mutace genu EGFR (PS 0-2). V této indikaci je úhrada zavedena od roku 2013.
Afatinib představuje ireverzibilní inhibitor EGFR druhé generace, který je zacílen kromě EGFR i na jiné, strukturně podobné receptory. Podává se též perorálně [6]. S afatinibem se u pacientů s NSCLC uskutečnila řada studií nazvaných LUX Lung 1-8. Základní studií hodnotící účinnost a bezpečnost afatinibu byla LUX Lung 3. V tomto sledování byl afatinib podáván v první linii léčby NSCLC stadia IIIB/IV pacientům s mutacemi EGFR. Byla porovnávána jeho účinnost oproti chemoterapii cisplatinou a pemetrexedem. Studie prokázala významné prodloužení PFS ve skupině léčené afatinibem (11,1 měsíce) oproti kontrolní skupině (6,9 měsíce) [18]. Další ze studií s afatinibem byla LUX Lung 6. Jednalo se o randomizovanou, otevřenou klinickou studii fáze III, která porovnávala afatinib s chemoterapií ve složení cisplatina a gemcitabin v první linii léčby pokročilého plicního adenokarcinomu u pacientů s aktivační mutací EGFR. Zařazeni do ní byli pacienti z Asie (Čína, Jižní Korea, Thajsko). Při léčbě afatinibem došlo rovněž k výraznému prodloužení PFS [19].
Na základě výsledků výše uvedených studií byl afatinib registrován v roce 2013 k léčbě pacientů s lokálně pokročilým nebo metastatickým NSCLC s aktivačními mutacemi genu EGFR dosud neléčených TKI. V této indikaci má stanovenu úhradu i v ČR od roku 2013. Další indikací je od roku 2016 léčba pacientů se skvamózním NSCLC po chemoterapii založené na platině [20].
Dakomitinib je také inhibitorem EGFR druhé generace. Jedná se o selektivní inhibitor EGFR/humánního epidermální receptoru (HER)1, HER2 a HER4. V září 2018 byl registrován americkým Úřadem pro kontrolu potravin a léčiv (FDA) pro léčbu první linie u pacientů s lokálně pokročilým nebo metastatickým NSCLC s mutacemi EGFR (delece exonu 19, substituce L858R). V dubnu 2019 byl schválen EMA ve stejné indikaci. K výše uvedeným registracím došlo na základě výsledků studie ARCHER, která porovnávala dakomitinib s gefitinibem. Čas do progrese byl v rameni s dakomitinibem delší, ale jeho podání bylo provázeno vyšším počtem nežádoucích účinků [21]. V České republice nemá tento přípravek stanovenu úhradu.
Osimertinib je TKI třetí
generace. Studií, v níž byl osimertinib testován v léčbě
po stanovení diagnózy, byla FLAURA. Jednalo se o dvojitě
zaslepenou, randomizovanou studii porovnávající TKI 3. generace
(osimertinib) s TKI 1. generace (gefitinib nebo erlotinib)
u dosud neléčených pacientů s lokálně pokročilým
nebo metastatickým NSCLC s prokázanou aktivační mutací
(delece na exonu 19 nebo bodová mutace L858 na exonu 21).
Primárním sledovaným parametrem bylo PFS dle hodnocení
zkoušejícího. Medián PFS byl statisticky signifikantně vyšší
u skupiny pacientů léčených osimertinibem oproti nemocným,
kteří byli léčeni gefitinibem nebo erlotinibem, konkrétně 18,9
měsíce versus 10,2 měsíce (graf 4). Délka trvání
odpovědi na základě posouzení zkoušejícího byla
17,2 měsíce ve skupině osimertinibu a 8,5 měsíce
u pacientů léčených gefitinibem nebo erlotinibem. Celkové
přežití činilo 38,6 měsíce u léčených osimertinibem
oproti 31,8 měsíce u léčených erlotinibem nebo gefitinibem.
Studie FLAURA též potvrdila efektivitu v CNS a snížení
rizika progrese i vzniku nových lézí v CNS při použití
osimertinibu oproti léčbě gefitinibem nebo erlotinibem v první
linii léčby u EGFR TKI naivních pacientů [22,23]. Na základě
těchto výsledků je léčba osimertinibem po stanovení
diagnózy registrována jak FDA, tak EMA. V České republice má
lék úhradu až od 1. června 2021.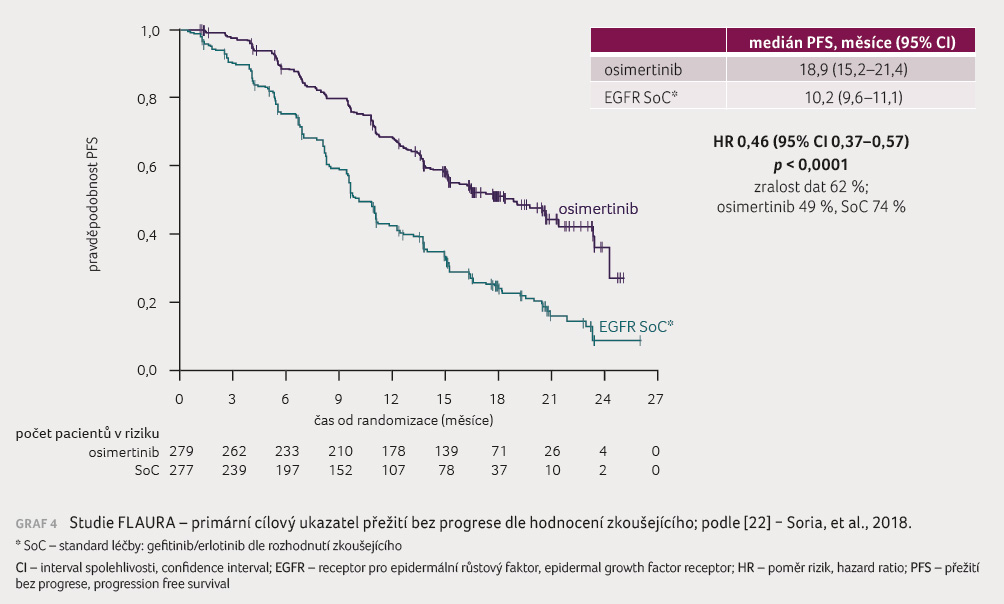
Přibližně u 70 % pacientů léčených s NSCLC a pozitivní aktivační mutací EGFR, kteří odpovídali na terapii TKI, není léčba dlouhodobě úspěšná. V roce 2005 byla v exonu 20 genu EGFR popsána mutace T790M, která je přítomna přibližně u poloviny pacientů s NSCLC, u nichž se vyvinula rezistence na léčbu EGFR TKI. Mutace T790M však nepůsobí pouze sekundární neboli získanou rezistenci na tyto přípravky. Opakovaně bylo totiž prokázáno, že tato mutace je přítomna v DNA pacientů ještě před zahájením cílené terapie. Předpokládá se totiž, že klon nesoucí mutaci T790M je v nádoru zastoupen v minoritní frakci a léčbou, která přednostně tlumí proliferaci klonů s aktivačními mutacemi EGFR (nejčastěji s delecí v exonu 19 nebo bodovou mutací L858R), získává prostor pro vlastní expanzi. Přestože je na počátku podávání pozorována léčebná odpověď, v průběhu několika měsíců převáží v nádoru klon s rezistentní mutací T790M a léčba se stává neefektivní [6,8].
Významnou studií prokazující účinnost osimertinibu u nemocných s rezistentní mutací T790M byla AURA3, která porovnávala účinnost osimertinibu proti platinovému dubletu u pacientů s lokálně pokročilým nebo metastatickým NSCLC s prokázanou mutací T790M progredujících po léčbě TKI. Osimertinib prokázal statisticky významný prospěch oproti chemoterapii založené na platině, s PFS 10,1 měsíce versus 4,4 měsíce, ORR byla 71 % u osimertinibu versus 31 % u chemoterapie. Přínos byl pozorován jak u pacientů s metastázami v CNS při vstupu do studie, tak u pacientů bez nich [24]. Na základě výsledků výše uvedené studie byl osimertinib schválen k použití u nemocných s NSCLC a prokázanou mutací T790M EMA v únoru 2016. V této indikaci má stanovenu úhradu i v ČR od února 2019.
V roce 2020 byly prezentovány
výsledky studie ADAURA, což je globální randomizovaná, dvojitě
zaslepená, placebem kontrolovaná studie fáze III s adjuvantní
léčbou osimertinibem. Do studie bylo zařazeno 682 pacientů
klinického stadia IB, II, IIIA po radikální resekci nádoru.
V nádorové tkáni musela být prokázána aktivační mutace
genu EGFR (delece na exonu 19, bodová mutace na exonu 21).
V jednom rameni byla podána adjuvantní chemoterapie nebo
placebo a v experimentálním rameni osimertinib v dávce
80 mg jednou denně po dobu tří let nebo do recidivy
onemocnění. Studie se účastnilo více než 200 center z více
než 20 zemí. Primárním cílovým ukazatelem bylo přežití bez
nemoci (disease free survival, DFS) u stadií
II a IIIA. Tato studie prokázala,
že adjuvantně podávaný
osimertinib je první cílenou léčbou, která statisticky
signifikantně a klinicky významně vedla ke zlepšení
DFS u pacientů s EGFR mutovaným NSCLC stadia IB,
II a IIIA po kompletní resekci. Dále prokázala
79% snížení rizika rekurence onemocnění
nebo smrti v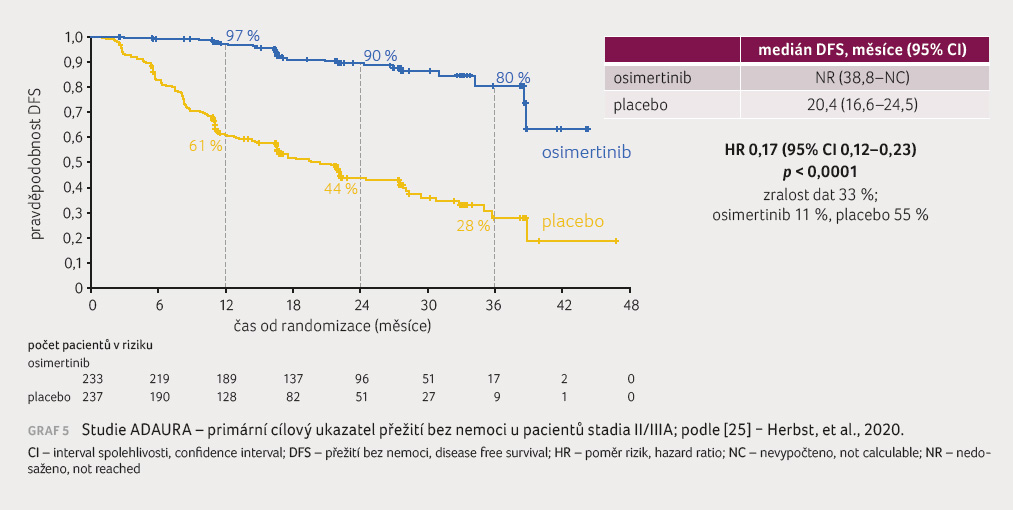 rameni s osimertinibem
(DFS: poměr rizik [HR] 0,21;
95% interval spolehlivosti [CI] 0,16–0,28;
p < 0,0001).
Přežití bez nemoci činilo po dvou
letech v rameni s osimertinibem 89 %
oproti 53 % ve skupině druhé. Zlepšení DFS
bylo pozorováno nezávisle na tom, zda pacienti
dostávali adjuvantní chemoterapii. Plánovaná
délka studie byla tři roky, avšak klinické hodnocení bylo
odslepeno dříve na doporučení nezávislé
hodnoticí komise z důvodu pozitivních účinnostních dat.
V době odslepení, po plánované analýze v dubnu
2020, byl již nábor pacientů kompletně ukončen a všichni
nemocní byli sledováni minimálně po dobu jednoho roku [25]
(graf 5).
rameni s osimertinibem
(DFS: poměr rizik [HR] 0,21;
95% interval spolehlivosti [CI] 0,16–0,28;
p < 0,0001).
Přežití bez nemoci činilo po dvou
letech v rameni s osimertinibem 89 %
oproti 53 % ve skupině druhé. Zlepšení DFS
bylo pozorováno nezávisle na tom, zda pacienti
dostávali adjuvantní chemoterapii. Plánovaná
délka studie byla tři roky, avšak klinické hodnocení bylo
odslepeno dříve na doporučení nezávislé
hodnoticí komise z důvodu pozitivních účinnostních dat.
V době odslepení, po plánované analýze v dubnu
2020, byl již nábor pacientů kompletně ukončen a všichni
nemocní byli sledováni minimálně po dobu jednoho roku [25]
(graf 5).
Osimertinib byl v této indikaci schválen EMA od června 2021, v ČR zatím v uvedené indikaci úhradu nemá.
Inhibitory ALK
V roce 2007 byla identifikována přestavba genu ALK (anaplastická lymfomová kináza), která je přítomna u 3-8 % pacientů s NSCLC. Tato abnormalita koreluje s některými klinickými parametry jako adenokarcinom, lehké či žádné kouření, nižší věk, absence mutací v genech KRAS (Kirsten rat sarcoma viral oncogene homolog) a EGFR. Testování stavu ALK ze vzorku nádorové tkáně probíhá v akreditovaných laboratořích. Vyšetření se provádí u všech adenokarcinomů a NSCLC blíže nespecifikovaného imunohistochemicky průkazem exprese proteinu ALK a dále fluorescenčně in situ hybridizací průkazem přestavby genu [6,8,9].
Krizotinib je TKI s malou molekulou a vykazuje inhibici kinázové aktivity ALK, MET, ROS1, která blokuje signální dráhy do buněčného jádra. Jeho účinnost a bezpečnost byly prokázány u ALK pozitivních nemocných s NSCLC v klinických studiích fáze I-III. Nejprve získal v ČR úhradu u pacientů s lokálně pokročilým nebo metastazujícím NSCLC, u kterých je potvrzena přítomnost přestavby genu ALK a u nichž došlo k selhání předchozí linie léčby platinovým dubletem, u pacientů s PS 0-2 dle ECOG (Eastern Cooperative Oncology Group). V této indikaci je úhrada stanovena od března 2014, a to na základě studie fáze III PROFILE 1007, která u ALK pozitivních nemocných s pokročilým NSCLC porovnávala účinnost krizotinibu s účinností pemetrexedu a docetaxelu ve druhé linii léčby po selhání první linie chemoterapie. Medián PFS činil 7,7 měsíce (krizotinib), 4,2 měsíce u pemetrexedu a 2,6 měsíce u docetaxelu. Celková léčebná odpověď byla 65 % u nemocných léčených krizotinibem a 19,5 % u pacientů léčených chemoterapií [26]. Pro léčbu v první linii u dospělých pacientů s pokročilým ALK pozitivním NSCLC je stanovena úhrada od listopadu 2018, na základě studie fáze III PROFILE 1014, která prokázala účinnost krizotinibu v první linii léčby u ALK pozitivních nemocných s NSCLC v pokročilém stadiu. Medián PFS byl v rameni pacientů léčených krizotinibem 10,9 měsíce oproti 7 měsícům v rameni nemocných léčených chemoterapií. Celková léčebná odpověď byla v rameni s krizotinibem významně lepší (75 %) ve srovnání se skupinou nemocných léčených kombinací cisplatina a pemetrexed (47 %) nebo karboplatina a pemetrexed (44 %) [27]. K další terapeutické indikaci léčby krizotinibem patří ROS1 pozitivní pokročilý NSCLC. V této indikaci je registrován od března 2016 FDA, od srpna 2016 EMA, úhrada v ČR však stanovena není. Lze však o léčbu požádat na základě paragrafu 16 [28].
Alektinib, vysoce selektivní perorálně podávaný inhibitor ALK, je vysoce účinný jak proti nemutované kináze ALK, tak i v přítomnosti mutací ALK, včetně mutací spojených s rezistencí vůči krizotinibu. ALUR je studií, která se zabývala účinností alektinibu v porovnání se standardní chemoterapií na mozkové metastázy u pacientů s ALK pozitivním NSCLC léčených v předchozím režimu platinovým dubletem a krizotinibem. Pacienti byli rozděleni do tří skupin: s léčbou alektinibem a s chemoterapií pemetrexedem nebo docetaxelem. Hodnotily se PFS, úmrtí nebo ukončení léčby. Při progresi byl umožněn přechod na alektinib. Progrese po šesti měsících byla zaznamenána u 11 % pacientů ve skupině s alektinibem oproti 48 % ve skupině s chemoterapií. Výsledky potvrdily vyšší účinnost alektinibu v porovnání s chemoterapií v prevenci i léčbě mozkových metastáz [29]. Alektinib je v ČR indikován a má stanovenu úhradu od května 2020 v monoterapii u dospělých pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) NSCLC, u nichž došlo k progresi při léčbě krizotinibem.
Léčba alektinibem v první linii předtím neléčených pacientů s NSCLC byla předmětem studie ALEX. Do této studie byli zařazeni nemocní s pokročilým ALK pozitivním NSCLC. Pacienti byli rozděleni k léčbě alektinibem nebo krizotinibem. Primárním sledovaným parametrem bylo PFS, čas do progrese metastáz v CNS, ORR a OS. Progrese onemocnění nebo úmrtí byly zaznam
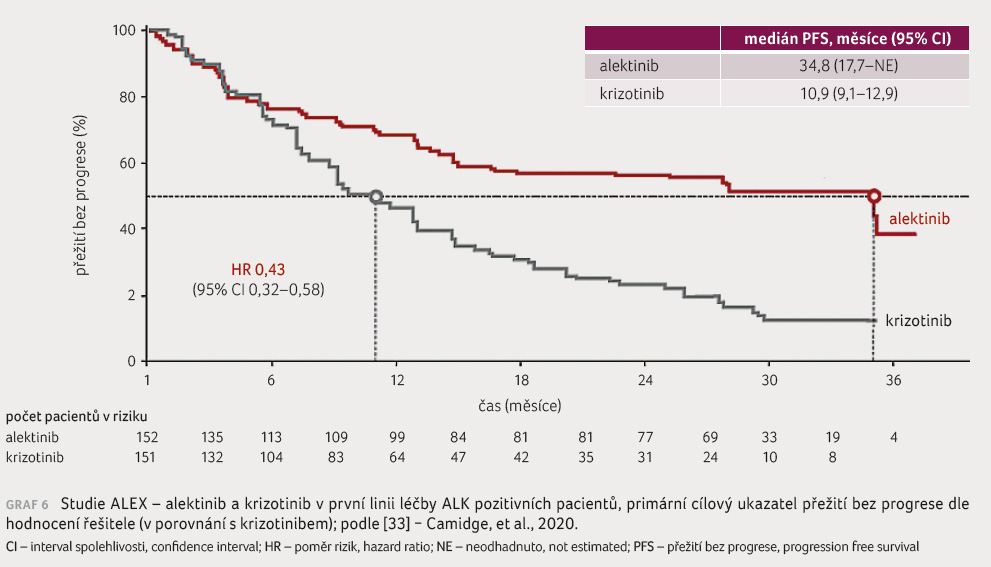
enány u 41 % pacientů léčených alektinibem a u 68 % pacientů léčených krizotinibem. Doba do progrese byla delší ve skupině léčené alektinibem (34,8 měsíce) oproti krizotinibu (10,9 měsíce), graf 6. Ve skupině s alektinibem byla progrese do CNS pozorována u 18 pacientů, ve skupině s krizotinibem u 68 pacientů [30].
Alektinib je v ČR indikován a má stanovenu úhradu po stanovení diagnózy od 1. listopadu 2019 v monoterapii k léčbě dospělých pacientů s ALK pozitivním pokročilým NSCLC.
Ceritinib je selektivní inhibitor ALK 2. generace o malé molekule. Inhibuje receptor pro inzulinu podobný růstový faktor (insulin like growth factor 1, IGF 1), inzulinový receptor a ROS1. Je velmi účinný v léčbě nemocných s nádory rezistentními vůči krizotinibu, které neobsahují sekundární mutace ALK. Podává se perorálně [6,31].
Ceritinib byl testován ve studiích ASCEND 1-5. Ceritinib s chemoterapií porovnávala studie ASCEND 5 u pacientů předléčených krizotinibem a s možností předléčení jednou nebo dvěma liniemi chemoterapie. Medián PFS byl delší při léčbě ceritinibem v porovnání s chemoterapií (5,4 měsíce vs. 1,6 měsíce). Podíl pacientů, kteří dosáhli kontroly onemocnění, činil 76,5 % u ceritinibu a 36,2 % u chemoterapie [31]. Ceritinib tedy představuje účinný a dobře snášený lék pro nemocné s ALK pozitivním adenokarcinomem plic, který dává nemocným naději na prodloužení života i poté, kdy se pokročilý karcinom plic vymkne kontrole dosažené dřívějšími léčebnými modalitami pro ALK pozitivní NSCLC. Ceritinib v monoterapii je indikován u dospělých pacientů s pokročilým ALK pozitivním NSCLC, u nichž došlo k progresi při léčbě krizotinibem. Pro tuto indikaci je v ČR stanovena úhrada od 1. října 2019.
Brigatinib je TKI, který blokuje ALK, onkogen ROS1 a receptor IGF 1. Lék byl testován ve studii ALTA, která prokázala delší PFS u nemocných po předchozím selhání krizotinibu léčených vyšší dávkou brigatinibu (180 mg vs. 90 mg). Je indikován k léčbě dospělých pacientů s NSCLC a s pozitivitou ALK, kteří byli dříve léčeni krizotinibem. Podává se perorálně [32].
V randomizované klinické studii fáze III ALTA 1L přímo porovnávající brigatinib oproti krizotinibu po stanovení diagnózy byla dokumentována superiorita brigatinibu. Léčba brigatinibem byla spojena s prodloužením PFS (hodnoceno investigátorem: 29,4 měsíce vs. 9,2 měsíce; HR 0,43; p < 0,0001; hodnoceno nezávislou komisí: 24,0 měsíce vs. 11,0 měsíce; HR 0,49; p < 0,0001) [33]. V České republice je stanovena úhrada pro léčbu ALK pozitivních NSCLC ihned po stanovení diagnózy od 1. května 2021.
Ensartinib představuje inhibitor ALK další generace. Ve studii fáze III eXalt3 prokázal slibnou účinnost v léčbě první linie u pacientů s ALK pozitivním pokročilým NSCLC. Předběžná prozatímní analýza studie ukázala medián PFS 25,8 měsíce v případě ensartinibu u populace pacientů s ALK pozitivním NSCLC oproti 12,7 měsíce u krizotinibu (HR 0,51; p = 0,0001). Navíc u pacientů léčených ensartinibem nebylo dosaženo mediánu PFS (HR 0,45; p < 0,0001). Ensartinib rovněž vykazoval lepší účinnost na mozkové metastázy než krizotinib u pacientů se známými mozkovými metastázami na počátku léčby [34].
Lorlatinib je inhibitor ALK/ROS 3. generace, který vykazuje aktivitu proti rezistentním mutacím po léčbě inhibitory ALK první a druhé generace. V listopadu 2018 byl FDA registrován pro pacienty s ALK pozitivním NSCLC, jejichž onemocnění progredovalo po léčbě krizotinibem a nejméně jedním dalším inhibitorem ALK, nebo u pacientů, jejichž onemocnění progredovalo po léčbě alektinibem nebo ceritinibem v první linii. V České republice není zatím pro tento přípravek stanovena úhrada [35].
Dabrafenib je selektivní inhibitor BRAF (B Raf protoonkogen) kináz. V mezinárodních doporučeních pro rok 2017 bylo nově zmíněno testování mutace BRAF V600E, která se vyskytuje asi u 1-2 % pacientů s adenokarcinomem, a to i u kuřáků nebo bývalých kuřáků. Dabrafenib byl testován ve studii BRF113928 v první linii léčby metastatického NSCLC s mutací BRAF V600E. Dabrafenib společně s trametinibem (inhibitor dráhy MEK1 a MEK2 vznikající onkogenní mutací genu BRAF) prokázaly protinádorovou aktivitu a dlouhotrvající odpověď u dosud neléčených pacientů [36]. Na základě těchto výsledků byla kombinace dabrafenibu s trametinibem registrována FDA a EMA pro léčbu pacientů s řídící mutací i bez ohledu na předléčenost. V České republice není zatím pro tuto léčbu stanovena úhrada. Lze ji podat pouze prostřednictvím paragrafu 16.
Inhibitor angiogeneze
Nintedanib je inhibitorem tří receptorů pro VEGF (VEGFR 1-3), dále inhibuje destičkový růstový faktor a fibroblastový růstový faktor.
Klinické zkušenosti s nintedanibem byly získány především v rámci klinických studií LUME Lung 1 a 2. Do studie LUME Lung 1 bylo zahrnuto 1 314 pacientů s NSCLC ve stadiu IIIB/IV, u nichž onemocnění progredovalo po absolvování první linie léčby. Nemocným byl v třítýdenních intervalech podáván docetaxel intravenózně a 2.-21. den dostávali dvakrát denně placebo nebo nintedanib. Léčba byla podávána do vzniku vážných nežádoucích účinků nebo do progrese nádoru. Primárním cílovým ukazatelem bylo PFS, dále se hodnotilo OS. Nejčastěji se jednalo o adenokarcinom a dlaždicobuněčný karcinom. Studie potvrdila, že při zařazení nintedanibu bylo PFS delší než bez něj (3,4 měsíce vs. 2,7 měsíce). Délka OS u všech nemocných byla při léčbě nintedanibem větší než při podávání placeba (10,1 měsíce vs. 9,1 měsíce). Analýza nemocných s adenokarcinomem však ukázala, že nintedanib dobu přežití v této skupině nemocných významně prodloužil, konkrétně na 12,6 měsíce oproti 10,3 měsíce při podávání placeba [37].
Navazující studií byla LUME Lung 2, v níž byl pacientům s neskvamózním NSCLC progredujícím po první linii léčby podán první den místo docetaxelu pemetrexed. Mimoto dostávali dvakrát denně placebo nebo nintedanib. Léčba pokračovala až do progrese nádoru nebo do neakceptovatelných projevů toxicity. Opět se hodnotily zejména PFS a délka OS. Studie se týkala 713 nemocných, mezi nimiž významně dominovaly adenokarcinomy (94 %). Studie opět prokázala příznivý vliv nintedanibu na prodloužení doby do progrese nádoru, konkrétně to bylo 4,4 měsíce oproti 3,6 měsíce, což se však neodrazilo v prodloužení OS (12 měsíců vs. 12,7 měsíce) [38]. Na základě výše uvedených studií je nintedanib v kombinaci s docetaxelem indikován ve druhé linii léčby pacientů s lokálně pokročilým metastazujícím adenokarcinomem plic. Po ukončení podávání docetaxelu je možné v podávání nintedanibu pokračovat tak dlouho, dokud trvá příznivý účinek léčby, respektive dokud se nevyskytnou nežádoucí účinky zabraňující pokračování v léčbě. V České republice není pro tento lék stanovena úhrada.
Inhibitory NTRK
Larotrektinib je
v monoterapii indikován k léčbě dospělých
a pediatrických pacientů se solidními nádory vykazujícími
fúzní gen neurotrofní receptorové tyrozinkinázy (neurotrophic
receptor tyrosine kinase, NTRK), kteří mají lokálně pokročilé
a metastatické onemocnění nebo u nichž by chirurgická
resekce pravděpodobně vedla k závažné morbiditě a pro
něž neexistují uspokojivé možnosti léčby [39].
Entrektinib
je v monoterapii indikován k léčbě dospělých
a pediatrických pacientů ve věku od 12 let se
solidními nádory s fúzí genu NTRK, kteří mají lokálně
pokročilé a metastazující onemocnění nebo u nichž
chirurgická resekce může vyústit v závažnou morbiditu
a kteří neobdrželi předchozí léčbu inhibitorem NTRK
a nemají jiné vhodné možnosti léčby [40].
V České republice zatím není pro nemocné s NSCLC s fúzí genu NTRK stanovena úhrada ani u entrektinibu, ani u larotrektinibu.
Monoklonální protilátky
Bevacizumab je humanizovaná monoklonální protilátka s vysokou afinitou k VEGF. Rodina VEGF hraje důležitou roli při šíření nádoru a její hlavní úloha spočívá v řízení angiogeneze. Jako první z této rodiny byl popsán VEGF A. Zvýšená produkce VEGF u pacientů s nádorovým onemocněním je důsledkem hypoxie v nádoru. Rostoucí nádor stimuluje angiogenezi, čímž si zajišťuje dostatečný přívod živin a kyslíku. Mechanismus působení bevacizumabu spočívá ve vyvázání volného VEGF, čímž je zamezeno jeho vazbě na příslušné receptory a dochází ke ztlumení signální kaskády vedoucí k angiogenezi [6,8,41].
Bevacizumab byl testován v klinické studii ECOG 4599, z níž vyplynulo, že přidání bevacizumabu každé tři týdny ke kombinaci karboplatiny a paklitaxelu vede k prodloužení PFS i OS. Medián OS činil 10,3 měsíce ve skupině s chemoterapií a 12,3 měsíce ve skupině s přidaným bevacizumabem. Medián OS při udržovací léčbě bevacizumabem následující v případě, že bylo dosaženo celkové remise, parciální remise a stabilního onemocnění, byl významně delší než u pacientů, kteří bevacizumab nedostávali [42,43].
Ve studii fáze III AVAiL byli pacienti léčeni kombinací cisplatiny a gemcitabinu nebo režimem chemoterapie s bevacizumabem podávanými každé tři týdny. Studie potvrdila prodloužení PFS v rameni s bevacizumabem [44]. V klinické studii AVAPERL pacienti dostávali bevacizumab samotný nebo v kombinaci s pemetrexedem jako udržovací léčbu po čtyřech cyklech léčby indukční v kombinaci cisplatina + pemetrexed + bevacizumab. Udržovací léčba bevacizumabem a pemetrexedem významně prodloužila PFS [45].
Úlohu bevacizumabu v udržovací léčbě hodnotila také analýza studie fáze IV MO19390 (SAiL), kdy primárním cílem bylo zhodnotit bezpečnostní profil léčby bevacizumabem. V této studii byl bevacizumab podáván s dvojkombinací standardní chemoterapie. U pacientů v udržovací léčbě bevacizumabem bylo PFS 8,9 měsíce s mediánem OS 18,8 měsíce [46].
V České republice má bevacizumab stanovenu úhradu pro léčbu neskvamózních NSCLC stadia IIIB a IV. Pokud je po 4-6 cyklech chemoterapie na bázi platiny dosaženo kontroly onemocnění, je indikováno jeho podávání do progrese nebo nepřekonatelné toxicity.
Necitumumab je plně humanizovaná, rekombinantní IgG1 monoklonální protilátka namířená proti receptoru EGFR. Mechanismus účinku necitumumabu spočívá ve vazbě na vazebné místo EGFR, konkrétně na extracelulární doménu. Důsledkem je potlačení angiogeneze a navození buněčné smrti [47].
Studie SQUIRE provedená u 1 093 nemocných se skvamózním typem NSCLC sledovala přidání necitumumabu v téže dávce ke kombinační léčbě cisplatinou s gemcitabinem. Celkové přežití bylo významně delší v rameni s necitumumabem, konkrétně 11,5 měsíce oproti 9,9 měsíce, taktéž bylo s necitumumabem zaznamenáno delší PFS (5,7 měsíce vs. 5,5 měsíce), vyšší byla i ORR [48]. Na základě této studie je necitumumab indikován k podávání v kombinaci s cisplatinou a a gemcitabinem u dospělých osob s lokálně pokročilým nebo metastazujícím dlaždicobuněčným NSCLC s expresí EGFR, kteří k léčbě tohoto onemocnění dosud neužívali chemoterapii. Necitumumab se přidává k chemoterapii po dobu až šesti cyklů léčby, posléze u pacientů bez progrese choroby následuje monoterapie necitumumabem až do progrese či nezvládnutelných projevů toxicity [47,48]. V České republice nemá necitumumab v květnu 2021 stanovenu úhradu.
Ramucirumab je plně lidská IgG1 monoklonální protilátka. Na rozdíl od bevacizumabu se ramucirumab váže na receptor pro VEGF 2, čímž inhibuje vazbu VEGF A, VEGF C a VEGF D [49].
Hlavním klinickým hodnocením stran účinnosti a bezpečnosti ramucirumabu byla studie fáze III REVEL, v níž byl porovnáván ramucirumab v kombinaci s docetaxelem oproti docetaxelu samotnému v druhé linii léčby pacientů s NSCLC, u nichž onemocnění progredovalo při dosavadní chemoterapii obsahující platinu. Kombinovaná léčba vedla k signifikantnímu prodloužení mediánu OS na 10,5 měsíce oproti 9,2 měsíce. Delší byl rovněž medián PFS: 4,5 měsíce oproti 3,0 měsíce [50].
Ramucirumab je možné užít v kombinaci s docetaxelem v léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC, u nichž po chemoterapii založené na platině došlo k progresi onemocnění. V České republice není pro tuto léčbu v květnu 2021 stanovena úhrada.
V roce 2019 byla publikována studie fáze III RELAY. Do této studie byli zařazeni nemocní s průkazem aktivační mutace genu EGFR. Po stanovení diagnózy byli v jednom rameni nemocní léčeni erlotibem s ramucirumabem a ve druhém rameni erlotinibem s placebem. V rameni, v němž byla podávána kombinace erlotinib a ramucirumab, bylo zaznamenáno statisticky významně delší PFS než v rameni s erlotibem a placebem (19,4 měsíce vs. 12,4 měsíce) [17].
Na základě této studie byla uvedená léčebná kombinace erlotinib s ramucirumabem schválena EMA i FDA pro pacienty s EGFR senzitivními mutacemi. V České republice není pro kombinaci erlotinib plus ramucirumab v květnu 2021 stanovena úhrada.
Závěr
S příchodem molekulárně cílené léčby se u určité skupiny pacientů s pokročilým NSCLC výrazně prodloužila doba přežití. Tato léčba se uplatňuje především u adenokarcinomu. Vzhledem k tomu, že při průkazu určitých mutací je možné léčbu zahájit již po stanovení diagnózy, má přesné určení morfologické diagnózy a velmi podrobné vyšetření mutačního stavu pokročilého NSCLC zásadní význam.
Seznam použité literatury
- [1] www.svod.cz
- [2] Národní onkologický registr – ÚZIS ČR. Dostupné na: https://www.uzis.cz/index.php?pg=registry‑sber‑dat‑‑narodni‑zdravotni‑registry‑‑narodni‑onkologicky‑registr#publikace
- [3] Li T, King HJ, Mack DC, Gandara DR. Genotyping and genomic profiling of non‑small‑cell lung cancer: implications for current and future therapies. J Clin Oncol 2013; 31: 1039−1049.
- [4] Kris M, Johnson BE, Berry LD, et al. Using Multiplexed Assays of Oncogenic Drivers in Lung Cancers to Select Targeted Drugs. JAMA 2014; 311: 1998−2006.
- [5] Lung Cancer. American Cancer Society. Dostupné na: http://www.cancer.org/acs/groups/cid/documents/webcontent/003115‑pdf.pdf
- [6] Skřičková J, Kadlec B, Venclíček O, Merta Z. Karcinom plic. Čas Lék čes 2018; 157: 226–236.
- [7] Kadlec B. Postavení imunoterapie v léčbě nemalobuněčného karcinomu plic. In: Skřičková J, Kolek V, et al. Základy moderní pneumoonkologie. Praha: Maxdorf, 2017: 297−311.
- [8] Skřičková J, Petr D. Cílená biologická léčba nemalobuněčného karcinomu plic. Onkol Rev 2019; 6: 25−35.
- [9] Matěj R, Dundr P, Hornychová H, et al. Nádory plic. Doporučený postup pro bioptické vyšetření. Společnost českých patologů ČLS JEP. Dostupné na: http://www.patologie.info/soubory/all/2019‑5
- [10] Vašíková A. Principy biologické léčby karcinomu plic. In: Skřičková J, Kolek V, et al. Základy moderní pneumoonkologie. Praha: Maxdorf, 2017: 162−175.
- [11] Duffield EL, Watkins CL, Armour AA, Fukuoka M. Gefitinib or carboplatin‑paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947−957.
- [12] Douillard JY, Ostoros GM, Cobo M, et al. First‑line gefitinib in Caucasian EGFR mutation‑positive NSCLC patients: a phase‑IV, open‑label, single‑arm study. Brit J Cancer 2014; 110: 55–62.
- [13] Shepherd FA, Pereira JR, Ciuleanu T, et al. Erlotinib in previously treated non‑small‑cell lung cancer. N Engl J Med 2005; 353: 123–132.
- [14] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first‑line treatment for European patients with advanced EGFR mutation‑positive non‑small‑cell lung cancer (EURTAC): a multicentre, open‑label, randomised phase 3 trial. Lancet Oncol 2012; 13: 239−246.
- [15] Rosell R, Dafni U, Felip E, et al. Erlotinib and bevacizumab in patients with advanced non‑small‑cell lung cancer and activating EGFR mutations (BELIEF): an international, multicentre, single‑arm, phase 2 trial. Lancet Respi Med 2017; 5: 435−444.
- [16] Seto T, Kato T, Nishio M, et al. Erlotinib alone or with bevacizumab as first‑line therapy in patients with advanced non‑squamous non‑small‑cell lung cancer harbouring EGFR mutations (JO25567): an open‑label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15: 1236−1244.
- [17] Nagawa K, Garon EB, Seto T, et al. RELAY: A multinational, double‑blind, randomized Phase 3 study of erlotinib (ERL) in combination with ramucirumab (RAM) or placebo (PL) in previously untreated patients with epidermal growth factor receptor mutation‑positive (EGFRm) metastatic non‑small cell lung cancer (NSCLC). Lancet Oncol 2019; 20: 1655−1669.
- [18] Yang JCH, Schuler MH, Yamamoto N, et al. LUX‑Lung 3: A randomized, open‑label, phase III study of afatinib versus pemetrexed and cisplatin as first‑line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR‑activating mutations. J Clin Oncol 2012; 30(18 Suppl): LBA7500‑LBA7500.
- [19] Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first‑line treatment of Asian patients with advanced non‑small‑cell lung cancer harbouring EGFR mutations (LUX‑Lung 6): an open‑label, randomised phase 3 trial. Lancet Oncol 2014; 15: 213−222.
- [20] Soria JCh, Felip E, Cobo M, et al. Afatinib versus erlotinib as second‑line treatment of patients with advanced squamous cell carcinoma of the lung (LUX‑Lung 8): an open‑label randomised controlled phase 3 trial. Lancet Oncol 2015; 16: 897.
- [21] Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first‑line treatment for patients with EGFR‑mutation‑positive non‑small‑cell lung cancer (ARCHER 1050): a randomised, open‑label, phase 3 trial. Lancet Oncol 2017; 18: 1454−1466.
- [22] Soria JCh, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR‑Mutated Advanced Non-Small‑Cell Lung Cancer. N Engl J Med 2018; 378: 113−125.
- [23] Ramalingam SS, Gray JE, Ohe Y, et al. Osimertinib vs comparator EGFR‑TKI as first‑line treatment for EGFRm aNSCLC (FLAURA): Final OS analysis [oral presentation]. Presented at: ESMO; September 27−October 1, 2019; Barcelona, Spain. Abstract LBA5.
- [24] Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum–pemetrexed in EGFR T790M–positive lung cancer. N Engl J Med 2017; 376: 629−640.
- [25] Herbst RS, Tsuboi M, John T, et al. Osimertinib as adjuvant therapy in patients (pts) with stage IB–IIIA EGFR mutation positive (EGFRm) NSCLC after complete tumor resection: ADAURA. LBA5 J Clin Oncol 2020; 38(18 Suppl): LBA5.
- [26] Shaw, AT, Kim DW, Nakagawa K, et al. Phase III study of crizotinib versus pemetrexed or docetaxel chemotherapy in patients with advanced ALK‑positive non‑small cell lung cancer (NSCLC) (PROFILE 1007). Ann Oncol 2012; 23(Suppl 9): 21.
- [27] Mok T, Kim DW, Wu YL, et al. First‑line crizotinib versus pemetrexed–cisplatin or pemetrexed–carboplatin in patients (pts) with advanced ALK‑positive non‑squamous non‑small cell lung cancer (NSCLC): results of a phase III study (PROFILE 1014). J Clin Oncol 2014; 32(15 Suppl): 8002−8002.
- [28] SPC Xalkori. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/xalkori‑epar‑product‑information_cs.pdf
- [29] De Castro J, Novello S, Mazieres J, et al. CNS efficacy results from the phase III ALUR study of alectinib vs chemotherapy in previously treated ALK+ NSCLC. Ann Oncol 2017; 28(Suppl 5): Abstr 3617.
- [30] Peters S, Camidge DR, Shaw AT, et al. Alectinib versus crizotinib in untreated ALK‑positive non‑small‑cell lung cancer. N Engl J Med 2017; 377: 829−838.
- [31] Scagliotti G, Kim TM, Crinò L, et al. Ceritinib vs chemotherapy (CT) in patients (pts) with advanced anaplastic lymphoma kinase (ALK)‑rearranged (ALK+) non‑small cell lung cancer (NSCLC) previously treated with CT and crizotinib (CRZ): results from the confirmatory phase 3 ASCEND‑5 study. Ann Oncol 2016; 27: 1−36.
- [32] Kim DW, Tiseo M, Ahn MJ, et al. Brigatinib in patients with crizotinib‑refractory anaplastic lymphoma kinase‑positive non‑small‑cell lung cancer: a randomized, multicenter phase II trial. J Clin Oncol 2017; 35: 2490−2498.
- [33] Camidge DR, Kim HR, Ahn M‑J, et al. Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK‑Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA‑1L Trial. J Clin Oncol 2020; 38: 3592−3603.
- [34] Horn L, Wang Z, Wu G, et al. Phase 3 Randomized Study of Ensartinib vs Crizotinib in Anaplastic Lymphoma Kinase (ALK)-Positive NSCLC Patients: eXalt3. WCLC2020, Presidental Symposium, Aug 8, 2020.
- [35] Shaw AT, Felip E, Bauer TM, et al. Lorlatinib in non‑small‑cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open‑label, single‑arm first‑in‑man phase 1 trial. Lancet Oncol 2017; 18: 1590−1599.
- [36] Planchard D, Smit EF, Groen HJ, et al. Dabrafenib plus trametinib in patients with previo usly untreated BRAFV600E‑mutant metastatic non‑small‑cell lung cancer: an open‑label, phase 2 trial. Lancet Oncol 2017; 18: 1307−1316.
- [37] Reck M, Kaiser R, Mellemgaard A, et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non‑small‑cell lung cancer (LUME‑Lung 1): a phase 3, double‑blind, randomised controlled trial. Lancet Oncol 2014; 15: 143−155.
- [38] Hanna NH, Kaiser R, Sullivan RN, et al. Nintedanib plus pemetrexed versus placebo plus pemetrexed in patients with relapsed or refractory, advanced non‑small cell lung cancer (LUME‑Lung 2): A randomized, double‑blind, phase III trial. Lung Cancer 2016; 102: 65−73.
- [39] Drilon A, Theodore W, Laetsch TW, et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N Engl J Med 2018; 378: 731−739.
- [40] Al‑Salama ZT, Keam SJ. Entrectinib: First Global Approval. Drugs 2019; 79: 1477−1483.
- [41] Kadlec B. Úloha bevacizumabu v léčbě nemalobuněčného karcinomu plic. Farmakoterapie 2017; 13: 30−34.
- [42] Sandler A, Yi J, Dahlberg S, et al. Treatment outcomes by tumor histology in Eastern Cooperative Group Study E4599 of bevacizumab with paclitaxel/carboplatin for advanced non‑small cell lung cancer. J Thorac Oncol 2010; 5: 1416−1423.
- [43] Lopez‑Chavez A, Young T, Fages S, et al. Bevacizumab maintenance in patients with advanced non-small‑cell lung cancer, clinical patterns, and outcomes in the Eastern Cooperative Oncology Group 4599 Study: results of an exploratory analysis. J Thorac Oncol 2012; 7: 1707−1712.
- [44] Reck M, von Pawel J, Zatloukal P, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first‑line therapy for nonsquamous non-small‑cell lung cancer: AVAiL. J Clin Oncol 2009; 27: 1227−1234.
- [45] Barlesi F, De Castro J, Dvornichenko V, et al. AVAPERL (MO22089): Final efficacy outcomes for patients (pts) with advanced non‑squamous non‑small cell lung cancer (nsNSCLC) randomised to continuation maintenance (mtc) with bevacizumab (Bev) or Bev + pemetrexed (Pern) after first‑line (1L) Bev‑cisplatin (Cis)‑Pem treatment (Tx). Eur J Cancer 2011; 47: 16.
- [46] Crinó L, Dansin E, Garrido P, et al. Safety and efficacy of first‑line bevacizumab‑based therapy in advanced non‑squamous non‑small‑cell lung cancer (SAiL, MO19390): a phase 4 study. Lancet Oncol 2010; 11: 733−740.
- [47] Slíva J. Necitumumab. Farmakoterapie 2017; 13: 60−63.
- [48] Thatcher N, Hirsch FR, Luft AV, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first‑line therapy in patients with stage IV squamous non‑small‑cell lung cancer (SQUIRE): an open‑label, randomised, controlled phase 3 trial. Lancet Oncol 2015; 16: 763−774.
- [49] Slíva J. Ramucirumab. Farmakoterapie 2017; 13: 95−97.
- [50] Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second‑line treatment of stage IV non‑small‑cell lung cancer after disease progression on platinum‑based therapy (REVEL): a multicentre, double‑blind, randomised phase 3 trial. Lancet 2014; 384: 665−673.