Molekulární farmakologie látek stimulujících erytropoézu
Přesná regulace tvorby červených krvinek je důležitá pro včasnou a precizně kontrolovanou odpověď organismu na stavy hyperoxie nebo hypoxie. Podrobná znalost tohoto mechanismu je nutná nejen pro pochopení fyziologie erytropoézy, ale i pro případnou farmakologickou intervenci do tohoto děje. Poslední vědecké poznatky dokazují, že regulace tvorby červených krvinek je dosaženo jak na úrovni syntézy erytropoetinu, tak na úrovni degradace erytropoetinu i jeho receptoru. S pomocí moderních metod genetického inženýrství byly připraveny látky stimulující erytropoézu, které buď věrně napodobují účinky endogenního erytropoetinu, nebo pomocí strukturálních modifikací molekuly ovlivňují farmakokinetiku a farmakodynamiku výsledné látky. Vzhledem k exspiraci patentové ochrany erytropoetinu lze očekávat nástup nových preparátů na trh a biotechnologické společnosti budou nuceny prokázat, že jejich nové přípravky jsou jak bezpečné, tak efektivní. Znalost molekulární farmakologie erytropoetinu a dalších látek stimulujících erytropoézu tak bude klíčová pro kvalifikovanou orientaci v dostupných přípravcích a pro jejich efektivní a ekonomické využití v terapii.
Úvod
Omezená životnost červených krvinek vyžaduje jejich kontinuální a regulovanou náhradu. Nová produkce červených krvinek, erytropoéza, musí přesně reagovat nejen na bazální potřebu organismu, ale i na stavy zvýšené či snížené potřeby. Je zřejmé, že celý systém tvorby červených krvinek musí být velmi citlivě a těsně kontrolován řadou regulačních mechanismů, neboť jak nedostatek, tak nadbytek erytrocytů, stejně jako nadměrné oscilace hladin hemoglobinu jsou životu nebezpečné [1]. Přesná regulace tvorby červených krvinek je tedy nezbytná nejen pro fyziologii tohoto procesu, nýbrž je zásadní i pro farmakologickou intervenci do mechanismu erytropoézy.
Základní principy erytropoézy jsou obecně známy již desítky let, ovšem revoluční rozvoj metod molekulární biologie a genetiky přinesl v posledních letech celou řadu nových poznatků, osvětlujících mnoho aspektů celého děje. V tomto článku se zaměříme především na molekulární farmakologii erytropoetinu a jeho receptoru jakožto základních proteinů regulujících erytropoézu. Znalosti těchto mechanismů jsou zásadní pro pochopení celého procesu i pro orientaci v přípravcích ovlivňujících erytropoézu, jež jsou v současnosti na trhu nebo v klinickém zkoušení.
Erytropoéza a erytropoetin
Organismus každý den vyprodukuje z kmenových buněk kostní dřeně na 400 miliard plně specializovaných buněk krevního systému. Tato produkce je uskutečněna „dozráváním" hematopoetických kmenových buněk v jednu z devíti buněčných linií. Způsob, jakým se bude „nezralá" kmenová buňka vyvíjet a diferencovat, je řízen tzv. hematopoetickými růstovými faktory. Tyto, ve vodě rozpustné, glykoproteiny nemohou proniknout membránou do cílové buňky; interagují proto se specifickým receptorem lokalizovaným na povrchu cílové buňky, aby ovlivnily buněčné funkce. Po vazbě s ligandem jsou receptory pomocí tzv. druhých poslů schopny přeložit extracelulární signály na signály intracelulární, a ovlivnit tak expresi některých důležitých genů. Zásadním růstovým faktorem pro tvorbu červených krvinek je erytropoetin [2], jehož existenci předpokládali Carnot a Deflandre již v roce 1906, tehdy ještě pod názvem hemapoetin, a potvrzena byla v padesátých letech minulého století.
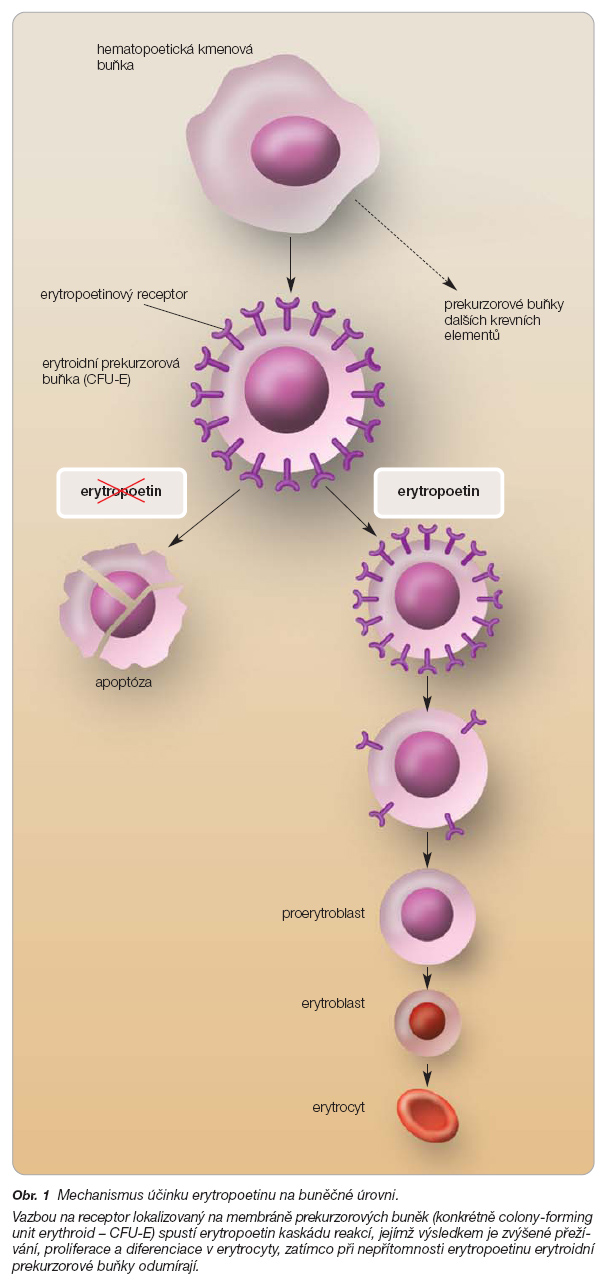
Predominantní účinek erytropoetinu je ve svém důsledku antiapoptotický – vazbou na receptor lokalizovaný na membráně prekurzorových buněk spustí erytropoetin kaskádu reakcí (viz níže), jejímž výsledkem je zvýšené přežívání, proliferace a diferenciace v erytrocyty (obr. 1) [3, 4]. Erytroidní prekurzorové buňky (konkrétně CFU-E – colony-forming unit erythroid), které exprimují erytropoetinový receptor, při nepřítomnosti erytropoetinu odumírají, zatímco v přítomnosti tohoto hormonu přežívají, proliferují, mohou se dále dělit a diferencovat v erytrocyty.
Nedostatek erytropoetinu je primární příčinou anémie spojené s chronickým selháním ledvin. V takovém případě je nutná substituční terapie rekombinantním erytropoetinem nebo jinou látkou stimulující erytropoézu; cílem farmakoterapie je dosažení hladin hemoglobinu 110 až 120 g/l (hematokrit 0,33–0,36) [5]. Pro terapii anémie u pacientů s chronickým selháním ledvin byl erytropoetin schválen v roce 1988, tedy pouhé tři roky poté, co se podařilo zajistit jeho produkci rekombinantní technologií [6]. Kromě selhání ledvin se dnes erytropoetin klinicky používá i v dalších indikacích, jako je prevence anémie u pacientů s nádorovým onemocněním, kteří podstupují chemoterapii, u pacientů postižených AIDS a léčených zidovudinem, u pacientů s hepatitidou C nebo před závažným chirurgickým zákrokem [5]. Další potenciální indikace pramenící z extrahematologických účinků erytropoetinu, jako jsou protekce kardiocytů (léčba a prevence infarktu myokardu), protekce nervových buněk CNS (prevence ischemického poškození mozku, Parkinsonova choroba) a dalších orgánů jsou centrem současného výzkumu [7–11].
Humánní rekombinantní erytropoetin i další látky stimulující erytropoézu jsou obvykle dobře snášeny s minimem nežádoucích účinků. Závažným, nicméně vzácným vedlejším účinkem je produkce protilátek inhibujících erytropoetin a způsobujících úplnou aplazii červených krvinek [12]. U pacientů léčených látkami stimulujícími erytropoézu by měl být pečlivě monitorován krevní tlak; rovněž kolísání hodnot hemoglobinu (Hb) [1, 13] a čas nezbytný k dosažení cílových hladin Hb [14, 15] jsou rizikovými faktory zvyšujícími náklady na léčbu, morbiditu i mortalitu. Začátkem roku 2007 se rovněž objevily údaje poukazující na použití látek stimulujících erytropoézu u pacientů s nádorovým onemocněním; zdá se, že tyto látky mohou zvyšovat progresi nádorů hlavy a krku a zkracovat dobu přežití [16].
Struktura a farmakokinetika erytropoetinu
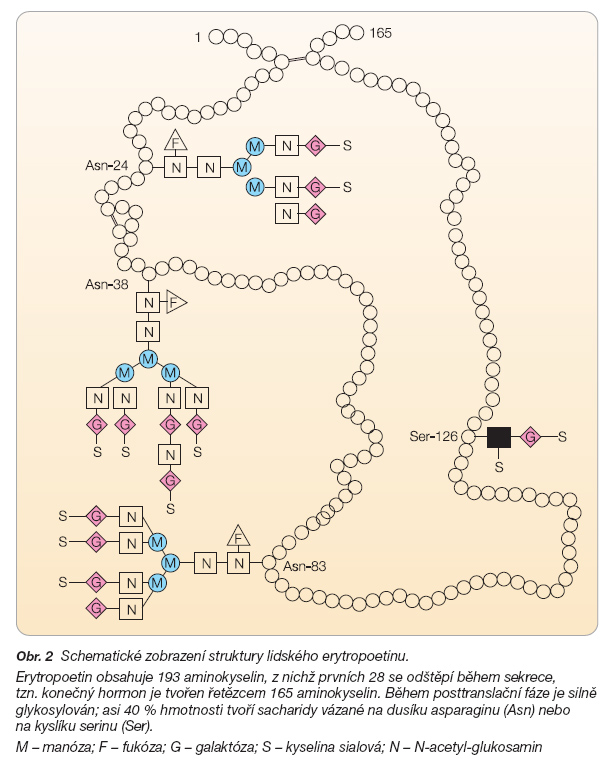
Stejně jako další růstové faktory patří i erytropoetin do rodiny cytokinů. U člověka je kódován genem na 7. chromozomu, který je exprimován převážně v peritubulárních intersticiálních buňkách ledvin [17]. Erytropoetin obsahuje 193 aminokyselin, z nichž prvních 28 se odštěpí během sekrece. Konečný hormon je tedy tvořen řetězcem 165 aminokyselin o molekulové hmotnosti 30 400 daltonů [18]. Během posttranslační fáze je erytropoetin silně glykosylován; asi 40 % hmotnosti tvoří sacharidy vázané na dusíku asparaginu nebo na kyslíku serinu (obr. 2) [19, 20]. Blíže bude o struktuře erytropoetinu pojednáno v části Závislost struktury a účinku.
Uvolňování erytropoetinu z ledvin do krevního řečiště není kontinuální, nýbrž kvantální, vyúsťující v rychlá a krátkodobá maxima plazmatických koncentrací. Za fyziologických podmínek dosahují plazmatické koncentrace erytropoetinu hodnot 6–32 U/l. Biologický poločas se pohybuje mezi 2 a 13 hodinami a distribuční objem se rovná objemu plazmy. Erytropoetin je organismem eliminován nelineární, saturovatelnou kinetikou [21]. Méně než 10 % molekuly se vyloučí ledvinami, hlavním eliminačním orgánem je kostní dřeň, kde je erytropoetin degradován společně s receptorem (viz Ukončení účinku erytropoetinu).
Regulace syntézy erytropoetinu
Během embryonálního vývoje je erytropoetin syntetizován převážně v játrech; po narození se však syntéza přesouvá do peritubulárních buněk kortexu ledvin [22–24]. Z bezpečnostních důvodů není erytropoetin nikde v organismu skladován a v případě potřeby proto musí být rychle nasyntetizován. Regulace produkce erytropoetinu se odehrává na úrovni syntézy mRNA, která probíhá stylem „všechno, nebo nic" [25]; mRNA se v ledvinných buňkách objeví do jedné hodiny po zjištěném deficitu kyslíku a její hladiny stoupají následující čtyři hodiny. Jakmile se hodnoty kyslíku vrátí k normálu, okamžitě se sníží i syntéza mRNA. Erytropoetin tak na podnět hypoxémie vytváří „ostré peaky" plazmatických koncentrací. Rychlý nárůst a následný rychlý pokles plazmatických koncentrací erytropoetinu je zásadní pro zvýšenou produkci erytrocytů pouze v době potřeby. Tento systém, jemně vyladěný přírodou, může být narušen nemocí ledvin, poruchou kostní dřeně, nedostatkem železa a vitaminů či se projeví jako vedlejší účinek při podávání některých léčiv (např. cytostatika, zidovudin). Během anémie nebo hypoxémie syntéza erytropoetinu okamžitě vzrůstá na více než tisícinásobek normálních hodnot, zvýší se sérové hladiny erytropoetinu, který následně stimuluje přežívání, proliferaci a dozrávání progenitorových buněk.
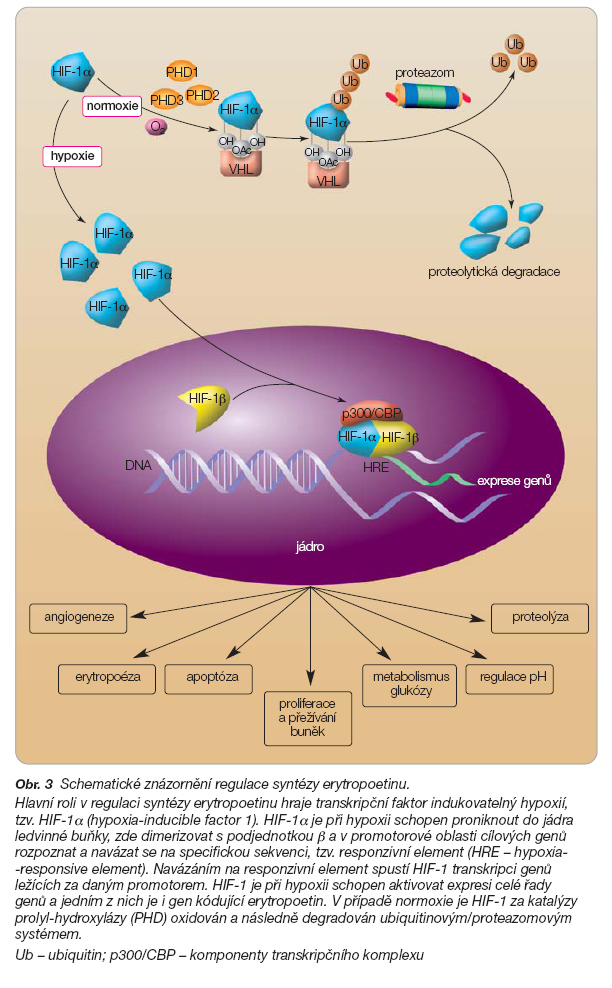
Samotná syntéza erytropoetinu je pod kontrolou sofistikovaného regulačního mechanismu schopného detekovat množství kyslíku v krvi. Detailní mechanismus tohoto děje není dosud zcela objasněn, ale je zřejmé, že hlavní roli v regulaci syntézy erytropoetinu hraje transkripční faktor indukovatelný hypoxií, tzv. HIF-1a (hypoxia-inducible factor 1) [26]. HIF-1a je v podmínkách hypoxie schopen proniknout do jádra ledvinné buňky, zde dimerizovat s podjednotkou b a v promotorové oblasti cílových genů rozpoznat a navázat se na specifickou sekvenci, tzv. responzivní element (HRE – hypoxia-responsive element). Navázáním na responzivní element spustí HIF-1 transkripci genů ležících za daným promotorem. HIF-1 je při hypoxii schopen aktivovat expresi celé řady genů a jedním z nich je i gen kódující erytropoetin. V případě normoxie je HIF-1 za katalýzy prolyl-hydroxylázy oxidován [27] a následně degradován ubiquitinovým/proteazomovým systémem [28, 29] – nemůže tedy splnit svoji roli transkripčního faktoru (obr. 3).
Mechanismus účinku erytropoetinu
Za fyziologických okolností je erytropoetin zodpovědný za denní produkci zhruba 200 miliard červených krvinek. Erytropoetin je v podstatě růstový faktor, který ovlivňuje intracelulární signalizaci po interakci se specifickým receptorem lokalizovaným na povrchu buněk. Tímto receptorem je erytropoetinový receptor (EPOR) patřící do rodiny cytokinových receptorů. EPOR je homodimer složený ze dvou glykoproteinových řetězů o 484 aminokyselinách [30, 31]. Stejně jako další receptory této rodiny je také EPOR charakterizován extracelulární doménou uzpůsobenou pro vazbu ligandu, transmembránovou doménou pronikající do buňky a intracelulární doménou spojenou s tyrozinkinázovým systémem.
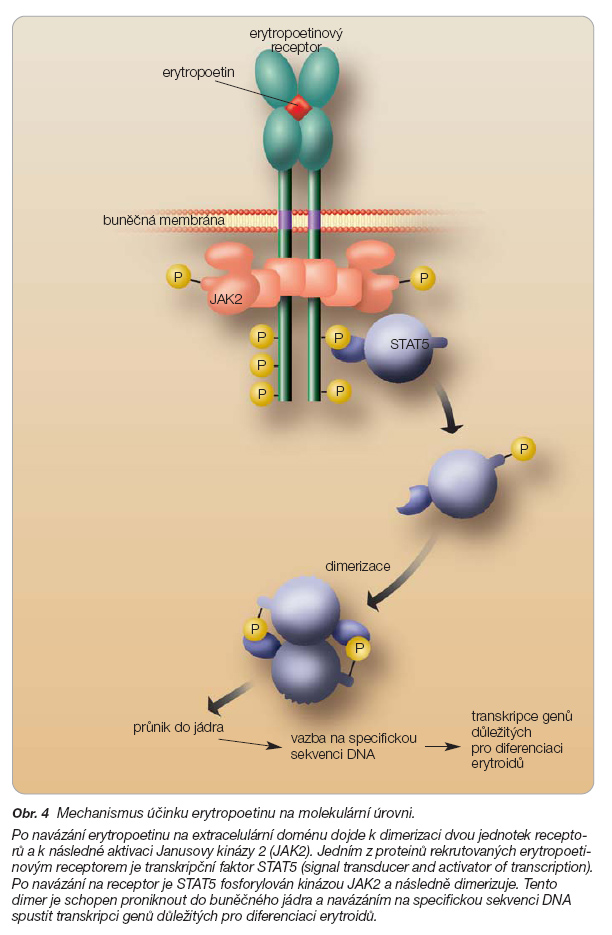
Po navázání erytropoetinu na extracelulární doménu dojde k dimerizaci dvou jednotek receptorů, k následné aktivaci Janusovy kinázy 2 (JAK2) konstitutivně spojené s intracelulární doménou receptoru a k následné transdukci signálu [32]. Aktivovaná JAK2 fosforyluje tyrozinové zbytky mnoha substrátů, které dále interagují s řadou intracelulárních proteinů spojených s transdukcí signálu. Jedním z proteinů rekrutovaných erytropoetinovým receptorem je transkripční faktor STAT5 (signal transducer and activator of transcription). Po navázání na receptor je STAT5 fosforylován kinázou JAK2 a následně dimerizuje [33]. Tento dimer je schopen proniknout do buněčného jádra a navázáním na specifickou sekvenci DNA spustit transkripci genů důležitých pro diferenciaci erytroidů (obr. 4).
Ukončení účinku erytropoetinu
Přesná regulace sérových koncentrací erytropoetinu a aktivace jeho receptoru je kritická pro udržení konstantního množství erytrocytů a pro prevenci jak anémie, tak polycytémie. Erytropoetin a jeho receptor disponují unikátními mechanismy, které takovouto regulaci umožňují. Interakce erytropoetinu s EPOR v podstatě vytváří signál jak pozitivní (zodpovědný za antiapoptotický efekt), tak negativní (rychle ukončující účinek erytropoetinu).
Na rozdíl od dalších regulačních molekul nebo léčiv není účinek erytropoetinu ukončen typickými exkrečními orgány, jako jsou játra, ledviny či plíce; u zvířecích modelů nebyl po odstranění jater nebo ledvin pozorován rozdíl v clearance a v biologickém poločasu erytropoetinu [34–36], nýbrž přímo v místě účinku, tedy v prekurzorové buňce [21].
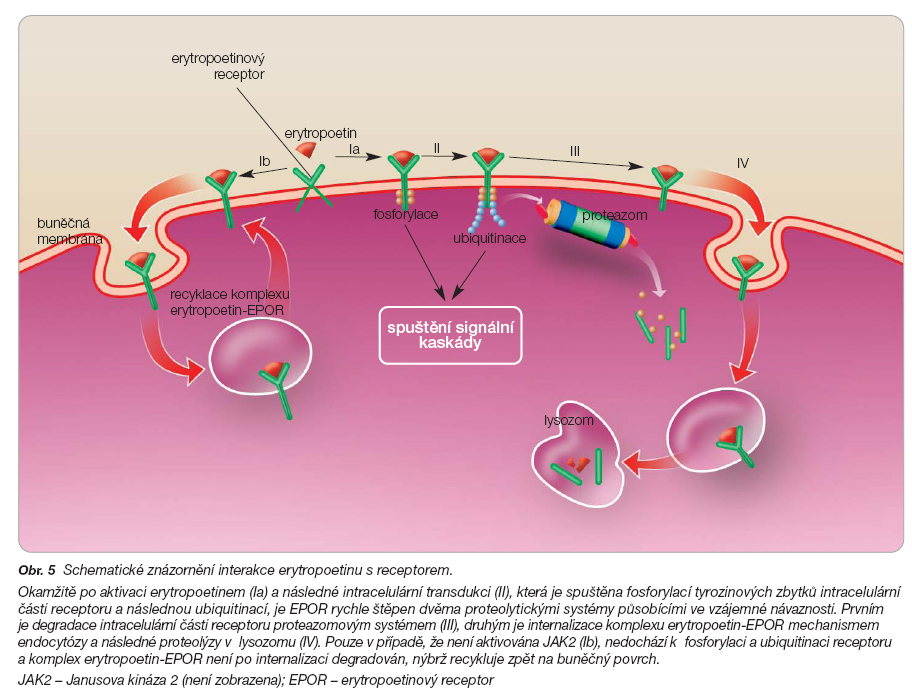
Okamžitě po aktivaci erytropoetinem a následné intracelulární transdukci je EPOR rychle štěpen dvěma proteolytickými systémy působícími ve vzájemné návaznosti [37]. Prvním je degradace intracelulární části receptoru proteazomovým systémem, druhým je internalizace komplexu erytropoetin-EPOR mechanismem endocytózy a následné proteolýzy v lysozomu. Bez přítomnosti erytropoetinu disponuje EPOR biologickým poločasem 3 hodiny, zatímco po navázání ligandem poločas klesá na 30 minut. Pouze v případě, že není aktivována JAK2, není komplex erytropoetin-EPOR po internalizaci degradován, nýbrž recykluje zpět na buněčný povrch [37] (obr. 5).
Lze tedy tvrdit, že endogenní či rekombinantně připravený erytropoetin (nikoliv některá nová léčiva – darbepoetin, CERA; viz níže) vazbou na receptor spustí okamžitou kaskádu aktivačních reakcí a ve stejném okamžiku způsobí degradaci svoji i receptoru [38]. Tímto způsobem lze tedy vysvětlit velmi krátké trvání účinku erytropoetinu. I tento řídící mechanismus je, vedle striktně kontrolované syntézy erytropoetinu, zásadní pro přesně načasovanou regulaci tvorby červených krvinek.
Vztah struktury a účinku
Jak již bylo zmíněno, erytropoetin je glykoprotein a 40 % jeho hmotnosti tvoří cukry. Každá molekula erytropoetinu však obsahuje trochu jiné množství sacharidů, a proto se o erytropoetinu hovoří jako o mikroheterogenní směsi. Důležité je, že právě stupeň glykosylace, tedy množství sacharidů v molekule erytropoetinu, ovlivňuje významnou měrou jeho aktivitu i osud v organismu.
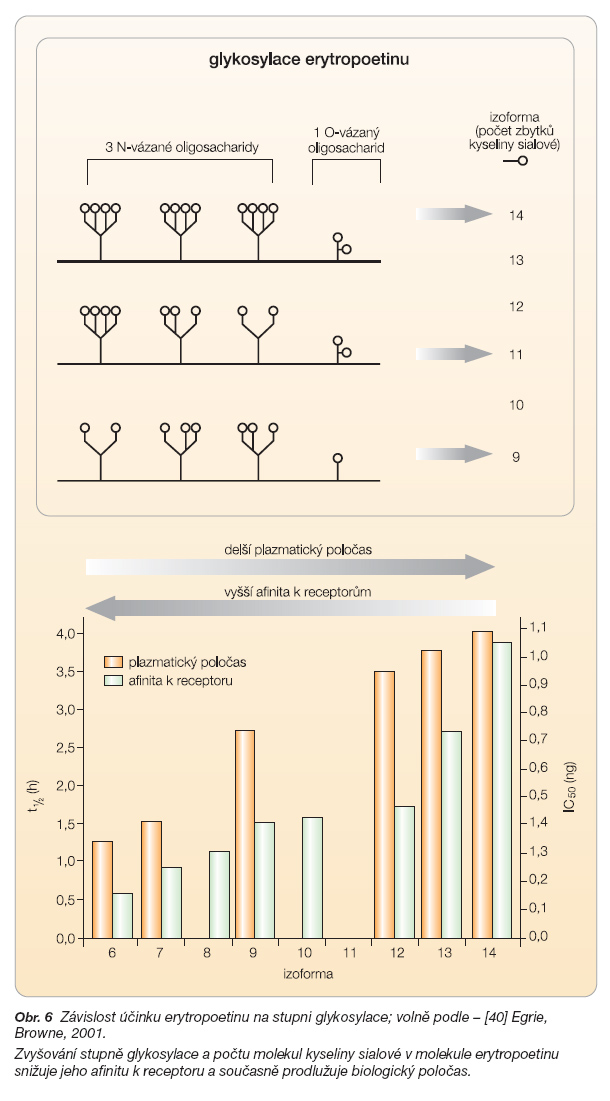
Ke glykosylaci erytropoetinu dochází v rámci posttranslačních modifikací, vazbou cukerných řetězců k asparaginu v polohách 24, 38 a 83 (N-glykosylace) a serinu v pozici 126 (O-glykosylace) [39]. Oligosacharidy vázané na dusíku asparaginu mohou tvořit dvě až čtyři větve, Ovázaný oligosacharid na serinu může vytvářet 1 nebo 2 větve. Každá větev oligosacharidu je zakončena galaktózou a kyselinou sialovou (obr. 2). Celkový počet molekul kyseliny sialové na jedné molekule erytropoetinu se tedy může teoreticky pohybovat od 7 (3 x 2 + 1) po 14 (3 x 4 + 2), prakticky jich rekombinantně připravovaný erytropoetin-a obsahuje 9 až 14 (obr. 6).
V roce 2001 byla v British Journal of Cancer publikována zajímavá studie zaměřená na vztah mezi stupněm glykosylace a aktivitou erytropoetinu [40]. Autoři této práce jednoznačně prokázali, že počet cukerných zbytků přímo ovlivňuje jak afinitu erytropoetinu k receptoru, tak biologický poločas erytropoetinu. Zjistili, že zvyšování stupně glykosylace a počtu molekul kyseliny sialové v molekule erytropoetinu snižuje jeho afinitu k receptoru a současně prodlužuje biologický poločas (protože pouze erytropoetin navázaný na EPOR je internalizován a degradován, viz Ukončení účinku erytropoetinu), obr. 6.
S ohledem na farmaceutickou přípravu a terapeutické použití rekombinantního erytropoetinu v klinické praxi je tato informace zcela zásadní ze dvou hledisek:
1. Stupeň glykosylace a tím i aktivita erytropoetinu jsou z velké části dány způsobem přípravy rekombinantního erytropoetinu, tedy typem použitých buněk, způsobem purifikace, použitými pufrovacími roztoky apod. [41, 42]. Vzhledem k tomu, že patenty chránící erytropoetin v některých zemích nedávno exspirovaly a v dalších se tak zanedlouho stane, lze očekávat nástup nových preparátů stimulujících erytropoézu na trh. Detailní charakterizace jejich struktury, farmakokinetiky a farmakodynamiky bude zásadní pro adekvátní použití v terapii a biotechnologické společnosti budou nuceny prokázat, že jejich nové přípravky jsou jak bezpečné, tak efektivní [43].
2. Podobné studie rovněž vedly k hypotéze, že genetickou modifikací molekuly erytropoetinu by bylo možno zvýšit počet vazebných míst pro další oligosacharidy, aby se prodloužil biologický poločas erytropoetinu; výhodou takového preparátu by bylo méně časté podávání přípravku v terapii. Pomocí bodových mutací se skutečně podařilo do molekuly erytropoetinu vnést vazebná místa pro další N-vázané oligosacharidy a připravit novou molekulu nazvanou novel erytropoesis stimulating protein (NESP, později darbepoetin-a) [44], která se liší od humánního erytropoetinu jak ve struktuře, tak v účincích (viz níže).
Látky stimulující erytropoézu; přípravky na trhu a trendy ve vývoji
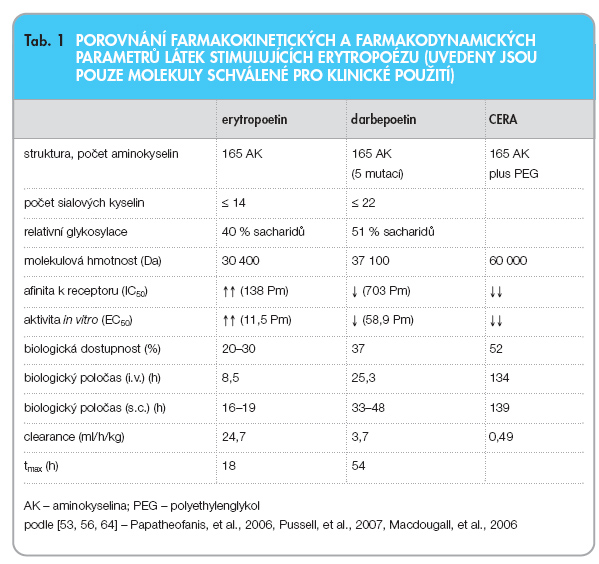
Mezi dnes užívanými či aktuálně klinicky testovanými přípravky, jež ovlivňují erytropoézu, lze vystopovat dvě filozofie přístupu k léčbě anémií: výrobci se buďto vydávají „přírodní cestou" ve snaze co nejvěrněji kopírovat strukturu, vlastnosti a účinky endogenního erytropoetinu, nebo se tyto vlastnosti snaží modifikovat tak, aby se prodloužil biologický poločas erytropoetinu a s ním i dávkovací rozmezí. Rekombinantní humánní erytropoetin se v léčbě anémie úspěšně používá již dvě dekády. Podává se obvykle v subkutánních nebo intravenózních injekcích, jedenkrát až třikrát týdně. Právě snaha o méně časté aplikování injekcí erytropoetinu vedla farmaceutické firmy k vývoji látek s prodlouženým biologickým poločasem. V literatuře je popsáno několik strategií, jak prodlouženého setrvání proteinu v plazmě dosáhnout; např. konstrukce dimerických molekul erytropoetinu [45], zavedení dalších oligosacharidů do molekuly erytropoetinu [46] nebo kovalentní připojení polymeru polyethylenglykolu [47]. Cílem vývoje přípravků s prodlouženým biologickým poločasem je zvýšit komfort pro pacienta a snížit ekonomické náklady na léčbu. Charakteristiky jednotlivých látek jsou uvedeny v tab. 1, výhody i nevýhody jednotlivých přístupů jsou nastíněny v následujícím textu.
Látky imitující endogenní erytropoetin
Do této skupiny látek stimulujících erytropoézu patří rekombinantně připravované erytropoetiny a a b (erytropoetiny w a d nebudou v rámci tohoto textu diskutovány). Obě látky jsou na českém trhu k dispozici a můžeme tvrdit, že mezi erytropoetinem a a b nejsou zásadní rozdíly ve struktuře, afinitě k receptorům ani v biologickém poločasu. Tyto erytropoetiny jsou produkovány technologií rekombinantní DNA s využitím savčích buněk (ovariální buňky čínského křečka) transfekovaných genem kódujícím lidský erytropoetin [6]. Rekombinantní lidský erytropoetin je strukturálně téměř totožný s endogenním erytropoetinem a ve své podstatě imituje jeho fyziologické účinky: stejně jako endogenní ligand disponuje rekombinantní erytropoetin vysokou afinitou k erytropoetinovému receptoru, vyvolává okamžitou odpověď, rychle mizí z organismu a jeho účinek je časově velmi omezen (viz tab. 1). Tím je umožněna velmi přesná kontrola, rychlé dosažení cílových hladin hemoglobinu a minimalizace jeho kolísání.
Jako negativní vlastnost lidského rekombinantního erytropoetinu se uvádí nutnost jeho častějšího podávání – u dialyzovaných pacientů až 3 aplikace týdně. Tento nedostatek je však relativní, uvědomíme-li si, že pacient se selháním ledvin musí lékaře navštívit třikrát týdně, aby mu mohla být provedena dialýza, a je pouze otázkou časové synchronizace sjednotit dialyzaci s aplikací erytropoetinu bez dalšího časového zatěžování pacienta a zdravotnického personálu. Kromě toho byla v rámci studie PROMPT úspěšně testována prolongovaná dávkovací schémata s jednou či dvěma subkutánními dávkami erytropoetinu měsíčně, což znamená výhodu u nedialyzovaných pacientů [48].
Látky s prodlouženým biologickým poločasem
Prvním přístupem, jak zpomalit clearance a prodloužit biologický poločas erytropoetinu, je již zmiňovaná hyperglykosylace. Prvním a dosud jediným hyperglykosylovaným přípravkem na trhu je darbepoetin-a [44], u něhož byla genetickou modifikací vytvořena další vazebná místa pro cukerné řetězce. Zavedením dalších míst pro navázání oligosacharidů a následným zvýšením procentuálního zastoupení sacharidů v molekule darbepoetinu (více než 50 % oproti 40 % u endogenního erytropoetinu) se v první řadě sníží afinita ligandu k receptoru. V důsledku nižší vazby darbepoetinu na EPOR dochází také k pomalejší internalizaci komplexu darbepoetin-EPOR endocytózou a k delšímu setrvání darbepoetinu v organismu. Proto je možno darbepoetin podávat v delších časových odstupech. Další předpokládanou výhodou uváděnou u tohoto přípravku jsou snížené náklady na léčbu. Tyto údaje jsou však stěží hodnotitelné, mimo jiné také proto, že erytropoetin je odměřován v mezinárodních jednotkách (U), kdežto darbepoetin v mikrogramech. Pro porovnání dávek mezi oběma molekulami byl zaveden poměr 200 : 1, spočítaný na základě specifické aktivity humánního erytropoetinu [49]. Na základě rozsáhlých studií byl však tento dávkovací poměr upraven zhruba na 165 : 1 až 187 : 1, což dokumentuje, že ve skutečnosti je k dosažení stejných hodnot hemoglobinu potřeba méně proteinové masy erytropoetinu než darbepoetinu [5]. Výsledky studií hodnotící ekonomické aspekty léčby darbepoetinem-a vs. erytropoetinem jsou velmi nejednotné; některé potvrzují předpokládanou nižší cenu oproti erytropoetinu [50], jiné došly k překvapivému závěru, že léčba darbepoetinem-a je výrazně (až o 39–56 %) dražší než léčba erytropoetinem [51–55].
Darbepoetin-a byl popsán jako porovnatelný s erytropoetinem v dlouhodobém účinku; v korekční fázi léčby, kdy je žádoucí rychlá reakce na léčbu, se však erytropoetin zdá vhodnější. Dlouhodobě působící darbepoetin-a vykazuje oproti krátkodobě působícím erytropoetinům horší hematologické parametry (hladiny hemoglobinu, saturace transferinu, sérový feritin) [56].
Dalším způsobem, jak dosáhnout prodlouženého setrvání přípravku v organismu, je tzv. pegylace, tedy kovalentní navázání polymeru polyethylenglykolu (PEG) na protein. Tento přístup byl v minulosti použit u mnoha dalších farmakologických preparátů a firma Roche jej nedávno aplikovala na erytropoetin [57]. Přípravek vyvíjený pod názvem CERA (z angl. Continuous Erytropoetin Receptor Activator – kontinuální aktivátor EPOR) byl před několika měsíci schválen pro klinické užití v léčbě anémie spojené s chronickým selháním ledvin.
Navázání PEG na e-aminoskupinu lysinu na pozici 45 nebo 53 v řetězci erytropoetinu výrazně zvyšuje molekulovou hmotnost (60 000 Da) a snižuje imunogenitu přípravku. Oproti „klasickým" erytropoetinům vykazuje CERA zásadně jiné vlastnosti i mechanismus účinku. Afinita k EPOR je mnohem nižší (až 45krát nižší než u erytropoetinu) a na rozdíl od erytropoetinu po aktivaci EPOR nedochází k endocytóze a internalizaci. Erytropoetinový receptor tak není degradován v lysozomu, nýbrž zůstává na povrchu buňky a může být opakovaně aktivován. CERA díky dlouhému biologickému poločasu setrvává v organismu a může aktivovat i další receptory. Tyto vlastnosti umožňují podávat přípravek obsahující CERA v mnohem delších časových intervalech než běžné látky stimulující erytropoézu; biologický poločas je zhruba 140 hodin (po i.v. i po s.c. aplikaci), díky tomu se přípravek obsahující CERA může podávat v zahajovací fázi léčby jednou za dva až tři týdny, v udržovací fázi léčby u dialyzovaných pacientů zajistí adekvátní hladiny hemoglobinu jedna dávka CERA měsíčně [57].
Tato látka bude jistě znamenat další pokrok v léčbě anémie, některé otázky spojené s jejím používáním však dosud nejsou zcela zodpovězeny; jedná se především o přesný mechanismus eliminace léčiva z organismu, významná pro klinickou praxi bude i otázka ekonomická. Na základě soudobých znalostí membránových receptorů lze rovněž usuzovat, že dlouhodobá aktivace receptorů může vést k jejich desenzitizaci a down-regulaci, a v konečném důsledku tedy k toleranci na léčbu. K zodpovězení těchto otázek budou nutné ještě další preklinické, klinické i postmarketingové studie.
Příkladem dimerického peptidu se schopností stimulovat erytropoézu je přípravek vyvíjený firmou Affymax, který se v současné době nachází ve druhé fázi klinických studií. Má unikátní sekvenci aminokyselin lišící se od humánního erytropoetinu, s předpokladem nízké imunogenity a dlouhého biologického poločasu [58–60]. Dosavadní klinické studie naznačují, že jedna dávka měsíčně způsobuje signifikantní a dlouhodobý vzestup hladin hemoglobinu a že se jedná o látku bezpečnou a dobře tolerovanou; na trhu by se mohla objevit v roce 2010 [61].
Kromě uvedených poznámek je na tomto místě nutno připomenout, že endogenní erytropoetin vykazuje pleiotropní potenciál, který nesouvisí se zvyšováním hladin hemoglobinu; erytropoetin je hlavním regulátorem formování cév a orgánů u embryí, chrání neurony proti ischemickému poškození a má přímý účinek na endoteliální buňky [62]. Tyto účinky, projevující se zlepšením funkcí myokardu, ledvin, buněk CNS, jsou vlastní endogennímu erytropoetinu a některé byly popsány i pro darbepoetin [63]; je otázkou dalšího výzkumu, zda budou tyto vlastnosti nalezeny i u nově vyvíjených molekul typu CERA či u dimerických peptidů.
Další možnosti regulace tvorby červených krvinek
Pro úplnost zde zmíníme i nejnovější trendy v zásahu do erytrogeneze, které jsou v současnosti ve fázi preklinických pokusů. Prvním příkladem je využití potenciálu genové terapie pro ektopickou syntézu erytropoetinu. V experimentech na myších bylo dosaženo úspěšné syntézy erytropoetinu buňkami kosterních svalů a následného uvolnění erytropoetinu do cirkulace [65]. Výhodou takovéhoto přístupu by byla jednorázová léčba, ovšem nezodpovězeny zůstávají kromě jiného otázky zpětnovazebné regulace ektopické syntézy. Z tohoto důvodu i s ohledem na další problémy provázející techniky genové terapie nelze očekávat, že by se tento přístup objevil v klinické praxi v nejbližších letech. Realističtější možností je zásah do syntézy erytropoetinu na úrovni HIF-1 [66, 67]. Firma FibroGen pracuje na vývoji tzv. inhibitorů prolylhydroxylázy, které snižují degradaci HIF-1 a následně zvyšují syntézu erytropoetinu (viz obr. 3). Zjevnou výhodou tohoto přístupu je fakt, že by se jednalo o nízkomolekulární látky, u kterých lze očekávat nižší cenu a hlavně možnost perorálního podávání. Kromě toho, zásah do stabilizace HIF-1 má vyšší účinnost než erytropoetin, protože je stimulována kompletní erytropoéza, včetně mobilizace železa a suprese negativního vlivu cytokinů [61]. Na druhou stranu, problémy lze předvídat v nespecifitě účinku, neboť HIF-1 není striktně transkripčním faktorem pro erytropoetin, ale pro celou škálu dalších proteinů (lékových transportérů, biotransformačních enzymů apod.) a zásah do jeho syntézy se může projevit i v dalších oblastech lidské fyziologie či lékových interakcí.
Seznam použité literatury
- [1] Ebben JP, Gilbertson DT, Foley RN, et al. Hemoglobin level variability: associations with comorbidity, intercurrent events, and hospitalizations. Clin J Am Soc Nephrol 2006; 1: 1205–1210.
- [2] Krantz SB. Erythropoietin. Blood 1991; 77: 419–434.
- [3] Boyer SH, Bishop TR, Rogers OC, et al. Roles of erythropoietin, insulin-like growth factor 1, and unidentified serum factors in promoting maturation of purified murine erythroid colony-forming units. Blood 1992; 80: 2503–2512.
- [4] Koury MJ, Bondurant MC. Erythropoietin retards DNA breakdown and prevents programmed death in erythroid progenitor cells. Science 1990; 248: 378–381.
- [5] Jelkmann W. Recombinant erythropoietins – the role of glycosylation in receptor binding, action and degradation. Busines Briefing: European Kidney and Urological Disease 2006; 1–5.
- [6] Lin FK, Suggs S, Lin CH, et al. Cloning and expression of the human erythropoietin gene. Proc Natl Acad Sci U S A 1985; 82: 7580–7584.
- [7] Varlotto J, Stevenson MA. Anemia, tumor hypoxemia, and the cancer patient. Int J Radiat Oncol Biol Phys 2005; 63: 25–36.
- [8] Henry DH, Bowers P, Romano MT, et al. Epoetin alfa. Clinical evolution of a pleiotropic cytokine. Arch Intern Med 2004; 164: 262–276.
- [9] Jelkmann W, Wagner K. Beneficial and ominous aspects of the pleiotropic action of erythropoietin. Ann Hematol 2004; 83: 673–686.
- [10] Li F, Chong ZZ, Maiese K. Erythropoietin on a tightrope: balancing neuronal and vascular protection between intrinsic and extrinsic pathways. Neurosignals 2004; 13: 265–289.
- [11] Maiese K, Li F, Chong ZZ. Erythropoietin in the brain: can the promise to protect be fulfilled? Trends Pharmacol Sci 2004; 25: 577–583.
- [12] Casadevall N. What is antibody-mediated pure red cell aplasia (PRCA)? Nephrol Dial Transplant 2005; 20 (Suppl. 4): 3–8.
- [13] Fishbane S, Berns JS. Hemoglobin cycling in hemodialysis patients treated with recombinant human erythropoietin. Kidney Int 2005; 68: 1337–1343.
- [14] Campos SM, Duh MS, Lefebvre P, et al. Benefits associated with an early hemoglobin response to epoetin alfa therapy in the treatment of chemotherapy-related anemia. J Natl Compr Canc Netw 2005; 3: 807–816.
- [15] Ishani A, Guo H, Gilbertson DT, et al. Time to target haemoglobin concentration (11 g/dl) risk of hospitalization and mortality among incident dialysis patients. Nephrol Dial Transplant 2007; 22: 2247–2255.
- [16] Steensma DP. Erythropoiesis stimulating agents. Bmj 2007; 334: 648–649.
- [17] Law ML, Cai GY, Lin FK, et al. Chromosomal assignment of the human erythropoietin gene and its DNA polymorphism. Proc Natl Acad Sci U S A 1986; 83: 6920–6924.
- [18] Davis JM, Arakawa T, Strickland TW, et al. Characterization of recombinant human erythropoietin produced in Chinese hamster ovary cells. Biochemistry 1987; 26: 2633–2638.
- [19] Egrie JC, Strickland TW, Lane J, et al. Characterization and biological effects of recombinant human erythropoietin. Immunobiology 1986; 172: 213–224.
- [20] Browne JK, Cohen AM, Egrie JC, et al. Erythropoietin: gene cloning, protein structure, and biological properties. Cold Spring Harb Symp Quant Biol 1986; 51 Pt 1: 693–702.
- [21] Jelkmann W. The enigma of the metabolic fate of circulating erythropoietin (Epo) in view of the pharmacokinetics of the recombinant drugs rhEpo and NESP. Eur J Haematol 2002; 69: 265–274.
- [22] Bachmann S, Le Hir M, Eckardt KU. Co-localization of erythropoietin mRNA and ecto-5“-nucleotidase immunoreactivity in peritubular cells of rat renal cortex indicates that fibroblasts produce erythropoietin. J Histochem Cytochem 1993; 41: 335–41.
- [23] Maxwell PH, Osmond MK, Pugh CW, et al. Identification of the renal erythropoietin-producing cells using transgenic mice. Kidney Int 1993; 44: 1149–1162.
- [24] Maxwell PH, Ferguson DJ, Nicholls LG, et al. Sites of erythropoietin production. Kidney Int 1997; 51: 393–401.
- [25] Koury ST, Koury MJ, Bondurant MC, et al. Quantitation of erythropoietin-producing cells in kidneys of mice by in situ hybridization: correlation with hematocrit, renal erythropoietin mRNA, and serum erythropoietin concentration. Blood 1989;74: 645–651.
- [26] Semenza GL. HIF-1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol 2001; 13: 167–171.
- [27] Ivan M, Haberberger T, Gervasi DC, et al. Biochemical purification and pharmacological inhibition of a mammalian prolyl hydroxylase acting on hypoxia-inducible factor. Proc Natl Acad Sci U S A 2002; 99: 13 459–13 464.
- [28] Huang LE, Gu J, Schau M, et al. Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci U S A 1998; 95: 7987–7992.
- [29] Salceda S, Caro J. Hypoxia-inducible factor 1al-pha (HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions. Its stabilization by hypoxia depends on redox-induced changes. J Biol Chem 1997; 272: 22 642–22 647.
- [30] D“Andrea AD, Zon LI. Erythropoietin receptor. Subunit structure and activation. J Clin Invest 1990; 86: 681–867.
- [31] Youssoufian H, Longmore G, Neumann D, et al. Structure, function, and activation of the erythropoietin receptor. Blood 1993; 81: 2223–2236.
- [32] Jelkmann W. Molecular biology of erythropoietin. Intern Med 2004; 43: 649–659.
- [33] Liu KD, Gaffen SL, Goldsmith MA. JAK/STAT signaling by cytokine receptors. Curr Opin Immunol 1998; 10: 271–278.
- [34] Steinberg SE, Garcia JF, Matzke GR, et al. Erythropoietin kinetics in rats: generation and clearance. Blood 1986; 67: 646–649.
- [35] Widness JA, Veng-Pedersen P, Schmidt RL, et al. In vivo 125I-erythropoietin pharmacokinetics are unchanged after anesthesia, nephrectomy and hepatectomy in sheep. J Pharmacol Exp Ther 1996; 279: 1205–1210.
- [36] Mladenovic J, Eschbach JW, Koup JR, et al. Erythropoietin kinetics in normal and uremic sheep. J Lab Clin Med 1985; 105: 659–663.
- [37] Walrafen P, Verdier F, Kadri Z, et al. Both proteasomes and lysosomes degrade the activated erythropoietin receptor. Blood 2005;105: 600–608.
- [38] Gross AW, Lodish HF. Cellular trafficking and degradation of erythropoietin and novel erythropoiesis stimulating protein (NESP). J Biol Chem 2006; 281: 2024–2032.
- [39] Dordal MS, Wang FF, Goldwasser E. The role of carbohydrate in erythropoietin action. Endocrinology 1985; 116: 2293–2299.
- [40] Egrie JC, Browne JK. Development and characterization of novel erythropoiesis stimulating protein (NESP). Br J Cancer 2001; 84 (Suppl. 1): 3–10.
- [41] Skibeli V, Nissen-Lie G, Torjesen P. Sugar profiling proves that human serum erythropoietin differs from recombinant human erythropoietin. Blood 2001; 98: 3626–3634.
- [42] Sasaki H, Bothner B, Dell A, et al. Carbohydrate structure of erythropoietin expressed in Chinese hamster ovary cells by a human erythropoietin cDNA. J Biol Chem 1987; 262: 12 059–12 076.
- [43] Combe C, Tredree RL, Schellekens H. Biosimilar epoetins: an analysis based on recently implemented European medicines evaluation agency guidelines on comparability of biopharmaceutical proteins. Pharmacotherapy 2005; 25: 954–962.
- [44] Powell J, Gurk-Turner C. Darbepoetin alfa (Ara-nesp). Proc (Bayl Univ Med Cent) 2002; 15: 332–335.
- [45] Sytkowski AJ, Lunn ED, Davis KL, et al. Human erythropoietin dimers with markedly enhanced in vivo activity. Proc Natl Acad Sci U S A 1998; 95: 1184–1188.
- [46] Elliott S, Lorenzini T, Asher S, et al. Enhancement of therapeutic protein in vivo activities through glycoengineering. Nat Biotechnol 2003; 21: 414–421.
- [47] Mehvar R. Modulation of the pharmacokinetics and pharmacodynamics of proteins by polyethy-lene glycol conjugation. J Pharm Pharm Sci 2000; 3: 125–136.
- [48] Provenzano R, Bhaduri S, Singh AK. Extended epoetin alfa dosing as maintenance treatment for the anemia of chronic kidney disease: the PROMPT study. Clin Nephrol 2005; 64: 113–123.
- [49] Storring PL, Gaines Das RE. The International Standard for Recombinant DNA-derived Erythropoietin: collaborative study of four recombinant DNA-derived erythropoietins and two highly purified human urinary erythropoietins. J Endocrinol 1992; 134: 459–484.
- [50] Shalansky K, Jastrzebski J. Complete switch to darbepoetin in a hemodialysis unit. Clin Nephrol 2005; 64: 55–63.
- [51] Martin-Holohan A, Curtis K, Masterson P, et al. Conversion of Chronic Hemodialysis Patients from Erythropoetin Alfa to Darbepoetin Alfa. Hosp Pharm 2004; 39: 333–337.
- [52] Morreale A, Plowman B, DeLattre M, et al. Clinical and economic comparison of epoetin alfa and darbepoetin alfa. Curr Med Res Opin 2004; 20: 381–395.
- [53] Papatheofanis FJ, McKenzie RS, Mody SH, et al. Dosing patterns, hematologic outcomes, and costs of erythropoietic agents in predialysis chronic kidney disease patients with anemia. Curr Med Res Opin 2006; 22: 837–842.
- [54] Cremieux PY, Van Audenrode M, Lefebvre P. The relative dosing of epoetin alfa and darbepoetin alfa in chronic kidney disease. Curr Med Res Opin 2006; 22: 2329–2336.
- [55] Wish JB. The economic realities of erythropoesis-stimulating agent therapy in kidney disease. Kidney Int 2006; 70: S21–S25.
- [56] Pussell BA, Walker R. Australian haemodialysis patients on intravenous epoetin alfa or intravenous darbepoetin alfa: how do they compare? Nephrology (Carlton) 2007;12: 126–129.
- [57] Macdougall IC. CERA (Continuous Erythropoietin Receptor Activator): a new erythropoiesis-stimulating agent for the treatment of anemia. Curr Hematol Rep 2005; 4: 436–440.
- [58] Stead RB, Lambert J, Wessels D, et al. Evaluation of the safety and pharmacodynamics of Hematide, a novel erythropoietic agent, in a phase 1, double-blind, placebo-controlled, dose-escalation study in healthy volunteers. Blood 2006; 108: 1830–1834.
- [59] Fan Q, Leuther KK, Holmes CP, et al. Preclinical evaluation of Hematide, a novel erythropoiesis stimulating agent, for the treatment of anemia. Exp Hematol 2006; 34: 1303–1311.
- [60] Woodburn KW, Fan Q, Winslow S, et al. Hematide is immunologically distinct from erythropoietin and corrects anemia induced by anti-erythropoietin antibodies in a rat pure red cell aplasia model. Exp Hematol 2007; 35: 1201–1208.
- [61] Melnikova I. Anaemia therapies. Nat Rev Drug Discov 2006; 5: 627–628.
- [62] Bahlmann FH, de Groot K, Haller H, et al. Erythropoietin: is it more than correcting anaemia? Nephrol Dial Transplant 2004; 19: 20–22.
- [63] Bahlmann FH, Song R, Boehm SM, et al. Low-dose therapy with the long-acting erythropoietin analogue darbepoetin alpha persistently activates endothelial Akt and attenuates progressive organ failure. Circulation 2004; 110: 1006–1012.
- [64] Macdougall IC, Robson R, Opatrna S, et al. Pharmacokinetics and pharmacodynamics of intravenous and subcutaneous continuous erythropoietin receptor activator (C.E.R.A.) in patients with chronic kidney disease. Clin J Am Soc Nephrol 2006; 1: 1211–1215.
- [65] Tripathy SK, Svensson EC, Black HB, et al. Long-term expression of erythropoietin in the systemic circulation of mice after intramuscular injection of a plasmid DNA vector. Proc Natl Acad Sci U S A 1996; 93: 10876–10880.
- [66] Siddiq A, Aminova LR, Ratan RR. Hypoxia inducible factor prolyl 4-hydroxylase enzymes: center stage in the battle against hypoxia, metabolic compromise and oxidative stress. Neurochem Res 2007; 32: 931–946.
- [67] Hsieh MM, Linde NS, Wynter A, et al. HIF-prolyl hydroxylase inhibition results in endogenous erythropoietin induction, erythrocytosis, and fetal hemoglobin expression in rhesus macaques. Blood 2007; In Press.