Úvod
První nástin léčby protilátkami učinil již v 19. století Paul Ehrlich. Ale teprve až po objevu Köhlera a Milsteina, kteří jako první realizovali v roce 1975 myšlenku produkce monoklonálních protilátek pomocí
tzv. hybridomu (fúzní produkt myší mye
lo
mové buňky a imunizovaného B lymfocytu)
, se monoklonální protilátky s definovanou specificitou dostaly do běžné praxe [1]. Využívají se jednak v oblasti diagnostiky
nádorů, ale zejména v léčbě. Imunotera
pie monoklonálními protilátkami představuje
jeden z milníků medicíny konce 20. století.
Optimální antigen, proti kterému jsou monoklonální protilátky namířeny, by měl splňovat několik vlastností:
– �měl by být exprimován zejména na povrchu maligních buněk,
– �jeho exprese by měla být co nejvyšší a relativně konstantní,
– �měl by být dobře fixován a neměl by být secernován.
Skutečnost, že nejčastěji využívaný antigen CD20 splňuje jen některé z výše uvedených vlastností, potvrzuje fakt, že i antigen, který není naprosto ideální, může být z klinického hlediska výhodný. Mechanismus účinku monoklonálních protilátek závisí na několika faktorech: na antigenu, proti kterému jsou namířeny, zda jsou použity nekonjugované protilátky, nebo protilátky s navázaným radioizotopem či toxinem (tedy konjugované).
Monoklonální protilátky prošly zajímavým vývojem – od čistě myších (jejich nevýhodou byla tvorba protilátek proti myší komponentě – tzv. human anti mouse antibodies – HAMA), přes chimérické až po humanizované nebo čistě humánní. Původ protilátky poznáme podle generického názvu – chimérické (v názvu se poznají podle zakončení -ximab, např. rituximab), humanizované (se zakončením -zumab, např. alemtuzumab), nebo čistě humánní (se zakončením -mumab, např. ofatumumab). V následujícím textu budou jednotlivé protilátky rozděleny podle antigenu, proti kterému jsou namířeny.
Ve výzkumu jsou desítky monoklonálních protilátek proti různým antigenům. Z praktického hlediska budou podrobněji probrány ty, které jsou v současné době v rámci České republiky k dispozici (nebo se dá jejich uvedení na trh očekávat v blízké budoucnosti), ostatní budou zmíněny jen okrajově.
Protilátky anti-CD20
Transmembránový antigen CD20 se vyskytuje na pre-B lymfocytech a zralých B lymfocytech, na normálních i maligních B lymfocytech. Není přítomen na progeni
torových buňkách kostní dřeně, stejně jako
chybí na povrchu zralých plazmatických buněk. Jeho fyziologická funkce není dosud zcela jasná, pravděpodobně představuje kalciový kanál a podílí se na ovlivnění buněčného cyklu. Protilátky proti antigenu CD20 mají po navázání vliv na celou řadu signálních drah vedoucích k apoptóze buněk [2].
Rituximab
Rituximab je chimérická monoklonální protilátka, což znamená, že variabilní část, která zodpovídá za kontakt s antigenem
CD20, je myšího původu a zbytek proti
látky je lidského původu. Rituximab byl v roce
1997 historicky první monoklonální proti
látkou pro léčbu hematologických malignit
schválenou FDA, a to prvotně pro nemoc
né s relabovaným folikulárním nehodgkin
s
kým lymfomem (FL), v klasickém dávko
vání 375 mg/m2 jedenkrát týdně po 4 týdny. V současné době jeho indikace zahrnují většinu CD20 pozitivních lymfoidních malignit a indikace přesahují i do jiných oblastí medicíny, například u nemocných se systémovými onemocněními pojiva. Mechanis
mus účinku rituximabu zahrnuje cytotoxi
ci
tu závislou na komplementu (CDC – complement dependent cytotoxicity), na protilátkách (ADCC – antibody dependent cell-mediated cytotoxicity) a indukci apoptózy [3].
Rituximab v monoterapii představoval první indikaci použití této protilátky, a to na základě studií prokazujících jeho účinnost u relabujících folikulárních lymfomů [4]. Vzhledem k velmi slibné účinnosti a zejména minimální toxicitě rituximabu byly zahájeny další studie testující jak efekt rituximabu, tak další možnosti jeho podávání: optimální dávkování, účinnost při kombinaci s chemoterapií, stanovení optimálních
intervalů mezi podáními, ale i rychlost infuze.
Optimální dávkování rituximabu
Stanovení optimální dávky rituximabu neprobíhalo zcela klasicky jako u jiných léčivých látek. Zajímavostí je, že 375 mg/m2 nepředstavovalo dávku, která by limitovala toxicitu rituximabu (tedy tzv. dávku limitující toxicitu z fáze I studie), ale tato dávka byla stanovena na základě omezené dostupnosti léčiva pro první studii fáze II. Dá se tedy předpokládat, že i vyšší dávky rituximabu by byly tolerovány bez problémů, otázkou zůstává efektivita jejich zvyšování. Pouze několik studií zkoumalo
účinnost vyšších dávek rituximabu. Coiffi
er a kol. v malé randomizované studii porovnávali u nemocných s agresivními lymfomy 375 mg/m2 s 500 mg/m2 rituximabu a nezaznamenali rozdíl v účinnosti [5].
U nemocných s chronickou lymfatickou leukémií
(CLL) zkoumala O Brien se spolu
pra
covníky efektivitu dávek rituximabu eska
lovaných z klasického dávkování 375 mg/m2 až na hodnoty 2250 mg/m2 [6].
Tyto vyšší dávky sice prokazovaly
o něco vyšší účinnost bez nárůstu toxicity ritu
ximabu, ale další vývoj vede v léčbě
CLL
spíše k využití kombinace rituximabu
s chemoterapií, zejména purinovými analogy. Navíc nelze extrapolovat výsledky od nemocných s CLL na ostatní B lymfomy vzhledem k odlišnosti v expresi CD20 u těchto 2 jednotek (výrazně nižší exprese CD20 u CLL než u lymfomů).
Optimální interval, délka a rychlost podávání rituximabu
Původní schéma 4 týdenních dávek bylo následováno jen několika málo pilotními studiemi zkoušejícími podávání po dobu 6 nebo 8 týdnů – efektivita se zdála vyšší než při 4 dávkách, ale vzhledem k tomu, že množství dat potvrzujících tuto vyšší účinnost bylo nedostatečné, za standardní schéma monoterapie rituximabem se stále považují 4 dávky v týdenních intervalech [7]. Z farmakokinetických studií zkoumajících efektivitu rituximabu vyplývá, že nemocní, kteří si udržují vyšší a déle trvající hladiny tohoto léku, mají vyšší šanci odpovědět na tuto léčbu a nižší riziko relapsu onemocnění. Z tohoto konceptu vyplývá například udržovací léčba rituximabem nebo režimy, které zkoumají význam rychleji navozené vyšší hladiny rituximabu u nemocných s lymfomy pomocí aplikace několika dávek rituximabu během úvodního cyklu (tzv. rituximab-denzní imunochemoterapeutické režimy). Zatímco význam udržovací léčby rituximabem je z tohoto pohledu již například u relabujících FL prokázán, otázka tzv. rituximab-denzních kombinovaných režimů s chemoterapií je předmětem probíhajících studií. Z předběžných výsledků těchto studií vyplývá nutnost pečlivé podpůrné, zejména antibiotické terapie. Na druhou stranu, při dodržení těchto podmínek mohou určité podskupiny nemocných, zejména pacienti s vyšším rizikem dle prognostického indexu IPI (International Prognostic Index), mít prospěch z této léčby, která zajišťuje rychlej
ší navození terapeutických hladin rituxi
mabu.
Dosud nevyjasněnou otázkou je i celková možná délka podávání rituximabu. V běžné klinické praxi je dosud nejdéle podávána tato protilátka v rámci udržovací léčby u pacientů s relabujícími folikulárními lymfomy (1 dávka za 3 měsíce po dobu 2 let). Vzhledem k minimální toxicitě tohoto léčiva lze předpokládat bezpečné podávání i po dobu delší. V současné době probíhá SAKK (Swiss Group for Clinical Cancer Research), studie testující prodloužené podávání rituximabu až po dobu 5 let. K otázce toxicity dlouhodobého podávání se proto zatím nelze příliš jasně vyjádřit.
Optimální interval podávání rituximabu vyplývá z biologického poločasu, který je u této monoklonální protilátky asi1 týden. V prospektivní farmakokinetické studii Gordana a kol. bylo stanoveno 25 mg/ml jako minimální účinná hladina rituximabu, pod kterou by neměla jeho koncentrace v průběhu léčby klesnout, aby byla zachována dlouhodobá účinnost léku. Z výsledků studie vyplývá, že při intervalu podávání 1krát za 3 měsíce si většina pacientů udržela účinnou hladinu rituximabu, při zkrácení na 2 měsíce byla účinná koncentrace zaznamenána dokonce u všech testovaných nemocných [8].
Jak je tomu s rychlostí podávání rituxi
mabu? Asi u 50 % pacientů dochází během první infuze rituximabu k infuzní reakci, která je podmíněna pravděpodobně akutní lýzou cirkulujících B lymfoidních buněk s následným uvolněním celé řady cytokinů. Z tohoto důvodu je nezbytné
pomalé podávání rituximabu v rámci prv
ní infuze od dávky 50 mg/hod s následnou eskalací na maximální rychlost 400 mg/hod
při nekomplikovaném průběhu. Od dru
hého cyklu je již možno zahájit vyšší rychlostí (100 mg/hod). Autoři z Britské Kolumbie Sehn, Donaldson a kol. úspěšně testovali podávání rituximabu po nekomplikovaném prvním podání rychlou infuzí od 2. cyklu během 90 minut. Tento přístup se jeví jako prakticky dobře akceptovatelný, což přináší výraznou časovou úsporu při ambulantním podávání [9].
Rituximab v kombinaci s chemoterapií
Kombinace imunoterapie rituximabem s chemoterapií se již od začátku jevila jako velmi slibná. Důvodem je odlišný mechanismus působení imunoterapie a chemoterapie. Zpočátku nebylo zcela jasné, zda oba mechanismy mají aditivní, synergistický, nebo antagonistický účinek. Z tohoto důvodu bylo nutné provedení studií
in vitro,
které prokázaly aditivní a v některých případech dokonce potencující efekt (napří
klad kombinace rituximabu s kortikoste
roidy) [10]. Celá řada studií zkoumala, zda je optimální kombinace chemoterapie s rituximabem podávaná najednou, nebo podání samotné chemoterapie s následným podáním rituximabu. Přestože výsledky některých studií prokázaly podobnou účinnost obou přístupů, z praktického hlediska je doporučováno podávat rituximab současně ve stejný den s chemoterapií.
Rituximab u folikulárního lymfomu
U 166 relabujících nemocných s folikulárním lymfomem bylo při standardním týdenním dávkování 375 mg/m2 po 4 týdny dosaženo 48% léčebné odpovědi (včetně 6 % celkové remise) s mediánem doby do progrese 13 měsíců [4]. Účinnost byla
prokázána i při následné opakované léč
bě rituximabem ve stejné indikaci – medián
doby do progrese byl v rámci studie dokonce delší než při předchozí léčbě. V rámci léčby 1. linie u nemocných s FL bylo dosaženo v monoterapii (4 dávky v týdenním intervalu) ještě lepších výsledků – celková léčebná odpověď byla 73 % (26 % celko
vá remise) včetně 57 % molekulárních remi
sí v podskupině informativ
ních (tedy bcl-2/IgH pozitivních) nemocných [11]. Hlavní nevýhodou monoterapie rituximabem je relativně krátké trvání jeho účinku. Naopak výhodou je minimální toxicita a dobrá tolerance u většiny nemocných.
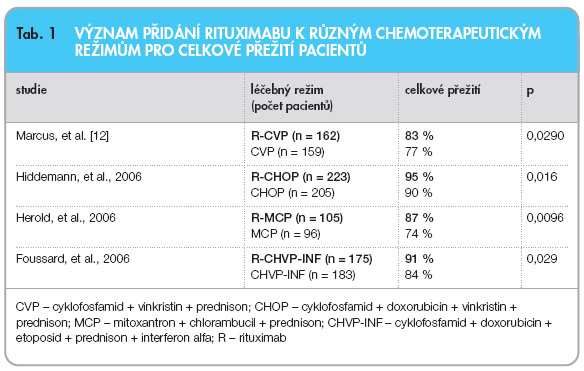
Z tohoto důvodu se pozornost celé řady studií počátkem 21. století upřela na průkaz efektivity kombinace chemoterapie s rituximabem již v rámci léčby 1. linie FL. Několik studií (
tab. 1
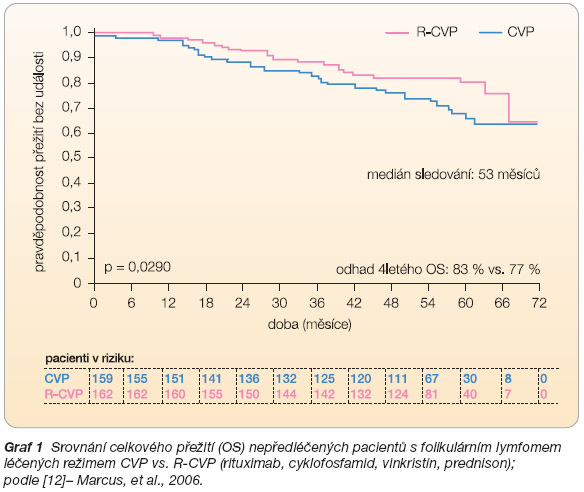
) prokázalo význam přidání rituximabu k chemoterapii, a to jak zvýšením procenta dosažených kompletních remisí, tak prodloužením doby do progrese, ale i prodloužením celkového přežití – tedy parametru, který je hlavním cílem většiny hematoonkologických studií. Historicky první studie randomizovala nemocné s pokročilým stadiem FL mezi režim CVP (cyklofosfamid, vinkristin, prednison) a R-CVP – tedy kombinaci chemoterapie s rituximabem. Procento dosažených celkových remisí bylo v rameni CVP 10 % vs. 41 % v rameni R-CVP (p < 0,0001), což se následně promítlo i v delší době do progrese ve větvi R-CVPi v delším celkovém přežití (
graf 1
) [12]. K obdobným závěrům dospěly i další 3 randomizované studie (
tab. 1
). Kombinace 8 dávek rituximabu a chemoterapie je tedy nezpochybnitelným standardem léčby 1. linie FL. Dosud není pouze jasné, kterou chemoterapii kombinovat s rituximabem. Z praktického hlediska je v našich podmínkách nejčastěji používaným reži
mem u pacientů v dobrém celkovém sta
vu R-CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednison), přestože neexistují randomizované studie prokazující jeho přínos oproti ostatním užívaným režimům imunochemoterapie – R-CVP, R-FCM (rituximab, fludarabin, cyklofosfamid, mitoxantron) nebo R-MCP (rituximab, mitoxantron, chlorambucil, prednison). Jednou z možných výhod antracyklinového režimu R-CHOP je popisované nižší riziko možné transformace FL do agresivního lymfomu. Režimy s fludarabinem vzhledem k nezanedbatelné toxicitě v 1. linii téměř nepoužíváme. Naopak u starších nemocných s limitující kardiální toxicitou lze s výhodou podávat režim bez antracyklinů, tedy například R-CVP.
Udržovací léčba rituximabem u FL
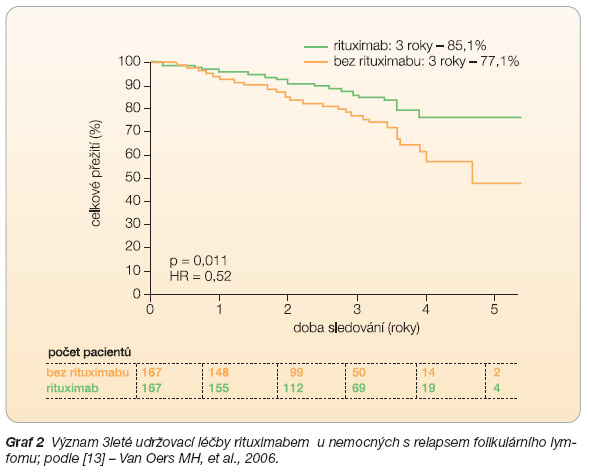
Koncept udržovací léčby je v případě indolentních lymfoproliferací velmi zajímavý. Folikulární lymfom je charakteristický ve svém pokročilém stadiu střídáním remisí choroby s relapsy, z tohoto pohledu se jeví udržování hodnot rituximabu na hladinách dostatečných k eliminaci reziduální aktivity lymfomu jako možné řešení při prevenci relapsu lymfomu. Studie EORTC (European Organisation for Research and Treatment of Cancer) hodnotila význam udržovací léčby rituximabem u nemocných s relapsem FL. Nemocní byli léčeni v době relapsu režimem CHOP
6
rituximab (1. randomizace). Následně byli ti, u kterých bylo touto léčbou dosaženo alespoň parciální remise, podruhé randomizováni mezi observaci a udržovací léčbu rituximabem ve standardní dávce 375 mg/m2 podávané v tříměsíčních intervalech po dobu 2 let (nebo do progrese). Medián doby do progrese se prodloužil udržovací léčbou rituximabem z 15 měsíců na 51,5 měsíce, což se promítlo do statisticky významně zlepšeného celkového přežití nemocných (
graf 2
). Tento pozitivní efekt byl sledován u všech podskupin nemocných, tedy jak u skupiny pacientů iniciálně léčených samotnou chemoterapií CHOP, tak u pacientů, kteří již absolvovali režim R-CHOP, a současně i v podskupině nemocných, kteří dosáhli celkové nebo parciální remi
se po úvodní terapii [13]. Na základě těch
to výsledků byla udržovací léčba rituximabem po 3 měsících po dobu 3 let u nemocných s relabujícím FL schválena od roku 2007 i v České republice.
Podobně nadějné výsledky se jeví i v rámci 1. linie léčby FL. Ve studii ECOG 1496 byli nemocní s FL po léčbě CVP randomizováni mezi observaci a udržovací terapii rituximabem (4 dávky 375 mg/m2 rituximabu podávané v 6měsíčních intervalech po dobu 2 let). Studie prokázala význam udržovací léčby rituximabem jak
v prodloužení doby do progrese (61 měsí
ců vs.15 měsíců), tak i v prodloužení celkového přežití [14]. Hlavním nedostatkem této studie je ale skutečnost, že nemocní dostávali v rámci léčby 1. linie pouze samotnou chemoterapii (studie byla zahájena před érou rituximabu v 1. linii), proto je nutno ověřit tyto nadějné výsledky i v době, kdy je standardem léčby 1. linie kombinace rituximabu s chemoterapií. Z tohoto hlediska jsou napjatě očekávány výsledky studie
PRIMA (nábor ukončen v roce 2007), kte
rá zkoumá význam udržovací léčby rituximabem po podání imunochemoterapie v rámci léčby 1. linie. Studie probíhá i na několika pracovištích v ČR a předběžné výsledky lze očekávat v následujících letech.
Rituximab u difuzního velkobuněčného B lymfomu
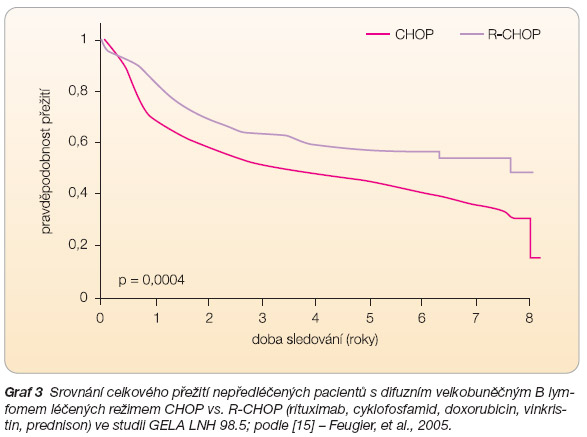
Difuzní velkobuněčný B lymfom (DLBCL) představuje v našich podmínkách nejčastější nehodgkinský lymfom. Po 25 let byl režim CHOP považován za standard léčby DLBCL. Historickým milníkem se pak ukázala studie francouzské skupiny GELA LNH 98.5, která randomizovala nemocné starší 60 let s DLBCL mezi 8 cyklů CHOP a 8 cyklů R-CHOP. Přidání rituximabu k chemoterapii CHOP vedlo k dosažení
statisticky vyššího procenta celkové remi
se, delší doby do progrese a současně i delšího celkového přežití nemocných (
graf 3
). Podle aktuálních publikací studie trvá význam přidání rituximabu i při mediánu sledování více než 5 let a týká se všech prognostických skupin pacientů dle IPI [15]. Obdobné pozitivní výsledky ve prospěch imunochemoterapie s rituximabem byly prezentovány i dalšími studijními skupinami. Ve studii MinT (MabThera International Trial), která randomizovala nemocné do 60 let věku s IPI
0
–1 (nízké riziko) mezi
6 cyklů CHOP a 6 cyklů R-CHOP, bylo
dosaženo opět obdobných výsledků ve prospěch skupiny nemocných léčených kombinací rituximabu a chemoterapie, a to včetně zlepšení celkového přežití v rámci této skupiny [16]. Význam přidání rituximabu k chemoterapii CHOP byl následně ověřen i v celé řadě retrospektivních analýz [17], a to i v rámci dat z registru české Kooperativní lymfomové skupiny [18].
V současné době tak zatím zůstává nevyřešena otázka optimální chemoterapie pro kombinaci s rituximabem – zda zvolit CHOP-21 v třítýdenních intervalech, nebo denzní režim CHOP-14, kdy je zvýšena dávková intenzita léčby zkrácením intervalu mezi cykly na 2 týdny (za použití růstového faktoru granulopoézy G-CSF). Aktuálně probíhají 2 velké randomizované studie porovnávající R-CHOP-14 vs. R
-CHOP-21 (v Německu a ve Velké Britá
nii), jejich výsledky zatím nejsou k dispozici.
Otázka udržovací léčby rituximabem u DLBCL je také velmi diskutovaným tématem. Některé studie prokazují možný přínos této léčby, většina z nich se ale uskutečnila v době před zavedením rituximabu, a proto jsme opět odkázáni na výsledky dosud probíhajících studií. V rámci léčby
1. linie probíhá studie NHL-13, která ran
domizuje nemocné s DLBCL po úspěšné indukční léčbě (randomizováni jsou jen pacienti v celkové remisi) mezi observaci a udržovací léčbu rituximabem podávanou ve 2měsíčních intervalech po dobu 2 let.
Na studii se podílí i několik center v rámci ČR.
Byl již ukončen příjem nemocných
s relapsem DLBCL do studie CORAL, kte
rá porovnává 2 různé záchranné léčebné režimy těchto pacientů – R-ICE (rituximab, ifosfamid, karboplatina, etoposid) a R-DHAP (rituximab, cisplatina, cytosinarabinosid, prednison). Pacienti, kteří reagují na tuto záchrannou terapii s dosažením minimálně parciální remise, jsou následně léčeni vysokodávkovou terapií s autologní transplantací kmenových buněk a následně jsou podruhé randomizováni mezi standardní sledování a udržovací terapii rituximabem po 2 měsících po dobu 1 roku. I zde zatím nebyly definitivní výsledky prezentovány.
Rituximab v léčbě pacientů s ostatními CD20 pozitivními lymfomy
Zatímco předmětem velkých randomizovaných studií jsou převážně pacienti s nejčastěji se vyskytujícími lymfomy (tedy DLBCL a FL), u ostatních lymfomů se zjištěnou CD20 pozitivitou jsme při prokazování efektivity rituximabu odkázáni na menší studie nebo metaanalýzy několika studií. Například u nemocných s lymfomem z plášťových buněk (mantle cell lymphoma, MCL) lze na základě subanalýzy větších studií pro nemocné s indolentními lymfomy prokázat benefit přidání rituximabu
k chemoterapii v rámci léčby 1. linie i léč
by relapsu. Studie německých autorů porovnávající chemoterapii CHOP a R-CHOP v léčbě 1. linie přinesla důkaz o statisticky významně vyšším procentu remisí dosa
žených v rameni R-CHOP, což se promít
lo v delší době do progrese i v delší době celkového přežití nemocných [19]. K obdobným závěrům dospěla i metaanalýza několika studií porovnávajících význam přidání rituximabu k chemoterapii [20]. Forstpoitnerová a spolupracovníci prokázali i význam udržovací terapie rituximabem u nemocných s relapsem MCL [21].
U dalších CD20 pozitivních lymfomů s nižší incidencí (lymfomy z buněk marginální zóny, MALT lymfomy, Burkittův lymfom atd.) neexistují velké randomizované studie a vzhledem k nízké incidenci nelze ani jejich vznik předpokládat. U těchto diagnóz máme k dispozici pouze extrapolaci
výsledků od diagnóz biologicky podob
ných (například DLBCL vs. Burkittův lymfom). I zde je podání rituximabu při prokázané CD20 pozitivitě jednoznačně indikováno. V rámci České republiky je u těchto menších diagnóz podání vázáno na kterékoliv z center intenzivní hematologické péče
(CIHP) – jedná se o VFN Praha, FN Krá
lovské Vinohrady, FN Plzeň, FN Brno, FN Olomouc a FN Hradec Králové.
Ofatumumab
Ofatumumab je čistě humánní IgG1 monoklonální protilátka anti-CD20. V současné době není v České republice dostupná pro běžné klinické podání, zatím probíhají klinické studie ověřující její účinnost u CD20 pozitivních lymfoproliferací (FL, CLL), a to i v rámci několika center v České republice. Zajímavostí je, že protilátka se váže na odlišný epitop než rituximab, což vysvětluje i odlišný mechanismus účinku. Proto tato protilátka vykazuje účinnost i u nemocných rezistentních k léčbě rituximabem. Některé testy uskutečněné
in vitro
ukazují na nadějné výsledky ofatumumabu – tyto závěry je ale nutno ověřit
v rámci randomizovaných klinických stu
dií.
Zatím v rámci studií fáze I/II byla prokázá
na účinnost u nemocných s relabujícími folikulárními lymfomy a B-CLL, další studie v 1. linii léčby probíhají.
Protilátky anti-CD20 s navázaným radionuklidem nebo toxinem
Radioimunoterapie je zajímavou možností léčby nemocných s lymfomy vzhledem ke kombinaci imunoterapie s lokálním ozářením i sousedních buněk (tzv. cross fire effect). Díky tomuto efektu jsou zničeny nejen nádorové buňky, na které se protilátka naváže, ale i buňky okolní, což je výhodné zejména u větších nádorových mas.
Ibritumomab tiuxetan
Yttrium 90 je čistý beta zářič s poločasem rozpadu 64 hodin. Ibritumomab je myší IgG1 anti-CD20 monoklonální protilátka, která je kovalentně navázána přes
chelátor tiuxetan k molekule yttria. Kom
binace lokálně působící radioterapie yttriem (střední dosah působení beta zářiče je cca 5,3 mm) s imunoterapií představuje slibnou kombinaci v boji proti B lymfoproliferativním onemocněním, má ale své omezení při použití. Efektivita ibritumomab tiuxetanu byla poprvé zkoušena v rámci studie fáze II u relabovaných indolentních
lymfomů. Léčebné odpovědi bylo dosaže
no
u 67 % s 26 % kompletních remisí; medián
trvání léčebné odpovědi byl 13 měsíců. Zajímavostí bylo, že ibritumomab tiuxetan byl efektivní i u skupiny nemocných rezistentních k léčbě rituximabem, kde dosahoval 74 % léčebných odpovědí s 15 % celkových remisí a dobou do progrese 6,8 měsíce [22]. Hlavní výhodou této radioimunoterapie je skutečnost, že léčba spočívá v podání jedné dávky léku, kterou lze aplikovat i ambulantně. Před podáním ibritumomab tiuxetanu je nemocnému aplikován rituximab v dávce 250 mg/m2 v den 1 a stejná dávka i v den 8; ta je poté následována podáním 0,4 mCi/kg ibritumomab tiuxetanu. Podmínkou léčby ibritumomab tiuxetanem je ale maximálně 25% postižení kostní dřeně lymfomovými buňkami a dobrá dřeňová rezerva (definovaná jako hodnoty trombocytů vyšší než 100 x 109/l). Ibritumomab tiuxetan proká
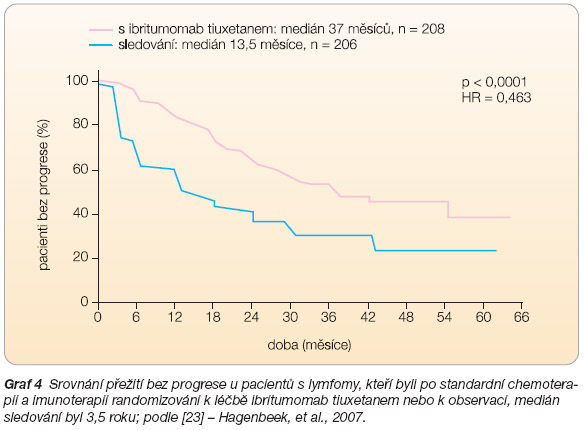
zal svoji účinnost i v léčbě 1. linie, a to
i v rámci konsolidace po úvodní léčbě chemoterapií a imunochemoterapií (studie FIT). Z výsledků této studie vyplývá, že u 77 % pacientů došlo po podání jedné dávky ibritumomab tiuxetanu ke konverzi z parciální remise do celkové remise. Nemocní, kteří byli léčeni konsolidační terapií ibritumomab tiuxetanem, měli medián doby do progrese 37 měsíců, zatímco ve skupině s observací byl jen 13,5 měsíce (p < 0,0001), viz
graf 4
. Hlavní nevýhodou studie je nízký počet nemocných, kteří byli léčeni v 1. linii nyní již standardní kombinací rituximabu a chemoterapie [23]. V České republice je v současné době možno podávat ibritumomab tiuxetan nemocným s relabujícím lymfomem nebo s rituximab refrakterním folikulárním lymfomem. Schválení konsolidační terapie ibritumomab tiuxetanem v 1. linii léčby je zatím předmětem jednání s pojišťovnami.
Tositumomab
Na rozdíl od ibritumomab tiuxetanu je radioizotop jódu 131I gama i beta zářič (s poločasem rozpadu 8 dní), což přináší některé praktické problémy s aplikací (nutnost podání na oddělení nukleární medicíny). Tositumomab prokázal svoji účinnost v léčbě relabujících folikulárních lymfomů, ale i v léčbě 1. linie. Ve studii u 66 nově diagnostikovaných nemocných stadia III a IV s FL léčených 1 dávkou tositumomabu bylo dosaženo 95% léčebné odpovědi včetně 75 % kompletních remisí. Medián doby do progrese byl 6,1 roku [24]. Výsledky této studie je ale nutné hodnotit obezřetně, neboť se jednalo vesměs o nemocné s malou nádorovou masou (podmínkou zařazení nemocných bylo maximálně 25% postižení kostní dřeně) – i tato selekce nemocných může být příčinou tak kvalitních výsledků. Tositumomab není bohužel v České republice dostupný.
Protilátka anti-CD52
Alemtuzumab, humanizovaná IgG1 monoklonální protilátka namířená proti antigenu CD52, který se nachází na povrchu B i T lymfocytů, byl dosud schválen FDA pro léčbu nemocných s chronickou lymfatickou leukémií. Podobně jako při léčbě ostatními monoklonálními protilátkami hrozí i v případě alemtuzumabu z klinického pohledu hlavní riziko infuzních reakcí při intravenózním podání. Tyto reakce, za které jsou zodpovědné uvolněné cytokiny při lýze nádorových buněk, zahrnují horečku, třesavku, vyrážku, eventuálně i hypotenzi. Riziko vzniku infuzních reakcí může snížit profylaktické podání premedikace antipyretiky a antihistaminiky. I z těchto důvodů se jeví alternativní subkutánní podání léku jako bezpečnější a lépe tolerované pacienty. Jelikož podání alemtuzumabu je provázeno těžkou imunosupresí T i B lymfocytů, která může způsobit vznik oportunních infekcí, je doporučováno profylaktické podávání virostatik a prevence
onemocnění
Pneumocystis jiroveci,
a to
po dobu léčby a následně ještě 3–6 měsíců po jejím ukončení, než dojde k rekonstituci imunitních funkcí. Nezbytností při léčbě alemtuzumabem je monitorování cytomegalovirových (CMV) infekcí, a to 1krát týdně. V případě prokázané CMV infekce nebo CMV onemocnění je třeba ihned zahájit virostatickou léčbu ganciklovirem nebo valganciklovirem.
Ukazuje se zajímavá indikace podání alemtuzumabu u nemocných s T lymfomy. Například u skupiny nemocných se Sézaryho syndromem bylo dosaženo 55% léčebné odpovědi s 32 % kompletních remisí [25]. U skupiny nemocných s periferními T lymfomy, blíže nespecifikovanými, bylo procento léčebných odpovědí nižší (36 %), přesto podání alemtuzumabu můžeme i zde zvážit v případě nemocných s chemorezistentním onemocněním [26]. I zde je nezbytností dodržení všech profylaktických opatření (monitorování CMV infekcí, profylaxe atd.). V budoucnosti se jeví jako zajímavá i možnost kombinace alemtuzumabu s chemoterapií. V současné době probíhá celá řada studií testujících tuto kombinaci u nemocných s T lymfomy.
Ostatní protilátky
V současnosti se zkouší v klinických studiích fáze I nebo II velké množství monoklonálních protilátek. Z celého rozsáhlého výčtu budou v následujícím textu jmenovány ty, které v současné nebo blízké době mohou být nabídnuty i našim pacientům v rámci klinických studií v České republice.
Protilátka anti-CD30
U zdravých jedinců je exprese antigenu CD30 omezena na aktivované B a T lymfocyty. CD30 je ale také exprimován na povrchu maligních RS buněk (Reedové-Sternberga) a Hodgkinových buněk a elementů anaplastického velkobuněčného lymfomu (ALCL). Chimérická protilátka SGN 30 je zkoušena u nemocných s relabujícím Hodgkinovým lymfomem a ALCL. Výsledky jsou zatím spíše rozpačité, studie ale zatím probíhají.
Protilátka anti-CD40
Antigen CD40 je vyjádřen na povrchu B lymfocytů, monocytů a dendritických i některých epiteliálních buněk. V současné době probíhají i v České republice studie s protilátkou SGN 40 (pro nemocné s relapsem DLBCL, a to v kombinaci s imunochemoterapií R-ICE).
Protilátka anti-CD22
Protilátky proti antigenu CD22 jsou k dispozici v nekonjugované, ale rovněž v konjugované formě (s toxinem). Nekonjugovaná humanizovaná protilátka anti-CD22, epratuzumab, prokázala ve studii fáze II 10% léčebnou odpověď s nejvyšší účinností u nemocných s DLBCL [27].
V rámci klinických studií je zkoušena i kombinace s chemoterapií (například CHOP). Zajímavější se jeví kombinace protilátky anti-CD22 s konjugovaným imunotoxinem. Inotuzumab ozogamicin vzniká konjugací anti-CD22 protilátky s kalicheamycinem, potentním protinádorovým antibiotikem. Výsledky léčby pacientů s B lymfomy se jeví jako velmi nadějné, ve studii fáze II bylo dosaženo až 75 % léčebných odpovědí [28]. V blízké době bude v České republice zahájena studie fáze III s touto molekulou, a sice u nemocných s relabujícím FL.
Protilátka anti-CD80
Antigen CD80 se nachází na povrchu B lymfocytů. Galiximab představuje chimérickou protilátku anti-CD80 s klinicky prokázanou velmi dobrou tolerancí a aktivitou u nemocných s relabujícími folikulárními lymfomy, zejména v kombinaci s rituximabem. V současné době probíhají klinické studie porovnávající rituximab s kombinací rituximab + galiximab, a to i v České republice.
Protilátka proti VEGF
Vaskulární endoteliální růstový faktor
(VEGF) představuje důležitý promotor
angiogeneze. Zvýšená angiogeneze byla pozorována u celé řady hematologických malignit, včetně lymfomů (zejména agre
sivních – DLBCL). Bevacizumab, mono
klonální protilátka proti VEGF, prokázal efektivitu v rámci studie fáze II u nemocných s DLBCL [29]. Slibné výsledky byly zaznamenány i při kombinaci s chemoterapií R-CHOP. V současné době probíhá velká randomizovaná zaslepená studie porovnávající standardní léčbu nemocných s DLBCL, tedy R-CHOP, se stejným režimem s přidaným bevacizumabem. Studie byla zahájena v roce 2007, účastní se jí i pacienti z České republiky, její výsledky ale nelze očekávat dříve než v roce 2011.
Závěr
Monoklonální protilátky představují obrovský pokrok v hematologii, neboť pozitivně ovlivnily osud celé řady pacientů s lymfoidními malignitami.
V současné době jsou v běžné klinické praxi v České republice pro léčbu maligních lymfomů k dispozici jen 3 zástupci – rituximab, alemtuzumab a ibritumomab tiuxetan. Probíhá zde však celá řada klinických studií s novými protilátkami (ofatumumab, SGN 40, bevacizumab, galiximab atd.), což přináší i pro české pacienty možnost léčby nejmodernějšími preparáty.
Vyjmenovaný seznam zdaleka neobsahuje všechny protilátky, které jsou v současné době zkoušeny – výzkum v této oblasti jde vpřed mílovými kroky a neustále se objevují nové a nové monoklonální protilátky, ať již nekonjugované nebo s navázaným radioizotopem či toxinem. V této rychle se rozrůstající řadě molekul bude klíčovým faktorem nalezení optimálního místa pro jejich použití v monoterapii, v kombinaci s klasickou chemoterapií, nebo v udržovací léčbě. U některých indikací (DLBCL, FL) je jejich postavení již naprosto nezpochybnitelné, u dalších zatím s netrpělivostí čekáme na výsledky probíhajících klinických studií. Nová generace protilátek anti-CD20 nabízí zatím hlavní možnosti využití u pacientů refrakterních na léčbu rituximabem, ostatní monoklonální protilátky namířené proti jiným B-lymfocytárním znakům představují možnost kombinace s rituximabem. Velký potenciál mají i protilátky s navázaným radioizotopem či toxinem. Každopádně obrovský vývoj, který lze zaznamenat v posledních letech v této oblasti, by měl mít hlavní motto – a tím je další zlepšování výsledků léčby nemocných s maligními lymfomy.
Tato práce byla podpořena grantem IGA MZ ČR NR/9453-3 a výzkumným záměrem MZO 00179906.




