Možnosti farmakoterapie u pacientů s karcinomem žaludku
Karcinom žaludku je významným zdravotním problémem v mnoha zemích světa, včetně těch nejvyspělejších. Jeho systémová léčba je stále relativně neúspěšná. V posledních letech bylo zkoumáno mnoho léčiv, ale pouze některá prokázala efektivitu a uplatnila se v klinické praxi. Stále probíhá další hledání účinných látek, které by léčbu karcinomu žaludku posunuly kupředu. V současnosti je stále léčbou volby chemoterapie, v poslední době jsou nová cytostatika do léčebných schémat zařazována spíše kvůli lepšímu bezpečnostnímu profilu než kvůli účinnosti. Nová léčiva umožňující zejména cílenou léčbu a imunoterapii představují směr, jímž se bude systémová léčba karcinomu žaludku v budoucnu pravděpodobně ubírat.
Úvod
Karcinom žaludku zaujímá přibližně prostřední příčku na žebříčku výskytu solidních nádorů v České republice. Za posledních třicet let klesla incidence karcinomu žaludku na polovinu, ale výskyt adenokarcinomů v oblasti kardie a gastroezofageální junkce (GEJ) narůstá, zejména u pacientů mladších 40 let. Mezi země s nejvyšší incidencí tohoto onemocnění patří asijské státy: Jižní Korea, Mongolsko, Japonsko a Čína (přepočet na světový standard ASR-W – age-standardized rate – World), přičemž nejvyšší absolutní incidenci na 100 tisíc obyvatel má Japonsko, kde se toto onemocnění oproti České republice vyskytuje více než 5krát častěji. Ve srovnání se západními zeměmi je však v Japonsku díky zavedenému screeningovému programu téměř dvojnásobné procento záchytu časných stadií. V našich podmínkách je většina onemocnění (v roce 2010 asi 64 %) diagnostikována v pokročilém inoperabilním stadiu (III a IV) [1].
Celosvětově je karcinom žaludku významným problémem s incidencí více než 800 tisíc případů za rok a je druhou nejčastější příčinou úmrtí na rakovinu [2].Rizikovými faktory pro vznik karcinomu žaludku jsou kouření, infekce Helicobacter pylori (HP) nebo virem Epsteina-Barrové, nevhodná dieta, obezita, alkoholismus, zánětlivá a některá jiná chronická onemocnění žaludku, vzácně genetické pozadí (maximálně 3 % případů) [3, 4].
Naopak mezi protektivní faktory patří odstranění infekce HP, vhodná strava s vysokým obsahem syrové zeleniny a ovoce či antioxidanty a vitaminy A, C a E.Karcinom žaludku časně metastazuje do regionálních lymfatických uzlin, jater, skeletu, břišní dutiny, plic a mozku. Ložiska bývají mnohočetná, což znemožňuje efektivní použití regionálních léčebných metod.K trvalému vyléčení vede pouze kompletní chirurgické odstranění nádoru. Inoperabilní nádory jsou nevyléčitelné a jejich prognóza je špatná, medián přežití (overall survival, OS) s pokročilým či metastatickým onemocněním je ve studiích podle použité léčby a dalších parametrů 8–12 měsíců, u cílené léčby až 16 měsíců.
Karcinomy žaludku, zejména adenokarcinom, který tvoří 95 % z celkového počtu nádorů žaludku, nepatří mezi chemosenzitivní onemocnění; dobře volenou paliativní systémovou léčbou inoperabilního onemocnění ovšem lze u pacientů v dobrém klinickém stavu prodloužit přežití a zlepšit kvalitu života. Přínos léčby pro pacienta je nutné posuzovat individuálně právě podle jeho výkonnostního stavu a komorbidit.
Současné možnosti farmakoterapie
Platinové deriváty, fluoropyrimidiny, antracykliny, taxany, irinotekan a etoposid jsou přípravky s prokázanou účinností v terapii karcinomu žaludku, které jsou běžně dostupné a rutinně se používají.Obecné principy se stále vyvíjejí, podle doporučení National Comprehensive Cancer Network (NCCN) a České onkologické společnosti (ČOS) zahrnují tato pravidla:
- chemoterapeutické režimy doporučené pro terapii pokročilého dlaždicobuněčného karcinomu jícnu, adenokarcinomu jícnu, GEJ a žaludku jsou až na výjimky zaměnitelné;
- výběr režimu závisí na výkonnostním stavu pacienta, komorbiditách, profilu toxicity přípravků a expresi HER-2 (human epidermal growth factor receptor 2) v tumoru (u adenokarcinomu žaludku);
- vzhledem k nižší toxicitě je preferován režim s dvojkombinací cytostatik před trojkombinací: trojkombinace zůstává vyhrazena pro pacienty v dobrém klinickém stavu a s možností častějšího sledování;
- je přípustná modifikace doporučených režimů s nejvyšší kategorií průkaznosti (kategorie 1) či použití režimů v nižší kategorii průkaznosti (kategorie 2A a 2B), poněvadž existují data poukazující na lepší profil toxicity bez snížení účinnosti;
- jsou povoleny alternativní kombinace a schémata založená na dostupnosti účinných látek, na praktických zvyklostech a kontraindikacích;
- infuzní 5-fluorouracil (5-FU), oproti bolusovému podání, a kapecitabin jsou zaměnitelné;
- cisplatina a oxaliplatina mohou být zaměňovány s ohledem na profil toxicity [5].
U pacientů s lokalizovaným potenciálně resekabilním onemocněním se s cílem zvýšit podíl radikálních resekcí úspěšně používá perioperační chemoterapie ECF nebo ECX (epirubicin, cisplatina, 5-FU nebo kapecitabin), u nemocných s adenokarcinomem GEJ je nyní preferována předoperační chemoradioterapie. Účinnost chemoterapie cisplatinou v kombinaci s 5-FU byla prokázána výsledky tří randomizovaných studií fáze III (MAGIC, EORTC 40954, ACCORD). Výše uvedená perioperační chemoterapie nebo adjuvantní chemoradioterapie s 5-FU a leukovorinem je doporučována v případě resekce časného nádoru žaludku s rizikovými faktory (nízce diferencované karcinomy nebo nádory s vyšším stupněm, lymfovaskulární invaze, perineurální invaze, věk pod 50 let), rovněž také u pokročilého nádoru s postižením nebo bez postižení regionálních lymfatických uzlin. Studie Intergroup INT0116 update prokázala po 10 letech zlepšení OS (hazard ratio – HR = 1,32) a DFS (disease free survival; HR = 1,51) [6].
Po radikální resekci včetně D2 lymfadenektomie je doporučována adjuvantní chemoradioterapie (studie fáze III ARTIST: kapecitabin v kombinaci s cisplatinou plus radioterapie) [7] nebo lze použít adjuvantní chemoterapii, a to kombinaci oxaliplatiny s kapecitabinem – režim XELOX (studie fáze III CLASSIC: XELOX vs. sledování; tříleté DFS 74 % vs. 59 %, p < 0,0001) [8].
Paliativní chemoterapie hraje zásadní roli v léčbě pokročilého a metastatického karcinomu žaludku. Monoterapie nemá vliv na přežití. Dvojkombinace léčiv přežití prodlužuje, což bylo potvrzeno metaanalýzou řady klinických studií; ve srovnání s podpůrnou léčbou (best supportive care, BSC) byla doba přežití delší o 6 měsíců (HR = 0,39; 95% konfidenční interval – CI: 0,28–0,52), a došlo i ke zlepšení kvality života spolu s lepší kontrolou symptomů [9].
Přestože v klinických studiích byla testována celá řada chemoterapeutických režimů, dosud neexistuje mezinárodně akceptovaný standard péče. V Evropě a USA jsou nejčastěji používány léčebné režimy založené na kombinaci fluoropyrimidinu a platinového derivátu s případným přidáním taxanu či antracyklinu. Ve druhé linii léčby lze použít irinotekan, případně paklitaxel nebo docetaxel u pacientů, kteří nebyli předléčeni taxanem [10, 11]. Stále se hledají nové léčebné metody s přijatelným profilem toxicity, které by pozitivně ovlivnily nepříznivou prognózu pacientů s tímto závažným onemocněním [12].
Novin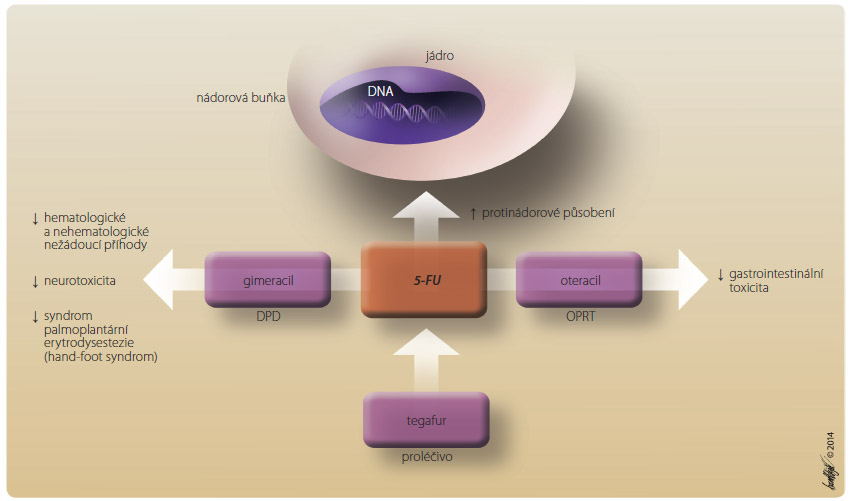 kou na trhu, nyní plně dostupnou v klinické praxi, je perorální fluoropyrimidin čtvrté generace S-1. Jedná se o fixní kombinaci tří účinných látek: tegafuru, gimeracilu a oteracilu. Mechanismus působení tohoto tripletu znázorňuje obr. 1. Tegafur je po absorpci konvertován na protinádorově působící 5-FU. Gimeracil je inhibitor dihydropyrimidin dehydrogenázy (DPD), určený k prevenci degradace 5-FU v těle. Oteracil je inhibitor orotátfosforibosyltransferázy, který snižuje účinnost působení 5-FU v normální gastrointestinální sliznici. Ve studii fáze III neprokázal tento triplet ve srovnání s kombinací cisplatina s infuzním 5-FU zlepšení OS, ale vedl k významně nižšímu výskytu nežádoucích účinků (neutropenie stupně 3–4, stomatitidy, hypokalemie a úmrtí v souvislosti s léčbou) [13].Trastuzumab v kombinaci s kapecitabinem nebo 5-FU a cisplatinou je indikován a hrazen pojišťovnou v léčbě pacientů s HER2-pozitivním metastatickým adenokarcinomem žaludku nebo gastroezofageálního spojení, kteří nebyli léčeni předchozí chemoterapií.
kou na trhu, nyní plně dostupnou v klinické praxi, je perorální fluoropyrimidin čtvrté generace S-1. Jedná se o fixní kombinaci tří účinných látek: tegafuru, gimeracilu a oteracilu. Mechanismus působení tohoto tripletu znázorňuje obr. 1. Tegafur je po absorpci konvertován na protinádorově působící 5-FU. Gimeracil je inhibitor dihydropyrimidin dehydrogenázy (DPD), určený k prevenci degradace 5-FU v těle. Oteracil je inhibitor orotátfosforibosyltransferázy, který snižuje účinnost působení 5-FU v normální gastrointestinální sliznici. Ve studii fáze III neprokázal tento triplet ve srovnání s kombinací cisplatina s infuzním 5-FU zlepšení OS, ale vedl k významně nižšímu výskytu nežádoucích účinků (neutropenie stupně 3–4, stomatitidy, hypokalemie a úmrtí v souvislosti s léčbou) [13].Trastuzumab v kombinaci s kapecitabinem nebo 5-FU a cisplatinou je indikován a hrazen pojišťovnou v léčbě pacientů s HER2-pozitivním metastatickým adenokarcinomem žaludku nebo gastroezofageálního spojení, kteří nebyli léčeni předchozí chemoterapií.
Trastuzumab by měl být podáván pouze pacientům, jejichž nádory mají zvýšenou expresi HER2 prokázanou v referenční laboratoři. Podává se v nasycovací dávce 8 mg/kg a v pokračovací dávce 6 mg/kg každé tři týdny.
Použití trastuzumabu je registrováno na základě randomizované prospektivní studie fáze III ToGA, která srovnávala kombinace trastuzumab plus cisplatina/5-FU vs. cisplatina/5-FU.
V této studii s 594 HER2-pozitivními pacienty s lokálně pokročilým, rekurentním či metastatickým adenokarcinomem žaludku (80–83 %) nebo adenokarcinomem GEJ vedlo zařazení trastuzumabu do léčby k prodloužení OS na 13,8 měsíce oproti 11měsíčnímu přežití pacientů, kteří trastuzumab nedostávali [14]. Post-hoc podskupinová analýza prokázala ještě výraznější přínos léčby trastuzumabem z hlediska OS u pacientů s výraznou amplifikací HER-2, tj. IHC 2+/FISH+ (imunohistochemistry/fluorescence in situ hybridization) nebo IHC 3+ (medián OS: 16 vs. 11,8 měsíce) oproti pacientům s IHC 0 nebo 1+/FISH (medián OS 10 vs. 8,7 měsíce).
Blízká budoucnost
V současné době probíhá celá řada klinických studií s cílenou léčbou. Výsledky studií zaměřených na inhibici EGFR (epidermal growth factor receptor), VEGFR (vascular endothelial growth factor receptor) a m-TOR (mam-
malian target of rapamycin) nejsou dosud zcela uspokojivé. Je snaha zejména o identifikaci dalších prediktivních faktorů, které by umožnily správně vybrat pacienty pro účinnou terapii [15]. Uvádíme příklady některých klinických studií s pozitivními závěry.
Ve druhé linii léčby lokálně pokročilého a metastatického karcinomu žaludku po selhání chemoterapie s cisplatinou a/nebo fluoropyrimidinem prokázal účinnost ramucirumab, humánní IgG1 (imunoglobulin G1) monoklonální protilátka proti VEGFR-2. Jeho blokáda vedla ve studii fáze III REGARD k signifikantnímu prodloužení přežití ve srovnání s placebem za příznivého bezpečnostního profilu (medián OS 5,2 měsíce vs. 3,8 měsíce pro ramucirumab, HR = 0,483, 95% CI: 0,376–0,620; p < 0,0001; medián PFS 2,1 měsíce vs. 1,3 měsíce pro ramucirumab) [16].
V další studii fáze III RAINBOW prokázal ramucirumab ve stejné indikaci po selhání první linie chemoterapie prodloužení přežití také v kombinaci s paklitaxelem oproti paklitaxelu samotnému (medián OS 9,63 vs. 7,36 měsíce pro ramucirumab/paklitaxel). Neutropenie se vyskytla u 40,7 % pacientů ve větvi s ramucirumabem ve srovnání s 18,8 % ve větvi bez ramucirumabu; frekvence febrilní neutropenie byla srovnatelná v obou ramenech [17].
Probíhá studie fáze III, v níž je podávána monoklonální protilátka proti receptoru MET (mesenchymal epithelial transition factor) onartuzumab v kombinaci s chemoterapií FOLFOX-6 (5-FU plus kyselina listová plus oxaliplatina). Cílem blokády receptoru MET je překonat rezistenci nádorových buněk a metastatický potenciál zprostředkovaný právě pomocí signální dráhy HGF/MET (hepatocyte growth factor) [18].
Katumaxomab se používá v paliativní léčbě maligního ascitu. Je to trojfunkční potkaní-myší hybridní monoklonální protilátka specificky zaměřená proti adhezní molekule epitelových buněk (EpCAM) a antigenu CD3 po selhání standardní terapie. Pacienti musí být v relativně dobrém výkonnostním stavu. Katumaxomab se používá tam, kde je nutnost opakované punkce ascitu a kde je ascites refrakterní k chemoterapeutické léčbě; cílem léčby je především snížení počtu nutných punkcí ascitu.
Nemocné je třeba sledovat kvůli riziku případné hypersenzitivity, projevů syndromu systémové zánětlivé odpovědi a pro riziko dalších nežádoucích účinků (bolesti břicha, subileus, ileus, cytolytická hepatitida, hyperbilirubinemie, infekce, iontová dysbalance, anorexie, stomatitida, nauzea, vomitus, průjem, lymfopenie, anémie, leukocytóza, trombocytóza, astenie, bolesti hlavy, nespavost, rush, artralgie, myalgie, zimnice a třesavka atd.). Je doporučována premedikace antipyretiky. Dávka se postupně eskaluje, je třeba aplikovat nosný roztok k dobré distribuci po peritoneální dutině a tuto tekutinu je před další punkcí vždy třeba odsát.
Výrazná ekonomická náročnost v porovnání s cílem této léčby, který směřuje k redukci počtu punkcí, je předmětem diskusí. V současnosti nebyla stanovena úhrada z veřejného zdravotního pojištění. Ovlivnění aktivní protinádorové imunity, jež představuje další indikaci této terapie, je předmětem následného zkoumání [19].
Předpokládá se další významný rozvoj imunoterapie v onkologii, terapii karcinomu žaludku nevyjímaje. Probíhají četné klinické studie se známými přípravky a novými látkami. Některé již přinesly slibné výsledky, např. studie s cytokiny indukovanými NK (natural killers) buňkami, které v kombinaci s FOLFOX-4 chemoterapií snižují riziko recidivy karcinomu žaludku po resekci [20]. Jedná se o studie menší, k validním závěrům budou zapotřebí obsáhlejší data.
Ipilimumab, lidská monoklonální protilátka (IgG1k) proti antigenu CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4, známý také jako CD152), indukuje mohutnou protinádorovou odpověď. Prokázal svou účinnost a je používán v léčbě maligního melanomu. Studie u karcinomu žaludku probíhají mimo jiné v Japonsku, kde je tato diagnóza palčivým problémem [21].
Závěr
Karcinom žaludku je významným celosvětovým zdravotním problémem. Zůstává obtížně léčitelným onemocněním a farmakoterapie v inoperabilním stadiu přináší jen krátkodobý účinek. Probíhá intenzivní výzkum prediktivních faktorů s cílem identifikovat vhodnou léčbu pro konkrétního pacienta na základě molekulárního vyšetření nádorové tkáně. Lze očekávat, že cílené léky budou postupem času léčbě nádorů žaludku dominovat.
Podpořeno MZ ČR - RVO (MOÚ, 00209805).
Seznam použité literatury
- [1] www.svod.cz [cit. 21. 1. 2014].
- [2] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006. CA Cancer J Clin 2006; 56: 106–130.
- [3] Tramacere I, Pelucchi C, Bagnardi V, et al. A meta-analysis on alcohol drinking and esophageal and gastric cardia adenocarcinoma risk. Ann Oncol 2012; 23: 287–297.
- [4] Fitzgerald RC, Caldas C. Clinical implications of E-cadherin associated hereditary diffuse gastric cancer. Gut 2004; 53: 775–778.
- [5] NCCN Guidelines Version 2.2013. Gastric cancer. www.nccn.org [cit. 18. 1. 2014].
- [6] Smalley SR, Benedetti JK, Haller DG, et al. Updated Analysis of SWOG-Directed Intergroup Study 0116: A Phase III Trial of Adjuvant Radiochemotherapy Versus Observation After Curative Gastric Cancer Resection. J Clin Oncol 2012; 30: 2327–2333.
- [7] Lee J, Lim Do H, Kim S, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial. J Clin Oncol 2012; 30: 268–273. Epub 2011 Dec 19.
- [8] Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase III trial. Lancet 2012; 379: 315–321.
- [9] Wagner AD, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data. J Clin Oncol 2006; 24: 2903–2909.
- [10] Ueda S, Hironaka S, Zasuj H, et al. Randomized phase III study of irinotecan (CPT-11) versus weekly paclitaxel (wPTX) for advanced gastric cancer (AGC) refractory to combination chemotherapy (CT) of fluoropyrimidine plus platinum (FP): WJOG4007 trial. J Clin Oncol 2012; 30 (suppl; abstr 4002).
- [11] Ford H, Marshall A, Wadsley J, et al. Cougar-02: A randomized phase III study of docetaxel versus active symptom control in advanced esophagogastric adenocarcinoma. J Clin Oncol 2012; 30: (suppl 34; abstr LBA4).
- [12] Jurečková A, Všianská M. Cílená léčba u pokročilého karcinomu žaludku – novinky v léčbě karcinomu žaludku. Onkologie 2012; 6: 24–27.
- [13] Ajani JA, Rodriguez W, Bodoky G, et al. Multicenter phase III comparison of cisplatin/S-1 with cisplatin/infusional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study: the FLAGS trial. J Clin Oncol 2010; 28: 1547–1553. doi: 10.1200/JCO.2009.25.4706. Epub 2010 Feb 16.
- [14] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastu-zumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376: 687–697.
- [15] Kordes S, Cats A, Meijer SL, et al. Targeted therapy for advanced esophagogastric adenocarcinoma. Crit Rev Oncol Hematol 2013 Oct 12. pii: S1040-8428(13)00214-X.
- [16] Fuchs CS, Tomášek J, Cho JY, et al. REGARD: A phase III, randomized, double-blinded trial of ramucirumab and best supportive care (BSC) versus placebo and BSC in the treatment of metastatic gastric or gastroesophageal junction (GEJ) adenocarcinoma following disease progression on first-line platinum- and/or fluoropyrimidine-containing combination therapy. J Clin Oncol 2012; 30 (suppl 34; abstr LBA5).
- [17] Wilk H, Van Cutsem E, Oh SC, et al. RAINBOW: A global, phase III, randomized, double-blind study of ramucirumab plus paclitaxel versus placebo plus paclitaxel in the treatment of metastatic gastroesophageal junction (GEJ) and gastric adenocarcinoma following disease progression on first-line platinum – and fluoropyrimidine-containing combination therapy rainbow IMCL CP12-0922 (I4T-IE-JVBE). J Clin Oncol 2014; 32: (suppl 3; abstr LBA7).
- [18] Cunningham D, Bang Y-J, Tabernero J, et al. MetGastric: A randomized phase III study of onartuzumab (MetMAb) in combination with mFOLFOX6 in patients with metastatic HER2-negative and MET-positive adenocarcinoma of the stomach or gastroesophageal junction. J Clin Oncol 2013; 31 (suppl; abstr TPS4155).
- [19] Atanackovic D, Reinhard H, Meyer S, et al. The trifunctional antibody catumaxomab amplifies and shapes tumor-specific immunity when applied to gastric cancer patients in the adjuvant setting. Hum Vaccin Immunother 2013; 9: 2533–2542.
- [20] Liu H, Song J, Yang Z, et al. Effects of cytokine-indu-ced killer cell treatment combined with FOLFOX4 on the recurrence and survival rates for gastric cancer following surgery. Exp Ther Med 2013; 6: 953–956. Epub 2013 Aug 5.
- [21] Tokudome T. Ipilimumab. Gan To Kagaku Ryoho 2013; 40: 1140–1144.