Možnosti využití některých perorálních antidiabetik v adjuvantní léčbě diabetiků 1. typu
Článek podává přehled recentních publikovaných studií, souhrnných prací a metaanalýz, které se zabývají efektivitou a bezpečností podávání perorálních antidiabetik jako adjuvantní léčby u diabetiků 1. typu. Zahrnuty jsou práce hodnotící vliv metforminu, rosiglitazonu, pioglitazonu a stručně je zde pojednáno i o možnostech, které v terapii diabetu mellitu 1. typu (DM1) nabízí inkretinová léčba. Závěrem jsou zmíněny deriváty sulfonylurey, akarbóza a u nás dosud neregistrovaný pramlintid. Z přehledu vyplývá, že nejvíce důkazů pro využití v adjuvantní terapii pacientů s DM1 má metformin, slibně se jeví i thiazolidindiony a inkretinová léčba. Nicméně vše je ještě nutné potvrdit v dlouhodobých kvalitně designovaných randomizovaných studiích.
Úvod
Diabetes mellitus 1. typu (DM1) je chronické onemocnění vyznačující se absolutním nedostatkem inzulinu, který je způsoben zánikem β-buněk pankreatu vlivem autoimunitního procesu. Vyžaduje trvalou lékařskou péči pro prevenci vzniku akutních komplikací a snížení rizika rozvoje a další progrese komplikací dlouhodobých. Trvale dobré kompenzace lze u diabetiků 1. typu dosáhnout pouze intenzifikovanou inzulinovou léčbou (IIT). Cílem terapie, podle České diabetologické společnosti, jsou hodnoty glykovaného hemoglobinu (HbA1c) nižší než 4,5 % dle IFCC [1]. Americká diabetologická asociace udává, že cílové hodnoty HbA1c pacientů s DM1 mají být < 7 % dle DCCT [2]. Při stanovování cílů terapie je samozřejmě nezbytné vzít vždy v potaz konkrétního pacienta a např. délku trvání jeho onemocnění.
Fakt, že IIT u diabetiků 1. typu zpomaluje vznik a další rozvoj mikrovaskulárních komplikací, jednoznačně prokázala roku 1993 rozsáhlá randomizovaná klinická studie The Diabetes Control and Complications Trial (DCCT) [3]. IIT však nemá pouze pozitiva. Pro zajištění normálních koncentrací inzulinu v játrech je totiž nutné dodávat exogenní inzulin v podstatě v nadbytku, což působí hyperinzulinemii na periferii. To zvyšuje riziko závažné hypoglykemie i chuť k jídlu a následně dochází k nežádoucímu nárůstu hmotnosti. V dlouhodobé perspektivě je nutné myslet i na to, že výše zmíněné vede u pacientů dále např. k vyššímu riziku kardiovaskulárnímu. Kromě toho je IIT spojena s určitým diskomfortem, když diabetik musí aplikovat inzulin obvykle v několika injekcích denně [2, 4].
Výsledky mnohých studií dávají naději v možnosti použít u pacientů s DM1 jako adjuvantní léčbu ke standardní terapii inzulinem některá perorální antidiabetika (PAD) s úspěchem aplikovaná u diabetiků 2. typu. V současnosti tento postup sice lékové agentury ani lékařské společnosti neschvalují u žádného z PAD (kromě pramlintidu), nicméně v budoucnu se možnost využití některých PAD u pacientů s DM1 jeví jako reálná.
PAD působí na vlastní onemocnění diabetem 2. typu (DM2) různými mechanismy. Stejně tak mají jednotlivé skupiny léčiv nebo látky řadící se mezi PAD různé další účinky, které prokazatelně přispívají např. ke snižování kardiovaskulárního rizika či zpomalení progrese onemocnění pacientů s DM2. U diabetiků 1. typu by se, především v počátečních, nebo dokonce preklinických stadiích onemocnění, mohl příznivě projevit efekt některých PAD na podporu proliferace a inhibice apoptózy β-buněk pankreatu. Při manifestaci DM1 je ještě určitá reziduální sekrece inzulinu zachována, a lze tedy usuzovat na přítomnost zbytkové hmoty b-buněk, na niž by bylo možné působit [5]. Stejně tak snižování inzulinové rezistence (IR), definované jako potřeba inzulinu vyšší než 1 U/kg tělesné hmotnosti/den [6], tzv. inzulinovými senzitizéry by bylo u DM1 prospěšné. IR se totiž jeví jako významný faktor přispívající k nutnosti výrazně vyšších dávek inzulinu nejen u adolescentů s DM1, ale i u dospělých diabetiků 1. typu, je nezávislým rizikovým faktorem rozvoje makro- i mikrovaskulárních komplikací a může také přispívat k další progresi onemocnění [7, 8]. Adjuvantní léčba PAD v kombinaci se standardní terapií inzulinem by u diabetiků 1. typu mohla příznivě ovlivnit všechny výše zmíněné nevýhody IIT.
Cílem tohoto článku je podat přehled recentních prací (publikovaných v letech 2000–2010), které se zabývají danou problematikou u lidských subjektů s diabetem 1. typu, a poukázat tak na dosud opomíjený potenciál zmiňované skupiny léčiv. Relevantní práce byly získány hledáním v databázi PubMED pomocí klíčových slov: diabetes mellitus, type 1; metformin; thiazolidinediones; dipeptidyl-peptidase IV inhibitors; glucagon-like peptide 1; incretins; exenatide; liraglutide; gliptins; sulfonylurea compounds; nateglinide; mitiglinide; acarbose.
Metformin
Metformin je léčivem první volby u diabetiků 2. typu [9, 10]. Zvyšuje inzulinovou senzitivitu a snižuje glukoneogenezi v játrech, což zlepšuje především glykemii nalačno. Dle některých studií in vitro má metformin i určitou schopnost zlepšovat funkci β-buněk pankreatu a bránit jejich apoptóze. Nicméně data in vivo z United Kingdom Prospective Diabetes Study (UKPDS) [11] i z A Diabetes Outcome Progression Trial (ADOPT) [12] s diabetiky 2. typu toto vyvrátila. To ale nijak nesnižuje význam metforminu, který redukuje podle studií UKPDS i ADOPT hmotnostní přírůstek a podle UKPDS i riziko makrovaskulárních komplikací u pacientů s DM2. I když je třeba vzít v úvahu, že počet sledovaných subjektů, jimž byl ve studii podáván metformin, byl podle současných doporučení nedostatečný pro adekvátní zhodnocení kardiovaskulárního výstupu (n = 342) [13, 14].
Výše zmíněné vlastnosti metforminu, především jeho schopnost snižovat IR, poukazují na možnost využití dané látky i v podpůrné léčbě pacientů s DM1.
Nejaktuálnější systematický přehled z roku 2010 [14] s cílem zhodnotit efekt metforminu přidaného k inzulinové terapii diabetiků 1. typu na hladinu HbA1c, na hmotnost a dávky inzulinu zahrnuje 9 prací vybraných podle poměrně přísných kritérií. Bere v potaz pouze studie randomizované, s pacienty, od nichž byl získán informovaný souhlas se zařazením do studie, kde bylo kontrolní skupině podáváno placebo, srovnávací léčivý přípravek nebo měly zkřížený design a které trvaly minimálně jeden týden. Celkem studie pokryly 192,8 pacientoroků. Podávání metforminu pacientům s DM1 bylo asociováno s redukcí HbA1c (o 0,6–0,9 % ve 4 ze 7 studií), dávek inzulinu (o 5,7–10,1 U/den v 6 ze 7 studií) a hmotnosti (o 1,7–6,0 kg ve 3 z 6 studií). Terapie metforminem byla dobře tolerována, i když byl patrný vzestup v četnosti hypoglykemií oproti pacientům léčeným pouze inzulinem. Metaanalýza byla provedena pouze s 5 studiemi, které uváděly průměry a směrodatné odchylky pro hodnoty HbA1c a dávky inzulinu aplikované pacientům. Absolutní pokles HbA1c ve skupině léčené metforminem byl oproti placebu 0,11 % (směrodatná průměrná odchylka, SMD, -0,10; 95% konfidenční interval, CI: -0,36–0,15; p = 0,42). Ke statisticky signifikantnímu poklesu došlo u subjektů s přidaným metforminem podle metaanalýzy pouze v případě denních dávek inzulinu, a to o 6,6 U/den (SMD -0,65; 95% CI: -0,92–-0,39; p < 0,001).
Review z roku 2008 [8] zabývající se inzulinovou rezistencí u pacientů s DM1 a možnostmi jejího ovlivnění shrnuje vliv adjuvantní léčby diabetiků 1. typu s nadváhou (BMI > 25,0 kg/m2) nebo s inzulinovou rezistencí (celková denní dávka inzulinu (TDD > 0,9 U/kg) metforminem. Popisuje pouze 5 prací, z nichž 4 jsou obsaženy i v předchozím review. Nedostatkem tohoto přehledu je, že neobsahuje 2 dosud největší publikované studie týkající se dané problematiky [15, 16], a navíc je v něm zařazena i jedna nerandomizovaná kontrolovaná studie [17]. Provedená metaanalýza 5 kontrolovaných studií s celkem 149 subjekty ukázala signifikantní zlepšení hodnot HbA1c o 0,27 % (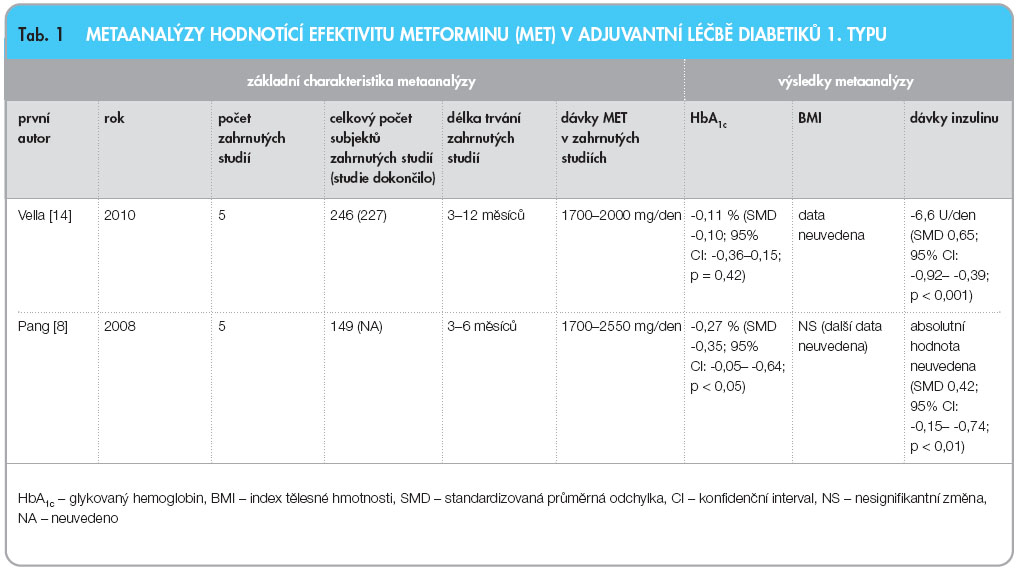 SMD -0,35; 95%; CI: -0,05– -0,64; p < 0,05). Dále došlo ke snížení potřebných dávek inzulinu (SMD -0,42; 95% CI: -0,15– -0,74; p < 0,01) a 3 studie také udávaly zlepšení hodnot celkového cholesterolu (vážená průměrná odchylka p < 0,05). Léčba metforminem nevedla podle metaanalýzy k signifikantním změnám hmotnosti, nárůstu četnosti závažných hypoglykemií nebo ke gastrointestinálním nežádoucím účinkům, které by vyžadovaly přerušení terapie. Přehledné shrnutí obou metaanalýz je v tab. 1.
SMD -0,35; 95%; CI: -0,05– -0,64; p < 0,05). Dále došlo ke snížení potřebných dávek inzulinu (SMD -0,42; 95% CI: -0,15– -0,74; p < 0,01) a 3 studie také udávaly zlepšení hodnot celkového cholesterolu (vážená průměrná odchylka p < 0,05). Léčba metforminem nevedla podle metaanalýzy k signifikantním změnám hmotnosti, nárůstu četnosti závažných hypoglykemií nebo ke gastrointestinálním nežádoucím účinkům, které by vyžadovaly přerušení terapie. Přehledné shrnutí obou metaanalýz je v tab. 1.
Účinkem metforminu přidaného k inzulinové terapii adolescentů s DM1 se zabývá i systematický přehled Cochranovy databáze publikovaný roku 2009 [18]. Ten obsahuje 2 randomizované studie [19, 20] s celkem 60 pacienty. Cílem autorů bylo totiž zahrnout pouze příslušné randomizované klinické studie, které trvaly minimálně tři měsíce. Obě práce byly obsaženy i v předchozích přehledech. Metaanalýza provedena nebyla, proto lze pouze citovat závěr autorů, že existují určité důkazy, podle kterých přidání metforminu k inzulinové terapii špatně kontrolovaných adolescentů s DM1 zlepšuje jejich metabolickou kontrolu.
Ani jeden z předchozích přehledů nezahrnoval studii Moona z roku 2007 [21], která hodnotila efekt adjuvantní terapie metforminem u diabetiků 1. typu na inzulinovou senzitivitu, kompenzaci diabetu, tělesnou kompozici, kvalitu života (QOL) a spokojenost s léčbou. Dva posledně jmenované parametry sledovala práce jako jediná ze zde uvedených. Ve studii nebyla žádná kontrolní skupina, což lze spolu s nezaslepením a malým počtem zahrnutých subjektů považovat za významné nevýhody práce. Inzulinová senzitivita, hodnocená frekventně vzorkovaným intravenózním glukózovým tolerančním testem, po 3 měsících léčby metforminem signifikantně vzrostla (p = 0,043). Zároveň došlo k poklesu denní potřeby inzulinu (p = 0,047). Hodnoty HbA1c (p = 0,20) ani tělesná kompozice se po terapii metforminem signifikantně nezměnily. QOL se signifikantně zlepšila (p < 0,002). Zároveň autoři provedli retrospektivní studii u 30 pacientů s DM1, kteří byli léčeni metforminem minimálně 4 měsíce. Data ukázala počáteční (po 3 měsících léčby) pokles HbA1c(-0,8 Ī 1,4 %; p = 0,001), který s délkou léčby slábnul. Po úvodním nárůstu BMI u pacientů, kteří byli metforminem léčeni po dobu 2 let (8 pacientů), došlo k jeho poklesu (0,5 Ī 0,5 kg/m2; p = 0,042).
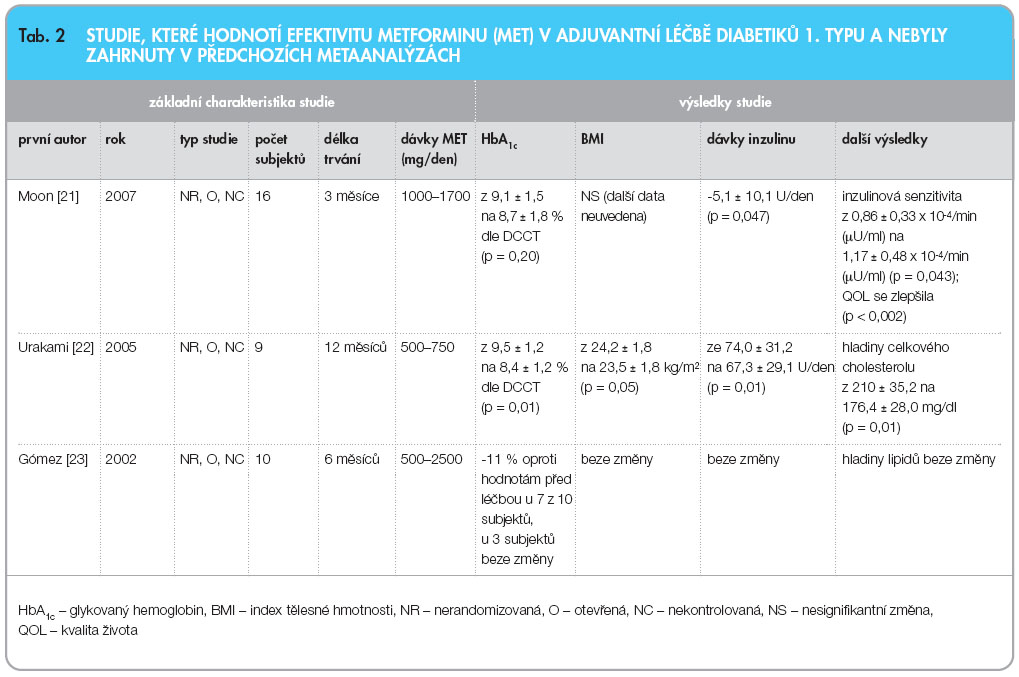 Roku 2005 publikoval Urakami [22] práci, jejímž cílem bylo, podobně jako v předchozích studiích, zhodnotit efekt metforminu přidaného k inzulinové léčbě u adolescentů a mladých dospělých s DM1. Výhodou je poměrně dlouhé trvání studie v délce 12 měsíců, nicméně práce byla nekontrolovaná a otevřená. Hodnoty HbA1c (p < 0,01), BMI (p < 0,05) a dávek inzulinu (p < 0,01) během léčby metforminem signifikantně poklesly. Zajímavá jsou i data, která dokládají, že u diabetiků 1. typu, kterým byl do kombinační léčby s inzulinem přidán metformin, došlo k signifikantnímu poklesu hladin celkového cholesterolu (p < 0,01) ve srovnání s počátkem léčby. Během terapie metforminem se u pacientů vyskytly pouze mírné přechodné gastrointestinální nežádoucí účinky a epizody lehké hypoglykemie. Pozitivní vliv metforminu na kompenzaci některých diabetiků 1. typu dokládá i pilotní studie Goméze [23], jejíž základní charakteristiky a výsledky jsou spolu s přehledem předchozích prací uvedeny v tab. 2.
Roku 2005 publikoval Urakami [22] práci, jejímž cílem bylo, podobně jako v předchozích studiích, zhodnotit efekt metforminu přidaného k inzulinové léčbě u adolescentů a mladých dospělých s DM1. Výhodou je poměrně dlouhé trvání studie v délce 12 měsíců, nicméně práce byla nekontrolovaná a otevřená. Hodnoty HbA1c (p < 0,01), BMI (p < 0,05) a dávek inzulinu (p < 0,01) během léčby metforminem signifikantně poklesly. Zajímavá jsou i data, která dokládají, že u diabetiků 1. typu, kterým byl do kombinační léčby s inzulinem přidán metformin, došlo k signifikantnímu poklesu hladin celkového cholesterolu (p < 0,01) ve srovnání s počátkem léčby. Během terapie metforminem se u pacientů vyskytly pouze mírné přechodné gastrointestinální nežádoucí účinky a epizody lehké hypoglykemie. Pozitivní vliv metforminu na kompenzaci některých diabetiků 1. typu dokládá i pilotní studie Goméze [23], jejíž základní charakteristiky a výsledky jsou spolu s přehledem předchozích prací uvedeny v tab. 2.
Podle výše uvedeného lze konstatovat, že podávání metforminu ke standardní léčbě inzulinem diabetikům 1. typu snižuje inzulinovou rezistenci pacientů, což dále umožňuje redukci dávek aplikovaného inzulinu. Pokles HbA1c není nijak výrazný, i když každé další snížení jeho hodnot vede u diabetiků 1. typu k poklesu rizika mikrovaskulárních komplikací. Teprve další výzkum, především studie s větším množstvím subjektů a s delším trváním, může prokázat, zda metformin u pacientů s DM1 významně redukuje jejich kardiovaskulární riziko stejně jako u diabetiků 2. typu a zda pokles denních dávek inzulinu při kombinační léčbě s metforminem má dlouhodobý charakter.
Thiazolidindiony
I když v září roku 2010 doporučila Evropská léková agentura (EMA) pozastavit registraci léčivých přípravků obsahujících rosiglitazon kvůli zpochybnění kardiovaskulární bezpečnosti léčiva v terapii pacientů s DM2, je pro úplnost přehledu vhodné zmínit zde i možnost využití thiazolidindionů (TZD), včetně rosiglitazonu, v léčbě diabetiků 1. typu [24]. Látky z dané skupiny zvyšují citlivost periferních tkání vůči inzulinu, a to mnohonásobně více než metformin, a snižují patologicky zvýšenou glukoneogenezi v játrech. TZD také prokazatelně zlepšují a uchovávají činnost β-buněk pankreatu. Posledně jmenovaná vlastnost TZD byla prokázána pro rosiglitazon (studie DREAM) [25], pioglitazon (studie ACT NOW) [26] i troglitazon (studie TRIPOD) [27] u pacientů s narušenou glukózovou tolerancí, u nichž po podávání daných látek významně poklesl počet případů rozvinutého diabetu mellitu 2. typu. Glitazony se standardně užívají v kombinační léčbě diabetiků 2. typu s vyjádřenou inzulinovou rezistencí [7, 9, 10, 13].
Stejné review, které popisovalo inzulinovou rezistenci u pacientů s DM1 a možnosti jejího ovlivnění metforminem, shrnulo stručně i výsledky dvou studií s TZD [8]. Protože však byla jedna práce provedena s rosiglitazonem a druhá s pioglitazonem, jejichž některé účinky jsou odlišné, budou studie, spolu se dvěma dalšími, které byly nalezeny, popsány podrobněji samostatně.
Práce Strowigové z roku 2005 [28] řešila bezpečnost a účinnost rosiglitazonu v kombinaci s inzulinem u diabetiků 1. typu s nadváhou (BMI ≥ 27 kg/m2). V randomizované, dvojitě zaslepené studii kontrolované placebem dostávaly subjekty k terapii inzulinem, která byla upravována tak, aby bylo dosaženo glykemie co nejblíže normálním hodnotám, placebo (A), nebo 4 mg rosiglitazonu (B) dvakrát denně po dobu 8 měsíců. U obou skupin došlo po této době k signifikatnímu poklesu HbA1c (A: p = 0,002; B: p = 0,0001) a k signifikantnímu nárůstu hmotnosti (A: p = 0,016; B: p = 0,008). Denní dávky inzulinu signifikantně vzrostly pouze ve skupině léčené placebem (p < 0,05), zatímco v intervenované skupině mírně poklesly. Ve větvi léčené rosiglitazonem došlo ke zlepšení hodnot systolického (p < 0,02) i diastolického tlaku krve (p < 0,0001) a hladiny celkového cholesterolu (p < 0,05). Ve výskytu hypoglykemie nebyl mezi skupinami žádný rozdíl. U žen léčených rosiglitazonem byl zaznamenán signifikantně vyšší výskyt edémů a anémie v porovnání s placebovou větví. Zlepšení hodnot HbA1c se současným poklesem dávek inzulinu v rosiglitazonové větvi můžeme přisuzovat pozitivnímu vlivu testovaného léčiva.
Nejvýrazněji byl účinek rosiglitazonu patrný u pacientů s více vyjádřenou inzulinovou rezistencí (BMI ≥ 30 kg/m2), protože u nich došlo k největšímu zlepšení HbA1c a ke snížení hladiny celkového cholesterolu při snížení dávek inzulinu. Je zřejmé, že snaha dosáhnout cílových hodnot HbA1c vedla v obou skupinách pacientů k nežádoucímu nárůstu hmotnosti.
Efekt rosiglitazonu přidaného k terapii inzulinem u adolescentů s DM1 a nedostatečnou kontrolou glykemie (HbA1c 8,9 Ī 0,96 % dle DCCT) hodnotila randomizovaná, dvojitě zaslepená a placebem kontrolovaná zkřížená studie z roku 2008 [29]. Každá ze skupin dostávala 24 týdnů placebo (A), nebo 4 mg rosiglitazonu (B) 2krát denně a 4 týdny 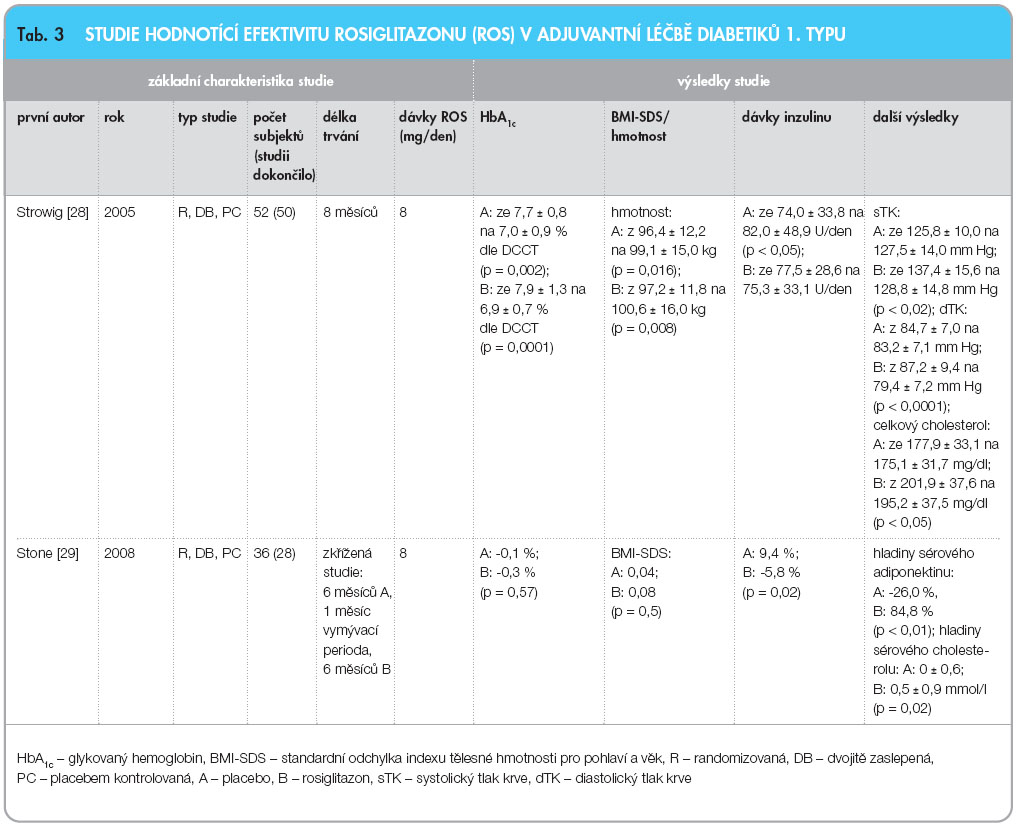 trvala vymývací perioda před změnou režimu. V porovnání s placebem vedla aplikace rosiglitazonu k poklesu dávek inzulinu (p = 0,02), k nárůstu hladin sérového adiponektinu (p < 0,01) a celkového cholesterolu (p = 0,02). HbA1c (p = 0,57) a směrodatná odchylka BMI pro věk a pohlaví (BMI-SDS; p = 0,5) se mezi skupinami signifikantně nelišila. Z poklesu dávek inzulinu a nárůstu hladin sérového adiponektinu ve větvi rosiglitazonu lze usuzovat na zlepšení inzulinové senzitivity vlivem testovaného léčiva. Ve skupině rosiglitazonu se nevyskytly žádné významné nežádoucí účinky. Přehledné shrnutí základních charakteristik a výsledků obou prací uvádí tab. 3.
trvala vymývací perioda před změnou režimu. V porovnání s placebem vedla aplikace rosiglitazonu k poklesu dávek inzulinu (p = 0,02), k nárůstu hladin sérového adiponektinu (p < 0,01) a celkového cholesterolu (p = 0,02). HbA1c (p = 0,57) a směrodatná odchylka BMI pro věk a pohlaví (BMI-SDS; p = 0,5) se mezi skupinami signifikantně nelišila. Z poklesu dávek inzulinu a nárůstu hladin sérového adiponektinu ve větvi rosiglitazonu lze usuzovat na zlepšení inzulinové senzitivity vlivem testovaného léčiva. Ve skupině rosiglitazonu se nevyskytly žádné významné nežádoucí účinky. Přehledné shrnutí základních charakteristik a výsledků obou prací uvádí tab. 3.
Dvě studie zkoumající vliv pioglitazonu jako doplňkové terapie u diabetiků 1. typu přinesly rozdílné výsledky. Práce Zdravkovicové publikovaná roku 2006 [30] sledovala adolescenty s nedostatečnou kontrolou diabetu (HbA1c= 7,5–11 % dle DCCT) i přes vysoké dávky inzulinu (> 0,9 U/kg/ den), kteří byli randomizováni do skupiny dostávající pioglitazon (15 mg, od 4. týdne 30 mg denně, pokud léčbu dobře tolerovali) nebo placebo. Studie byla dvojitě zaslepená. Po 6 měsících došlo ke zlepšení hodnot HbA1c u všech subjektů (p = 0,02) bez významného rozdílu mezi intervenovanou skupinou a větví placeba. BMI-SDS vzrostla ve skupině pioglitazonu, zatímco u pacientů dostávajících placebo se nezměnila (p = 0,01). Z toho lze odvozovat, že příčinou nárůstu hmotnosti v intervenované skupině je právě pioglitazon, neboť dávky inzulinu se zde ani ve skupině placeba významně nezměnily. Mezi oběma skupinami nedošlo po 6 měsících k žádným signifikantním změnám v lipidovém profilu.
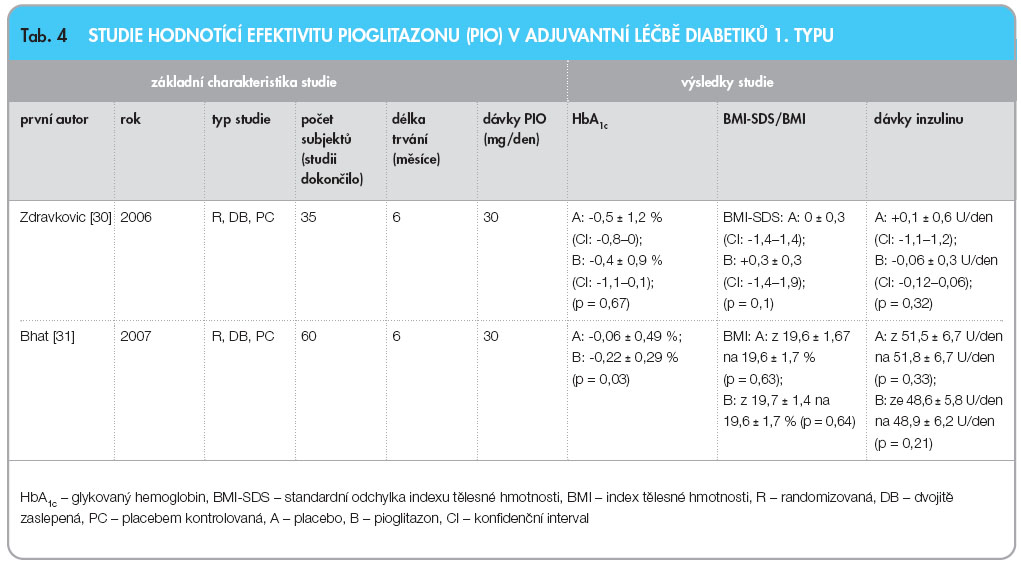 Práce Bhata z roku 2007 [31] byla také randomizovaná, dvojitě zaslepená a placebem kontrolovaná. Zahrnovala 60 štíhlých (BMI 18–24,9 kg/m2) mladých dospělých diabetiků 1. typu. V intervenované větvi pacienti dostávali 30 mg pioglitazonu denně ke standardní terapii inzulinem. Po 6 měsících došlo ve skupině pioglitazonu k signifikantnímu zlepšení hodnot HbA1c (p = 0,001) a hladin postprandiální glykemie v plazmě (PPPG; p = 0,002) oproti placebu (HbA1c: p = 0,74; PPPG: p = 0,06). Průměrný pokles PPPG a HbA1c mezi skupinami byl však po korekci na hodnoty z počátku studie signifikantní pouze pro HbA1c (p = 0,03). BMI a dávky inzulinu zůstaly v obou skupinách nezměněny, což lze vysvětlit tím, že cílových hodnot HbA1c nebylo dosahováno tak agresivně a za cenu nárůstu hmotnosti subjektů. Obě práce udávaly, že četnost hypoglykemií se mezi skupinami nelišila a že u subjektů léčených pioglitazonem nedošlo k rozvoji edémů. Přehledné shrnutí obou prací je v tab. 4.
Práce Bhata z roku 2007 [31] byla také randomizovaná, dvojitě zaslepená a placebem kontrolovaná. Zahrnovala 60 štíhlých (BMI 18–24,9 kg/m2) mladých dospělých diabetiků 1. typu. V intervenované větvi pacienti dostávali 30 mg pioglitazonu denně ke standardní terapii inzulinem. Po 6 měsících došlo ve skupině pioglitazonu k signifikantnímu zlepšení hodnot HbA1c (p = 0,001) a hladin postprandiální glykemie v plazmě (PPPG; p = 0,002) oproti placebu (HbA1c: p = 0,74; PPPG: p = 0,06). Průměrný pokles PPPG a HbA1c mezi skupinami byl však po korekci na hodnoty z počátku studie signifikantní pouze pro HbA1c (p = 0,03). BMI a dávky inzulinu zůstaly v obou skupinách nezměněny, což lze vysvětlit tím, že cílových hodnot HbA1c nebylo dosahováno tak agresivně a za cenu nárůstu hmotnosti subjektů. Obě práce udávaly, že četnost hypoglykemií se mezi skupinami nelišila a že u subjektů léčených pioglitazonem nedošlo k rozvoji edémů. Přehledné shrnutí obou prací je v tab. 4.
Protože TZD mají i určitý protizánětlivý efekt a chrání b-buňky pankreatu před oxidativním stresem a apoptózou i napomáhají jejich proliferaci, je logickým krokem jejich testování také u latentního autoimunitního diabetu dospělých (LADA). Ten má mnohé genetické, metabolické i imunitní prvky diabetu 1. typu, ale zároveň sdílí některé klinické, antropometrické a metabolické charakteristiky s diabetem 2. typu [32]. Studie, které se zabývaly vlivem rosiglitazonu na další progresi ztráty β-buněk slinivky u pacientů s LADA, přinesly pozitivní výsledky, nicméně problematika vyžaduje další zkoumání [33, 34].
Zatím se zdá, že pozitivní vliv TZD v adjuvantní terapii pacientů s DM1 není jednoznačný, i když v jejich prospěch hovoří schopnost zachovávat funkce β-buněk pankreatu a příznivě ovlivňovat inzulinovou senzitivitu diabetiků. Zde uvedené studie zahrnovaly poměrně dost pacientů, byly randomizované i placebem kontrolované a vzhledem k tomu, že vliv TZD u diabetiků 2. typu lze objektivně hodnotit až po několika měsících léčby, i relativně dostatečně dlouhé, nicméně jejich závěry nejsou nijak přesvědčivé. Ukazuje se, že podávání TZD diabetikům 1. typu vede u pacientů k nežádoucímu nárůstu hmotnosti (stejně jako u pacientů s DM2), k čemuž, zvláště v případě rosiglitazonu, jistě významně přispívá vyšší výskyt periferních edémů u léčených subjektů. Ve studiích, které hodnotily pioglitazon, se větší četnost edémů u pacientů ve větvi hodnoceného léčiva neprokázala. Zde může být vzestup hmotnosti způsoben např. nárůstem hmoty podkožního tuku (i přes určitý pokles v množství tuku viscerálního) [10]. Pro zhodnocení kardiovaskulárního rizika netrvaly studie dostatečně dlouho.
Inkretinová léčba
Inkretinová léčba zahrnuje relativně novou skupinu látek používaných v kombinační terapii s metforminem či TZD u diabetiků 2. typu se zachovalou sekrecí inzulinu, kterou v přítomnosti glukózy zvyšují [9]. Zdálo by se tedy, že jejich využití u pacientů s DM1 nemá opodstatnění, ale nesmíme zapomínat ani na další efekty inhibitorů dipeptidyl peptidázy-4 (DPP-4) a analog glukagon-like peptidu-1 (GLP-1). Mezi ně patří především jejich schopnost zpomalovat vyprazdňování žaludku a potlačovat neadekvátně zvýšenou sekreci glukagonu. Pozitivní je jednoznačně i to, že inkretinová léčba u diabetiků 2. typu nezvyšuje riziko hypoglykemie a má neutrální vliv na hmotnost pacientů, případně svou schopností snižovat chuť k jídlu působí určitý hmotnostní úbytek léčených subjektů. K výraznější ztrátě hmotnosti dochází u diabetiků 2. typu s vyššími hodnotami BMI, toto by tedy u štíhlých pacientů s DM1 nemělo být překážkou [5, 35, 36]. Z negativ inkretinové léčby je nutné poukázat na možné riziko vyšší incidence infekcí horních cest dýchacích v případě podávání inhibitorů DPP-4, na zažívací potíže a na určité zprávy varující před rizikem vzniku pankreatitid v souvislosti s podáváním agonistů GLP-1 [10].
Kvůli stále ještě nedostatečným praktickým zkušenostem s danou skupinou látek zde panují mnohé nejasnosti v jejich vlivu na funkci β-buněk pankreatu. Studie in vitro a použití inkretinové léčby u zvířecích modelů neautoimunitního, ale i autoimunitního diabetu ukázaly jejich potenciál zvyšovat různými mechanismy hmotu i činnost β-buněk slinivky a inhibovat jejich apoptózu. Objevily se i studie, které toto prokázaly u diabetiků 2. typu. Přesto je potřeba potvrdit daný účinek inkretinové léčby v dlouhodobějších studiích a přímo u pacientů s DM1. Stejně tak je již prokázáno, že u diabetiků 2. typu je sekrece GLP-1 deficitní, ale výsledky prací, které toto sledovaly u pacientů s DM1, jsou stále rozporuplné. Nedávné experimentální i klinické studie naznačují, že inkretinová léčba může mít určité pozitivní vlivy na kardiovaskulární systém [5, 26, 37, 38].
Tři přehledové články z let 2005 [39] a 2009 [5, 38] popisují výše zmíněné efekty inkretinové léčby a shrnují poznatky o GLP-1 a jeho agonistech ve vztahu k jejich možnému využití u pacientů s DM1. Zahrnují studie provedené u diabetiků 1. typu a práce se zvířaty a s diabetiky 2. typu sledující vliv zmiňovaných látek na β-buňky pankreatu. Jejich závěrem je shodně to, že inkretinová léčba má určitý potenciál pro využití v adjuvantní terapii pacientů s DM1, ale že vše je ještě nutné prokázat rozsáhlejšími studiemi.
Možnost využití inkretinové léčby v adjuvantní terapii diabetiků 1. typu nelze tedy shrnout jinak, než že určité důkazy hovořící v její prospěch již existují. Ale vše je nezbytné prokázat teprve rozsáhlejšími randomizovanými klinickými studiemi s kvalitním designem, delším trváním a se zaměřením na ovlivnění DM1 v počátečních stadiích a na zhodnocení potenciálního inzulin šetřícího efektu inkretinové léčby u diabetiků 1. typu.
Ostatní perorální antidiabetika
Deriváty sulfonylurey
Deriváty sulfonylurey (DSU) zlepšují bazální i prandiální sekreci inzulinu z β-buněk pankreatu a pravděpodobně mají i další účinky extrapankreatické (antioxidační, antiaterogenní, zvyšující inzulinovou senzitivitu), pro které by případně bylo možné je využít u pacientů s DM1. Jedná se především o gliklazid nebo glimepirid, látky ze skupiny DSU, které se u diabetiků 2. typu užívají pro zlepšení kompenzace v kombinaci s metforminem nejčastěji [9, 40, 41]. Podle UKPDS [42] nemají DSU u nově diagnostikovaného DM2 protektivní efekt na b-buňky slinivky a ani signifikantní vliv na snížení rizika kardiovaskulárních komplikací u diabetiků 2. typu. Co se týká účinku DSU na b-buňky, podobné výsledky přinesla i rozsáhlá studie ADOPT [12], kde u pacientů s DM2 došlo po počátečním poklesu hodnot HbA1c k jejich kontinuálnímu nárůstu kvůli progresivní ztrátě β-buněk pankreatu podobně jako u metforminu, i když zde byl počáteční efekt na HbA1c trvalejší [13].
Práce, jež by toto studovaly u diabetiků 1. typu, chybí, stejně tak jako aktuální studie, které by testovaly účinnost DSU v kombinaci se standardní terapií inzulinem u pacientů s DM1. Podobně neexistují příslušné práce s glinidy.
Jediná recentní nalezená studie z roku 2002 [43], sledující 14 diabetiků 2. typu s pozitivními protilátkami proti cytoplazmě T-lymfocytů (ICA) a dekarboxyláze kyseliny glutamové (anti-GAD65 A), dokazuje nevhodnost použití DSU u LADA nebo pomalu progredujícího diabetu 1. typu. Ve skupině pacientů léčených pouze inzulinem, po ukončení předchozí kombinované léčby glibenklamidem, došlo totiž po roce k poklesu lačné glykemie a u většiny z nich byla zjištěna ICA negativita. Kdežto ve větvi pacientů užívajících ke standardní terapii inzulinem glibenklamid zůstali všichni ICA pozitivní a glykemie nalačno se nezlepšila. Je tedy patrné, že léčba DSU zvyšuje expresi autoantigenů v b-buňkách slinivky. Hladiny anti-GAD65 A a C-peptidu nalačno zůstaly nezměněné v obou skupinách.
Akarbóza
Akarbóza, inhibitor a-glukosidáz, výrazně snižuje štěpení oligosacharidů v horní části tenkého střeva, což vede ke zpoždění a omezení absorpce glukózy. To je spojeno s poklesem především postprandiální glykemie bez zvýšení hladiny inzulinu [41]. Z uvedeného mechanismu účinku vyplývá možnost využití akarbózy i u pacientů s DM1. Aktuální práce, která by toto sledovala, byla nalezena pouze jedna. Dvojitě zaslepená, randomizovaná, zkřížená studie kontrolovaná placebem z roku 2000 [44] hodnotila vliv akarbózy na potřebu inzulinu po standardním jídle u 10 diabetiků 1. typu. Po podání 100 mg akarbózy spolu s jídlem u pacientů statisticky signifikantně poklesla postprandiální potřeba inzulinu (p = 0,003). Při úvahách nad podáním inhibitoru a-glukosidáz pacientovi je nezbytné vždy zvážit i nepříjemné gastrointestinální nežádoucí účinky, které často vedou k ukončení léčby subjektem [10].
Pramlintid
Na závěr nelze alespoň stručně nezmínit pramlintid, velice nadějnou látku, která u nás dosud není registrovaná. Jedná se o syntetický analog amylinu, což je polypeptidový hormon produkovaný spolu s inzulinem β-buňkami pankreatu. Má schopnost zpomalovat vyprazdňování žaludku, potlačovat sekreci glukagonu a snižovat postprandiální tvorbu glukózy v játrech. To významně snižuje glykemii po jídle. Podle klinických studií pramlintid sám o sobě nezvyšuje riziko hypoglykemie, ale může zvýšit riziko inzulinem indukované hypoglykemie. Pramlintid má schopnost potlačovat chuť k jídlu. To vede k poklesu hmotnosti u pacientů s DM1. Někdy vyvolává dokonce až anorexii. Běžnými nežádoucími účinky této zajímavé látky jsou nevolnost a zvracení. Americká FDA schválila pramlintid pro použití u diabetiků 1. typu starších 15 let v kombinaci s krátkodobým inzulinem, jehož dávky umožňuje snížit. Pramlintid je aplikován subkutánně. Při jeho podávání by měly být dávky inzulinu redukovány o 20–50 % [7, 38].
Závěr
Možnost využít některá PAD v adjuvantní léčbě diabetiků 1. typu je obrovským příslibem do budoucnosti. Zatím se jako nejvhodnější jeví kombinace metforminu s inzulinovou léčbou, která podle publikovaných studií umožňuje redukovat aplikované dávky inzulinu především zlepšením inzulinové senzitivity pacientů. Pro svou schopnost pozitivně ovlivňovat funkce a hmotu β-buněk slinivky by mohly být u pacientů s DM1, zvláště u těch s nově se manifestujícím onemocněním, použitelné i TZD a inkretinová léčba. U TZD je však kromě dalších průkazů jejich účinnosti u diabetiků 1. typu nezbytné znovu zhodnotit i kardiovaskulární bezpečnost, která byla u pacientů s DM2 lékovými agenturami zpochybněna. Aktuálních důkazů pro účinnost DSU, akarbózy a glinidů u diabetiků 1. typu je nedostatek.
Podpořeno výzkumným projektem SVV-2010-261-004.
Seznam použité literatury
- [1] Standardy péče o diabetes mellitus 1. typu [online]. Česká diabetologická společnost 2007. [citováno 21. 9. 2010]. URL: http://www.diab.cz/ modules/Standardy/dm1_2007.pdf.
- [2] American Diabetes Association. Standards of Medical Care in Diabetes – 2009. Diab Care 2009; 32 Suppl 1: S13–S61.
- [3] The Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986.
- [4] Lebovitz HE. Adjunct therapy for type 1 diabetes mellitus. Nat Rev Endocrinol 2010; 6: 326–334.
- [5] Kielgast U, Holst JJ, Madsbad S. Treatment of type 1 diabetic patients with glucagon-like peptide-1 (GLP-1) and GLP-1R agonists. Curr Diabetes Rev 2009; 5: 266–275.
- [6] Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19: 527–534.
- [7] Sherr J, Cengiz E, Tamborlane WV. From pumps to prevention: recent advances in the treatment of type 1 diabetes. Drug Discov Today 2009; 14: 973–981.
- [8] Pang TTL, Narendran P. Addressing insulin resistance in type 1 diabetes. Diabet Med 2008; 25: 1015–1024.
- [9] Doporučený postup péče o diabetes mellitus 2. typu [online]. Česká diabetologická společnost 2009. [citováno 20. 11. 2010]. URL: http://www. diab.cz/modules/Standardy/dm2_2009.pdf.
- [10] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. Diabetes Care 2009; 32: 193–203.
- [11] UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352: 854–865.
- [12] Kahn SE, Haffner SM, Heise MA, et al. ADOPT Study Group. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355: 2427–2443.
- [13] DeFronzo RA. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58: 773–795.
- [14] Vella S, Buetow L, Royle P, et al. The use of metformin in type 1 diabetes: a systematic review of efficacy. Diabetologia 2010; 53: 809–820.
- [15] Lund SS, Tarnow L, Astrup AS, et al. Effect of adjunct metformin treatment in patients with type-1 diabetes and persistent inadequate glycaemic control. A randomized study. PLoS One 2008; 3: e3363.
- [16] Walravens PA, Chase PH, Klingensmith GJ, et al. Low dose metformin in adolescents with type 1 diabetes mellitus: a double blind, controlled study. Diabetes 2000; 49 (Suppl 1): A128 (Abstract).
- [17] Lacigova S, Rusavy Z, Jankovec Z, et al. Metformin in the treatment of type 1 diabetics – a placebo controlled study. Cas Lek Ces 2001; 140: 302–306.
- [18] Abdelghaffar S, Attia AM. Metformin added to insulin therapy for type 1 diabetes mellitus in adolescents. Cochrane Database Syst Rev 2009; 21 (1): CD006691 (Abstract).
- [19] Hamilton J, Cummings E, Zdravkovic V, et al. Metformin as an adjunct therapy in adolescents with type 1 diabetes and insulin resistance: a randomized controlled trial. Diabetes Care 2003; 26: 138–143.
- [20] Särnblad S, Kroon M, Aman J. Metformin as additional therapy in adolescents with poorly controlled type 1 diabetes: randomised placebo-controlled trial with aspects on insulin sensitivity. Eur J Endocrinol 2003; 149: 323–329.
- [21] Moon RJ, Bascombe LA, Holt RIG. The addition of metformin in type 1 diabetes improves insulin sensitivity, diabetic control, body composition and patient well-being. Diabetes Obes Metab 2007; 9: 143–145.
- [22] Urakami T, Morimoto S, Owada M, et al. Usefulness of the addition of metformin to insulin in pediatric patients with type 1 diabetes mellitus. Pediatr Int 2005; 47: 430–433.
- [23] Gómez R, Mokhashi MH, Rao J, et al. Metformin adjunctive therapy with insulin improves glycemic control in patients with type 1 diabetes mellitus: a pilot study. J Pediatr Endocrinol Metab 2002; 15: 1147–1151 (Abstract).
- [24] EMA doporučuje pozastavení registrací pro přípravky obsahující rosiglitazon [online]. SÚKL 2010. [citováno 23. 11. 2010]. URL: http://www. sukl.cz/ema-doporucuje-pozastaveni-registraci-pro-pripravky?highlightWords= rosiglitazon.
- [25] The Dream (Diabetes Reduction Assessment with ramipril and rosiglitazone Medication) Trial Investigators. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet 2006; 368: 1096–1105.
- [26] De Fronzo RA, Banerji MA, Bray G, et al. ACTos NOW for the prevention of diabetes (ACT NOW) study. BMC Endocrine Disorders 2009; 9: 17–24.
- [27] Buchanan TA, Xiang AH, Peters RK, et al. Preservation of pancreatic beta-cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high-risk hispanic women. Diabetes 2002; 51: 2796–2803.
- [28] Strowig SM, Raskin P. The effect of rosiglitazone on overweight subject with type 1 diabetes. Diabetes Care 2005; 25: 1562–1567.
- [29] Stone ML, Walker JL, Chisholm D, et al. The addition of rosiglitazone to insulin in adolescents with type 1 diabetes and poor glycaemic control: a randomized-controlled trial. Pediatr Diabetes 2008; 9: 326–334.
- [30] Zdravkovic V, Hamilton JK, Daneman D, et al. Pioglitazone as adjunctive therapy in adolescents with type 1 diabetes. J Pediatr 2006; 149: 845–849.
- [31] Bhat R, Bhansali A, Bhadada S, et al. Effect of pioglitazone therapy in lean type 1 diabetes mellitus. Diabetes Res Clin Pract 2007; 78: 349–354.
- [32] Cernea S, Buzzetti R, Pozzilli P. Beta-cell protection and therapy for latent autoimmune diabetes in adults. Diabetes Care 2009; 32 (Suppl. 2): S246–S252.
- [33] Zhou Z, Li X, Huang G, et al. Rosiglitazone combined with insulin preserves islet beta cell function in adult-onset latent autoimmune diabetes (LADA). Diabetes Metab Res Rev 2005; 21: 203–208.
- [34] Yang Z, Zhou Z, Li X, et al. Rosiglitazone preserves islet beta-cell function of adult-onset latent autoimmune diabetes in 3 years follow-up study. Diabetes Res Clin Pract 2008; 83: 53–60.
- [35] Kvapil M. Sitagliptin. Remedia 2008; 18 (Supl. 1): S4–S10.
- [36] Perušičová J. Exenatid. Remedia 2008; 18 (Supl. 1): S18–S23.
- [37] Bosi E. Time for testing incretin therapies in early type 1 diabetes? Endocrinol Metab 2010; 95: 2607–2609.
- [38] Raman VS, Heptulla RA. New potential adjuncts to treatment of children with type 1 diabetes mellitus. Pediatr Res 2009; 65: 370–374.
- [39] Dupre, J. Glycaemic effects of incretins in type 1 diabetes mellitus: A concise review, with emphasis on studies in humans. Regul Pept 2005; 128: 149–157.
- [40] Šmahelová A. Perorální antidiabetika skupiny derivátů sulfonylurey. Remedia 2008; (Supl. 1): S56–S60.
- [41] Piťhová P, Perušičová J, Pelikánová M, et al. Nehypoglykemizující účinky perorálních antidiabetik. Interní Med 2007; 9: 507–513.
- [42] Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 831–853.
- [43] Cabrera-Rode E, Perich P, Diaz-Horta O, et al. Slowly progressing type 1 diabetes: persistence of islet cell autoantibodies is related to glibenclamide treatment. Autoimmunity 2002; 35: 469–474.
- [44] Juntti-Berggren L, Pigon J, Hellström P, et al. Influence of acarbose on post-prandial insulin requirements in patients with type 1 diabetes. Diabetes Nutr Metab 2000; 13: 7–12.