Mukositida dutiny ústní u pacientů s onkologickou léčbou
Souhrn:
Mukositida dutiny ústní je významnou komplikací onkologické léčby s primárním postižením sliznic a podslizniční tkáně dutiny ústní. Zhoršuje kvalitu života pacienta, zvyšuje riziko malnutrice a infekčních komplikací, negativně ovlivňuje onkologickou péči. Ve snaze omezit výskyt mukositidy nebo souvisejících komplikací je nutné využívat dostupné možnosti lékařské a ošetřovatelské péče. Minimálním požadavkem je zajištění řádných hygienických poměrů v dutině ústní, tišení bolesti a zabezpečení adekvátního příjmu tekutin, výživy a léků pro pacienta.
Key words: mucositis, oral cavity, chemotherapy, radiotherapy, mTOR, nursing.
Summary:
Oral mucositis represents a signifi cant complication of oncological therapy with primary damage to oral mucosa and submucosa. It worsens the quality of life of aff ected patients, increases the risk of malnutrition and infectious complications, and it has negative impact on the course of oncology care. To reduce mucositis and its complications, available medical and nursing procedures must be used. As a minimum demand, the provision of satisfactory oral hygiene, reduction of pain and proper nutrition, hydration and medicals in a patient is necessary.
Mukositida dutiny ústní je charakteristický typ toxicko zánětlivého postižení sliznice a podslizniční tkáně v souvislosti s podanou chemoterapií nebo aktinoterapií. Při onkologické léčbě využívající inhibitory mTOR (mammalian target of rapamycin) se postižení sliznic dutiny ústní označuje jako stomatitida [1,2].
Patofyziologie
Působení cytostatika nebo radiace přímo poškozuje buněčnou DNA, uvolňují se toxické volné kyslíkové radikály a dochází k apoptóze epitelií a fibroblastů submukózy. Iniciuje se aktivita prozánětlivých mediátorů (NF κB, TNFα, IL 1β, IL 6) a enzymů hydrolyzujících sfingomyelin buněčných membrán (sfingomyelináza, ceramid syntetáza). Probíhající procesy dále poškozují tkáň, rozvíjí se až ztráta integrity sliznice, invaze mikroorganismů a další produkce cytokinů, rozvoj zánětu, apoptóza. Postupně pak začínají převažovat signály buněčné proliferace, diferenciace, angiogeneze a fáze hojení [3]. Na poškození sliznic při léčbě inhibitory mTOR se podílejí jiné mechanismy, které ovlivňují buněčný metabolismus, reparaci, angiogenezi a funkci imunitních procesů [2,4,5].
Možnou roli v patogenezi může hrát také infekce bakterií Clostridium difficile, není ale jisté, zda těžká mukositida (včetně gastrointestinální mukositidy) předchází infekci, nebo zda naopak infekce potencuje zpětně zatím neobjasněným mechanismem mukositidu – u zvířecího modelu byl výskyt těžké mukositidy dutiny ústní po aplikaci methotrexatu významně několikanásobně nižší při současně zajištěné aplikaci vancomycinu [6–8].
Incidence
V případě intenzivních vysokodávkovaných režimů s transplantací krvetvorných buněk se mukositida objevuje až u 100 % pacientů v závislosti na konkrétním typu předtransplantační přípravy. Při rizikové chemoterapii s podáváním an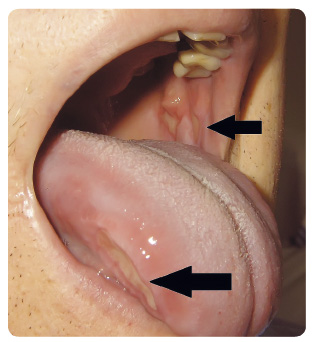 tracyklinů, cytarabinu, melfalanu, methotrexatu, bleomycinu, cyklofosfamidu nebo ifosfamidu se mukositida vyskytuje nanejvýš u 15 % pacientů, při podávání irinotekanu u více než 20 % pacientů a po léčbě fluorouracilem až u 40 % léčených [9]. Vysoké riziko vzniku mukositidy provází také léčbu taxany, kdy v případě třítýdenního režimu léčby metastatického karcinomu prsu vykazovalo postižení při podávání docetaxelu až 51 % pacientů a při podávání paclitaxelu 16 % [10]. Při léčbě everolimem u pacientů s karcinomy ledvin, prsu nebo s neuroendokrinními tumory dosahoval výskyt postižení dutiny ústní 44–64 % [11–14] a až 60 % pak u pacientů po transplantacích ledvin a krvetvorných buněk se zajištěnou imunosupresivní léčbou s využitím sirolimu [15,16].
tracyklinů, cytarabinu, melfalanu, methotrexatu, bleomycinu, cyklofosfamidu nebo ifosfamidu se mukositida vyskytuje nanejvýš u 15 % pacientů, při podávání irinotekanu u více než 20 % pacientů a po léčbě fluorouracilem až u 40 % léčených [9]. Vysoké riziko vzniku mukositidy provází také léčbu taxany, kdy v případě třítýdenního režimu léčby metastatického karcinomu prsu vykazovalo postižení při podávání docetaxelu až 51 % pacientů a při podávání paclitaxelu 16 % [10]. Při léčbě everolimem u pacientů s karcinomy ledvin, prsu nebo s neuroendokrinními tumory dosahoval výskyt postižení dutiny ústní 44–64 % [11–14] a až 60 % pak u pacientů po transplantacích ledvin a krvetvorných buněk se zajištěnou imunosupresivní léčbou s využitím sirolimu [15,16].
Po radioterapii v oblasti hlavy a krku se mukositida objevuje až u tří čtvrtin pacientů, někdy se dokonce blíží ke 100 %. Zásadním ovlivňujícím faktorem je dávka záření, použitá technika, plánování a ochrana struktur při záření. Zvýšené riziko hrozí při kombinaci záření a chemoterapie a/nebo léčby cílené, jakou představují fluorouracil, cisplatina, taxany či cetuximab [17].
Průběh a výskyt mukositidy není při shodných režimech onkologické léčby stejný, ale vykazuje individuální odlišnosti. Významnou roli ve vnímavosti hrají genetické predispozice, polymorfismy genů regulace prozánětlivých dějů a vnímavosti vůči cytostatikům, polymorfismus enzymů zodpovědných za degradaci cytostatik – typicky při podávání fluorouracilu a methotrexatu [18]. Obecně je za rizikový faktor považováno ženské pohlaví, ale činitelem, který toto může výrazně ovlivňovat, je i dávkování cytostatik vázané na tělesný povrch, což výsledně vede k výrazné variabilitě reálné dávky aplikované na kilogram hmotnosti, přičemž tyto dávky jsou při stejném tělesném povrchu pacientů vyšší u nemocných s nižší hmotností, a tedy častěji u žen [19]. Zásadním rizikovým faktorem vzniku mukositidy po aplikaci melfalanu je nezajištění profylaktického chlazení dutiny ústní [20].
Klinický obraz a souvislosti
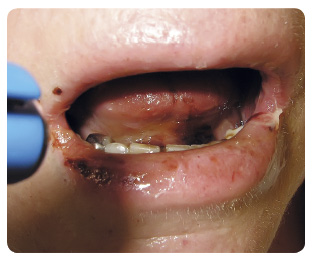
Nejčastěji bývá postižen jazyk a bukální a labiální sliznice. V úvodu lze pozorovat prosáknutí sliznic, které mívají lehce vybledlý nádech. Bukálně nebo po okraji jazyka může být patrné vroubkování způsobené otisky zubů (tzv. scalloping). Dalším projevem bývá erytém a při těžších poškozeních různě rozsáhlé defekty kryté většinou bělavou či žlutavou fibrinovou pablánou, která se v průběhu dalších dní postupně od okrajů odhojuje. V případě těžkých postižení bývá patrno krvácení defektů. Nekróza tkáně se může rozvinout po ozařování. Defekty po léčbě everolimem (inhibitor mTOR) mají typický aftózní charakter, o průměru 5–10 mm i více, mohou splývat, mají centrální bledou pablánu a zarudlý lem.
Postižení sliznice vyvolává u pacienta diskomfort až bolestivost, která může případně vyžadovat i aplikaci opiátů a omezovat perorální příjem. Stav je doprovázen poruchou vnímání chuti, produkce slin se mění na vazkou, snižuje se její intenzita a rozvíjí se xerostomie. Poškozená slizniční bariéra usnadňuje průnik patogenů se zvýšeným rizikem vzniku lokálních či systémových infekcí. Mezi hlavní patogeny patří např. streptokoky, stafylokoky, anaerobní či gramnegativní bakterie (Klebsiella pneumoniae, Pseudomonas aeruginosa, enterobakterie). V případě mykotické infekce jde nejčastěji o kandidózu (převážně Candida albicans, ale i ostatní druhy). Mezi významné virové infekce se pak řadí infekce virem Herpes simplex, Coxsackie viry, dále virem Varicella zoster nebo cytomegalovirem. Ve srovnání s významem většinou korelující mukositidy gastrointestinálního traktu se však vliv poškození dutiny ústní na výskyt horeček nejasné etiologie a na spotřebu intravenózních antibiotik po autologní transplantaci krvetvorných buněk jeví jako méně zásadní [21].
Mukositida po chemoterapii nastupuje nejčastěji za 4–8 dní a přetrvává podle tíže zhruba 7–14 dní, někdy i déle. Při léčbě everolimem se objevuje nejčastěji do 8 týdnů, riziko rozvoje mukositidy po dvou měsících je pak již zcela minimální a postižení se většinou při odpovídající léčbě vyhojí během 2–3 týdnů [22]. Při aktinoterapii nastupuje obvykle po dvou týdnech léčby, v jejím průběhu se dále zhoršuje, změny vrcholí zhruba za 4–6 týdnů a poškození ustupuje za 2–3 měsíce poté. Porucha produkce slin může po intenzivní radioterapii nebo alogenní transplantaci kostní dřeně při chronické reakci štěpu proti hostiteli (graft versus host disease, GVHD) přetrvávat řadu měsíců i let [17,23].
Hodnocení závažnosti postižení
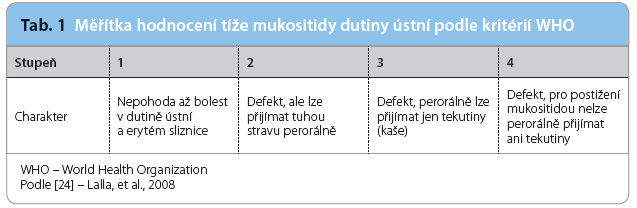 V klinických studiích patří mezi nejvíce využívané nástroje hodnocení tíže mukositidy kritéria WHO (World Health Organization) a NCI CTC (National Cancer Institute – Common Toxicity Criteria) [24] ‚ tab. 1 a 2. U pacientů po radioterapii se k hodnocení tíže akutních a chronických komplikací používá také klasifikace dle RTOG/EORTC (Radiation Therapy Oncology Group/European
V klinických studiích patří mezi nejvíce využívané nástroje hodnocení tíže mukositidy kritéria WHO (World Health Organization) a NCI CTC (National Cancer Institute – Common Toxicity Criteria) [24] ‚ tab. 1 a 2. U pacientů po radioterapii se k hodnocení tíže akutních a chronických komplikací používá také klasifikace dle RTOG/EORTC (Radiation Therapy Oncology Group/European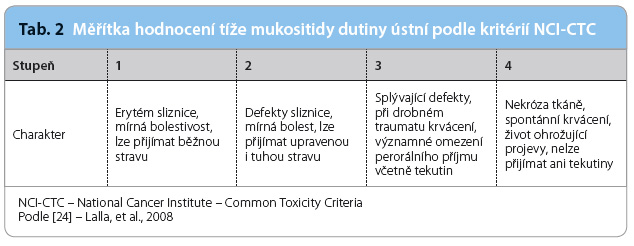 Organization for Research and Treatment of Cancer) [25].
Organization for Research and Treatment of Cancer) [25].
Možnosti prevence a léčby
Výskyt a rozsah mukositidy lze do jisté míry omezit vhodným přístupem v léčbě. Většina doporučení vychází ze závěrů expertů mezinárodní skupiny Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology (MASCC/ISOO) a European Society for Blood and Marrow Transplantation (EBMT) [24], National Comprehensive Cancer Network (NCCN) a European Society for Medical Oncology (ESMO) [27, 28].
Edukace pacienta
S ohledem na charakter onkologické léčby by měl být pacient informován o riziku rozvoje mukositidy, o komplikacích a možnostech ovlivnění, o nutnosti udržování dobrého stavu hygieny v dutině ústní a vhodné dietní úpravě takovým způsobem, aby nedocházelo k poškození a dráždění sliznic mechanicky, fyzikálně nebo chemicky tvrdou, ostrou, příliš slanou, kyselou či horkou stravou.
Stomatologická příprava
Pacientům před rizikovou chemoterapií je doporučeno vyšetření u stomatologa s ošetřením defektního chrupu, ostrých hran, protéz a zubního kamene. Vhodná je konzultace a péče dentálního hygienisty. Před plánovanou radioterapií a intenzivní chemoterapií se vždy snažíme o zajištění kvalitního vyšetření ústní dutiny a případné kompletní ošetření včetně ošetření infekčních ložisek. Před radioterapií je zásadní výměna nebo clonění kovové protetiky a amalgámových zubních výplní z důvodu rizika sekundárního záření, zhotovovány jsou případně zubní krytky nebo je i někdy nutná extrakce silně defektního chrupu.
Péče o chrup a hygiena sliznic
Pacienti by měli k čištění chrupu používat měkký zubní kartáček, pečovat o zubní protézy, odkládat je na noc a při mukositidě i během dne. Pacient by měl provádět pravidelné výplachy dutiny ústní roztoky, které mu vyhovují, protože již samotný mechanický, zvlhčující a mírně úlevový účinek výplachů je významný. Volba prostředků je individuální s ohledem na rozdílnou toleranci roztoků. Obecně nejsou doporučovány roztoky s obsahem alkoholu, ale některým pacientům mohou vyhovovat. Teplotu a frekvenci výplachů nebo kloktání by si měl určit sám pacient, aby pro něj byly co nejpříjemnější.
Roztoky a gely
Zklidňující pocit na postižené sliznici mohou navozovat již prosté výplachy chladnou vodou (ideálně voda balená, převařená nebo sterilní), fyziologickým roztokem, přípravky s výtažky šalvěje nebo celá řada komerčních přípravků, které sám pacient považuje za jemu pomáhající. Pro pacienty léčené středně intenzivní radioterapií v oblasti hlavy a krku jsou doporučovány roztoky benzydaminu, který má protizánětlivý účinek a může navodit úlevu od bolesti. Využít jej mohou i pacienti s mukositidou po chemoterapii. V případě těžké mukositidy, u nesamostatných pacientů a zcela jistě při infekčním postižení v dutině ústní jsou vhodné roztoky s antimikrobiálním účinkem – v lékárně ředěný chlorhexidin 0,1–0,3% nebo komerční ústní vody (0,1% či 0,12% chlorhexidin), dále roztoky s povidon iodinem, z antimykotik pak například itraconazol a nystatin.
Mezi přípravky určené k léčbě diskomfortu v dutině ústní, bolesti a případně suchosti sliznic dutiny ústní náležejí spíše viskózní až gelovité produkty především s kyselinou hyaluronovou a dalšími látkami. Podle stupně viskozity vytvářejí tyto přípravky jemný film na sliznici, který adhezí na defekty a překrytím odhalených nervových zakončení zajišťuje mírné analgetické působení a přispívá k udržení vlhkosti sliznice a tím i k hojení.
Roztok s vysokým obsahem kalciových a fosfátových iontů přispívá podle dosavadních pozorování k redukci výskytu a tíže mukositidy u pacientů po vysokodávkované chemoterapii s transplantací krvetvorných buněk nebo po radioterapii pro nádory hlavy a krku [29]. Pozor – peroxid vodíku narušuje hojení ran a při nedostatečném ředění alteruje i jinak intaktní sliznice dutiny ústní; rizikový je z tohoto pohledu i bikarbonát, který v roztoku jinak přispívá ke snížení vazkosti slin [30,31].
Kryoterapie a chlazení
Velmi účinný mechanismus ochrany sliznic úst před působením úzké skupiny cytostatik s velmi krátkým biologickým poločasem (fluorouracil, edatrexat a melfalan) a při jejich aplikaci v bolusu nebo v rychlé infuzi do 15 minut představuje kryoterapie a chlazení. Pomocí ledové vody, tříště nebo ledových lízátek a nanuků lze dosáhnout místního podchlazení dutiny ústní, lokální vazokonstrikce, snížení průtoku krve a tím menšího působení cytostatika na sliznici. Působení chladu má začínat 5 minut před aplikací cytostatika, pokračovat během jeho maximálně 15minutové aplikace a pak ještě maximálně 15 až 30 minut. Je třeba dát pozor na nežádoucí účinky, jako je celkový chlad, bolestivost dásní, hlavy a nevolnost, poškození sliznice chladem (omrzlina) při použití kostek ledu. S účinností kryoterapie nelze počítat při delších infuzích nebo při aplikaci cytostatik s dlouhým biologickým poločasem.
Chlazení sliznic studenou vodou nebo tříští, opatrně s ledem, lze s ohledem na individuální toleranci a pocit pozitivního působení použít k omezení bolestivosti a zánětu při již rozvinuté mukositidě. Místo vody lze individuálně využít ovocné džusy – doporučuje se ananas (bromelainu, který je v něm obsažen, se přisuzují protizánětlivé a hojivé účinky), ale je třeba myslet na to, že u někoho mohou ovocné džusy a ananas naopak vést k reakcím v podobě tvorby aft; nemocného je nutno na toto nebezpečí upozornit a doporučení individualizovat podle pacientovy zkušenosti. Kyselost džusů také může způsobit bolestivost.
Lokální kortikosteroidy
Roztoky nebo gely s obsahem dexamethasonu podávané samostatně nebo v kombinaci s lokálním anestetikem se doporučují a mohou být dobře účinné v potlačení bolesti a hojení aftózních defektů, a především stomatitidy u pacientů léčených inhibitory m TOR (everolimus, temsirolimus, sirolimus) [5,32] nebo u pacientů s GVHD po alotransplantaci kostní dřeně [33]. Ideální je lokální aplikace těchto přípravků vatovou štětičkou přímo do míst aft. V této indikaci se také uplatňuje magistraliter příprava v lékárně, níže jsou uvedeny příklady některých používaných magistraliter přípravků.
Rp.
Dexamethasoni acetatis 0,1
Methylcellulosi 5,0
Aq. purif. ad 100,0
M. f. sol.
Rp.
Dexamethasoni acetatis 0,02
Trimecaini hydrochloridi 1,0
Aluminii acetotartratis sol. 5,0
Ethanoli 60% 10,0
Methylrosanilinii chlor. sol. 0,5% gtt. III (tres)
Menthae piper. etherol. gtt. I
Methylcellulosi 0,4
Aq. purif. ad 50,0
M. f. sol.
Analgetika
Kromě výše uvedených roztoků a gelů lze ke zmírnění obtíží nabídnout k vyzkoušení cucavé pastilky s obsahem benzocainu, případně navíc s obsahem antimikrobiálního chlorhexidinu. Roztoky, pastilky nebo sprej s benzydaminem rovněž přinášejí do určité míry úlevu od bolesti, ale u někoho mohou vyvolávat počáteční štiplavost, obzvláště při současném obsahu ethanolu.
Další možností lokálního ovlivnění bolesti jsou roztoky s obsahem lokálních anestetik, například lidocainu nebo trimecainu. Není vhodné jejich kloktání, obzvláště při vyšší koncentraci, z důvodu rizika útlumu polykacího reflexu s nebezpečím aspirace do dýchacích cest. Výraznější místní znecitlivění sliznic může také zvýšit riziko traumatu při žvýkání a kousání a při větších defektech sliznice je nutné počítat i s vyšší absorpcí anestetik s jejich systémovým působením. Roztok lze připravit magistraliter v lékárně a příkladem je např. tato používaná receptura:
Rp.
Lidocaini hydrochloridi 2,0
Dexpanthenoli
Glyceroli 85% aa 10,0
Natrii hydrogenophosph. dodecahydr. 0,1
Aq. conservans ad 200,0
M. f. sol.
Lokálně lze provádět opakované výplachy dutiny ústní s roztokem 1% nebo 2% morfinu u pacientů po chemoradioterapii pro karcinom hlavy a krku, které rovněž přispívají ke snížení intenzity a trvání lokálních bolestí, aniž by jejich aplikace byla doprovázena zásadními nežádoucími účinky [34].
Při výrazných bolestech je nutno volit systémová analgetika. Jako první stupeň se nabízí nesteroidní antirevmatika, která se ale vyznačují slabší účinností a jejich podávání je spojeno s riziky, jako je zvýšená krvácivost a jaterní, renální a gastrointestinální toxicita. Využívá se zde tedy především tramadol podávaný perorálně (p.o.) nebo intravenózně (i.v.), dále pak morfin podávaný subkutánně (s.c.) nebo i.v. V případě dlouhodobější bolestivosti lze využívat transdermální formy opioidů – náplasti s obsahem fentanylu a buprenorfinu, které však mají pomalý nástup účinku a při jejichž aplikaci není možno rychle upravovat dávky podle potřeby při akutním zhoršení během polykání a žvýkání [35,36].
Jiné možnosti
N acetyl cystein je mukolytikum, antidotum paracetamolu a antioxidant, který nejspíše přispívá ve vysokých dávkách aplikovaných i.v. ke snížení rizika vzniku mukositidy u pacientů po alogenní transplantaci krvetvorných buněk [37]. Glutamin je aminokyselina významná pro zajištění integrity sliznic gastrointestinálního traktu, výsledky hodnocení jsou ale sporné a není jednoznačně prokázáno, že by glutamin suplementovaný perorálně nebo parenterálně vedl jednoznačně ke snížení incidence mukositidy.
 Amifostin je selektivní radioprotektivní látka chránící před vlivem volných kyslíkových radikálů. Mimo jiné má nejspíše i pozitivní vliv na redukci výskytu mukositidy, je li podán profylakticky krátce před aplikací vysokodávkovaného melfalanu u pacientů s autologní transplantací krvetvorných buněk; obecně je aminofostin doporučován při aktinoterapii oblasti hlavy a krku a při kombinované chemoaktinoterapii nemalobuněčného plicního karcinomu. Reálné využití aminofostinu je však nízké.
Amifostin je selektivní radioprotektivní látka chránící před vlivem volných kyslíkových radikálů. Mimo jiné má nejspíše i pozitivní vliv na redukci výskytu mukositidy, je li podán profylakticky krátce před aplikací vysokodávkovaného melfalanu u pacientů s autologní transplantací krvetvorných buněk; obecně je aminofostin doporučován při aktinoterapii oblasti hlavy a krku a při kombinované chemoaktinoterapii nemalobuněčného plicního karcinomu. Reálné využití aminofostinu je však nízké.
Palifermin je růstový faktor keratinocytů, který podporuje ochranu epitelií a jejich regeneraci. Původně byl doporučován jako prevence mukositidy po autologní transplantaci krvetvorných buněk po přípravě s celotělovým ozářením, využívá se omezeně u alogenních transplantací krvetvorných buněk, příznivě působí při radiochemoterapii pro karcinomy hlavy a krku, při léčbě fluorouracilem pro metastatický kolorektální karcinom, ale limitem využití paliferminu je ekonomická náročnost, úzká indikace a otázka možné dlouhodobé rizikovosti.
Nízkoenergetické lasery podporují hojení tkání a působí pozitivně na snížení výskytu a trvání mukositidy po vysokodávkované chemoterapii s transplantací krvetvorných buněk, po chemoradioterapii oblasti hlavy a krku a také u pacientů s GVHD po alogenní transplantaci kostní dřeně. Dostupnost metody je však velmi omezená a v běžné praxi nedosahuje výraznějšího rozšíření [17].
Nutriční podpora
Z důvodu předpokládaného nebo již reálného omezení perorálního příjmu stravy u pacientů ohrožených nebo již postižených mukositidou dutiny ústní je nutno věnovat náležitou pozornost nutriční podpoře. U pacientů s nádory hlavy a krku s plánovanou vysoce rizikovou intenzivní radioterapií nebo radiochemoterapií je ve většině případů indikováno profylaktické zajištění nutričního přístupu prostřednictvím perkutánní endoskopické gastrostomie již před zahájením onkologické léčby. Základní metodou v rámci nutriční podpory je použití přípravků tzv. sippingu (po použití doporučeno vypláchnout dutinu ústní vodou), v těžkých případech doplnění parenterální výživy. Ideální je vždy spolupráce s nutričním týmem a včasné odhalení výživově ohrožených pacientů [38].
Závěr
Mukositida dutiny ústní je jedním z častých problémů postihujících pacienty s onkologickou léčbou. Představuje oblast, ve které se významně doplňuje ošetřovatelská i lékařská péče. Součástí přístupu vůči onkologickému pacientovi ohroženému mukositidou by mělo být zajištění všech dobře dostupných možností účinné prevence a léčby.Text nového odstavce.
Seznam použité literatury
- [1] Raber Durlacher J, Barasch A, Peterson E, et al. Oral complications and management considerations in patients treated with high dose cancer chemotherapy. Support Cancer Ther 2004; 1: 219–229.
- [2] Sonis S, Treister N, Chawla S, et al. Preliminary characterization of oral lesions associated with inhibitors of mammalian target of rapamycin in cancer patients. Cancer 2010; 116: 210–215.
- [3] Sonis S. The pathobiology of mucositis. Nat Rev Cancer 2004; 4: 277–284.
- [4] Laplante M, Sabatini DM. mTOR signaling in growth control and disease. Cell 2012; 13: 274–293.
- [5] Aapro M, Andre F, Blackwell K, et al. Adverse event management in patients with advanced cancer receiving oral everolimus: focus on breast cancer. Ann Oncol 2014; 25: 763–773.
- [6] Apewokin S, Wontumi GM, Kumar NS, et al. Severe mucositis and Clostridium difficile infection in adult autologous stem cell recipients: another question of the chicken or the egg? Biol Blood Marrow Transplant 2014; 20: 288.
- [7] Silva J, Fekety R, Werk C, et al. Inciting and etiologic agents of colitis. Reviews of infectious diseases 1984; 6 (Suppl 1): S214–221.
- [8] Alonso CD, Carolyn D, Dufresne SF, et al. Clostridium difficile Infection after Adult Autologous Stem Cell Transplantation: A Multicenter Study of Epidemiology and Risk Factors. Biol Blood Marrow Transplant 2013; 19: 1502–1508.
- [9] Rubenstein E, Peterson D, Schubert M, et al. Clinical practice guidelines for the prevention and treatment of cancer therapy induced oral and gastrointestinal mucositis. Cancer 2004; 100: 2026–2046.
- [10] Jones SE, Erban J, Overmoyer B, et al. Randomized phase III study of docetaxel compared with paclitaxel in metastatic breast cancer. J Clin Oncol 2005; 23: 5542–5551.
- [11] Yardley DA, Noguchi S, Pritchard KI, et al. Everolimus plus exemestane in postmenopausal patients with HR+ breast cancer: BOLERO 2 final progression free survival analysis. Adv Ther 2013; 30: 870–884.
- [12] Motzer RJ, Escudier B, Oudard S, et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer 2010; 15: 4256–4265.
- [13] Yao JC, Shah MH, Tetsuhide Ito, et al. Everolimus for Advanced Pancreatic Neuroendocrine Tumors. N Engl J Med 2011; 364: 514–523.
- [14] Pavel ME, Hainsworth JD, Baudin E, et al. Everolimus plus octreotide long acting repeatable for the treatment of advanced neuroendocrine tumours associated with carcinoid syndrome (RADIANT 2): a randomised, placebo controlled, phase 3 study. Lancet 2011; 378: 2005–2012.
- [15] Mahe E, Morelon E, Lechaton S, et al. Cutaneous adverse events in renal transplant recipients receiving sirolimus based therapy. Transplantation 2005; 79: 476–482.
- [16] Villa A, Aboalela A, Luskin KA, et al. mTOR Inhibitor Associated Stomatitis in Hematopoietic Stem Cell Transplant Patients Receiving Sirolimus Prophylaxis for Graft versus Host Disease. Biol Blood Marrow Transplant 2015, doi: 10.1016/j.bbmt.2014.11.680. In press.
- [17] Svoboda T, Vokurka S. Postižení dutiny ústní a orofaryngu po radioterapii (postiradiační mukositida), in Vokurka S, Postižení dutiny ústní onkologických pacientů, Praha, 1. vydání, CurrentMedia 2014, 144 s.
- [18] Ulrich C, Yasui Y, Storb R, et al. Pharmacogenetics of methotrexate: toxicity among marrow transplantation patients varies with the methylenetetrahydrofolate reductase C677T polymorphism. Blood 2001; 98: 231–234.
- [19] Vokurka S. Variabilita dávek melfalanu vztažených na kilogram tělesné hmotnosti a následky. Klin Onkol 2010; 23: 452–453.
- [20] Vokurka S, Bystřická E, Ščudlová J, et al. The risk factors for oral mucositis and the effect of cryotherapy in patients after the BEAM and HD L PAM 200 mg/m2 autologous hematopoietic stem cell transplantation. Eur J Oncol Nurs 2011; 15: 508–512.
- [21] Vokurka S, Chvojková I, Svoboda T, et al. The impact of oral cryotherapy and oral and gastrointestinal mucositis after autologous stem cell transplantation. Eur J Oncol Nurs 2014; 18: 228–229.
- [22] Perez A, Rugo HS, Baselga J, et al. Clinical management and resolution of stomatitis in BOLERO 2. Poster Presentation at ASCO 49th annual Meeting; May 2013; poster 558.
- [23] Vokurka S, Svoboda T, Karas M, et al. Significant oral graft versus host disease after allogeneic stem cell transplantation with the FLU/MEL conditioning regimen. Med Sci Monit 2011; 17: 480–484.
- [24] Lalla R, Sonis S, Peterson D. Management of Oral Mucositis in Patients with Cancer. Dent Clin North Am 2008; 52: 61–68.
- [25] http://www.rtog.org/ResearchAssociates/AdverseEventReporting.aspx (navštíveno 28. 12. 2014)
- [26] Elad S, Raber Durlacher JE, Brennan MT, et al. Basic oral care for hematology oncology patients and hematopoietic stem cell transplantation recipients: a position paper from the joint task force of the Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology (MASCC/ISOO) and the European Society for Blood and Marrow Transplantation (EBMT). Support Care Cancer 2015; 23: 223–236.
- [27] Peterson DE, Bensadoun RJ, Roila F. Management of oral and gastrointestinal mucositis: ESMO Clinical Recommendations. Ann Oncol 2008; 19: 122–125.
- [28] Bensinger W, Schubert M, Ang KK, et al. Task Force Report: Prevention and management of mucositis in cancer care. J Natl Compr Canc Netw 2008; 6 (Suppl 1): 1–21.
- [29] Miyamoto C, Wobb JA. Retrospective Match Controlled Study Of Supersaturated Calcium Phosphate Oral Rinse vs. Supportive Care For Radiation Induced Oral Mucositis. Support Care Cancer 2009; 17: 857–1039.
- [30] Tombes M, Galluci B. The effect of hydrogen peroxide rinses on the normal oral mucosa. Nurs Res 1993; 42: 332–337.
- [31] Kite K, Pearson L. A rationale for mouth care: the integration of theory with practice. Intensive Crit Care Nurs 1995; 11: 71–76.
- [32] Pilotte AP, Hohos MB, Polson KM, et al. Managing stomatitis in patients treated with Mammalian target of rapamycin inhibitors. Clin J Oncol Nurs 2011; 15: 83–89.
- [33] Meier JK, Wolff D, Pavletic S, et al. Oral chronic graft versus host disease: report from the International Consensus Conference on clinical practice in cGVHD. Clin Oral Investig 2011; 15: 127–139.
- [34] Haritha TC, Shankar V. Oral morphine gargles: A cost effective approach for pain relief in patients with chemoradiation induced acute oral mucositis in head and neck cancers. J Clin Oncol 2009; 27: 20504.
- [35] Strupp C, Sudhoff T, Germing U, et al. Transdermal fentanyl during high dose chemotherapy and autologous stem cell support. Oncol Rep 2000; 7: 659–661.
- [36] Huscher A, Smussi I, Borghetti P, et al. Transdermal buprenorphine for oropharyngeal mucositis associated pain in patients treated with radiotherapy for head and neck cancer. J Palliat Med 2010; 13: 357–358.
- [37] Moslehi A, Taghizadeh Ghehi M, Gholami K, et al. N acetyl cysteine for prevention of oral mucositis in hematopoietic SCT: a double blind, randomized, placebo controlled trial. Bone Marrow Transplant 2014; 49: 818–823.
- [38] Beneš P, Holečková P, Krčmová L, et. Indikace nutriční podpory onkologicky nemocných. Modrá kniha České onkologické společnosti 2014; 19: 200–205.