Mukozitida dutiny ústní u onkologických pacientů
Mukozitida dutiny ústní je častým nežádoucím účinkem radioterapie u nádorů v oblasti hlavy a krku a intenzivní chemoterapie. Je způsobena poškozením slizniční a podslizniční tkáně. Mukozitida dutiny ústní svými projevy zhoršuje kvalitu pacientova života a může negativně ovlivnit průběh, výsledek léčby i léčebné náklady. Základním přístupem je péče o dutinu ústní. Léčba mukozitidy je zaměřena především na zlepšení symptomů, pouze u určité skupiny pacientů je možno použít specifická profylaktická opatření.
Úvod
Mukozitida trávicího systému jako následek poškození slizniční a podslizniční tkáně patří k častým nehematologickým komplikacím u pacientů léčených chemoterapií a k lokálním reakcím u pacientů léčených radioterapií. Poškození orální části – mukozitida dutiny ústní (dutiny ústní a faryngu) – je definováno jako zánětlivé a/nebo vředové léze postihující sliznici této oblasti. Mukozitida dutiny ústní představuje častou komplikaci intenzivní protinádorové léčby – radioterapie a chemoterapie [1]. Poškození sliznice negativně ovlivňuje její základní funkce. Takto narušená slizniční bariéra umožňuje průnik patogenních mikroorganismů a zvyšuje riziko infekce. Dochází ke snížené produkci slin s rozvojem xerostomie, poruše vnímání chutí, dyskomfortu, bolestivosti, což následně vede k poruše perorálního příjmu potravy se všemi negativními důsledky. Celkově mukozitida dutiny ústní zhoršuje kvalitu pacientova života; jako nejvíce obtěžující komplikaci léčby ji například udávalo 42 % pacientů léčených vysokodávkovanou chemoterapií a 38 % pacientů léčených radioterapií [2, 3]. Stejně tak může mukozitida dutiny ústní negativně ovlivnit průběh a výsledek onkologické léčby a náklady na tuto terapii. U vysokodávkované chemoterapie může být rovněž příčinou fatálních komplikací [4, 5].
Epidemiologie, rizikové faktory
Obecně jsou výskyt a závažnost mukozitidy dutiny ústní spojeny zejména s charakterem a intenzitou protinádorové léčby. Při použití vysokodávkované chemoterapie, s celotělovým ozářením nebo bez něj, se popisuje její výskyt u 70–95 % nemocných, kdy těžší formy – 3. a 4. stupně podle stupnice Světové zdravotnické organizace (World Health Organization, WHO) – se pohybují v rozmezí 25–60 % dle typu po-užitého režimu [6, 7]. Při běžné, standard-ní chemoterapii je četnost výskytu závažných forem mukozidity dutiny ústní nízká (1–15 %) [8]. Mezi riziková cytostatika poškozující sliznici patří zejména antimetabolity – především 5-fluorouracil a dále methotrexát. Mukozitida dutiny ústní může vzniknout např. i po léčbě taxany, antracykliny a dalšími cytostatiky, avšak v menší míře [9]. Riziko jejího rozvoje je ovlivněno použitým chemoterapeutickým režimem (druh cytostatika, jejich vzájemná kombinace, dávka a způsob podání) a zvyšuje se s počtem aplikovaných cyklů a s předchozí epizodou mukozitidy [10]. U naprosté většiny pacientů s nádory ORL oblasti léčených radioterapií se lze vždy setkat s určitým stupněm mukozitidy. Rozsah postižení souvisí s lokalizací/rozsahem primárního nádoru a objemem ozářené sliznice. Kombinovaná chemoradioterapie nebo alterované frakcionační režimy (např. ozařování dvakrát denně) zvyšují prevalenci, závažnost a trvání akutní mukozitidy [11]. Léčba zářením je nejčastěji potencována plati-novým derivátem. Při léčbě zářením u pa-cientů s nádory hlavy a krku byla mukozitida 3. a 4. stupně dle WHO popsána při konvenční radioterapii ve 37 % případů, při akcelerované radioterapii v 57 % případů a u kombinované chemoradioterapie ve 43 % případů [12]. Zatímco mukozitida vznikající při ozařování je lokální slizniční reakcí v místě ozařovaného pole, může chemoterapie indukovat mukozitidu napříč celým zažívacím traktem. Nežádoucí účinky v dutině ústní se mohou objevit i u cílené léčby (targeted therapy), kdy u většiny těchto léků jsou však v popředí jiné formy toxicity. Slizniční projevy jsou ve většině případů popsány jako mírné, případně střední intenzity. Častější slizniční změny mohou být pozorovány při léčbě inhibitory mTOR (mammalian target of rapamycin) [1, 13, 14]. S mukozitidou se lze dále setkat např. při podávání inhibitorů tyrozinkinázy (např. sunitinibu) [1, 13]. Na vznik a závažnost mukozitidy mají podstatný vliv i další faktory (genetické), a tak se lze v praxi setkat s rozdílnou závažností toxicity u pacientů léčených identickými léčebnými režimy. Například deficit enzymů zodpovědných za degradaci cytostatik či polymorfismus genů zodpovědných za regulaci prozánětlivých dějů (např. polymorfismus genu pro TNF – tumor necrosis factor) ovlivňují riziko toxicity [15]. Špatný stav chrupu a špatná hygiena dutiny ústní zhoršují a komplikují průběh mukozitidy [16]. Věk nejspíše není rizikovým faktorem [16–18].
Patofyziologie
![Patofyziologický model mukozitidy; podle [21, 38] – Sonis, et al., 2004; Trněný, Skácel, 2006. V 1. fázi (iniciace) dochází k přímému poškození DNA epiteliálních buněk a k tvorbě vysoce reaktivních volných radikálů (ROS), které dále poškozují epitelové buňky a buňky submukózy (endotel, fibroblasty). Poškození a přenos této informace spouští řadu signálních drah a kaskádu dějů, které dále vedou k buněčné smrti a slizničnímu poškození. Ve 2. fázi (signalizace, up-regulace) dochází k aktivaci transkripčních faktorů – nukleárního faktoru κB (NF-κB), což vede k nadprodukci prozánětlivých cytokinů, např. tumor nekrotizujícího faktoru α (TNF-α) a interleukinů (IL-1, IL-6), které se podílejí na dalším poškozování tkáně. Aktivují se i enzymy, které hydrolyzují buněčné membrány (sfingomyelináza, ceramid-syntetáza). Ve 3. fázi (amplifikace) zánětlivé cytokiny dále poškozují tkáň zesílením signální kaskády v důsledku pozitivní zpětné vazby (např. TNF-α zpětně aktivuje NF-κB, dochází k transkripci genů pro cyklooxygenázu 2). Dochází ke snížení epiteliálního obratu a obnovy. V této fázi je ještě celistvost sliznice neporušena, ale již se může objevit v dutině ústní erytém. Ve 4. fázi (ulcerace) dosahuje poškození tkáně maxima, kdy dochází ke ztrátě slizniční integrity a vzniku defektů, které obnažují submukózu a jsou vstupní branou pro infekční agens. Bakteriální kolonizace způsobuje stimulaci makrofágů s aktivní produkcí cytokinů a další poškození tkáně. Řada defektů bývá na povrchu kryta fibrinovou pablánou. V poslední, 5. fázi (hojení) dochází ke snížení produkce cytokinů a signalizací z oblasti submukózy dochází k proliferaci, diferenciaci a migraci epitelových buněk. Charakter hojení závisí na rozsahu postižení a trvání této fáze je ovlivněno faktory, které hojení ovlivňují, jako je např. infekce nebo mechanické dráždění [10]. Nedostatečná buněčná regenerace vyúsťuje v epiteliální atrofii a ztenčení mukózy.](https://www.remedia.cz/photo-a-28758---.jpg) Epiteliální buňky sliznice dutiny ústní procházejí rychlým buněčným obratem. Působením radioterapie a chemoterapie dochází jak k epiteliálnímu poškození, tak ke změnám v submukóze. Patofyziologický model popisující tento proces se skládá z pěti fází (obr. 1) [19–23].
Epiteliální buňky sliznice dutiny ústní procházejí rychlým buněčným obratem. Působením radioterapie a chemoterapie dochází jak k epiteliálnímu poškození, tak ke změnám v submukóze. Patofyziologický model popisující tento proces se skládá z pěti fází (obr. 1) [19–23].
Klinický obraz
Změny na molekulární a buněčné úrovni vznikají bezprostředně po zahájení cytotoxické léčby, klinicky se však projeví až s určitým časovým odstupem. Po chemo-terapii a ozáření lze zpočátku pozorovat prosáknutí sliznic, které mají vybledlý nádech. Bukálně nebo po okraji jazyka může být patrné jakési vroubkování či žebrování způsobené otisky zubů (tzv. scalloping, viz obr. 2a) [23]. Dále se objevuje erytém, atrofie, zejména patrná na ja-zyku s vyhlazením papil, a postupně různě rozsáhlé a hluboké defekty, které jsou většinou kryty bělavou nebo žlutavou pablánou („špekovitý vzhled“), doprovázené bolestivostí (obr. 2b). U ozařovaných pa-cientů často dochází ke splývání defektů (konfluentní mukozitida). V případě těžkých mukozitid se mohou objevovat i slizniční krvácivé projevy, zejména při současné trombocytopenii. Projevy mukozitidy dutiny ústní po chemoterapii nastupují nejčastěji za 4–8 dní po aplikaci cytostatika a přetrvávají podle závažnosti poškození průměrně 7–14 dní [24]. U pacientů léčených zevní radioterapií standardní frakcionací se objevuje erytém okolo 3. týdne ozařování (při dávce vyšší než 20 Gy) a výraznější klinické projevy mukozitidy nastupují ve druhé polovině ozařování (při dávce vyšší než 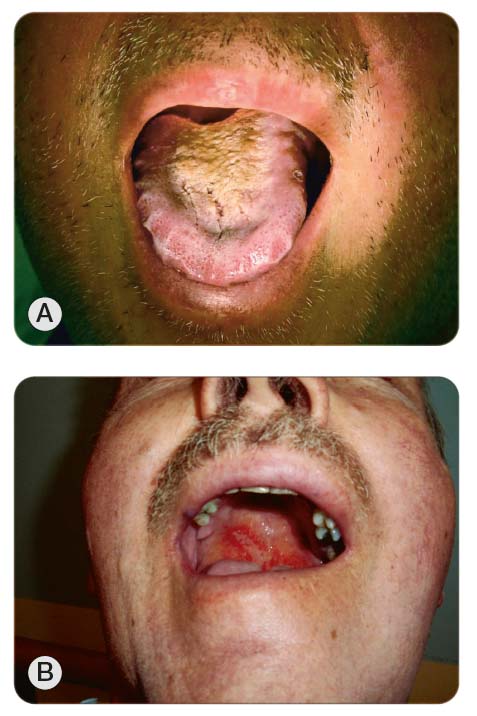
30 Gy, okolo 4. týdne ozařování). Ke zhojení obvykle dochází v průběhu 2–6 týdnů, u závažnějších forem i později. U pacientů léčených brachyterapií (ozařováním z krátké vzdálenosti) se mukozitida manifestuje za 7–10 dní s vrcholem kolem 2 týdnů [11, 25]. Při cytotoxické léčbě dochází k postižení chuťových pohárků a u pacienta vzniká částečná nebo úplná porucha vnímání chutí nebo je vnímání chutí změněno. Stejně tak dochází k rozvoji suchosti v ústech (xerostomii), jež je následkem postižení malých a zejména velkých slinných žláz. Xerosto-mie je velmi častá u ozařovaných pacientů a může přetrvávat jako pozdní, ireverzibilní následek ozařování. Suchost sliznice zvyšuje riziko infekce, zubního kazu a způsobuje těžkosti při žvýkání, polykání a řeči [26, 27]. Další pozdní postradiační změny, které mohou postihnout slizniční výstelku horní části zažívacího traktu, zahrnují atrofii a bledost, ztrátu pružnosti sliznice, teleangiektazie. K nejzávažnějším, ale zcela výjimečným, patří vznik chronické ulcera-ce/nekrózy. K rozvoji chronických postradiačních změn dochází nejčastěji v rozmezí 6 měsíců až 3 let [28]. Mukozitida v dutině ústní se v případě cílené terapie může projevovat např. pod klinickým obrazem erytému, zvýšené citlivosti, povrchových ulcerací krytých pseudomembránou nebo podobným obrazem jako u „aftózní stomatitidy“ [13, 14].
Predilekční lokalizací slizničního poškození při chemoterapii je oblast sliznic, které nejsou na povrchu keratinizovány, jako sliznice tváří, ventrální a laterální povrch jazyka, spodina dutiny ústní a měkké patro. U mukozitidy indukované radioterapií může být postižena celá ozařovaná slizniční oblast, ale nekeratinizované sliznice jsou ovlivněny častěji [29].
Hodnocení
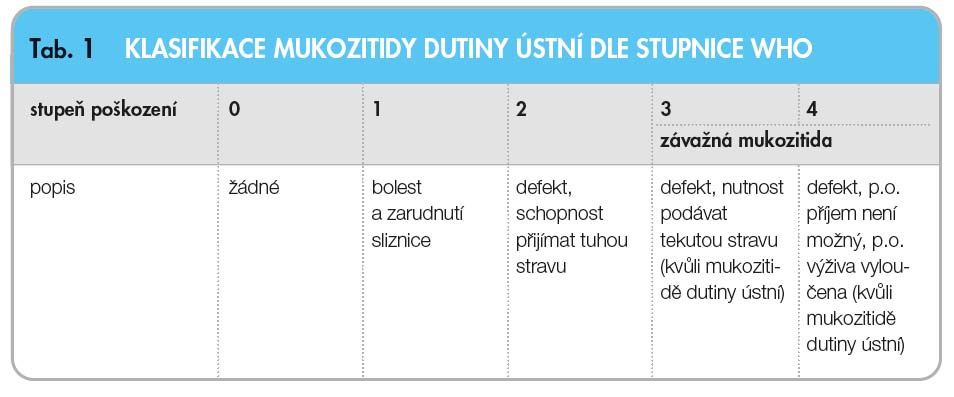 K hodnocení klinické závažnosti mukozitidy v dutině ústní je vypracováno několik skórovacích systémů. Stupně škály skó-rovacích systémů vycházejí z hodnocení lokálního slizničního nálezu a dalších přidružených symptomů (bolest) a funkčních změn (možnost polykání). Se zvyšujícím se stupněm stoupá závažnost slizničního postižení. Mezi časté používané skórovací systémy v praxi a klinických studiích patří hodnocení dle systému WHO (tab. 1) a NCI-CTCAE (National Cancer Institute – Common Toxicity Criteria) verze 4 [1]. U ozařova-ných pacientů se také používá klasifikace dle RTOG/EORTC (Radiation Therapy On-cology Group/European Organization for Research and Treatment of Cancer), která nežádoucí účinky dělí na akutní a chronické [27].
K hodnocení klinické závažnosti mukozitidy v dutině ústní je vypracováno několik skórovacích systémů. Stupně škály skó-rovacích systémů vycházejí z hodnocení lokálního slizničního nálezu a dalších přidružených symptomů (bolest) a funkčních změn (možnost polykání). Se zvyšujícím se stupněm stoupá závažnost slizničního postižení. Mezi časté používané skórovací systémy v praxi a klinických studiích patří hodnocení dle systému WHO (tab. 1) a NCI-CTCAE (National Cancer Institute – Common Toxicity Criteria) verze 4 [1]. U ozařova-ných pacientů se také používá klasifikace dle RTOG/EORTC (Radiation Therapy On-cology Group/European Organization for Research and Treatment of Cancer), která nežádoucí účinky dělí na akutní a chronické [27].
Prevence a léčba mukozitidy
Na možnost vzniku mukozitidy dutiny ústní je třeba myslet ještě před zahájením onkologické léčby, při níž může k jejímu vzniku dojít, a pacienta je nutno řádně po-učit. U pacientů před léčbou zářením v této oblasti a u pacientů před zahájením vysokodávkované chemoterapie s transplantací krvetvorných buněk je prováděno stomatologické vyšetření s ošetřením potenciálních zdrojů odontogenní fokální infekce, s odstraněním zubního kamene a zbroušením ostrých hran zubů a protéz, aby nedocházelo k traumatizaci okolní sliznice. Významné je i načasování předléčebných a případně i poléčebných stomatologických intervencí. Důležité je poučit rizikové pacienty o základní péči o dutinu ústní a chrup [1, 18]. K ní patří správné čištění chrupu (Stillmannova technika, měkký kartáček), čištění snímacích zubních náhrad a omezení jejich užívání pouze na jídlo. V základní péči je dále důležité udržovat čistotu a vlhkost sliznic pomocí častých, pravidelných výplachů dutiny ústní roztoky (např. fyziologický roztok nebo jiné), které by neměly být pacientovi odpudivé nebo dráždivé. Je vhodné se vyhnout přípravkům s obsahem alkoholu. Teplota výplachů je individuální, na základě dostavující se úlevy pacienta. Čistota sliznic omezuje nepříznivý vliv mikroflóry na průběh mukozitidy a snižuje riziko místních a celkových infekcí [24]. Mukozitida může být komplikována mykotickou, bakteriální nebo virovou infekcí, kdy riziko sekundární infekce hrozí zej-ména při myelosupresi. Dle rizika, charakteru a závažnosti infekce je tak používána lokální nebo systémová léčba (lokální antiseptika, antibiotika, antimykotika a antivirotika). U těžkých mukozitid, u nesamostatných pacientů, při infekčním postižení jsou vhodné roztoky s antimikrobiálním účinkem, které jinak samy o sobě nemají preventivní potenciál zabránit rozvoji mukozitidy dutiny ústní [24]. Poškozená slizniční bariéra usnadňuje průnik patogenů, jako jsou např. streptokoky, stafylokoky, anaerobní či gramnegativní bakterie (Klebsiella pneumoniae, Pseudomonas aeruginosa, enterobakterie). K lokálním antiseptickým a protizánětlivým přípravkům patří např. přípravky s chlorhexidinem a benzydaminem. V případě mykotické infekce se nejčastěji jedná o kandidózu (převážně Candida albicans, ale i ostatní druhy). K léčbě kandidózy se používá např. klotrimazol, ketokonazol, flukonazol a itrakonazol. Z virových infekcí se může vyskytnout infekce virem Herpes simplex, Coxsac-kie viry, dále virem Varicella zoster nebo cytomegalovirem [26]. Vhodné je vyšetření kultur.
Ve snaze omezit rozvoj mukozitidy v dutině ústní je v praxi využíván elektrolytový roztok s vysokým obsahem fosfátových a kalciových iontů (Caphosol), který podle dosavadních pozorování přispívá k redukci výskytu a závažnosti mukozitidy dutiny ústní u pacientů po transplantaci krvetvorných buněk nebo při radioterapii u nádorů hlavy a krku [1, 30–32]. V podpůrné péči jsou dále využívány adhezivní prostředky, které zmírňují symptomy mu-kozitidy. Používány jsou např. přípravky Gelclair, GUM-Aftamed a Bioxtra [1, 30]. Podle stupně viskozity vytvářejí jemný film na sliznici, který překrytím obnažených nervových zakončení a adhezí na defekty přináší úlevu od bolesti. Přípravky zároveň přispívají k udržení vlhkosti sliznic. Pokud pacienti používají kromě těchto adhezivních přípravků i jiné přípravky na ošetření sliznice, měly by se takovéto přípravky použít před jejich aplikací [33]. Přípravek Gelclair a GUM-Aftamed obsahují kyselinu hyaluronovou. Přípravek Bioxtra obsahuje bioaktivní antimikrobiální složky – laktoferin, lysozym, laktoperoxidázu. Jednoznačný ochranný slizniční efekt při mukozitidě dutiny ústní nebyl prokázán u sukralfátu a tento lék není běžně doporučován [1, 18].Další obecně doporučovaná režimová opatření směřují ke snížení slizničního poranění. Pacientovi je doporučováno vyloučit ostrá a dráždivá jídla, vynechat kousání tuhých potravin, vynechat kouření a alkohol a další nevhodné návyky, které mohou sliznici zraňovat [18]. Důležité je neopomíjet rozvahu o případné nutriční podpoře. V případech velmi těžké mukozitidy vedoucí k omezenému příjmu potravy a tekutin se musí zahájit podpůrná nebo úplná parenterální výživa. U pacientů s nádory hlavy a krku s plánovanou intenzivní radiotera-pií nebo radiochemoterapií je ve většině případů indikováno profylaktické zajištění nutričního přístupu (PEG – perkutánní endoskopická gastrostomie), a to již před zahájením léčby, jelikož je vysoká prav-děpodobnost, že v průběhu léčby dojde k nedostatečnému příjmu potravy [34, 35]. Pacienti by však měli být nadále podporováni v polykání [36].
K cytoprotektivním opatřením, která snižují riziko rozvoje mukozitidy, přispívá několik intervencí [37]. Lokální kryoterapie, jež k ochraně sliznic využívá místní-ho podchlazení s efektem vazokonstrikce a tím menšího vystavení tkáně cytostatiku. Působení chladu (např. ledová tříšť) má začít 5 minut před aplikací cytostatika a pokračovat po dobu 30 minut. Kryoterapie je doporučována při bolusové aplikaci fluorouracilu a vysokodávkovaného melfalanu [1]. Patofyziologické poznatky o mukozitidě přispěly k identifikaci látek vhodných pro klinické účely. Růstový faktor pro keratinocyty (KGF – keratinocyte growth factor) se podílí na proliferaci a diferenciaci epiteliálních buněk. Palifermin je rekombinantní formou lidského KGF, který se váže na receptor ze skupiny receptorů pro fibroblastové růstové faktory. Tento receptor (KGF-receptor) je exprimován pouze na epiteliálních buňkách. Vazbou je aktivována tyrozinkinázová cesta, která vede k proliferaci, diferenciaci a migraci epitelových buněk. Dále dochází k aktivaci cytoprotektivních mechanismů, např. ke snížení apoptózy a zvýšení hladiny enzymů chránících před volnými radikály [38]. V pro-vedených studiích palifermin snižoval incidenci a zlepšoval průběh mukozitidy. Ve formě několikadenní intravenózní infuze je doporučován k profylaxi mukozitidy dutiny ústní u pacientů podstupujících vysokodávkovanou chemoterapii a celotělové ozáření s autologní transplantací krvetvorných buněk [1]. Palifermin je také studován u solidních nádorů a potenciální přínos byl zaznamenán i u pacientů s nádory hlavy a krku léčených radiochemoterapií. Rozšíření indikací musí být podpořeno dalšími studiemi [1].
Při léčbě zářením se používají konformní techniky ozařování, které umožňují přizpůsobit ozařovaný objem nepravidelnému léčenému objemu a tím dosahovat většího šetření zdravých tkání. Vysoce konformní technika – IMRT (intensity modulated radio-therapy) – má potenciál omezit celkový objem sliznice spojený s vysokým stupněm mukozitidy a omezit dávku na funkčně důležité struktury (např. slinné žlázy, hrtan, krční jícen) [35].
Komplementární možností u mukozitidy dutiny ústní je použití nízkoenergetických laserů, které podporují regeneraci a hojení tkáně a mají efekt na snížení rozsahu a intenzity i na zkrácení doby trvání mukozitidy [1].
V případě mukozitidy indukované cílenou terapií nejsou vypracována specific-ká doporučení. Je možno použít obecnou symptomatickou péči jako u cytotoxické léčby nebo např. u defektů napodobujících aftózní stomatitidu lze podávat léčbu po-užívanou při tomto onemocnění [1, 14].
Léčba bolesti je jedním z důležitých aspektů v péči o pacienta s mukozitidou dutiny ústní. Je třeba na ni myslet a podává-ní analgetik zahájit včas. Při mírné bolesti mohou být dostačující lokální prostředky (přípravky s obsahem benzokainu, eventuálně s obsahem chlorhexidinu). Přípravky s benzydaminem potlačují tvorbu zánětlivých cytokinů a mohou přinést úlevu od bolesti, ale u některých pacientů mohou navozovat počáteční lehké pálení v ústech. Dále se jedná o lokální gely nebo roztoky s obsahem anestetik (např. lidokain, trimekain). K ovlivnění lokální bolestivosti je další možností provádění výplachů dutiny ústní 1% nebo 2% roztokem morfinu [30]. V případě neustupujících bolestí nebo silnějších bolestí je třeba zahájit systémovou analgetickou léčbu. Z analgetického žebříčku WHO se častěji využívají analgetika II. a III. stupně. Vhodným základním analgetikem je slabý opioid (tramadol). V případě silnějších bolestí, především při poradiační mukozitidě dutiny ústní nebo po transplantaci krvetvorných buněk, jsou pak vhodnou volbou silné opioidy v různých lékových formách [30].
Závěr
Základním přístupem u onkologického pacienta ohroženého mukozitidou je zajištění maximálně účinné péče k ochraně slizniční tkáně. I přes poměrně širokou nabídku ochranných přípravků zůstává základem prevence a léčby mukozitidy spolupracující pacient. Bez získání aktivního přístupu pacienta k léčbě onkologického onemocnění jsou vedlejší projevy léčby vždy závažnějšího charakteru.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem ČR OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101.
Seznam použité literatury
- [1] Peterson DE, Bensadoun RJ, Roila F. Management of oral and gastrointestinal mucositis: ESMO Clinical Practice Guidelines. Ann Oncol 2011; 22 (Suppl 6): 78–84.
- [2] Bellm, LA, Epstein JB, Rose-Ped A, et al. Pa-tients reports of complication of bone marrow transplantation. Support Care Cancer 2000; 8: 33–39.
- [3] Rose-Ped AM, Bellm LA, Epstein JB, et al. Complication of radiation therapy for head and neck cancers. The patient’s perspective. Cancer Nurs 2002; 25: 461–467.
- [4] Scully C, Sonis ST, Diz PD. Oral mucositis. Oral Diseases 2006; 12: 229–241.
- [5] Peterman A, Cella D, Glandon G, et al. Mucositis in head and neck cancer. Economic and quality-of-life outcomes. J Natl Cancer Inst Monogr 2001; 29: 45–51.
- [6] Gabriel DA, Shea T, Olajida O, et al. The effect of oral mucositis on morbidity and mortality in bone marrow transplant. Semin Oncol 2003; 30: 76–83.
- [7] Peterson DE. New strategies for management of oral mucositis in cancer patients. J Support Oncol 2006; 2: 9–14.
- [8] Redding SW. Cancer Therapy-Related Oral Mucositis. JDE 2005; 4: 919–929.
- [9] D’Hondt L, Lonchay CH, Marc A, et al. Oral mucositis induced by anticancer treatments: physiopathology and treatments. Ther Clin Risk Manag 2006; 2: 159–168.
- [10] Köstler WJ, Hejna M, Wenzel C, et al. Oral Mucositis Complicating Chemotherapy and/or Radio-therapy Options for Prevention and Treatment. CA Cancer J Clin 2001; 51: 290–315.
- [11] Naidu MUR, Ramana GV, Rani PU, et al. Chemotherapy-induced and/or radiation therapy-induced oral mucositis – complicating the treatment of cancer. Neoplasia 2004; 6: 423–431.
- [12] Trotti A, Bellm LA, Epstein JB, et al. Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: a systematic literature review. Radiother Oncol 2003; 66: 253–262.
- [13] Watters AL, Epstein JB, Agulnik M. Oral complications of targeted cancer therapies: A narrative literature review. Oral Oncology 2011; 47: 441–448.
- [14] Sonis S, Treister N, Chawla S, et al. Preliminary characterization of oral lesion associated with inhibitors of mammalian target of rapamycin in cancer patients. Cancer 2010; 1: 210–215.
- [15] Bowen JM, Keefe DMK. New pathways for alimentary mucositis. J Oncol 2008; 1–13.
- [16] Rubenstein E, Peterson D, Schubert M, et al. Clinical practice guidelines for preventive and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer 2004; 100: 2026–2046.
- [17] Lalla RV, Sonis ST, Douglas EP. Management of oral mucositis in patients with cancer. Dent Clin North Am 2008; 52: 61–77.
- [18] Besinger W, Schubert M, Ang KK, et al. NCCC Task Force Report: Prevention and management of mucositis in cancer care. JNCCN 2008; 6 (Suppl 1): 1–21.
- [19] Sonis ST. The pathobiology of mucositis. Nature Reviews Cancer 2004; 4: 277–284.
- [20] Treister N, Sonis S. Mucositis: biology and management. Curr Opin Otolaryngol Head Neck Surg 2007; 15: 123–129.
- [21] Sonis ST, Elting LS, Keefe DMK, et al. Perspectives on cancer therapy – induces mucosal injury: pathogenesis, measurement, epidemiology and consequences for patients. Cancer 2004; 100: 1996–2025.
- [22] Yeoh A, Gibson R, Yeoh E, et al. Radiation therapy-induced mucositis: Relationships between fractionated radiation, NF-kB, COX-1 and COX-2. Canc Treat Rev 2006; 32: 645–651.
- [23] Vokurka S. Mukozitida dutiny ústní a gastrointestinálního traktu u pacientů po chemoterapii – přehled. Klin Onkol 2007; 20: 23–28.
- [24] Vokurka S. Mukozitida dutiny ústní po chemoterapii a aktinoterapii v běžné praxi. Interní medicína pro praxi 2009; 11: 77–79.
- [25] Rodríquez-Caballero A, Torres-Lagares D, Robles-García M, et al. Cancer treatment – induced oral mucositis: a critical review. Int J Oral Maxillofac Surg 2011, article in press.
- [26] Jurga M a kol. Klinická a radiačná onkológia, druhý diel. 1. vyd. Martin; Osveta, 2010, 1658 s.
- [27] Šlampa P, Petera J a kol. Radiační onkologie. 1 vyd. Praha; Galén, 2007. 457 s.
- [28] Cooper JS, Karen FU, Marks J. Late effects of radiation therapy in the head and neck region. Int J Radiation Oncology Biol Phys 1995; 31: 1141–1164.
- [29] Stockman MA, Spijkervet FLK, Boezen HM, et al. Preventive intervention possibilities in radio-therapy and chemotherapy – induced oral mucositis: results of meta-analyses. J Dent Res 2006; 85: 690–700.
- [30] Vokurka S. Mukozitida dutiny ústní a laryngu – možnosti ovlivnění bolesti. Klin Onkol 2011; 24: 278–280.
- [31] Markiewitz M, Dzierzak Mietla M, Zielenska P, et al. Caphosol mouth rinse diminishes oral mucositis in allo-HSCP recipients. Blood 2010; 116: 3498.
- [32] Miyamoto C, Wobb J, Micaily B, et al. A retro-spective match controlled study of supersaturated calcium phospate oral rinse vs. supportive care of radiation induced oral mucositis. Support Care Cancer 2009; 17: 857–1039.
- [33] Hercová K. Mukozitida dutiny ústní při radioterapii v oblasti hlavy a krku. Onkologie 2009; 3: 127–129.
- [34] Autorský kolektiv. Zásady cytostatické léčby maligních onkologických onemocnění. Česká onkologická společnost ČLS JEP. 13 vyd. Brno; Masarykův onkologický ústav 2011, 230 s.
- [35] Rosenthal DI, Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin Radiat Oncol 2009; 19: 29–34.
- [36] Rosenthal DI, Lewin JS, Eisbruch A. Prevention and treatment of dysphagia and aspiration after chemoradiation for head and neck cancer. J Clin Oncol 2006; 24: 2636–2643.
- [37] Worthington HV, Clarkson JE, Bryan G, et al. Interventions for preventiv oral mucositis for pa-tients with cancer receiving treatment (Review). The Cochrane Library 2011; Issue 4: 1–222.
- [38] Trněný M, Skácel T. Rekombinantní lidský růstový faktor pro keratinocyty (rHuKGF) – palifermin: současný stav klinického použití. Farmakoterapie 2006; 5: 476–480.