Nazální kortikosteroidy a ovlivnění očních příznaků alergické rinitidy
Alergická rinitida je nejčastějším atopickým onemocněním, které postihuje 10–30 % populace. Základní charakteristikou alergické rinokonjunktivitidy je chronický eozinofilní zánět, proto vhodná protizánětlivá terapie představuje významný krok v léčbě. Alergická konjunktivitida doprovází až v 70 % alergickou rinitidu. Etiopatogeneticky je konjunktivální zánět totožný se zánětlivými procesy přítomnými u alergické rinitidy. Užití nazálních kortikosteroidů v léčbě středně těžké až těžké perzistující rýmy je dnes považováno za volbu první linie. Při pravidelné aplikaci nosních kortikosteroidů je pozorován současně účinek na oční příznaky v rámci rinokonjunktivitidy. S potlačením slizničního nosního zánětu je snižována iritace neuroreceptorů. Tímto nedochází k aktivaci tzv. nazo-okulárního reflexu a k rozvoji očních příznaků neurogenní cestou. Flutikason furoát jako jediný ze současných nazálních steroidů vykazuje ve všech studiích konzistentní zmírnění očních příznaků ve srovnání s placebem.
Úvod
Alergická onemocnění představují v současnosti globální zdravotnický problém. Jedná se o časté onemocnění, až 35 % rodin má zkušenosti s některým typem alergického onemocnění [1]. Nejčastějším projevem s výrazně vzestupnou prevalencí je alergická rinitida. V USA patří mezi 10 nejčastěji udávaných důvodů pro návštěvu praktického lékaře [2]. Alergická rýma v současnosti postihuje 10–30 % dospělé populace, u dětí je udávána téměř ve 40 % (dle ročního období a lokality) [3, 4]. 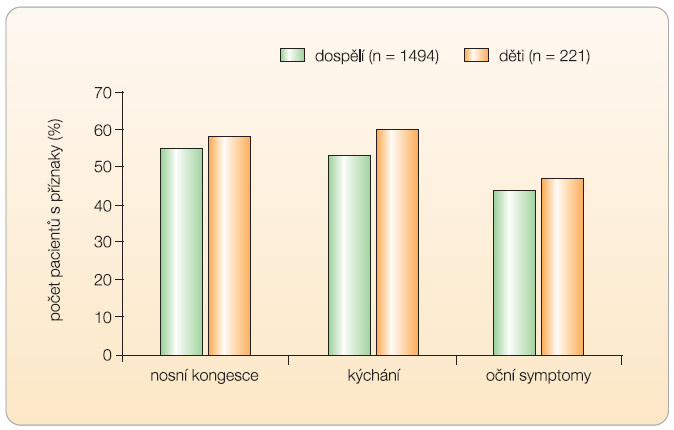 Alergická rýma je lokálním projevem systémového alergického onemocnění. Klinické projevy alergického onemocnění jsou individuálně variabilní, 60–70 % pacientů s alergickou rýmou (zejména s vazbou na pyl) má i projevy oční: alergickou konjunktivitidu. Používáme obvykle termín „alergická rinokonjunktivitida“ (výskyt očních a nosních příznaků u pacientů s alergickou rinokonjunktivitidou viz graf 1) [23].
Alergická rýma je lokálním projevem systémového alergického onemocnění. Klinické projevy alergického onemocnění jsou individuálně variabilní, 60–70 % pacientů s alergickou rýmou (zejména s vazbou na pyl) má i projevy oční: alergickou konjunktivitidu. Používáme obvykle termín „alergická rinokonjunktivitida“ (výskyt očních a nosních příznaků u pacientů s alergickou rinokonjunktivitidou viz graf 1) [23].
Alergická rýma byla po řadu let dělena dle typu senzibilizace na alergickou rýmu sezonní (SAR – seasonal allergic rhinitis) a alergickou rýmu celoroční (PAR – perennial allergic rhinitis). Tato klasifikace postupem času ztrácela na významu zejména z hlediska správné volby terapie [5].
Dokument vypracovaný mezinárodní skupinou expertů ve spolupráci se Světovou zdravotnickou organizací a iniciativou ARIA (Allergic Rhinitis and its Impact on Asthma) mění klasifikaci alergické rýmy, reviduje současnou terapii se zdůrazněním stupňovitého léčebného postupu. Nová klasifikace je založena na intenzitě a délce trvání příznaků a vychází z vlivu alergické rýmy na kvalitu života [6].
Faktory vyvolávající alergickou rinokonjunktivitidu (spouštěče)
Alergická rinitida je až v 60–80 % provázena alergickou konjunktivitidou. Jedná se o bilaterální konjunktivální zánětlivý proces vyskytující se u senzitizovaných jedinců. Přestože je v posledních 2 desetiletích u alergické rinitidy dokladován posun senzitizace k celoročním alergenům, u alergické konjunktivitidy i nadále převažuje vazba na pyly.
Pylové alergeny pocházejí zejména ze stromovin, travin a plevelů, z nichž se alergeny pylu travin podílejí až v 50 % na rozvoji pylové alergické rinokonjunktivitidy. I po ukončení pylové sezony však mohou u vysoce senzitizovaného jedince přetrvávat alergické příznaky, neboť pylové alergeny mohou být přítomny v interiérech i po pylovém období.
Pylová sezona v České republice trvá nejméně půl roku. Začíná již na konci února a končí počátkem října. V jarním období (někdy již v zimním období) jsou v ovzduší především pyly stromů. Již v únoru se uplatňují pyly olše a lísky. Vysokou alergenicitou se však vyznačuje bříza a jasan, pak následuje javor, habr, dub, ořešák. Období travin začíná v květnu a končívá v srpnu. Traviny jsou druhově pestré, ale tato pestrost nekomplikuje diagnostiku, protože imunologicky je zde přítomen vysoký stupeň zkřížené reaktivity. V letním období se podílejí na senzitizaci pacientů také pyly šťovíků, jitrocele, černého bezu a lípy. Období pozdního léta až časného podzimu je z hlediska alergenů taktéž velmi agresivní. Uplatňují se zde merlíkovité plevely, pelyněk a pelyňkovité a stále výrazněji se prosazuje ambrozie [7].
Pylová senzitizace narůstá více v oblastech s velkým automobilovým provozem. Pylová zrna mají odolné obalové vrstvy z exinu. Pod vlivem zplodin automobilových motorů se povrchové mikrokanály zvětšují, obal se narušuje a alergeny škrobových zrn s proteiny obalových vrstev se uvolňují a mohou více senzibilizovat. Na druhé straně zplodiny dieselových motorů jsou schopny na svém povrchu absorbovat pylové alergeny a hrát tak roli alergenových nosičů se zvýšením depozit v dýchacích cestách [8].
V letním i podzimním období se souběžně s pyly mohou uplatňovat i alergeny vzdušných plísní (Cladosporium, Alternaria).
Obyvatelé vyspělých zemí tráví zejména v zimním období až 90 % svého času v prostředí budov. Alergeny domácích roztočů se vyskytují v různých částech těla roztočů, v sekretech a výměšcích. Základním druhem domácích roztočů jsou roztoči čeledi Pyroglyphidae. Roztoči se živí živočišnými lupy. Pro jejich růst je vyhovující teplota 22–26 °C a relativní vlhkost vyšší než 55 %. Jako rizikové alergeny roztočů byly určeny cysteinové a serinové proteázy a amylázy.
Perzistující alergická rinitida s vazbou na alergeny roztočů je však méně provázena očními příznaky než například při kontaktu se živočišnými alergeny (zejména alergeny kočky), kde je projev rinokonjunktivitidy daleko častější. Kočičí alergeny jsou schopny výrazné senzibilizace. Hlavní alergenový protein (Fel d1) se vyskytuje v pokožce kočky (zejména ve faciální oblasti), v mazových sekretech a v moči. Psi produkují dva důležité alergenové proteiny Can f1 a Can f2. Charakteristické vlastnosti psích alergenů (alergenové partikule, všudypřítomnost) jsou obdobné jako u kočičích alergenů. Také hlodavci jsou chováni jako domácí zvířectvo, alergenní schopnost antigenů hlodavců je významná, s dominující senzibilizací na jejich močové proteiny [8].
Plísním a kvasinkám (Penicillium, Aspergillus, Alternaria, Cladosporium, Candida) se dobře daří v klimatizačních zařízeních budov. Profesní alergická rýma (popřípadě rinokonjunktivitida) se rozvíjí při pravidelném kontaktu s alergeny pracovního prostředí. Vysokomolekulární profesní antigeny jsou schopny senzibilizovat jedince stejnými mechanismy jako alergeny (např. mouka, latex) [5].
Etiopatogeneze alergické rinokonjunktivitidy
Alergická rinokonjunktivitida se rozvíjí na podkladě četných vlivů zevního prostředí u geneticky disponovaného jedince. Atopická predispozice je komplexem polymorfních genetických deviací, do nichž je zapojena genetická kontrola imunitní odpovědi (genový komplex HLA – chromozom 6p) a genetická kontrola prozánětlivých cytokinů (chromozomy 5q a chromozomy 11–14). Atopie je definována jako geneticky podmíněný sklon k produkci abnormálního množství IgE protilátek, která je odpovědí na expozici alergenům. Klinický projev atopie (např. alergická rinokonjunktivitida) vzniká na podkladě IgE zprostředkované odpovědi na opakovaný kontakt s alergenem, jejímž konečným důsledkem je slizniční eozinofilní zánět [9].
Podstatou perzistující alergické rinokonjunktivitidy je zánětlivá buněčná infiltrace nosní a konjunktivální sliznice, která v sobě zahrnuje řadu imunitních pochodů. Jedná se o aktivaci, chemotaxi a transendoteliální migraci buněk do submukózních vrstev s produkcí chemokinů a prozánětlivých cytokinů. Při neléčeném slizničním zánětu dochází k neustálé aktivaci, diferenciaci eozinofilních a bazofilních leukocytů, mastocytů, T lymfocytů a epiteliálních buněk. Je prodlouženo přežívání eozinofilů ve slizničních vrstvách, dochází k uvolňování mediátorů aktivovaných buněk, z nichž významnou úlohu má histamin a cysteinylové leukotrieny. Zapojen je také nervový systém, kdy při slizničním zánětu dochází k iritaci neuroreceptorů a k produkci neurokinů podporujících dále lokální zánět [9, 10].
Konjunktivální zánět podléhá totožným zánětlivým procesům jako alergická rinitida. Oční spojivka je aktivně imunologicky reagující tkání a dominantní roli zde hrají žírné buňky. Ve spojivkovém epitelu jsou přítomny i antigen prezentující buňky a lymfocyty. Žírné buňky jsou v normální konjunktivální epiteliální tkáni prezentovány řídce, jejich počet, a stejně tak počet eozinofilů, narůstá v souvislosti s alergickým zánětem, což lze nepřímo dokumentovat i pomocí analýzy slz. U alergických osob je dokladováno zvýšení hladiny histaminu, tryptázy, eotaxinu, eozinofilního kationtového proteinu a dalších mediátorů v očním sekretu [1].
Spojivková cévní pleteň je nastříknutá s různým stupněm konjunktiválního edému (chemózy). Hyperémie vzniká v důsledku vazodilatace, chemóza je následkem zvýšené cévní permeability postkapilárních venul. Důležitým znakem zánětlivé nosní a konjunktivální sliznice je její specifická, při progresi zánětu posléze i nespecifická hyperreaktivita [1].
Na očních příznacích se však nepodílí jen specifická alergická reakce I. typu probíhající přímo na povrchu oka při přímém kontaktu vzdušných alergenů s oční spojivkou. Tento mechanismus nevysvětluje například přítomnost očních obtíží u alergiků při nízkém obsahu pylových zrn ve vzduchu. Vznik nosních obtíží je pochopitelný i za nízké koncentrace alergenu, protože počet pylových částic vdechovaných nosem je dostatečně vysoký k vyvolání nosní reakce.
Přímým působením alergenu na oční spojivku nelze vysvětlit ani pozorovanou bilaterální oční odezvu po izolované unilaterální provokaci nosní sliznice alergenem.
Na vzniku očních příznaků při alergickém nosním zánětu se podílí i nervový systém, kdy při slizničním zánětu dochází k iritaci neuroreceptorů. Bylo prokázáno, že existuje centrální nazo-okulární reflex. Reflex je zprostředkován cholinergními vlákny, která bohatě zásobují jak sliznici nosu, tak spojivku oční. Aferentní vzruch vzniká působením histaminu uvolněného při alergickém zánětu na sliznici nosu [11].
Léčba alergické rinitidy a konjunktivitidy
Plán vedení léčby obsahuje edukaci pacienta, eliminaci alergenů, farmakoterapii a specifickou alergenovou imunoterapii. Je nutné si uvědomit, že léčíme geneticky disponovaného jedince, proto je sledování a terapeutické vedení pacienta s diagnózou perzistující rinokonjunktivitidy dlouhodobé. V současné době farmakoterapie alergické rýmy (popřípadě rinokonjunktivitidy) obsahuje několik terapeutických skupin s různým účinkem na nosní 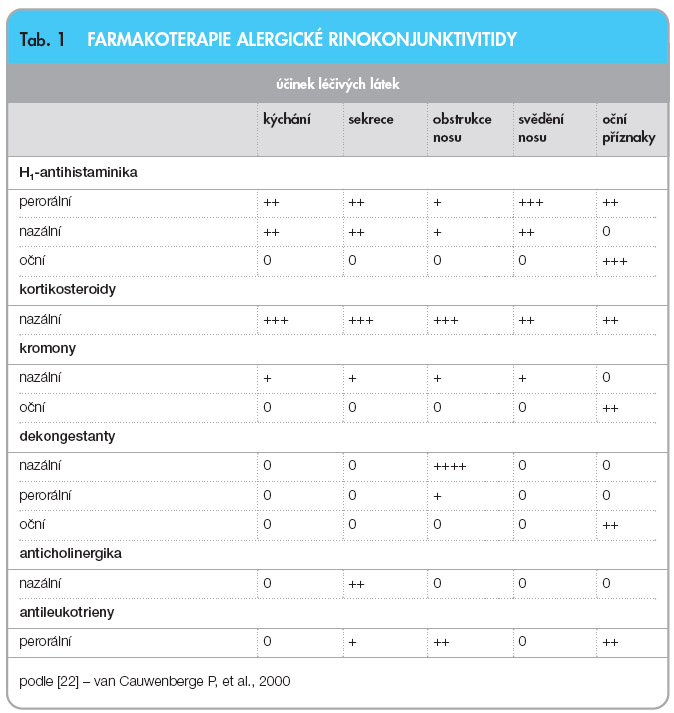 a oční příznaky (tab. 1) [22].
a oční příznaky (tab. 1) [22].
Léčba je stupňovitá (obr. 1). Ve zjednodušené formě můžeme říci, že u rýmy intermitentní (lehké, středně těžké až těžké) jsou základem v léčbě antihistaminika, dle odezvy na léčbu pak nazální kortikosteroidy. V současných terapeutických schématech nastupují tzv. antihistaminika nové generace (levocetirizin, desloratadin), která mají širší imunomodulační vlastnosti a současně vysokou afinitu a selektivitu k H1-receptorům.
U rýmy perzistující (středně těžké až těžké) zahajujeme léčbu vždy nazálními kortikosteroidy (KS) [6]. Topické nosní kortikosteroidy jsou nejúčinnější lékovou skupinou užívanou k potlačení alergického zánětu na nosní sliznici. 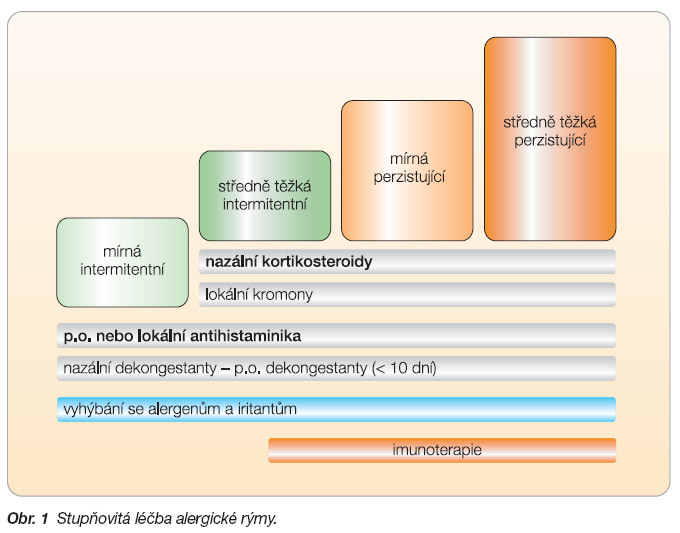 Ovlivňují všechny nosní příznaky alergické rýmy a v různé míře (viz dále) i příznaky oční.
Ovlivňují všechny nosní příznaky alergické rýmy a v různé míře (viz dále) i příznaky oční.
V terapii alergické konjunktivitidy lze aplikovat lokální léčivé přípravky. Jsou užívána oční terapeutika s obsahem vazokonstrikčních látek, antihistaminik či s jejich vzájemnou kombinací. Jsou aplikovány léčivé přípravky, které stabilizují membrány žírných buněk. Častěji jsou v současné době používány preparáty s obsahem antihistaminik a současně stabilizátorů membrány žírných buněk. Topické oční steroidy jsou doporučovány pouze přechodně u těžkých projevů alergické konjunktivitidy [1].
Nastupuje otázka, zda topická léčba alergické rinitidy nazálními steroidy je pro pacienty přínosem v léčbě očních příznaků. Uvědomme si, že spolupráce pacienta trpícího alergickou rinokonjunktivitidou je někdy obtížná. Nemocný užívá v různém léčebném režimu antihistaminika systémově, popřípadě lokálně, současně si aplikuje nosní kortikosteroidy. Pokud trpí pacient nejčastější komorbiditou alergické rinokonjunktivitidy, a to bronchiálním astmatem, je léčebný režim ještě komplikovanější. Je přirozenou snahou lékaře navodit pro pacienta co nejjednodušší účinný systém léčby.
Při pravidelně aplikovaných intranazálních KS pacienti postupně sami udávají úlevu od očních příznaků. Je však málo dvojitě slepých placebem kontrolovaných studií, které by tento údaj podpořily.
Nazální kortikosteroidy a ovlivnění očních příznaků alergické rinitidy
Při pravidelném podávání jsou nazální KS účinné v potlačení časné a pozdní fáze zánětu indukovaného alergenem.
Historie léčby nazálními KS se odvíjí již od konce šedesátých let, kdy byly užívány v některých zemích molekuly dexamethasonu, betamethasonu sodium fosfátu a betamethasonu valerátu ve formě nosních sprejů. U těchto léčivých látek nedošlo k velkému rozšíření, neboť při terapeutických dávkách vykazovaly nežádoucí systémové účinky. V roce 1973 byly publikovány výsledky první klinické studie, v níž byl nazálně aplikován beklometason dipropionát jako účinná a bezpečná molekula [12].
Od té doby vstoupily do léčby jako účinné a bezpečné látky další kortikoidní molekuly – flunisolid, budesonid, fluocortinbutyl. Počátkem devadesátých let začal být aplikován 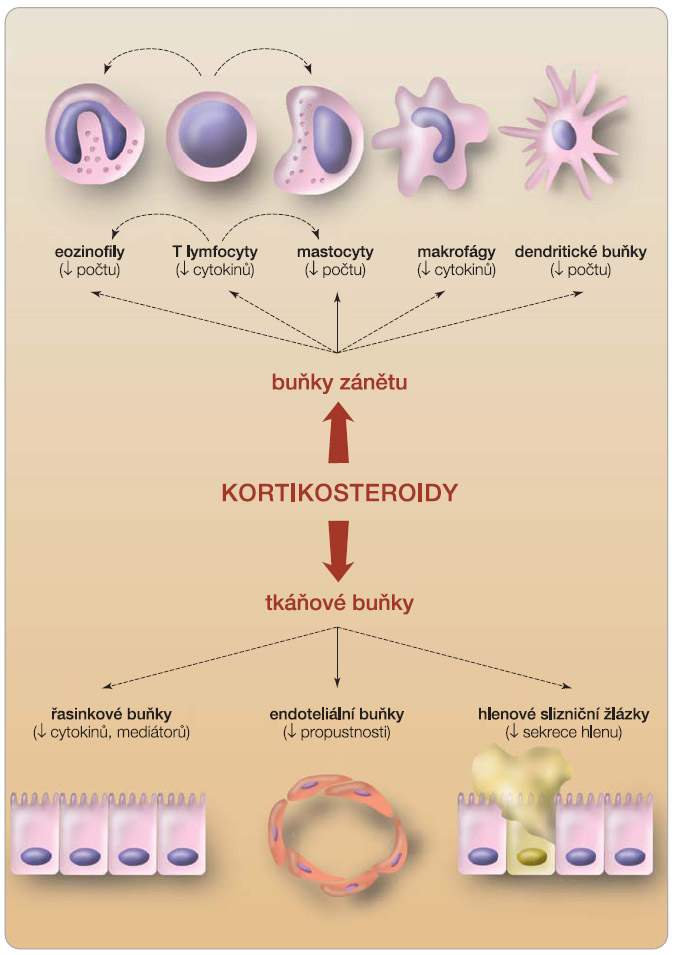 flutikason propionát a triamcinolon acetonid. V závěru 20. století byla uvedena na trh kortikoidní molekula mometason furoát. Jako poslední v řadě byl od 14. ledna 2008 v Evropské unii zaregistrován nový glukokortikoid určený pro léčbu alergické rýmy – flutikason furoát [13].
flutikason propionát a triamcinolon acetonid. V závěru 20. století byla uvedena na trh kortikoidní molekula mometason furoát. Jako poslední v řadě byl od 14. ledna 2008 v Evropské unii zaregistrován nový glukokortikoid určený pro léčbu alergické rýmy – flutikason furoát [13].
V České republice jsou užívány tyto druhy nazálních KS – beklometason, budesonid, flutikason propionát, mometason furoát a nově flutikason furoát.
Mechanismus účinku nazálních KS je objasněn jen do určité míry (obr. 2).
Nazální KS jsou látky lipofilní povahy, které prostupují cytoplazmatickou membránou a v cytoplazmě se váží na kortikoidní receptor (GR). Cytoplazmatický GR je identický ve všech buňkách lidského organismu, ale může se lišit jeho tkáňová exprese. Receptor je tvořen 3 doménami. Kortikoid se váže na C-koncovou část, střední část je určena k interakci s DNA a N-terminální část se účastní transaktivačních procesů v jádře. Polymorfní charakter receptoru může být podkladem pro individuální senzitivitu nemocných vůči nazálním KS.
Receptor GR je obsažen v cytoplazmě v inaktivní podobě, po vazbě s KS dochází ke konformační změně receptoru. Tato vazba je zásadní v účinku glukokortikoidů, neboť vede ke zvýšení či snížení transkripce.
Snížení transkripce se děje cestou tzv. negenomové transrepresivní blokády transkripčních faktorů AP-1 (aktivační protein 1) a NF-kapaB (nukleární faktor kapaB). Při probíhajícím zánětu jsou tyto transkripční faktory aktivovány některými cytokiny. Transkripční faktory v aktivované formě pronikají do jádra buňky a cestou mRNA indukují tvorbu řady prozánětlivých mediátorů. Nově vytvořený komplex KS-GR (kortikosteroid-kortikoidní receptor) je schopen navázat se na transkripční faktory a tímto způsobem blokovat jejich průnik do jádra buňky.
Kortikosteroidy jsou schopny takto inhibovat produkci celé škály prozánětlivých cytokinů – IL-1 (interleukin 1), IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-11, IL-12, IL-18, IFN-g≥ (interferon g), TNF-a (tumor nekrotizující faktor a), včetně dalších proteinů zapojených do procesu zánětu.
Cestou genomovou transaktivační jsou pozitivně regulovány geny kódující protizánětlivě působící látky. Po vazbě KS na GR a po vzniku komplexu KS-GR v cytoplazmě dochází ke konformační změně a k rozpadu receptoru. Do jádra buňky prostupuje jen jeho nukleární část a váže se na DNA, konkrétně na tzv. GRE sekvenci (glukokortikoidní responzivní element). Cestou mRNA dochází buď k potlačení, nebo k indukci produkce mediátorů. V první řadě je třeba jmenovat nově tvořený protein lipokortinu, který inhibuje fosfolipázu A2 a takto zasahuje do metabolismu kyseliny arachidonové, se snížením tvorby prozánětlivých leukotrienů, prostaglandinů a PAF (faktor aktivující destičky). Transkripční proces není okamžitý, čímž se vysvětluje časový odstup od aplikace nazálních KS do nástupu jejich klinického účinku [2, 12].
Mechanismy transaktivační jsou též odpovědny za nežádoucí systémové metabolické a endokrinní účinky KS, což v terapeutických dávkách topických nazálních KS představuje minimální, ač někdy diskutované riziko.
Zásahem kortikoidů do produkce regulačních a prozánětlivých cytokinů dochází k dalším dějům, které vyplývají z účinků těchto cytokinů. Je snižována exprese adhezivních molekul na endoteliích, čímž dochází ke snížené migraci buněk submukózně a k jejich přežívání v místech zánětu. Při pravidelné aplikaci nazálních KS dochází k redukci počtu mastocytů v nosní sliznici v důsledku snížení IL-3 a SCF (stem cell factor – růstový faktor kmenových buněk), je redukován počet aktivovaných T lymfocytů, antigen prezentujících buněk, eozinofilů a též neutrofilů v zánětlivé nosní sliznici. Epiteliální buňky, které jsou místem prvního kontaktu nazálních KS se sliznicí, vlivem nazálních KS redukují tvorbu chemokinů.
Vysoká exprese GR je dokladována zejména v endoteliálních buňkách respirační sliznice. Ačkoliv se jedná o tkáňové buňky, jsou aktivní taktéž v produkci cytokinů, která je inhibována účinkem nazálních KS. Snížení vaskulární permeability a antiexsudativní efekt nazálních KS odráží jejich přímý protizánětlivý účinek. Účinkem KS na hlenové slizniční žlázky je snížena sekrece hlenu a jejich odpovídavost na cholinergní podněty [14]. 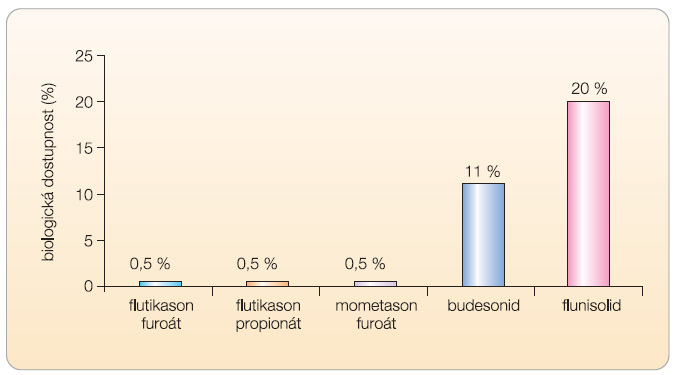 Při dlouhodobé aplikaci nazálních KS je dokladován restaurační vliv nazálních KS s obnovením a řádnou funkcí řasinkového epitelu nosní sliznice [12, 15].
Při dlouhodobé aplikaci nazálních KS je dokladován restaurační vliv nazálních KS s obnovením a řádnou funkcí řasinkového epitelu nosní sliznice [12, 15].
Z výše uvedeného vyplývá, že topické nosní kortikosteroidy jsou účinnou lékovou skupinou užívanou k potlačení alergického zánětu nosní sliznice. V klinické rovině významně snižují nosní příznaky alergické rýmy. Pacienti postupně udávají také úlevu od očních příznaků při pravidelné aplikaci nazálních KS.
Jakým mechanismem dochází ke zmírnění projevů alergické konjunktivitidy, pokud jsou kortikosteroidy aplikovány striktně nazálně?
Systémový účinek je nutné zcela zamítnout již v první rovině. Z hlediska systémových účinků je důležité uvést, že biologická dostupnost nazálních KS je uváděna < 1 % aplikované dávky při terapeutickém dávkování v µg (graf 2) [17, 24–26].
Dále se nabízí možnost retrográdního postupu nazálně aplikovaného steroidu nazolakrimální cestou. Tímto způsobem by však docházelo k daleko četnějším očním komplikacím.
Rozvoj zadní subkapsulární katarakty, jejíž možný vznik byl v souvislosti s aplikací nazálních KS též diskutován, nebyl ani při dlouhodobých studiích prokázán. Stejně tak nebyl ve studiích zjištěn vliv lokálních KS na vzestup nitroočního tlaku či na rozvoj glaukomu s otevřeným úhlem [13]. Postup nazálních steroidů nazolakrimálně je tedy nepravděpodobný.
V recentní literatuře je diskutován již výše uvedený nazo-okulární reflex, který je zprostředkován cholinergními vlákny zásobujícími jak sliznici nosu, tak oční spojivku. Aferentní vzruch vzniká působením histaminu uvolněného při alergickém nosním zánětu. Při potlačení nosního zánětu dochází ke snížení iritace neuroreceptorů [11].
Lze vysvětlení doložit klinickými studiemi, které splňovaly kritéria „medicíny založené na důkazech“?
Je pravdou, že naprostá převaha studií s užitím nazálních KS se zabývá především nosními příznaky či vlivem KS na bronchiální hyperreaktivitu. Vliv na oční příznaky je znám, avšak v randomizovaných dvojitě slepých placebem kontrolovaných studiích byl doložen teprve nedávno. Jedná se o studie s novou kortikoidní molekulou – flutikason furoátem.
Účinnost monoterapie flutikason furoátem u pacientů s alergickou rinokonjunktivitidou byla zkoumána ve 12 klinických studiích fáze IIb a III (8 studií u dospělých a adolescentů, 4 studie u dětí ve věku 2–11 let).
Kromě vlivu na nosní příznaky bylo standardním způsobem sledováno oční symptomové skóre (analýza TNSS – totální nazální symptomové skóre, a TOSS – totální oční symptomové skóre). Zmírnění nosních a očních symptomů se promítá do kvality života nemocných. V 6 studiích byl vyhodnocen i vliv léčby na kvalitu života pacientů s použitím standardizovaného dotazníku RQLQ (Rhinoconjunctivitis Quality of Life Questionnaire).
Dle dokladovaných výsledků studií lze konstatovat, že flutikason furoát je účinný v léčbě alergické rýmy u dospělých pacientů, adolescentů i dětí ve věku 2–11 let. Je významným zjištěním, že účinek léčby na alergické příznaky nastupuje velmi rychle – je pozorován u některých pacientů už za 8 hodin po aplikaci první dávky [13, 16].
U pacientů s očními příznaky vykazuje flutikason furoát ve všech studiích konzistentní zmírnění očních příznaků ve srovnání s placebem. Zmírnění příznaků přetrvávalo po celou dobu 24hodinového dávkovacího intervalu (graf 3).
Účinek na oční příznaky alergické rýmy byl pozorován i při podávání jiných nosních kortikosteroidů. Flutikason 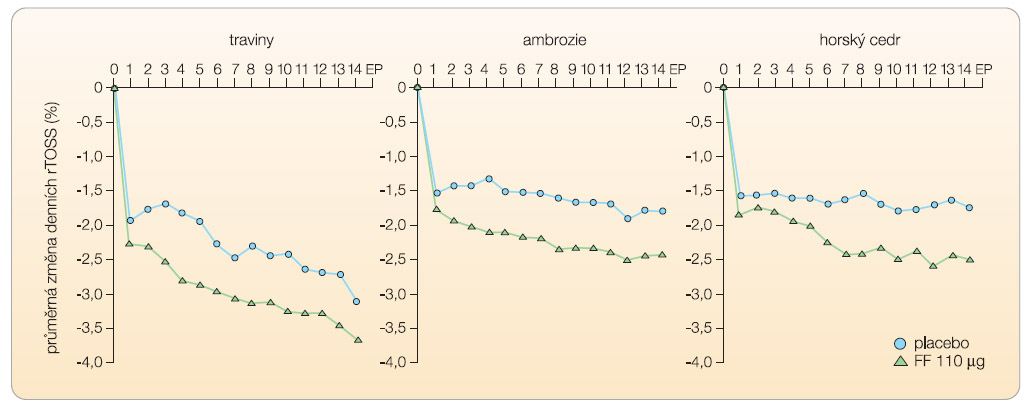 furoát jako jediný prokázal tento účinek ve všech studiích provedených u pacientů se SAR starších 12 let. Úleva od příznaků vedla k významnému zlepšení
furoát jako jediný prokázal tento účinek ve všech studiích provedených u pacientů se SAR starších 12 let. Úleva od příznaků vedla k významnému zlepšení 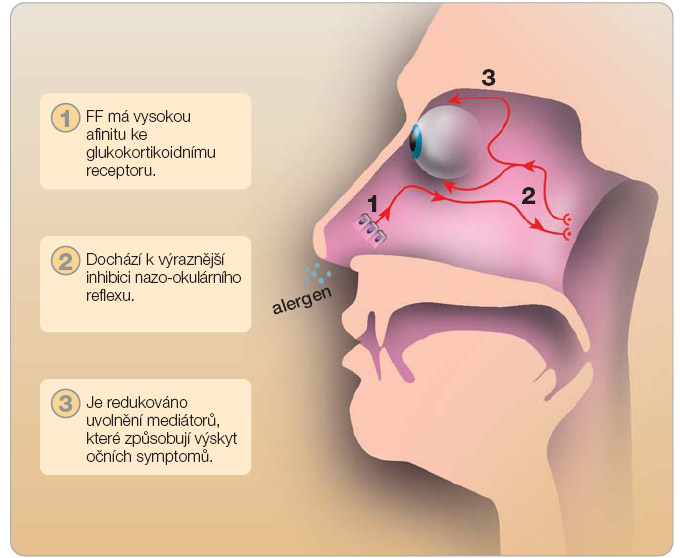 kvality života (spánek, běžné denní činnosti).
kvality života (spánek, běžné denní činnosti).
Vliv léčby nosním flutikason furoátem na oční příznaky u pacientů s alergickou rýmou viz graf 3.
Účinek topických nosních KS na oční příznaky alergické rýmy není novinkou a byl pozorován již dříve. U žádného z ostatních KS však nebyla úleva od očních obtíží konzistentní a nebyla potvrzena ve všech klinických studiích, jako je tomu u flutikason furoátu. Účinnější působení flutikason furoátu na oční příznaky je vysvětlováno jeho významným protizánětlivým účinkem na nosní sliznici se snížením produkce mediátorů iniciujících nazo-okulární reflex (obr. 3).
Závěr
Užití nazálních kortikosteroidů v léčbě středně těžké až těžké perzistující rýmy je dnes považováno za volbu první linie vzhledem k jejich dokladovanému protizánětlivému efektu při minimalizaci nežádoucích účinků. Alergická konjunktivitida doprovází až v 70 % alergickou rinitidu. Oční příznaky jsou lékaři nedostatečně diagnostikovány, neboť pacienti si často sami kupují dostupné oční přípravky.
Etiopatogeneticky je konjunktivální zánět totožný se zánětlivými procesy přítomnými u alergické rinitidy. Léčba alergické konjunktivitidy může být topická, v případě výskytu očních příznaků jsou účinná systémově podávaná antihistaminika v rámci léčby alergické rinokonjunktivitidy.
Zmírnění očních příznaků je uváděno i při léčbě nazálními KS. S potlačením slizničního nosního zánětu je rovněž snižována iritace neuroreceptorů. Tímto nedochází k aktivaci tzv. nazo-okulárního reflexu a k rozvoji očních příznaků neurogenní cestou.
Účinek na oční příznaky v rámci rinokonjunktivitidy je pozorován při pravidelné aplikaci nosních KS. Flutikason furoát však jako jediný ze současných nazálních KS vykazuje při podávání ve všech studiích konzistentní zmírnění očních příznaků ve srovnání s placebem.
Seznam použité literatury
- [1] Barney NP, Graziano FM. Allergic and immunological diseases of the eye. In Adkinson: Middleton's Allergy: Principles and Practice. Philadelphia (PA): Mosby, 2009.
- [2] Fokkens WJ. Nasal corticosteroids, first choice in moderate to severe allergic rhinitis. What prevents general practitioners from using them? Allergy 2003; 58: 724–726.
- [3] Dykewicz MS, Fineman S. Executive Summary of Joint Task Force Practice Parameters on Diagnosis and Management of Rhinitis. Ann Allergy Asthma Immunol 1998; 81: 463–468.
- [4] Blaiss MS. Cognitive, social, and economic costs of allergic rhinitis. Allergy Asthma Proc 2000; 21: 7–13.
- [5] Skoner DP. Allergic rhinitis: definition, epidemiology, pathophysiology, detection, and diagnosis. J Allergy Clin Immunol 2001; 108: S2–S8.
- [6] Bousquet J, Khaltaev N, Cruz AA, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy 2008; 63 (Suppl. 86): 8–160.
- [7] Jaeger S. Exposure to grass pollen in Europe. Clin Exp Allergy Rev 2008; 8: 2–6.
- [8] Špičák V, Kašák V, Pohunek P. Globální strategie péče o astma a jeho prevenci. 1. vyd. Praha, Jalna, 2003.
- [9] Braunstahl GJ, Fokkens WJ, Overbeek SE, et al. Mucosal and systemic inflammatory changes in allergic rhinitis and asthma: a comparison between upper and lower airways. Clin Exp Allergy 2003; 33: 579–587.
- [10] Vignola AM, Chanez P, Bousquet J. The relationship between asthma and allergic rhinitis: exploring the basis for a common pathophysiology. Clinical & Experimental Allergy Reviews 2003; 3: 63–68.
- [11] Baroody FM, Foster KA, Markaryan A, et al. Nasal ocular reflexes and eye symptoms in patients with allergic rhinitis. Ann Allergy Asthma Immunol 2008; 100: 194–199.
- [12] Mygind N, Nielsen LP, Hoffmann HJ, et al. Mode of action of intranasal corticosteroids. J Allergy Clin Immunol 2001; 108 (Suppl.1): S16–S25.
- [13] Rybníček O. Fluticason furoát – nový intranazální kortikosteroid. Farmakoterapie 2008; 1: 19–22.
- [14] Taramarcaz P, Gibson PG. The effectiveness of intranasal corticosteroids in combined allergic rhinitis and asthma syndrome. Clin Exp Allergy 2004; 34: 1883–1889.
- [15] Minshall E, Ghaffar O, Cameron L, et al. Assessment by nasal biopsy of long-term use of mometasone furoate aqueous nasal spray (Nasonex) in the treatment of perennial rhinitis. Otolaryngol Head Neck Surg 1998; 118: 648–654.
- [16] Seberová E. Fluticason furoát v léčbě alergické rýmy. Farmakoterapie 2008; 4: 365–381.
- [17] Daley-Yates PT, Kunka RL, Yin Y, et al. Bioavailability of fluticasone propionate and mometasone furoate aqueous nasal sprays. Eur J Clin Pharmacol 2004; 60: 265–268.
- [18] Gaga M, Lambrou P, Papageorgiou N, et al. Eosinophils are a feature of upper and lower airway pathology in non-atopic asthma, irrespective of the presence of rhinitis. Clin Exp Allergy 2000; 30: 663–669.
- [19] Hellgren J, Torén K, Balder B, et al. Increased nasal mucosal swelling in subjects with asthma. Clin Exp Allergy 2002; 32: 64–69.
- [20] Lange B, Lukat KF, Rettig K, et al. Efficacy, cost-effectiveness, and tolerability of mometasone furoate, levocabastine, and disodium cromoglycate nasal sprays in the treatment of seasonal allergic rhinitis. Ann Allergy Asthma Immunol 2005; 95: 272–282.
- [21] Naclerio R. Clinical manifestations of the release of histamine and other inflammatory mediators. J Allergy Clin Immunol 1999; 103: S382–S385.
- [22] van Cauwenberge P, Bachert C, Passalacqua G, et al. Consensus statement on the treatment of allergic rhinitis. European Academy of Allergology and Clinical Immunology. Allergy 2000; 55: 116–134.
- [23] Scadding G, Punekar Y. EAACI 2006; abstract 742.
- [24] Bryson HM, Faulds D. Intranasal fluticasone propionate. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in allergic rhinitis. Drugs 1992; 43: 760–775.
- [25] Daley-Yates PT, Baker RC. Systemic bioavailability of fluticasone propionate administered as nasal drops and aqueous nasal spray formulations. Br J Clin Pharmacol 2001; 51: 103–105.
- [26] Allen A, Down G, Newland A, et al. Absolute bioavailability of intranasal fluticasone furoate in healthy subjects. Clin Ther 2007; 29: 1415–1420.