Nealkoholická steatohepatitida – lipotoxická jaterní choroba
Nealkoholická tuková jaterní choroba (NAFLD) je onemocnění charakterizované jaterní steatózou vznikající u osob bez významné konzumace alkoholu. Nealkoholická steatohepatitida (NASH) je její progredientní forma, kde steatózu komplikují metabolické změny hepatocytů, zánět, fibróza, případně cirhóza a hepatocelulární karcinom. Těsná souvislost s centrální obezitou, diabetem 2. typu a hypertenzí nutí považovat NAFLD/NASH za jaterní komponentu metabolického syndromu. Pacienti s NASH mají vyšší letalitu na mimojaterní i jaterní onemocnění. V etiopatogenezi NAFLD se uplatňuje dysfunkční tuková tkáň uvolňující volné mastné kyseliny a humorální dysregulace charakterizovaná inzulinovou rezistencí, převahou prozánětlivých faktorů, hromaděním triglyceridů v hepatoctech, apoptózou hepatocytů, oxidačním stresem a stimulací fibroprodukce v jaterní tkáni. Diagnostika NAFLD je založena na zobrazovacích metodách, k průkazu NASH je nezbytná jaterní biopsie. V léčbě se uplatňují především režimová a dietní opatření, která zvyšují citlivost tkání k inzulinu a vedou ke snížení obsahu tuku v játrech i k omezení zánětlivé reakce. K redukci tělesné hmotnosti lze přispět farmakologicky, nebo spolehlivěji metodami bariatrické chirurgie. Dle posledního doporučení Americké společnosti pro studium jaterních chorob je farmakoterapie omezena na podávání vitaminu E jako první linie léčby u nemocných bez diabetu. Dále lze použít pioglitazon. Výsledky provedených studií zatím nepodporují podávání metforminu, ursodeoxycholové kyseliny, probiotika ani pentoxifylinu.
Definice a klasifikace
Z morfologického hlediska představuje NAFLD/NASH (non-alcoholic fatty liver disease/non-alcoholic steatohepatitis) kontinuum jaterních poruch počínajících benigním ztukověním jater (steatózou) přes progresivní steatohepatitidu až po pokročilou jaterní cirhózu, případně i hepatocelulární karcinom (HCC), které vznikají u osob bez významné konzumace alkoholu (< 20 g ethanolu/den) a bez současné přítomnosti jiných jaterních chorob vedoucích ke steatóze [1]. Vlastní název NAFLD – nealkoholická tuková jaterní nemoc – nemá přesný český ekvivalent; naproti tomu NASH – nealkoholická steatohepatitida – je pojem, který se v českém písemnictví vžil dobře. Krom uvedených pojmů existují ještě ztukovění a steatohepatitida jiného původu, někdy označované jako non-NASH fatty liver (NNFL) a steatohepatitida toxická (TASH). Těmto sekundárním ztukověním jater provázejícím jiná známá jaterní onemocnění se nebudeme v následujícím textu dále věnovat.
Ačkoliv souvislost mezi hromaděním tuku v játrech a následným vývojem jaterní cirhózy byla popsána již před polovinou devatenáctého století (Rokitanski, 1839), je podrobný popis onemocnění připisován Ludwigovi. Ten popsal NASH v roce 1980 jako onemocnění podobající se alkoholické jaterní steatohepatitidě u pacientů bez významné konzumace alkoholu [2]. S ohledem k lipotoxicitě volných mastných kyselin (FFA) jako vedoucímu patofyziologickému mechanismu onemocnění je pro NAFLD/NASH nově navrhován název lipotoxická jaterní nemoc [3].
Výskyt onemocnění
NAFLD/NASH je nyní v celém industriálním světě považována za nejčastější chronické progresivní jaterní onemocnění se vztahem k jaterní cirhóze, jaternímu selhání i k HCC a stává se rovněž v řadě zemí jednou z nejčastějších indikací transplantace jater [4]. Údaje o výskytu se mezi geograficky a geneticky rozdílnými populacemi liší. Problémy zjištění výskytu NASH jsou zčásti metodického charakteru. Zatímco k dosti přesnému stanovení výskytu nekomplikované NAFLD (steatózy jater) postačí prostá sonografie, počítačová tomografie (CT) nebo magnetická rezonance (MR), ke zjištění výskytu NASH jsou nezbytné studie histologické. Ty z pochopitelných důvodů postihují velmi malé vzorky většinou zvláštních populací. Histologické vyšetření klinicky zdravých osob vyšetřovaných před plánovaným darováním části jater ukázalo, že NAFLD je přítomna u 15–52 % případů, NASH u 3–15 % případů [5]. U morbidně obézních osob podstupujících bariatrický chirurgický výkon činil výskyt prosté steatózy 47 %, NASH 27–42 % a cirhózy 2,9–3,9 % [6]. Odhady prevalence NAFLD/NASH ve větších populačních vzorcích jsou zachyceny v průřezových studiích většinou na základě biochemických projevů choroby. Na základě výskytu nemocných s nevysvětlitelným zvýšením aktivity alaninaminotransferázy (ALT) ve studii NHANES III (National Health and Nutrition Examination Survey) lze odhadovat prevalenci NAFLD v neselektované severoamerické populaci až na 3–23 % [7].
Nárůst počtu případů steatohepatitidy nejspíše souvisí s celosvětovou epidemií nadváhy a obezity s jejími průvodními metabolickými projevy. V epidemiologických studiích dosahuje výskyt metabolického syndromu v neselektované populaci až 25 % a výskyt jaterní steatózy je odpovídající. Incidence NAFLD/NASH v různých populacích je značně rozdílná, nejvyšší je u obyvatelstva hispánského původu, nižší je u bělochů a nejnižší v černošské populaci. Tomu odpovídá i distribuce polymorfismu rs738409 C→G v genu pro PNPLA-3, která dle celogenomových studií zatím nejtěsněji koreluje s incidencí, ale i tíží NAFLD/NASH [8, 9].
Prevalence NAFLD/NASH v České republice není známa. Nicméně změny životního stylu charakterizované nadměrným kalorickým příjmem, nevhodným složením stravy a poklesem fyzické aktivity, které jsou považovány za klíčový faktor rostoucí incidence NAFLD/NASH, jsou běžné i v naší populaci. Pro konstantní vazbu NAFLD s rizikovými faktory aterosklerózy, jakými jsou diabetes mellitus 2. typu (DM2T), obezita centrálního typu a hypertenze, je NAFLD často chápána jako jaterní komponenta metabolického syndromu (syndromu inzulinové rezistence) a tato těsná asociace ukazuje na podobné etiopatogenetické faktory [10, 11]. Zároveň se ukázalo, že řada pacientů s tzv. kryptogenní cirhózou odpovídá charakteristikám nemocných s NASH, a má se za to, že NASH je zodpovědný za vznik většiny případů „kryptogenní cirhózy“.
Etiopatogeneze
Dysfunkce tukové tkáně, inzulinová rezistence a zánět jsou hlavními faktory vzniku NAFLD. Rozvoj NAFLD/NASH je tradičně spojován s teorií „dvojího úderu“, kdy akumulace tuku v játrech a inzulinová rezistence vedou k prozánětlivému stavu jaterní tkáně, oxidačnímu stresu, peroxidaci tuků, zániku jaterních buněk a fibrodukci jako obecné reakci na poškození jaterní tkáně. Současné poznatky však ukazují, že tyto mechanismy se uplatňují spíše paralelně než následně [12].
Visc![Obr. 1 Etiopatogenetické faktory vzniku a vývoje NAFLD/NASH; podle [63] – Krawczyk, et al., 2010. FFA – volné mastné kyseliny; HCC – hepatocelulární karcinom; IL – interleukin; NAFLD – nealkoholická tuková jaterní choroba; NASH – nealkoholická steatohepatitida; TG – triglyceridy; TNF-α – tumor nekrotizující faktor alfa](https://www.remedia.cz/photo-a-29231---.jpg) erální adipozita (obezita centrál-ního typu), inzulinová rezistence a akumulace triglyceridů v jaterních buňkách jsou úzce svázány [13]. Inzulinová rezistence vede v tukové tkáni k lipolýze, mobilizaci FFA a k jejich vstupu do jater (obr. 1). Předpokládá se, že tvorba triglyceridů v játrech představuje jejich ochranný mechanismus před lipotoxicitou FFA. Lipotoxicita FFA se v játrech uplatňuje především zvýšením permeability mitochondriálních membrán, tvorbou reaktivních sloučenin kyslíku (reactive oxygen species, ROS) a aktivací proteinkinázy JNK-1, vyvolávající apoptózu hepatocytů.
erální adipozita (obezita centrál-ního typu), inzulinová rezistence a akumulace triglyceridů v jaterních buňkách jsou úzce svázány [13]. Inzulinová rezistence vede v tukové tkáni k lipolýze, mobilizaci FFA a k jejich vstupu do jater (obr. 1). Předpokládá se, že tvorba triglyceridů v játrech představuje jejich ochranný mechanismus před lipotoxicitou FFA. Lipotoxicita FFA se v játrech uplatňuje především zvýšením permeability mitochondriálních membrán, tvorbou reaktivních sloučenin kyslíku (reactive oxygen species, ROS) a aktivací proteinkinázy JNK-1, vyvolávající apoptózu hepatocytů.
Centrální inzulinová rezistence zvyšuje glukoneogenezi, omezuje β-oxidaci a vede tak ke snížené utilizaci FFA a ke stimulaci syntézy triglyceridů de novo [14]. Tím dochází k další akumulaci triglyceridů v hepatocytech [15]. Dochází rovněž ke snížení transportu triglyceridů z hepatocytů [16]. Akumulace saturovaných mastných kyselin v hepatocytech vede k poškození membrán endoplazmatického retikula (ER), které rezultuje ve zvýšení zánětlivé reakce hepatocytů, v aktivaci kináz JNK-1, IKK, nukleárního transkripčního faktoru κB (NF-κB) a v produkci ROS. Stres ER je potencován porušením mechanismů autofagie, která patří mezi důležité mechanismy homeostázy lipidů v játrech (i v ostatních tkáních) a která je snížena u pacientů s obezitou a inzulinovou rezistencí [17].
Patologicky zmnožená tukové tkáň obézních pacientů je zdrojem adipokinů s převahou prozánětlivé aktivity. Převaha prozánětlivých a profibrogenních cytokinů (a nedostatek adiponektinu) vede k zánětu v jaterní tkáni (NASH), k její fibrotizaci a přestavbě. Zmiňované kinázy (IKK-β) aktivované přítomností FFA přispívají ke zvýšené produkci transkripčních faktorů (NF-κB), které vedou k expresi prozánětlivých cytokinů IL-1 a IL-6 [18] a k tvorbě cyklooxygenázy 2 (COX-2), vedoucí k syntéze dalších prozánětlivých mediátorů. Tukem indukovaná tvorba NF-κB aktivuje rovněž tumor nekrotizující faktor alfa (TNF-α) [19]. Není jasné, zda zvýšená koncentrace TNF-α přispívá více k prvotní akumulaci tuků mechanismem inzulinové rezistence, nebo zda je určující až pro rozvoj buněčného poškození.
Pro vznik fibrózy u pacientů s NAFLD jsou důležité jednak prozánětlivé cytokiny vznikající lokálně, jednak adipokiny z tukové tkáně. Leptin vyskytující se ve vysoké koncentraci u pacientů s obezitou aktivuje přímo jaterní stelátní buňky, které jsou zdrojem kolagenu [20]. Adiponektin naopak vede k inhibici jejich funkce a může vyvolat jejich apoptózu. Jeho koncentrace jsou ale u obézních a za přítomnosti steatózy nízké [21]. Dalším z významných mediátorů jaterní fibrózy u nemocných s metabolickým syndromem je angiotenzin II, který zvyšuje migraci a proliferaci stelátních buněk a jejich produkci kolagenu [22].
Předpokládá se, že centrální obezita je velmi důležitým etiopatogenetickým faktorem rozvoje jaterní cirhózy, která byla dříve považována za kryptogenní.
Diagnostika
Jen malá část pacientů se k hepatologovi dostává s podezřením na nevysvětlené jaterní onemocnění. Větší část případů je zjišťována nahodile na základě výsledků zobrazovacích vyšetřeních (ultrazvuk, CT, MR), nebo v průběhu operačního zákroku (tab. 1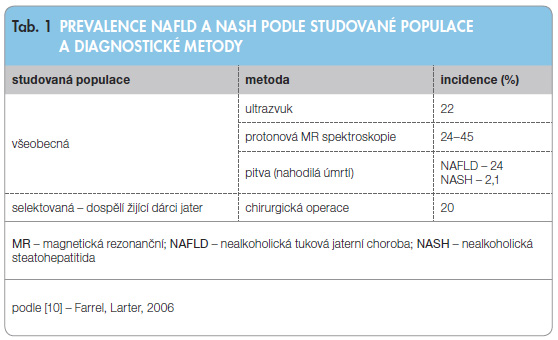 ). Onemocnění by mohlo být rovněž zjišťováno systematicky na základě screeningu prováděného u nemocných s metabolickým syndromem nebo s diabetem.
). Onemocnění by mohlo být rovněž zjišťováno systematicky na základě screeningu prováděného u nemocných s metabolickým syndromem nebo s diabetem.
Běžným klinickým nálezem u pacientů s NAFLD/NASH je hepatomegalie, u části pacientů i vyšší aktivity aminotransferáz ALT a AST (aspartátaminotransferázy) v krvi. Sonografický průkaz „jasných jater“ vede k diagnóze jaterní steatózy s vysokou pravděpodobností – senzitivita 89 % a specificita 93 % [23]. Tyto nálezy stačí při negativním výsledku screeningu nejfrekventnějších jaterních onemocnění vedoucích k symptomatické jaterní steatóze (hepatitida C, hereditární hemochromatóza, Wilsonova choroba, lékové poškození, parenterální výživa, těžká malnutrice) a při vyloučení konzumace alkoholu v množství přesahujícím 20 g ethanolu/den ke klinické diagnóze NAFLD. Autoprotilátky typické pro autoimunitní hepatitidu (antinukleární protilátky – ANA, protilátky proti hladké svalovině – ASMA) se vyskytnou až u 21 % pacientů s fenotypicky dobře vyjádřenou NAFLD, jejich nález tedy není s diagnózou NAFLD v rozporu [24].
Úkolem hepatologa je především diagnostikovat progresivní formy onemocnění, které pro pacienta představují vyšší riziko úmrtí z příčiny jaterních i nejaterních nemocí. To se ale většinou neobejde bez histologického vyšetření, které je v současnosti jedinou spolehlivou metodou ke stanovení diagnózy a aktivity NASH. Pacienti, kteří vyvinou jaterní cirhózu v rámci NASH, mají být zařazeni do screeningu HCC, stejně jako je tomu v případě jiných cirhotiků.
Moderní zobrazovací metody poskytují přesnou kvantifikaci obsahu tuku v jaterní tkáni (CT, MR protonová spektrometrie) [25]. Mají vyšší specificitu než prosté ultrazvukové vyšetření. Žádné ze současných zobrazovacích vyšetření však není dostatečně senzitivní ani specifické pro stanovení stupně fibrózy jaterní tkáně, a již vůbec ne pro posouzení přítomnosti zánětlivých změn. Průkaz přítomnosti vaziva a zánětu má však pro diagnózu komplikované NAFLD zásadní význam.
Neinvazivní způsoby průkazu vaziva v jaterní tkáni se v současnosti opírají o měření elasticity jater (metoda FibroScan) [26] nebo o stanovení biochemických markerů fibrózy. Pro laboratorní průkaz NASH bylo navrženo několik metod, předně stanovení cytokeratinu 18 nebo jeho fragmentů (jejich hodnoty jsou zvýšeny v případě vyššího výskytu jaterní nekrózy a apoptózy) [27]. Byly navrženy rovněž kombinace stanovení více faktorů zahrnujících jak biomarkery zániku jaterních buněk, tak i fibrózy, popřípadě i další jednoduše zjistitelné klinické parametry. Typickými příklady jsou NashTest [28] nebo známější Fibrotest. Před klinickým využitím těchto metodik je nezbytná rozsáhlejší validace těchto testů. Tyto komerčně dostupné metody jsou rovněž ekonomicky náročné a nejsou v současnosti součástí doporučených postupů.
K rozlišení NASH od benigní steatózy je nezbytná jaterní biopsie [29]. Z praktického hlediska není třeba podezření na prostou steatózu u obézního pacienta biopticky ověřovat. U pacientů s klinickými známkami progresivní formy onemocnění, zejména s vyšší aktivitou aminotransferáz, se biopsie většinou provádí. Bioptické vyšetření jater je nutné pro odhad prognózy vývoje onemocnění. V současnosti však přesně definovaná pravidla indikace bioptického vyšetření u nemocných s NAFLD/NASH neexistují [26].
Histologické vyšetření
Přes pokroky zobrazovacích metod je jaterní biopsie při stanovení diagnózy NAFLD/NASH považována stále za zlatý standard [24]. Hlavním přínosem je průkaz metabolických změn hepatocytů, zánětu a vaziva, tedy odlišení komplikované formy NAFLD od prosté steatózy. Další indikací jaterní biopsie je longitudinální sledování pro potřeby monitorace terapeutické odpovědi.
Podle konference AASLD (American Association for the Study of Liver Diseases) věnované NASH, která byla uspořádána v roce 2002 v severoamerické Atlantě, je za NAFLD považována akumulace tuků v jaterních buňkách přesahující 5–10 % hmotnosti jater, a to u pacientů bez významné konzumace alkoholu (do 20 g ethanolu/den). Ke stanovení histopatologické diagnózy NASH je kromě přítomné steatózy zapotřebí nález lobulárního zánětu a perivenulární a portální fibrózy [30]. Většina patologů pro diagnózu NASH dále požaduje přev
 ážně makrovezikulární charakter steatózy, balonovatění hepatocytů a zvýraznění změn v zóně III [31]. Na této konferenci byla přijata i klasifikace NAFLD uvedená v tab. 2. NASH je tedy třeba považovat za pokročilou fázi NAFLD.
ážně makrovezikulární charakter steatózy, balonovatění hepatocytů a zvýraznění změn v zóně III [31]. Na této konferenci byla přijata i klasifikace NAFLD uvedená v tab. 2. NASH je tedy třeba považovat za pokročilou fázi NAFLD. Přesnější klasifikaci a skórovací systém, který je obdobou systému užívaného pro chronické hepatitidy, navrhla Kleinerová se skupinou patologů zkoumajících NASH [33].
Vývoj a prognóza
Stručně lze říci, že zatímco prostá steatóza progreduje jen v menšině případů a velmi pozvolna, je histologický nález NASH spojen s progresí onemocnění. K dispozici jsou nejméně tři longitudinální studie zahrnující 22, 22 a 103 pacientů s průměrnou délkou intervalu mezi biopsiemi 5,7 a 4,3, respektive 3,2 roku (celkové rozpětí sledování 0,7–21,3 roku). Ve sledovaném období bylo zhoršení fibrózy pozorováno přibližně u třetiny pacientů. Zmenšení rozsahu fibrózy bylo pozorováno u 18 % a 37 % nemocných z prvé a třetí studie [4]. Sledování vývoje choroby na základě biochemických projevů onemocnění (aktivity ALT) není přínosné z důvodu kolísání aktivity ALT, kte-
rá je navíc zvýšena jen u 20 % pacientů s NAFLD [34].
Progresivní charakter NASH je zřejmý ze sledování pacientů s kryptogenní cirhózou. Pacienti v této skupině vykazují oproti ostatním cirhotikům zvýšený výskyt rizikových faktorů asociovaných s metabolickým syndromem (DM2T, obezita) a v jejich biopsiích je možno pozorovat některé znaky typické pro NASH. Navíc z longitudinálního sledování nemocných s NASH se ukazuje, že většina projevů aktivity onemocnění ve fázi cirhózy vymizí. Dlouhodobý potransplantační vývoj nemocných indikovaných k transplantaci jater pro NASH a kryptogenní cirhózu je identický [35].
Prostá steatóza patrně není spojena ani s rychlou progresí onemocnění, ani se zvýšením mortality proti běžné populaci [36]. Nález NASH však v komunitní studii vedl ke zvýšení mortality oproti srovnatelné populaci, přitom nejčastější příčinou úmrtí v kohortě byly malignity a kardiovaskulární onemocnění. Úmrtí na jaterní onemocnění se dostala na třetí místo oproti třináctému pořadí v obecné populaci odpovídajícího věku a pohlaví [37]. V mezinárodní studii 247 pacientů s NAFLD ve stadiu pokročilé fibrózy nebo cirhózy sledovaných po průměrnou dobu 85,6 ± 54,5 měsíce činilo desetileté přežívání 81,5 % a významně se nelišilo od kontrol nemocných s jaterní cirhózou C [38]. Dá se rovněž doložit, že pacienti s biopticky prokázanou NASH mají ve srovnání s osobami s prostou steatózou vyšší výskyt a závažnost ostatních projevů metabolického syndromu [3].
Léčba
Léčba NAFLD/NASH musí odpovídat stadiu jaterního onemocnění a reagovat na případný současný výskyt dalších klinických projevů metabolického syndromu (DM2T, dyslipidemie, ischemická choroba srdeční – ICHS atd.). Z hepatologického hlediska je třeba vycházet z pokročilosti jaterního poškození. Nemocné s vyvinutou jaterní cirhózou je třeba zařadit do programu screeningu HCC, pacienty vyšetřit na přítomnost jícnových varixů a popřípadě léčit projevy jaterního selhání a zvážit potřebu transplantace jater.
U osob s NAFLD/NASH bez známek jaterní insuficience je indikována specifická léčba. Při volbě farmakoterapie se vychází z faktu, že prostá steatóza dle současných znalostí nevede k podstatnému ohrožení zdraví pacienta, progresivní forma však má závažné důsledky.
Dosud zkoumané léčebné postupy směřují k několika patofyziologickým mechanismům důležitým při vzniku a progresi NAFLD/NASH, které lze ovlivnit:
1. úpravou životního stylu a dietou, tj. opatřeními vedoucími k redukci hmotnosti a zvýšení citlivosti tkání k inzulinu tělesným cvičením;
2. podáváním léků ovlivňujících vznik a progresi NASH; podávání léků je vyhrazeno pro osoby s histologicky prokázanou progresivní formou onemocnění.
Režimová opatření
Režimová a dietní léčba spočívá především v redukci tělesné hmotnosti. Ta vede k úbytku obsahu tuku v jaterní tkáni, poklesu aktivity aminotransferáz, k ústupu zánětlivých a nekrotických změn a konečně i ke zmírnění fibrózy v játrech. Při zavádění dietních a režimových opatření je zapotřebí se zaměřit na stanovení dosažitelných cílů (omezení energetického příjmu na 35–30 kcal/kg/den) a na nenáročnou pohybovou aktivitu. Redukce hmotnosti o 5–10 % př edstavuje pro většinu maximální dosažitelný a dlouhodobě udržitelný efekt. Kromě redukce kalorického příjmu má význam i optimalizace složení stravy (tab. 3). Z observačních studií se zdá, že zatímco vysoký kalorický příjem v podobě triglyceridů je spojen s jejich prostým ukládáním v játrech, osoby se zánětlivou odpovědí v játrech přijímaly nadbytečné kalorie častěji především v podobě cukrů, zejména cukrů jednoduchých. Zdá se tedy, že běžně známá doporučení ve prospěch smíšené a vyvážené skladby potravy z hlediska zastoupení makronutrientů mají význam i v prevenci a léčbě NASH [39].
edstavuje pro většinu maximální dosažitelný a dlouhodobě udržitelný efekt. Kromě redukce kalorického příjmu má význam i optimalizace složení stravy (tab. 3). Z observačních studií se zdá, že zatímco vysoký kalorický příjem v podobě triglyceridů je spojen s jejich prostým ukládáním v játrech, osoby se zánětlivou odpovědí v játrech přijímaly nadbytečné kalorie častěji především v podobě cukrů, zejména cukrů jednoduchých. Zdá se tedy, že běžně známá doporučení ve prospěch smíšené a vyvážené skladby potravy z hlediska zastoupení makronutrientů mají význam i v prevenci a léčbě NASH [39].
N-3 PUFA (n-3 polynenasycené mastné kyseliny) snižují inzulinovou rezistenci a v malých intervenčních studiích s jejich jednoroční suplementací bylo prokázáno snížení aktivity jaterních enzymů i zlepšení histologického nálezu (ústup steatózy, fibrózy, balonovatění i zánětu), a to nezávisle na změně tělesné hmotnosti. Podobně pozitivní ovlivnění lze očekávat od preferenčního příjmu MUFA (mononenasycené mastné kyseliny), zatímco TFA (trans-mastné kyseliny) jsou považovány za toxické pro játra [40, 41].
Zvýšení tělesné aktivity má zásadní význam jak pro snadnější dosažení negativní energetické bilance, tak i pro snížení poměrného zastoupení tělesného tuku a tím snížení inzulinové rezistence. I ve studiích, ve kterých nedošlo k poklesu tělesné hmotnosti, vedlo zvýšení pohybové aktivity k poklesu biochemických známek aktivity onemocnění a snížení obsahu tuku v játrech. V intervenční studii založené na posuzování tělesného složení metodou protonové MR spektroskopie došlo po čtyřech týdnech intenzivního cvičení (3krát týdně aerobní zátěž 30–45 minut) bez ovlivnění diety a tělesné hmotnosti k 21% redukci obsahu triglyceridů v játrech, 12% redukci viscerálního tuku a 14% snížení sérové koncentrace FFA [42].
Z hlediska udržitelnosti dosažených změn v životním stylu je podstatná i správná volba pohybové aktivity. Za nejvhodnější lze považovat rychlejší chůzi. Překvapivě nejen aerobní aktivita, ale i cvičení v posilovně zaměřené na růst svalové hmoty snižuje inzulinovou rezistenci, zvyšuje periferní utilizaci triglyceridů a snižuje steatózu. Doporučená dávka fyzické aktivity činí alespoň 30 minut mírné aktivity denně nebo alespoň 20 minut intenzivní fyzické aktivity 3krát týdně. Nicméně i minimální zvýšení fyzické aktivity má příznivý vliv. Pro úspěch léčby NAFLD/NASH modifikací životního stylu je třeba vytvořit systematický přístup zaměřený na soustavnou a dlouhodobou péči, která jediná může být dlouhodobě účinná. Jednorázové intervence nemají většinou žádný nebo mají jen přechodný efekt.
Žádná další léčba NASH není srovnatelně účinná s redukcí hmotnosti a s úpravou životního stylu. Nutno podotknout, že dosáhnout těchto cílů je nesnadné, adherence k restriktivnímu způsobu stravování a k aktivnímu životnímu stylu je omezená a dosud jedinou léčbu obezity s prokazatelným dlouhodobým účinkem představuje bariatrická chirurgie [43]. Diety s velmi vysokým omezením energetického příjmu vhodné nejsou, jejich užívání je spojeno se zvýšením zánětlivé reakce v játrech a nárůstem fibrózy [44]. Omezení energetického příjmu na 35–30 kcal/kg/den s cílem zredukovat hmotnost o 10 % v průběhu šesti měsíců se zdá být rozumné [45]. S výjimkou animálních studií nebylo složení diety rozsáhleji zkoumáno, většinou jsou respektována běžná doporučení omezující příjem sacharidů a zvyšující podíl MUFA a PUFA ve stravě. Problémem všech diet-ních opatření je velmi nízká a časově omezená compliance [46, 47].
Farmakoterapie
Farmakoterapie obezity u nemocných s NAFLD byla zkoumána jen omezeně. Orlistat prokázal účinnost v malé studii snížením tělesné hmotnosti pacientů a omezením aktivity aminotransferáz [48]. Sibutramin vedl rovněž ke snížení aktivity ALT i AST v průběhu šestiměsíční léčby u 13 pacientů. Problémem těchto studií je vedle minimálního počtu nemocných chybění histologického průkazu vývoje onemocnění. Bariatrická chirurgie je v současnosti jedinou spolehlivou metodou s dlouhodobým příznivým ovlivněním obezity. Je aplikována především u pacientů s body mass indexem (BMI) vyšším než 35. Její význam pro léčbu NASH je však třeba ozřejmit v rozsáhlejších studiích. Její aplikace u nemocných s pokročilou jaterní lézí může vyvolat její zhoršení i s fatálním zakončením [49, 50].
Podání hypolipidemik přes dobré teoretické vyhlídky nepřineslo obrat v léčbě NAFLD a v současnosti pouze dvě malé studie ukázaly snížení aktivit aminotransferáz při podávání atorvastatinu pacientům s NAFLD [51, 52]. Podávání fibrátů (klofibrátu) nepřineslo terapeutický efekt [53].
Nejvíce zkoumanou skupinou léků je skupina látek zvyšujících citlivost tkání na inzulin. Metformin zlepšil steatózu a aktivitu ALT v animálních studiích [45]. V otevřené randomizované studii provedené u nemocných s NASH, která srovnávala metformin 2 g/den (n = 55) s dietou (n = 27) a vitaminem E podávaným v dávce 800 mg/den (n = 28), došlo ke statisticky významnému snížení aktivity ALT ve skupině pacientů užívajících metformin. Z 55 nemocných užívajících metformin byla u 17 pacientů provedena jaterní biopsie, která oproti počátečnímu nálezu prokázala zmírnění steatózy, fibrózy a zánětlivých změn [54]. Ve většině publikovaných studií však léčba metforminem nepřinesla zlepšení biochemických ani histologických projevů NASH a metaanalýza publikovaných studií neprokázala žádný přínos podávání metforminu u pacientů s NASH [24].
Thiazolidindiony rosiglitazon a pioglitazon, agonisté PPAR-γ (peroxisome proliferator-activated receptor), jsou pro svoji schopnost zvýšit senzitivitu jaterní tkáně k inzulinu, zvyšovat oxidaci mastných kyselin a snižovat jaterní steatózu nejnadějnějšími látkami používanými k léčbě NASH. Byly publikovány dvě dobře navržené pilotní studie, ve kterých se podával pioglitazon v dávce 30 mg denně a rosiglitazon v dávce 4 mg 2krát denně. Došlo ke snížení aktivity ALT i k ústupu steatózy proti počátečním hodnotám, pioglitazon navíc vedl ke zmírnění stadia fibrózy [55, 56]. Zmírnění steatózy bylo popsáno rovněž v malé randomizované studii, ve které byl pioglitazon podáván společně s vitaminem E a porovnáván s účinkem vitaminu E podávaného samostatně [57]. Velkou nevýhodou podávání thiazolidindionů je zvyšování tělesné hmotnosti v důsledku ukládání triglyceridů v periferní tukové tkáni, ke kterému dochází u 67–72 % léčených [55, 56]. Metaanalýza pěti randomizovaných studií prokázala účinek podávání pioglitazonu na zmírnění steatózy (OR 4,05; 95% CI: 2,58–6,35) a zánětu (OR 3,53; 95% CI: 2,21–5,64), nikoliv však fibrózy. S ohledem na nebezpečí závažných kardiovaskulárních nežádoucích účinků, především kvůli obavám ze zvýšeného výskytu městnavého srdečního selhání, je třeba používat tyto léky u nemocných s biopticky prokázanou NASH s velkou opatrností [58].
Oxidační stres je považován za klíčový mechanismus hepatocelulárního poškození během progrese NASH. Proto se ve farmakoterapii NASH uplatňují látky omezující aktivitu kyslíkových radikálů, což vede k omezení peroxidace tuků, změn ER, lysozomálních proteinů, aktivace NF-κB a aktivace prozánětlivých cytokinů. Většina publikovaných studií použila vysoké dávky vitaminu E a C s rozporuplnými výsledky. V doposud největší publikované studii [59] srovnávající podávání pioglitazonu, vitaminu E a placeba bylo 84 nemocným s NASH podáváno 800 IU α-tokoferolu denně po dobu 96 týdnů. Léčebného efektu bylo dosaženo u 42 % pacientů oproti 19 % léčených placebem (p < 0,001). Zároveň ale v některých studiích s podáváním vitaminu E došlo ke zvýšení celkové mortality nebo ke zvýšení výskytu karcinomu prostaty. Nicméně dle doporučení AASLD je vitamin E v denní dávce 800 IU doporučen k první linii léčby nediabetických nemocných s histologicky prokázanou NASH.
Existuje rovněž pilotní studie s použitím pentoxifylinu jako inhibitoru produkce TNF-α, který má významnou roli v několika krocích vývoje NAFLD a NASH. Ke zlepšení laboratorních známek jaterní léze došlo u 9 z 20 léčených [60].
Ursodeoxycholová kyselina přes počáteční slibné výsledky nepřinesla terapeutický efekt u pacientů s NAFLD [61], a není k léčbě nemocných s NASH doporučována [24]. Vzhledem k tomu, že TNF-α je aktivován bakteriálním endotoxinem, patří probiotika k potenciálně příznivě působícím látkám u nemocných s NASH. V malé studii vedlo podávání jednoho z nich (VSL3) ke snížení aktivity ALT. Efekt na histologický nález není znám [62].
Dle sou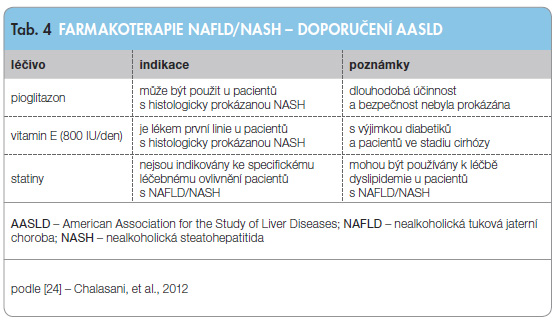 časného doporučení AASLD lze farmakologické léčebné postupy (tab. 4) – podávání pioglitazonu a vitaminu E – aplikovat jen u histologicky prokázané progresivní formy onemocnění, tato léčba však s sebou nese nezanedbatelná rizika.
časného doporučení AASLD lze farmakologické léčebné postupy (tab. 4) – podávání pioglitazonu a vitaminu E – aplikovat jen u histologicky prokázané progresivní formy onemocnění, tato léčba však s sebou nese nezanedbatelná rizika.
Farmakoterapie přidružených komplikací syndromu inzulinové rezistence musí být prováděna s ohledem na pokročilost případné přidružené jaterní poruchy, ze své povahy bude v praxi prováděna spíše diabetologem nebo kardiologem než hepatologem.
Transplantace jater
NASH je v registru UNOS (United network for Organ Sharing) v současnosti třetí nejčastější indikací k transplantaci jater. Indikace je dána projevy selhávání nebo nálezem malého HCC identicky jako u jiných cirhóz. Mezi kandidáty indikovanými k transplantaci jater pro NASH převažují osoby vyššího věku, s vyšším BMI a oproti jiným cirhózám s nižším výskytem HCC v explantátu. Převažují ženy. Přežívání nemocných se zásadním způsobem neliší od přežívání u ostatních příjemců jater. Lze předpokládat, že část nemocných indikovaných k léčbě pro kryptogenní jaterní cirhózu tvořily osoby s NASH. Přibližně u 7 % příjemců se v jaterním štěpu po letech vyvine obraz NASH [35].
Závěr
NAFLD a její závažná progresivní forma NASH jsou v současnosti nejčastějšími jaterními chorobami. Jsou úzce svázány se syndromem inzulinové rezistence. Hlavním patofyziologickým mechanismem vzniku a progrese onemocnění je obezitou indukovaná inzulinová rezistence a lipotoxicita FFA, které prohlubují metabolickou poruchu a zánětlivou odpověď v játrech, vyvolávají vznik reaktivních radikálů, peroxidaci tuků a indukují fibroprodukci. Hormonální dysfunkce tukové tkáně, provázená změnou poměru leptin/adiponektin, je faktorem vzniku převahy prozánětlivých cytokinů vedoucí k expresi Th1 fenotypu. Diagnostika NAFLD je založena na zobrazovacích metodách a na vyloučení nejběžnějších jaterních nemocí způsobujících steatózu jater. NASH lze v současnosti spolehlivě diagnostikovat pouze histologicky. Její nález je spojen s vyšší pravděpodobností úmrtí na nejaterní a jaterní onemocnění ve srovnání s běžnou populací. Základem léčby jsou režimová a dietní opatření vedoucí ke zvýšení citlivosti tkání k inzulinu, snížení obsahu tuku v játrech i k ústupu zánětlivých změn. Dle nejnovějšího doporučení AASLD se farmakoterapie NASH omezuje na podávání vitaminu E a pioglitazonu, a to jen u podskupiny nemocných s histologickým průkazem onemocnění. Bariatrická chirurgie u nemocných s NAFLD/NASH se uplatňuje v léčbě morbidně obézních pacientů. Transplantace jater je vyhrazena pro pacienty s jaterním selháním nebo s nálezem malého HCC.
Seznam použité literatury
- [1] Adams AD, Lindor KD. Nonalcoholic Fatty Liver Disease. Ann Epidemiol 2007; 17: 863–869.
- [2] Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc 1980, 55: 434–438.
- [3] Cusi K. Role of Obesity and Lipotoxicity in the Development of Nonalcoholic Steatohepatitis: Pathophysiology and Clinical Implications. Gastroenterology 2012; 142: 711–725.
- [4] Angulo P. Nonalcoholic fatty liver disease and liver transplantation. Liver transplantation 2006; 12: 523–534.
- [5] Minervini MI, Ruppert K, Fontes P, et al. Liver biopsy findings from healthy potential living liver donors: reasons for disqualification, silent diseases and correlation with liver injury tests. J Hepatol 2009; 50: 501–510.
- [6] Mathurin P, Hollebecque A, Arnalsteen L, et al. Prospective study of the long-term effects of bariatric surgery on liver injury in patients without advanced disease. Gastroenterology 2009; 137: 532–540.
- [7] Ioannou GN, Boyko EJ, Lee SP. The prevalence and predictors of elevated serum aminotransferase activity in the United States in 1999–2002. Am J Gastreoenterol 2006; 101: 76–82.
- [8] Romeo S, Huang-Doran I, Baroni MG, Kotronen A. Unravelling the pathogenesis of fatty liver disease: patatin-like phospholipase domain-containing 3 protein. Curr Opin Lipidol 2010; 21: 247–252.
- [9] Romeo S, Kozlitina J, Xing C, et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 2008; 40: 1461–1465.
- [10] Farrel CF, Larter CZ, Nonalcoholic fatty liver disease: From steatosis to cirrhosis. Hepatology 2006; 43: S99–S112.
- [11] McCullough AJ. The epidemiology and risk factors of NASH. In: Farrell GC, George J, de la M Hall P, McCullough AJ, eds. Fatty Liver Disease: NASH and Related Disorders. Malden, MA: Blackwell Publishing, 2005: 23–37.
- [12] Merriman RB, Aouizerat BE, Bass NM. Genetic influences in nonalcoholic fatty liver disease. J Clin Gastroenterol 2006; 40 (Suppl 1): S30–33.
- [13] Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002; 16; 1221–1231.
- [14] Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest 2004; 114: 147–152.
- [15] Sanyal AJ, Campbell-Sargent C, Mirshahi F, et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology 2001; 120: 1183–1192.
- [16] Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology 2010; 52: 1836–1846.
- [17] Amir M, Czaja MJ. Autophagy in nonalcoholic steatohepatitis. Expert Rev Gastroenterol Hepatol 2011; 5: 159–166.
- [18] Cai D, Juan M, Frantz DF, et al. The metabolic syndrome as a predictor of nonalcoholic fatty liver disease. Nat Med 2005; 11: 183–190.
- [19] Diehl AM. Tumor necrosis factor and its potential role in insulin resistance and nonalcoholic fatty liver disease. Clin Liver Dis 2004; 8: 619–638.
- [20] Saxena NK, Ikeda K, Rockey DC, et al. Leptin in hepatic fibrosis: evidence for increased collagen production in stallate cells and lean littermates of ob/ob mice. Hepatology 2002; 35: 762–771.
- [21] Ding X, Saxena NK, Lin S, et al. The role of leptin and adiponectin: a novel paradigma in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol 2005; 166: 1655–1659.
- [22] Bateller R, Schwabe RF, Choi YH, et al. NADPH oxidase signaltransduces angiotensin II in hepatic stellate cells and is critical in hepatic fibrosis. J Clin Invest 2003; 112: 1383–1394.
- [23] Joseph AE, Saverymuttu SH, al-Sam S, et al. Comparison of liver histology with ultrasonography in assessing diffuse parenchymal liver disease. Clin Radiol 1991; 43: 26–31.
- [24] Chalasani N, Younossi Z, Lavine, et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and American Gastroenterological Association Hepatology 2012; 55: 2005–2023.
- [25] Thomas EL, Hamilton G, Patel N, et al. Hepatic triglyceride content and its relation to body adiposity: a magnetic resonance imaging and proton magnetic resonance spectroscopy study. Gut 2005; 54: 122–127.
- [26] Foucher J, Chanteloup E, Vergniol J, et al. Diagnosis of cirrhosis by transient elastography (FibroscanR): a prospective study. Gut 2006; 55: 403–408.
- [27] Smith BW, Adams LA. Non-alcoholic fatty liver disease. Crit Rev Clin Lab Sci 2011; 48: 97–113.
- [28] Poynard T, Ratziu V, Charlotte F, et al. Diagnostic value of biochemical markers (NashTest) for the prediction of non alcoholo steato hepatitis in patients with non-alcoholic fatty liver disease. BMC Gastroenterol 2006; 6: 34.
- [29] Saadeh S, Younossi ZM, Remer EM, et al. The utility of radiological imaging in nonalcoholic fatty liver disease. Gastroenterology 2002; 123: 745–750.
- [30] Brent A, Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD single topic conference. Hepatology 2003; 37: 1202–1219.
- [31] Hubschner SG. Histopatological assessment of nonalcoholic fatty liver disease. Histopathology 2006; 49: 450–456.
- [32] Brunt EM, Janney CJ, Di Bisceglie AM, et al. Non-alcoholic steatohepatitis: a proposal for grading and staging the histologic lesions. Am J Gastroenterol 1999; 94: 2467–2474.
- [33] Kleiner DE, Brunt EM, Van Natta M, et al. Nonalcoholic Steatohepatitis Clinical Research Network Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41:1313–1321.
- [34] Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology 2004; 40: 1387–1395.
- [35] Charlton MR, Burns JM, Pedersen RA, et al. Frequency and outcomes of liver transplantation for nonalcoholic steatohepatitis in the United States. Gastroenterology 2011; 141: 1249–1253.
- [36] Dam-Larsen S, Franzmann M, Andersen IB, et al. Long term prognosis of fatty liver: risk of chronic liver disease and death. Gut 2004; 53: 750–755.
- [37] Adams LA, Lymp JF, St Sauver J, et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129: 113–121.
- [38] Yatsuji S, Hashimoto E, Tobari M, et al. Clinical features and outcomes of cirrhosis due to non-alcoholic steatohepatitis compared with cirrhosis caused by chronic hepatitis C. J Gastroenterol Hepatol 2009; 24: 248–254.
- [39] de Wit NJ, Afman LA, Mensink M, Müller M. Phenotyping the effect of diet on non-alcoholic fatty liver disease. J Hepatol 2012; 57: 1370–1373.
- [40] Tetri LH, Basaranoglu M, Brunt EM, et al. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. Am J Physiol Gastrointest Liver Physiol 2008; 295: G987–995.
- [41] Malhi H, Barreyro FJ, Isomoto H, et al. Free fatty acids sensitise hepatocytes to TRAIL mediated cytotoxicity. Gut 2007; 56: 1124–1131.
- [42] Johnson NA, Sachinwalla T, Walton DW, et al.Aerobic exercise training reduces hepatic and visceral lipids in obese individuals without weight loss. Hepatology 2009; 50: 1105–1112.
- [43] Blackburn GL, Mun EC. Effect of weight loss surgeries. Semin Liver Dis 2004, 24: 371–379.
- [44] Andersen T, Gluud C, Franzmann MB, et al. Hepatic effects of dietary weight loss in morbidly obese subjects. J Hepatol 1991; 12: 224–229.
- [45] Adams LA, Angulo P. Treatment of non-alcoholic liver disease. Postgrad Med J 2006; 82: 315–322.
- [46] Palmer M, Schaffner F. Effect of weight reduction on hepatic abnormalities in overweight patients. Gastroenterology 1990; 99: 1408–1413.
- [47] Huang MA, Greenson JK, Chao C, et al. One-year intense nutritional counseling results in histological improvement in patients with non-alcoholic steatohepatitis: a pilot study. Am J Gastroenterol 2005; 100: 1072–1081.
- [48] Ueno T, Sugawara H, Sujaku K, et al. Therapeutic effects of restricted diet and exercise in obese patients with fatty liver. J Hepatol 1997; 27: 103–107.
- [49] Kral JG, Thung SN, Biron S, et al. Effects of surgical treatment of the metabolit syndrome on liver fibrosis and cirrhosis. Surgery 2004; 135: 48–58.
- [50] Luyckx FH, Desaive C, Thiry A, et al. Liver abnormalities in severely obese subjects: effect of drastic weight loss after gastroplasty. Int J Obes Relat Metab Disord 1998; 22: 222–226.
- [51] Hatzitolios A, Savopoulos C, Lazaraki G, et al. Efficacy of omega-3 fatty acids, atorvastatin and orlistat in non-alcoholic fatty liver disease with dyslipidemia. Indian J Gastroenterol 2004; 23: 131–134.
- [52] Kiyici M, Gulten M, Gurel S, et al. Ursodeoxycholic acid and atorvastatin in the treatment of nonalcoholic steatohepatitis. Can J Gastroenterol 2003; 17: 713–718.
- [53] Laurin J, Lindor KD, Crippin JS, et al. Ursodeoxycholic acid or clofibrate in the treatment of non-alcohol-induced steatohepatitis: a pilot study. Hepatology 1996; 23: 1464–1467.
- [54] Bugianesi E, Gentilcore E, Manini R, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol 2005; 100: 1082–1090.
- [55] Neuschwander-Tetri BA, Brunt EM, Wehmeier KR, et al. Improved nonalcoholic steatohepatitis after 48 weeks of treatment with the PPAR gamma ligand rosiglitazone. Hepatology 2003; 38: 1008–1017.
- [56] Promrat K, Lutchman G, Uwaifo GI, et al. A pilot study of pioglitazone treatment for nonalcoholic steatohepatitis. Hepatology 2004; 39:188–196.
- [57] Sanyal AJ, Mofrad PS, Contos MJ, et al. A pilot study of vitamin E versus vitamin E and pioglitazone for the treatment of nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol 2004; 2: 1107–1115.
- [58] Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and nonalcoholic steatohepatitis in adults. Aliment Pharmacol Ther 2011; 34: 274–285.
- [59] Sanyal AJ, Chalasani N, Kowdley KV, et al. Pioglitazone, Vitamin E, or Placebo for Nonalcoholic Steatohepatitis. N Engl J Med 2010; 362: 1675–1685.
- [60] Adams LA, Zein CO, Angulo P, Lindor KD. A pilot trial of pentoxifylline in nonalcoholic steatohepatitis. Am J Gastroenterol 2004; 99: 2365–2368.
- [61] Leushner U, Lindenthal B, Herrman G, et al. High-dose Ursodeoxycholic acid therapy for nonalcoholic steatohepatitis: a double-blind, randomized, placebo-controlled trial. Hepatology 2010; 52: 472–479.
- [62] Loguercio C, Federico A, Tuccillo C, et al. Beneficial effects of a probiotic VSL#3 on parameters of liver dysfunction in chronic liver diseases. J Clin Gastroenterol 2005; 39: 540–543.
- [63] Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease. Best Pract Res Clin Gastroenterol 2010; 24: 695–708.