Nefarmakologická léčba fibrilace síní
Léčba fibrilace síní, která patří mezi nejčastější poruchy srdečního rytmu v klinické praxi, prochází v posledních letech hlubokými změnami, kdy je lépe definována úloha různých terapeutických přístupů a vzrůstá úloha nefarmakologické léčby pro dosažení a udržení sinusového rytmu. S ohledem na kapacitní a ekonomické možnosti specializovaných elektrofyziologických laboratoří je v podmínkách České republiky nadále pro většinu nemocných, kteří jsou postiženi touto arytmií, základním přístupem kontrola rytmu, resp. kontrola komorové frekvence, spolu s antikoagulační léčbou. Na druhé straně rostoucí úspěšnost katetrizační a chirurgické ablace u fibrilace síní vede k využívání těchto postupů u zvyšujícího se počtu pacientů a také u pokročilejších stadií nemoci. Katetrizační ablace se během posledních let stala metodou volby pro pacienty s paroxysmální či perzistující fibrilací síní, která vede k výrazným obtížím a je rezistentní na farmakologickou léčbu. Tato práce se zaměřuje na mechanismy fibrilace síní ve vztahu k ablačním metodám a analyzuje také metody a výsledky nejrůznějších nefarmakologických postupů při léčbě tohoto onemocnění.
Úvod
Vzhledem k prodlužování průměrné délky lidského života a zvyšování diagnostických možností se fibrilace síní (FS) stává klinickým problémem prudce nabývajícím téměř epidemických rozměrů, který je jednoznačně spojen se zvýšenou mortalitou, morbiditou, snížením kvality života a v neposlední řadě i se zvýšenými náklady na zdravotní péči. V průběhu posledních deseti let byly v několika klinických studiích srovnávány dvě nejčastější strategie farmakologické metody léčby FS: kontrola rytmu a kontrola komorové frekvence. Z hlediska délky a kvality života byly výsledky u obou postupů srovnatelné.
Existují pravděpodobně dva důvody, proč tomu tak bylo: antiarytmika jsou při stabilizaci sinusového rytmu jen málo účinná a sama jsou spojována se zvýšenou morbiditou a mortalitou, takže pozitivní efekt verze FS na sinusový rytmus (SR) byl účinkem antiarytmik pravděpodobně negativně ovlivněn. Tato pozorování spolu s výsledky z jiných klinických a experimentálních studií a s rozvojem ablačních technologií vedou k posílení úlohy nefarmakologické léčby fibrilace síní [1].
Epidemiologie
FS postihuje v rozvinutých zemích přibližně 1 % až 2 % populace [2]. Výskyt onemocnění se zvyšuje v průběhu stárnutí až na 10 % a více při dosažení věku 80 let [3]. S prodlužováním očekávané délky života se předpokládaný výskyt případů FS v populaci zvýší 2,5krát až 3krát [4]. Dále je nutno v každodenní klinické praxi kalkulovat s velkým počtem pacientů s asymptomatickou formou FS, kteří mají stejná rizika jako nemocní se symptomatickou formou [5]. Zvýšené riziko vzniku této arytmie se typicky vyskytuje u lidí vyššího věku, více u mužů než u žen, při hypertenzi, srdečním selhání, infarktu myokardu, konzumaci alkoholu, mitrální stenóze, thyreotoxikóze, syndromu spánkové apnoe, metabolickém syndromu, vysoké tělesné výšce, obezitě a při rodinné predispozici. U řady pacientů s FS se neprokáže žádné strukturální postižení myokardu [6]. Náklady na léčbu FS, zejména jejích komplikací, značně zatěžují rozpočet na zdravotní péči; například ve Francii a Velké Británii představují 1 % výdajů na zdravotnictví [7] a v USA ročně dosahují výše 6,6 miliardy USD [8]. Mortalita způsobená FS také významně stoupá: např. v USA z 27,6 na 100 000 obyvatel v roce 1980 na 69,8 na 100 000 obyvatel v roce 1998 [9].
Patofyziologický pohled na mechanismus vzniku a udržení FS
Na základě velké řady klinických a experimentálních pozorování byl v posledních deseti letech definován patofyziologický pohled na vznik a udržení FS [10]. Pro spuštění a udržování FS je nutná přítomnost dvou faktorů: spouštěcího a udržovacího. Spouštěcím faktorem jsou fokusy ektopické automacie přítomné zejména v plicních žilách [19], ačkoli v 10 % až 30 % případů jsou příčinou i jiné zdroje – rotory, ložiska ektopické aktivity v pravé a levé síní aj. [11, 12].
Patologické anomálie, jako je např. výrazná síňová fibróza myokardu, pozorované u hypertenze, ischemické choroby srdeční a srdečního selhání, nebo sekundární zvětšení levé síně při významnější mitrální regurgitaci, způsobují hluboké elektrofyziologické změny vytvářející substrát příznivý k udržování těchto „driverů“.
Opakované dlouhotrvající periody zrychlené stimulace srdeční tkáně mohou vyvolat elektrofyziologickou a mechanickou remodelaci zvyšující její heterogennost, čímž přispívají k udržování okruhů reentry způsobem, jejž vystihuje teze „FS způsobuje FS“. Zrychlená stimulace heterogenního substrátu vyvolává vysokou frekvenci reentrantních rotorů („driverů“). Tuto reentrantní aktivitu si lze asi nejlépe představit jako četné samoudržující se spirálové vlny vyvolávající fragmentaci a způsobující fibrilační vedení, kdy síňové oblasti vystavené rychlé stimulaci nejsou schopny zvládat všechny přicházející impulzy [13]. Parasympatická součást autonomního srdečního nervového systému navíc usnadňuje vyvolání a udržení FS ovlivňováním účinné refrakterní doby nebo vyvoláním spouštěcí aktivity [14].
Tento model podporuje řada klinických pozorování. Například přirozený průběh FS je často progresivní, začíná záchvatovými epizodami paroxysmální FS vedoucími nakonec k perzistujícím a posléze k permanentním formám [15]. FS ve velké míře souvisí s onemocněními vyvolávajícími hemodynamické nebo strukturální změny myokardu. Závěrem lze říci, že antiarytmická terapie postrádá dlouhodobou účinnost, protože díky progresivnímu vývoji substrátu se účinnost antiarytmik postupně snižuje až anuluje.
Katetrizační ablace FS
Iniciální úspěšnost chirurgické ablace FS prohloubila naše pochopení mechanismu vzniku a průběhu této arytmie a dále otevřela cestu k rozvoji sofistikovanějších metod založených na léčbě FS pomocí katetrizace [16, 17]. Od p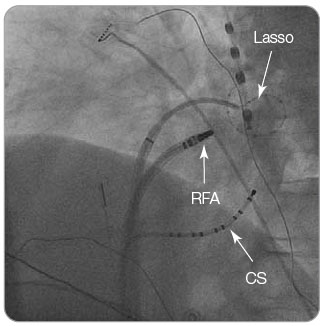 ůvodního postupu, kdy se modifikovala chirurgická metoda MAZE s lineárními lézemi v pravé a případně v levé síni, se nyní katetrizační ablační metody zaměřují na úplnou elektrickou izolaci plicních žil s možností doplnění dalších lineárních lézí nebo modifikací substrátu (např. rotorů) dle nálezů u konkrétního pacienta.
ůvodního postupu, kdy se modifikovala chirurgická metoda MAZE s lineárními lézemi v pravé a případně v levé síni, se nyní katetrizační ablační metody zaměřují na úplnou elektrickou izolaci plicních žil s možností doplnění dalších lineárních lézí nebo modifikací substrátu (např. rotorů) dle nálezů u konkrétního pacienta.
Zdokonalení katetrizačních a mapovacích technologií vedlo k prudkému zvýšení počtu prováděných výkonů [18]. V současné době došlo k dosažení konsenzu ohledně optimální ablační strategie v některých oblastech [19]. Obecně se ablace u paroxysmální FS zaměřuje na potenciální spouštěcí faktory této arytmie, zatímco ablace u permanentní FS zahrnuje rozsáhlejší postupy se záměrem modifikovat arytmický substrát.
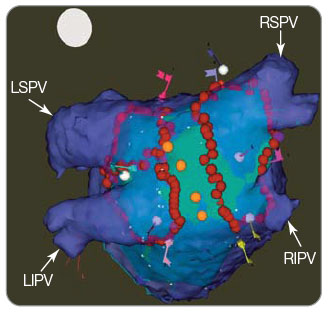 Hlavním cílem katetrizační ablace jsou plicní žíly. Elektrické izolace těchto žil dosahujeme dnes zejména periostiální ablací širokými liniemi. Standardní konfigurace katétrů pro ablaci FS je uvedena na obr. 1. Modifikace substrátu lze docílit buď zamezením reentrantních okruhů pomocí lineární ablace spojující anatomické struktury (například spojení prstence mitrální chlopně s dolní levou plicní žilou), nebo zaměřením se na abnormální substrát identifikovaný během extenzivního mapování levé síně (např. detekce a eliminace komplexně frakcionovaných síňových elektrogramů), viz obr. 2.
Hlavním cílem katetrizační ablace jsou plicní žíly. Elektrické izolace těchto žil dosahujeme dnes zejména periostiální ablací širokými liniemi. Standardní konfigurace katétrů pro ablaci FS je uvedena na obr. 1. Modifikace substrátu lze docílit buď zamezením reentrantních okruhů pomocí lineární ablace spojující anatomické struktury (například spojení prstence mitrální chlopně s dolní levou plicní žilou), nebo zaměřením se na abnormální substrát identifikovaný během extenzivního mapování levé síně (např. detekce a eliminace komplexně frakcionovaných síňových elektrogramů), viz obr. 2.
Ohledně cílových momentů ablace či definice akutní úspěšnosti neexistuje všeobecná shoda. U paroxysmální FS bývá za klíčovou a většinou dostačující považována izolace všech čtyř plicních žil, ačkoli sem některá centra běžně zahrnují také lineární ablaci trikuspidálního isthmu. U permanentní FS lze k izolaci plicních žil přidat také lineární ablaci využívající nejrůznější metody a případně ablaci komplexně frakcionovaných síňových elektrogramů. Ideálně by měl mít pacient na konci procedury sinusový rytmus s nenavoditelnou FS, ale dokonce ani tento cílový 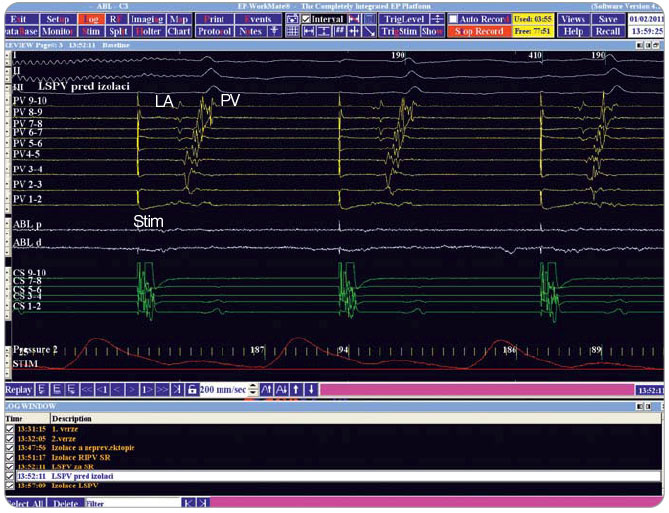 moment nemusí být z hlediska dlouhodobé úspěšnosti klíčový. Elektrofyziologický postup dokumentace provedené izolace plicních žil je prezentován na obr. 3 a 4.
moment nemusí být z hlediska dlouhodobé úspěšnosti klíčový. Elektrofyziologický postup dokumentace provedené izolace plicních žil je prezentován na obr. 3 a 4.
Preferovanou formou energie, pomocí níž je provedena síňová ablace, zůstává radiofrekvenční energie aplikovaná katétrem, ale byla vyvinuta celá řada alternativních zdrojů energie včetně kryoenergie a ultrazvukové či laserové energie. Aplikace těchto zdrojů energie může být provedena pomocí klasických katétrů nebo cirkulárním či balónkovým katétrem.
Pro zobrazení pozice katétru se stále standardně používá fluoroskopie; 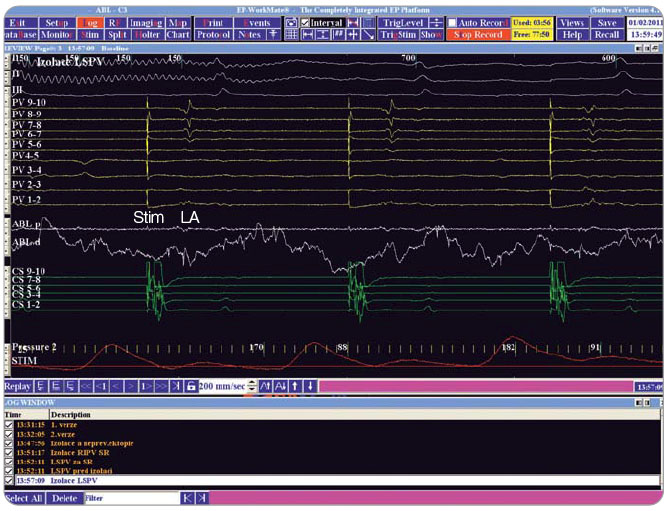 obtíže týkající se jejího omezeného prostorového rozlišení a nadměrné vystavení katetrizátora a celého týmu rentgenovému záření během časově náročných výkonů [20] však vedly k rozvoji pokročilých metod, které poskytnou podrobnější anatomické informace a vedou ke snížení rentgenové zátěže. Identifikace cíleného substrátu vyžaduje trojrozměrné mapovací systémy, které poskytují prostorově věrnou rekonstrukci srdečních komor a vizualizaci mapující ablační katétr uvnitř virtuální struktury [21]. To umožňuje přesnou identifikaci srdečních struktur a zjednodušuje tvorbu ablačních lézí. Zaznamenání předem získaných snímků počítačové tomografie (CT) či eventuálně
obtíže týkající se jejího omezeného prostorového rozlišení a nadměrné vystavení katetrizátora a celého týmu rentgenovému záření během časově náročných výkonů [20] však vedly k rozvoji pokročilých metod, které poskytnou podrobnější anatomické informace a vedou ke snížení rentgenové zátěže. Identifikace cíleného substrátu vyžaduje trojrozměrné mapovací systémy, které poskytují prostorově věrnou rekonstrukci srdečních komor a vizualizaci mapující ablační katétr uvnitř virtuální struktury [21]. To umožňuje přesnou identifikaci srdečních struktur a zjednodušuje tvorbu ablačních lézí. Zaznamenání předem získaných snímků počítačové tomografie (CT) či eventuálně 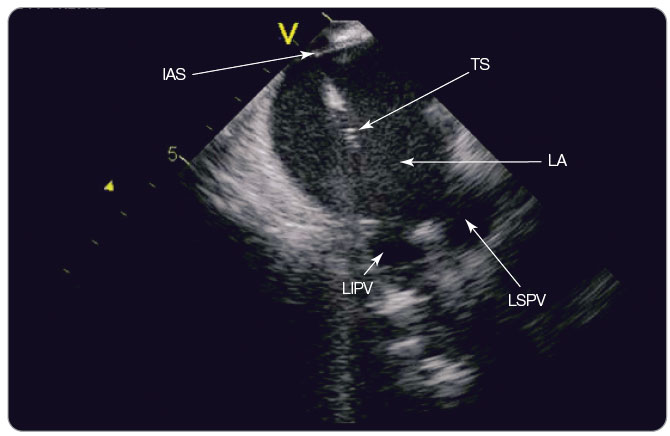 magnetické rezonance (MR) na trojrozměrné mapě je již řadu let používanou technologií, jež přispívá k přesné aplikaci ablační energie, zvyšuje efektivitu a bezpečnost výkonu [22]. V řadě center se také využívá pro zobrazování plicních žil intrakardiální echokardiografie (ICE) kvůli přesné manipulaci s katétry; tato metoda je velmi přínosná u transseptální katetrizace, která je dnes rutinní metodou i pro katetrizační ablace dalších arytmií – např. levostranných přídatných drah [23], viz obr. 5.
magnetické rezonance (MR) na trojrozměrné mapě je již řadu let používanou technologií, jež přispívá k přesné aplikaci ablační energie, zvyšuje efektivitu a bezpečnost výkonu [22]. V řadě center se také využívá pro zobrazování plicních žil intrakardiální echokardiografie (ICE) kvůli přesné manipulaci s katétry; tato metoda je velmi přínosná u transseptální katetrizace, která je dnes rutinní metodou i pro katetrizační ablace dalších arytmií – např. levostranných přídatných drah [23], viz obr. 5.
 Tři česká kardiocentra jsou již vybavena robotickými technologiemi umožňujícími dálkovou manipulaci s katétrem pomocí buď magnetického navigačního systému (Stereotaxis, Inc., St. Louis, MO) nebo speciálního systému zavaděčů řízeného robotem (Hansen Medical, Mountain View, CA), viz obr. 6 a 7.
Tři česká kardiocentra jsou již vybavena robotickými technologiemi umožňujícími dálkovou manipulaci s katétrem pomocí buď magnetického navigačního systému (Stereotaxis, Inc., St. Louis, MO) nebo speciálního systému zavaděčů řízeného robotem (Hansen Medical, Mountain View, CA), viz obr. 6 a 7.
Dlouhodobá úspěšnost katetrizační ablace FS
Recidiva FS po provedené katetrizační ablaci je dokumentována zhruba u 40 % pacientů do tří měsíců od provedení ablace. Arytmie v prvních třech měsících souvisejí s kurativním procesem v levé síni po provedení ablačních linií. Asi u 60 % pacientů k recidivě nedochází a není třeba jakéhokoli opětovného zákroku. Při následné péči se u 20 % až 50 % případů v závislosti na povaze původní FS vyskytuje rekurentní FS, nově vzniklá síňová tachykardie nebo síňový flutter související s předchozí ablací. U 20–30 % pacientů vyžadují arytmie opětovnou ablaci, a to v závislosti na typu FS, věku pacienta a přítomnosti strukturálního postižení myokardu.
Je stále otázkou, jak nejlépe monitorovat pacienty po ablaci, aby byly zdokumentovány jak symptomatické, tak asymptomatické recidivy. Během následné péče o pacienty po katetrizační ablaci se často využívají kromě běžného klinického vyšetření a standardního 12svodového EKG jedno- až sedmidenní vyšetřování pomocí holterovského monitorování a měsíční externí záznamníky událostí či implantabilní rekordéry [24]. Antikoagulace běžně pokračuje v délce minimálně šesti měsíců po ablaci s ohledem na udržení SR a riziko tromboembolie.
Komplikace katetrizační ablace FS
Text nového odstavce.
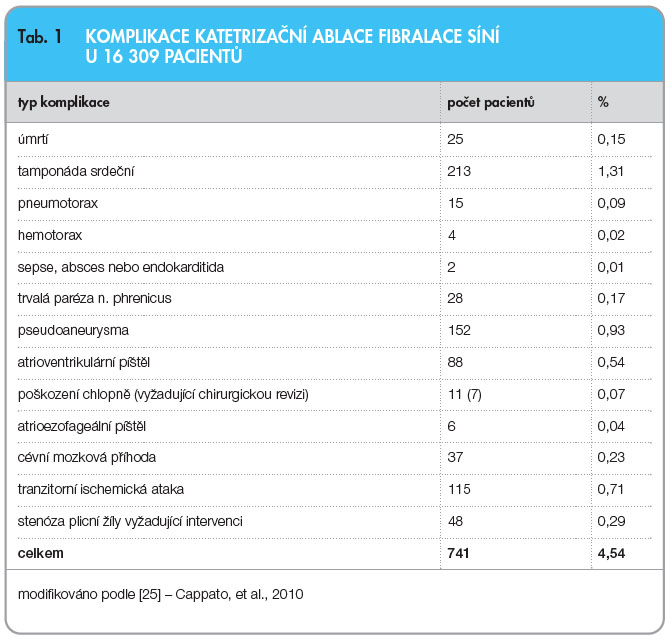 Katetrizační ablace u FS je komplexním intervenčním zákrokem s určitým rizikem vzniku komplikací. Z důvodu vstupu do žilního a arteriálního řečiště, manipulace s katétrem nebo aplikace vlastní ablační energie může dojít k závažnému poškození některých anatomických struktur. Není překvapením, že seznam dokumentovaných komplikací je dlouhý a zahrnuje srdeční tamponádu, stenózu plicních žil, parézu bráničního nervu, tromboembolické komplikace a vzácně i tvorbu atrioezofageální fistuly. K úmrtí při výkonu dochází jen výjimečně, nicméně takové případy zaznamenány byly (tab. 1). Celosvětový dobrovolný průzkum odhaduje počet celkových závažných komplikací u 4,54 % pacientů [25].
Katetrizační ablace u FS je komplexním intervenčním zákrokem s určitým rizikem vzniku komplikací. Z důvodu vstupu do žilního a arteriálního řečiště, manipulace s katétrem nebo aplikace vlastní ablační energie může dojít k závažnému poškození některých anatomických struktur. Není překvapením, že seznam dokumentovaných komplikací je dlouhý a zahrnuje srdeční tamponádu, stenózu plicních žil, parézu bráničního nervu, tromboembolické komplikace a vzácně i tvorbu atrioezofageální fistuly. K úmrtí při výkonu dochází jen výjimečně, nicméně takové případy zaznamenány byly (tab. 1). Celosvětový dobrovolný průzkum odhaduje počet celkových závažných komplikací u 4,54 % pacientů [25].
Chirurgická ablace FS
Na základě pozorování, že pro zachování reentrantních okruhů udržujících fibrilaci síní je potřebné určité množství tkáně, zavedl Cox a kol. [16] inovativní metodu MAZE. Jedná se o chirurgický zákrok významně omezující reentrantní okruhy vytvořením pevného sledu chirurgických incizí v obou síních v podobě jakéhosi bludiště.
Po několika modifikacích Cox se spolupracovníky prokázali dlouhodobou nepřítomnost FS u více než 90 % pacientů, přičemž byla zachována transportní funkce síní, stabilizována sinusová funkce a snížen výskyt mozkových příhod. Invazivní povaha a složitost operace však brání jejímu všeobecnému přijetí jako samostatného zákroku v tomto pojetí [26].
Při pokusu o zjednodušení a snížení invazivní povahy zákroku se dnes již v řadě center používá miniinvazivní postup (primární chirurgická ablace FS), kdy je přístup zajištěn pomocí minithorakotomie a cíle zákroku jsou omezeny na izolaci plicních žil, appendektomii levé síně a srdeční vagální denervaci [27]. Výsledky se však dle jednotlivých center liší a nedostatek dat z velkých souborů pacientů v současné době brání korektnímu srovnání přínosu těchto postupů. Absence randomizovaných studií srovnávajících operaci s katetrizační ablací u FS znemožňuje smysluplné srovnání obou uvedených přístupů.
Na druhé straně je chirurgická ablace FS u symptomatických pacientů, kteří podstupují jiný kardiochirurgický výkon, standardem ve všech českých kardiocentrech a je rutinně prováděna spolu s hlavním operačním výkonem.
Kardiostimulace a FS
V současné době je k dispozici dostatek důkazů o tom, že fyziologická kardiostimulace snižuje výskyt vzniku FS a zlepšuje kvalitu života u pacientů s chronickou FS a sick sinus syndromem [28]. Mezi těmito dvěma metodami kardiostimulace však neexistuje rozdíl, co se týče mortality a rizika srdečních příhod. U pacientů s kardiostimulátorem kvůli AV bloku se zdá, že tato metoda nemá žádný účinek na morbiditu nebo mortalitu, a to včetně výskytu FS [29].
Byly provedeny studie s cílem určit, zda má alternativní stimulace pravé síně vliv na výskyt FS u pacientů se symptomatickou poruchou tvorby vzruchu. Implantace elektrody do ouška pravé síně byla srovnávána s kardiostimulací Bachmannova svazku, stimulací síňového septa a mnohočetnými elektrodami v pravé síni [30]. Obecně se dá říci, že tyto studie prokázaly snížení výskytu FS a časové oddálení vzniku chronické FS, pravděpodobně díky zlepšenému vedení mezi oběma síněmi. Takto příznivé výsledky se ale neopakovaly při implantaci kardiostimulátorů u primární prevence FS ve velké multicentrické studii, jež neprokázala žádné konzistentní snížení výskytu arytmie v průběhu následné péče [31].
Komorová kardiostimulace po katetrizační ablaci AV uzlu poskytuje jasnou účinnou kontrolu komorové frekvence a značnou úlevu od symptomů u vybraných pacientů s FS. Pacienti s tachyfibrilací síní, u kterých lze obtížně dosáhnout správné kontroly komorové frekvence nebo kteří tuto léčbu špatně tolerují a nejsou indikováni k provedení katetrizační ablace, jsou dnes stále indikováni k provedení katetrizační ablace AV uzlu. Druhou skupinou jsou nemocní s indikací srdeční resynchronizační léčby a s permanentní FS, kde ablace AV junkce umožňuje dosáhnout prakticky 100% komorové stimulace a docílit tak vlastního efektu resynchronizace obou komor [32].
Síňové defibrilátory
Implantabilní síňové defibrilátory pro léčbu FS byly navrženy před rozvojem metody katetrizační ablace jako adjuvantní terapie u symptomatických pacientů. Problémy s akceptací této léčby, zejména bolest spojená s výboji, ukázaly omezené možnosti tohoto postupu a vedly ke stažení této technologie z trhu a k opuštění tohoto terapeutického postupu.
Katetrizační přístupy pro prevenci komplikací FS
Perkutánní katetrizační okluze ouška levé síně je metoda vyvinutá při pokusu o prevenci nebo redukci výskytu kardioembolických příhod. Transseptální cestou je do ouška levé síně implantován jeden z dostupných systémů (např. WATCHMAN, Atritech, Minneapolis, MN). Systém WATCHMAN prokázal uspokojivou bezpečnost a realizovatelnost u indikovaných pacientů [33]. Chirurgické odstranění levého síňového ouška nebo jeho exkluze jako součást MAZE procedury provedené během zákroku na chlopni či nejnověji katetrizační okluze ouška za použití suché perikardiální punkce a speciálního instrumentária snižují míru výskytu cévních mozkových příhod o více než 50 % [16].
Závěr
V posledních deseti letech se možnosti nefarmakologické léčby FS značně rozšířily. Nefarmakologická léčba je momentálně doporučena symptomatickým pacientům zejména s paroxysmální a perzistující formou fibrilace síní rezistentní na antiarytmickou léčbu, kde je metodou volby. Se zlepšujícími se technologiemi je pravděpodobné, že se katetrizační a eventuálně i chirurgické postupy, které povedou k reverzní remodelaci levé síně a nastolení sinusového rytmu, stanou standardem léčby u nemocných s permanentní FS včetně nemocných se strukturálním postižením myokardu. Na druhé straně je nutno uvést, že v podmínkách České republiky bude nadále antiarytmická a antikoagulační léčba a strategie kontroly rytmu a frekvence standardem pro většinu pacientů. Nové poznatky a postupy v léčbě FS jsou shrnuty v komplexním doporučení Evropské kardiologické společnosti z roku 2010 [34].
Seznam použité literatury
- [1] Freemantle N, Lafuente-Lafuente C, Mitchell S, et al. Mixed comparison of dronedarone, amiodarone, sotalol, flecainide and propafenone, for the management of atriial fibrillation. Europace 2011; doi 10: 1093/europace/euq450.
- [2] Nieuwlaat R, Capucci A, Camm AJ, et al. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005; 26: 2422–2434.
- [3] Feinberger WM, Blackshear JL, Laupacis A, et al. Prevalence, age distribution, and gender of patients with atrial fibrillation: analysis and implications. Arch Intern Med 1995; 155: 469–473.
- [4] Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation 2006; 114: 119–125.
- [5] Israel C, Groenfeld G, Ehlrich J, et al. Long term risk of atrial fibrillation documented by an implantable monitoring device. J Am Coll Cardiol 2004; 43: 47–52.
- [6] Ellinor PT, Yoerger TM, Ruskin JN, et al. Familial aggregation in lone atrial fibrillation. Hum Genet 2005; 118: 179–184.
- [7] Stewart S, Murphy N, Walker A, et al. Cost of an emerging epidemic: an economic analysis of atrial fibrillation in the U.K. Heart 2004; 90: 286–292.
- [8] Coyne KS, Paramore C, Grandy S, et al. Assessing the direct cost of treating nonvalvular atrial fibrillation in the United States. Value Health 2006; 9: 348–356.
- [9] Wattigney WA, Mensah GA, Croft JB. Increased atrial fibrillation mortality: United States, 1980–1998. Am J Epidemiol 2002; 155: 819–826.
- [10] Nattel S. New ideas about atrial fibrillation 50 years on. Nature 2002; 415: 219–226.
- [11] Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659–666.
- [12] Lin WS, Tai CT, Hsieh MH, et al. Catheter ablation of paroxysmal atrial fibrillation initiated by non-pulmonary vein ectopy. Circulation 2003; 107: 3176–3183.
- [13] Jalife J, Berenfeld O, Mansour M. Mother rotors and fibrillatory conduction: a mechanism of atrial fibrillation. Cardiovasc Res 2002; 54: 204–216.
- [14] Zhou J, Scherlag B, Edwards J, et al. Gradient of atrial refractoriness and inducibility of atrial fibrillation due to stimulation of ganglionated plexi. J Cardiovasc Electrophysiol 2007; 18: 83–90.
- [15] Al Kathib SM, Wilkinson WE, Sanders LL, et al. Observations on transition from intermittent to permanent atrial fibrillation. Am Heart J 2000; 140: 142–145.
- [16] Cox JL, Canavan TE, Schuessler RB, et al. The surgical treatment of atrial fibrillation. II. Intra-operative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101: 406–426.
- [17] Calkins H, Hall J, Ellenbogen K, et al. A new system for catheter ablation of atrial fibrillation. Am J Cardiol 1999; 83: 227D–236D.
- [18] Mickelsen S, Dudley B, Treat E, et al. Survey of physician experience, trends and outcomes with atrial fibrillation ablation. J Interv Card Electrophysiol 2005; 12: 213–220.
- [19] Calkins H, Brugada J, Packer DL, et al. European Heart Rhythm Association (EHRA); European Cardiac Arrhythmia Scoiety (ECAS); American College of Cardiology (ACC); American Heart Association (AHA); Society of Thoracic Surgeons (STS). HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007; 4: 816–861.
- [20] Macle L, Weerasooriya R, Jais P, et al. Radiation exposure during radiofrequency catheter ablation for atrial fibrillation. Pacing Clin Electrophysiol 2003; 26 (1 Pt 2): 288–291.
- [21] Novak PG, Guerra PG, Thibault B, et al. Utility of a nonfluoroscopic navigation system for pulmonary vein isolation. J Cardiovasc Electrophysiol 2004; 15: 967–972.
- [22] Dong J, Dickfeld T, Dalal D, et al. Integrated electroanatomical mapping with three dimensional MR/CT images for real time guided ablation. Circulation 2006; 113: 186–194.
- [23] Wazni OM, Rossillo A, Marrouche NF, et al. Embolic events and char formation during pulmonary vein isolation in patients with atrial fibrillation: impact of different anticoagulation regimens and importance of intracardiac echo imaging. J Cardiovasc Electrophysiol 2005; 16: 576–581.
- [24] Senatore G, Stabile G, Bertaglia E, et al. Role of transtelephonic electrocardiographic monitoring in detecting short-term arrhythmia recurrences after radiofrequency ablation in patients with atrial fibrillation. J Am Coll Cardiol 2005; 45: 873–876.
- [25] Cappato R, Calkins H, Chen SA, et al. Updated worldwide survey on the method, efficacy and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3: 32–38.
- [26] Reston JT, Shuhaber JH. Meta-analysis of critical outcomes of maze-related surgical pprocedures for medically refractory atrial fibrillation. Eur J Cardiothorac Surg 2005; 28: 724–730.
- [27] Wolf RK, Schneeberger EW, Osterday R, et al. Video assisted bilateral pulmonary vein isolation and left atrial appendage exclusion for atrial fibrillation.. J Thorac Cardiovasc Surg 2005; 130: 797–802.
- [28] Connolly SJ, Kerr CR, Gent M, et al. Effects of physiological pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. N Engl J Med 2000; 342: 1385–1391.
- [29] Gillis AM, Connolly SJ, Lacombe P, et al. Randomized crossover comparison of DDDR versus VDD pacing after atrioventricular junction ablation for prevention of atrial fibrillation. The atrial pacing periablation for paroxysmal atrial fibrillation PA (3) study investigators. Circulation 2000; 102: 736–741.
- [30] Saksena S, Prakash A, Hill M, et al. Prevention of recurrent atrial fibrillation with chronic dual site right atrial pacing. J Am Coll Cardiol 1998; 32: 1900–1908.
- [31] Mabo P, Daubert J, Bouhour A, et al. On behalf of SYNBIAPACE study group: Biatrial Synchronous Pacing for Atrial Arrhythmia Prevention: the SYNBIAPACE study. Pacing Clin Electrophysiol 1999; 22: 755.
- [32] Doshi RN, Daoud DG, Fellows G, et al. Left ventricular based cardiac stimulation post AV nodal ablation evaluation (the PAVE study). J Cardiovasc Electrophysiol 2005; 16: 1160–1165.
- [33] Sick PB, Schuler G, Hauptmann KE, et al. Initial world wide experience with the WATCHMAN left atrial appendage system for stroke prevention in atrial fibrillation. J Am Coll Cardiol 2007; 49: 1490–1495.
- [34] Camm AJ, Kirchhof P, Lipp GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31: 2369–2429.