Nízkomolekulární hepariny
Nízkomolekulární hepariny – významně se váží na antitrombin, a tím selektivněji inhibují faktor Xa, – zvyšují fibrinolýzu, – snižují hladinu inhibitoru aktivátoru plazminogenu (PAI), – zvyšují hladinu inhibitoru tkáňového faktoru, a tím inhibují tkáňový faktor a zevní koagulační systém. LMWH jsou standardizovány podle inhibiční aktivity k faktoru Xa. Preparáty s vyšší aktivitou anti Xa však nemají prokazatelně vyšší antitrombotický efekt. LMWH se používají v mnoha odvětvích medicíny. Oproti nefrakcionovanému heparinu je lze s výhodou použít v transplantologii, v léčbě a prevenci cévních uzávěrů u nádorových chorob, u nemocných s tromboembolismy v cerebrální oblasti, v profylaxi a léčbě hlubokých žilních trombóz u nemocných s ischemickou chorobou srdeční. LMWH specificky blokují receptor hladkých svalových vláken (SMC receptor), a tím brání jejich proliferaci; toho se využívá u nemocných po koronárních angioplastikách.
Úvod
Hepariny se považují za přímá antiko-agulancia, ale jejich účinek je zprostředkován především vazbou na antitrombin (AT). Při podání vysokých koncentrací heparinu se může uplatnit i působení na heparinový kofaktor II, který zprostředkovává antikoagulační účinky dermatansulfátu a sulfatovaných laktobionových kyselin.
Standardní nefrakcionovaný heparin (UFH) je směs mukopolysacharidových řetězců, jejichž molekulární hmotnost kolísá mezi 3000 až 40 000 daltony. Mukopolysacharidy se skládají z ekvimolárního množství D-glukosaminu a kyseliny D-glukuronové. Heparin zvyšuje účinek přirozeného inhibitoru řady tzv. serinových proteáz. Většina koagulačních faktorů odhaluje po aktivaci v místě svého účinku serin a označují se jako serinové proteázy. Potenciace účinku AT se projevuje inhibicí faktoru XII, XI a IX, dále především inhibicí faktoru Xa a trombinu [1].
Koagulační aktivita heparinu
Heparin má jako směs mukopolysacharidů různou afinitu k AT. Antitrombin se váže k heparinu pentasacharidovými sekvencemi. Vysokou afinitu k AT mají frakce heparinu s molekulární hmotností nižší než 6000 daltonů. Aktivita frakcionovaného nízkomolekulárního heparinu (LMWH) k antitrombinu je 4krát vyšší, než je aktivita nefrakcionovaného heparinu. O účinku heparinu tedy rozhodují velmi malé funkční fragmenty schopné vazby na AT. Vysokomolekulární či nefrakcionovaný heparin má nízkou afinitu k antitrombinu, a vyvolává tedy i nižší antikoagulační odpověď. Naproti tomu má nefrakcionovaný heparin jiné schopnosti: a) inhibovat hyperplazii vaskulárních svalových vláken, b) aktivovat lipoproteinovou lipázu, c) snižovat sekreci aldosteronu, d) indukovat destičkovou agregaci (středněmolekulární frakce). Fragmenty heparinu o 16–20 monosacharidových jednotkách, které mají molekulovou hmotnost nižší než 5000 daltonů a obsahují specifické vazebné pentasacharidové sekvence k AT, významně neovlivňují trombin. Ale na druhé straně významně inhibují faktor Xa.
Biologická využitelnost heparinu je rovněž vázána na molekulární hmotnost heparinových řetězců a na jejich schopnost vázat se na endotelie a plazmatické bílkoviny. Vysokomolekulární a nefrakcionovaný heparin se aktivně váže na endoteliální buňky a na makrofágy, čímž rychle mizí z cirkulace. K udržení účinné plazmatické hladiny je v klinické praxi nutná trvalá infuze nebo opakované podávání heparinu. Standardní heparin (UFH) se také váže na různé plazmatické bílkoviny, jako je fibronektin, vitronektin, destičkový faktor 4 a von Willebrandův faktor. Tím je omezováno množství heparinu schopné vázat se s AT, důsledkem těchto procesů je pak další snižování antikoagulačního účinku nefrakcionovaného heparinu. Dále se heparin váže na proteiny akutní fáze, jejichž hladina je zvýšena i při tromboembolické nemoci. Tím se částečně vysvětluje rezistence na antikoagulační léčbu heparinem při podávání fixních dávek heparinu.
Nízkomolekulární hepariny (LMWH) mají naopak nízkou afinitu k endoteliím a plazmatickým bílkovinám. Tím se udržuje jejich vysoká plazmatická hladina i při bolusovém podání LMWH a pokles není závislý na velikosti dávky heparinu. Tato skutečnost je příčinou výrazně lepší biologické využitelnosti nízkomolekulárních heparinů a umožňuje lépe odhadnout jejich antikoagulační působení. Nízkomolekulární hepariny se kromě mírně rozdílné molekulární hmotnosti liší především způsobem frakcionace.
Plazmatická aktivita LMWH dovoluje při prevenci tromboembolické nemoci (TEN) podávat nízkomolekulární heparin jednou denně podkožně. Nízká aktivita LMWH k fibronektinu, von Willebrandovu faktoru a k destičkovému faktoru 4 udržuje jeho stabilní plazmatickou hladinu, a tedy i dobře odhadnutelnou antikoagulační odpověď. Plazmatický poločas LMWH není závislý na dávce, jak je tomu u nefrakcionovaného heparinu, ale na renální clearance. Proto u nemocných s renální nedostatečností je biologický poločas LMWH prodloužen [2, 3].
Antitrombotické působení heparinu nespočívá pouze v jeho antikoagulační aktivitě. Nefrakcionovaný heparin ovlivňuje endoteliální funkce, aktivuje fibrinolýzu, působí na morfologické krevní elementy a působí i reologicky. LMWH uvolňují fibrinolytické markery a metabolity prostacyklinu. Klinicky se LMWH používají k prevenci žilních tromboembolismů a k prevenci arteriálních restenóz. Heparin, na rozdíl od přímých inhibitorů trombinu, působí méně na trombin vázaný na fibrin. Přesto byla prospěšnost heparinu spolehlivě prokázána při prevenci restenóz u nemocných se srdečním infarktem, kteří byli léčeni tkáňovým aktivátorem plazminogenu. LMWH je i v tomto případě výhodnější než nefrakcionovaný heparin, neboť má lépe předvídatelný antikoagulační účinek [4].
Příprava nízkomolekulárních heparinů
Příprava nízkomolekulárních heparinů může být: a) alkoholovou precipitací, frakcionací a depolymerizací, b) enzymatickou depolymerizací heparinázou, c) peroxidativní depolymerizací následovanou alkoholovou extrakcí, d) isoamylnitritovou depolymerizací, e) depolymerizací s kyselinou dusičnou a gelovou filtrací. Molekuly LMWH se izolují jednak gelovou filtrací, jednak ultrafiltrací či extrakcí s ethanolem.
Ovlivnění zevního koagulačního systému heparinem
Koagulace je patofyziologicky zahajována dvěma mechanismy:
– aktivací kontaktem ve vnitřním systému,
– uvolněním tkáňového aktivátoru v zevním systému.
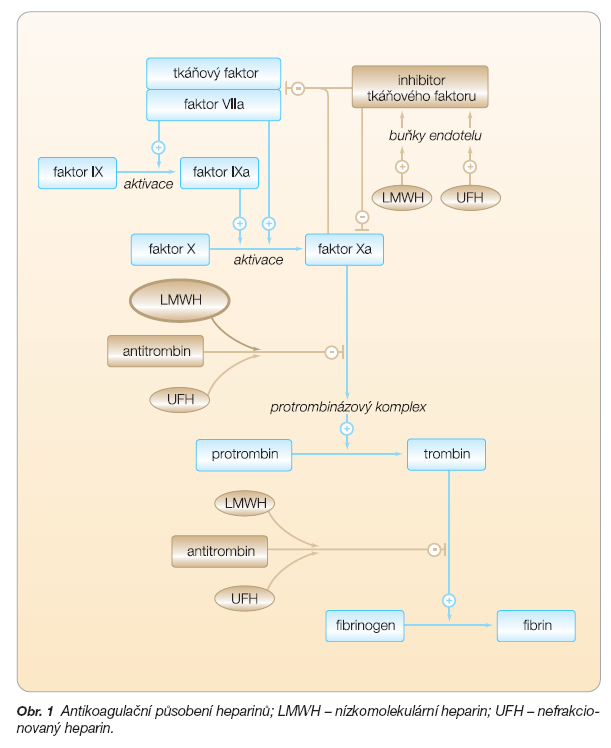
Zatímco ve vnitřním systému aktivace koagulace dlouho a podrobně známe celou řadu inhibitorů, které udržují tuto rovnováhu, odpovídající inhibitor zevního systému aktivace (inhibitor tkáňového faktoru, TFPI) byl objeven teprve v roce 1987. Tkáňový faktor (TF), jehož uvolnění zahajuje proces aktivace zevního systému, je transmembránový buněčný receptor, který se za normálních podmínek v cirkulaci nevyskytuje. Uvolňuje se do krevního oběhu při poškození stěny cévní nebo z povrchu stimulovaného mononukleáru. Dále se vytváří komplex TF a faktoru VIIa. Tento komplex se účastní koagulace tím, že aktivuje faktor IX (FIX) a faktor X (FX). TFPI vykazuje dvojnásobný inhibiční efekt: jednak inhibuje FXa vazbou na jeho aktivní část a jednak inhibuje TF pomocí kvarterního komplexu skládajícího se z TFPI, TF, FVIIa a FXa. Tento komplex reverzibilně inhibuje FXa a není závislý na iontech Ca2+, zatímco vazba TF/FVIIa na TFPI a FXa je na vápníku závislá. TFPI je protein, který obsahuje 276 aminokyselin a má hmotnost 32 000 daltonů. Význam TFPI je především v tom, že dokáže inhibovat malá množství TF, která mají pravděpodobně zásadní úlohu v udržení hemostatické rovnováhy.
Uvolnění TFPI a zvýšení jeho inhibiční aktivity po podání heparinu se považuje za jeden z hlavních momentů pro vysvětlení antikoagulační aktivity endotelu. TFPI se uvolňuje do plazmy a jeho obsah je závislý na heparinu. Nízkomolekulární heparin zvyšuje plazmatickou hladinu TFPI asi 10krát. TFPI se dále váže na krevní destičky a na endotel; 50–70 % váže endotel (endovaskulární pool), z něhož jej uvolňuje heparin. Kromě zvýšení TFPI vede podání LMWH i k selektivní inhibici faktoru Xa, a to bez nutnosti vazby na AT, tj. přímou blokádou zevní cesty aktivace hemostázy (obr. 1).
Podání nízkomolekulárního heparinu (LMWH) vede také ke snížení hladiny inhibitoru aktivátoru plazminogenu (plazminogen, resp. plazmin se podílí na rozpuštění fibrinové zátky), a tím mírně zvyšuje fibrinolytické vlastnosti krve.
Antitrombotický účinek LMWH při podkožním podání vytváří antitrombotické prostředí více mechanismy:
– významnější vazbou na AT, a v důsledku toho selektivnější inhibicí Xa (antitrombinový efekt);
– zvýšením fibrinolýzy (zvyšuje hladinu tkáňového aktivátoru plazminogenu – tPa, snižuje aktivitu inhibitoru aktivátoru plazminogenu – PAI);
– zvyšuje TFPI (inhibitor tkáňového faktoru), a tím inhibuje TF a zevní koagulační systém;
– má protidestičkový účinek;
– restituuje endoteliální dysfunkci (blokádou SMC receptoru);
– inhibuje prokoagulační aktivitu leukocytů.
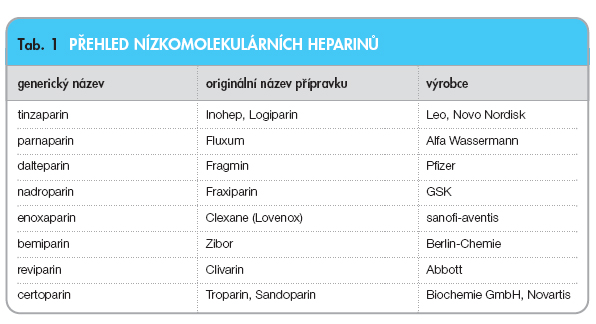
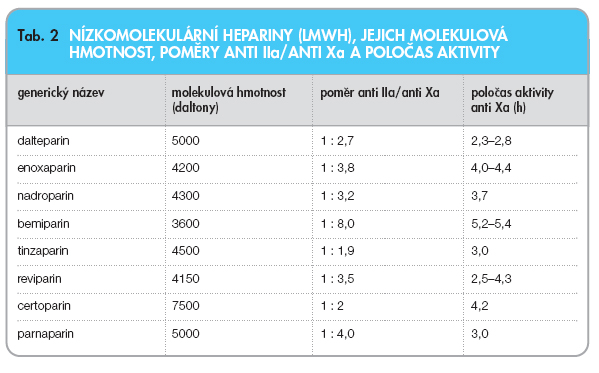
Nízkomolekulární heparin uvolňuje TFPI výrazněji než nefrakcionovaný heparin. Přehled nízkomolekulárních heparinů a jejich vlastností ukazují tab. 1, 2.
Vybrané situace užití LMWH v klinické praxi
Farmakologická prevence žilních tromboembolismů nízkomolekulárními hepariny
Nízkomolekulární hepariny v prevenci se uplatňují především v chirurgii, ortopedii a u imobilizovaných nemocných na klinických odděleních a jsou účinnější a bezpečnější nežli nefrakcionovaný heparin, výhodou je podávání jen 1krát denně s.c. Jejich podávání je provázeno nižším výskytem krvácivých komplikací. Dávku nízkomolekulárního heparinu volíme podle hmotnosti nemocného. První dávka se podává 2 hodiny před operací a pak 5–10 dnů po operaci nebo do doby mobilizace nemocného. Užívají se však i jiné léčebné postupy, především u ortopedických pacientů. U těchto vysoce rizikových nemocných se dává přednost podání nízkomolekulárního heparinu 12 hodin před operací, což je optimální. S ohledem na možné vyšší riziko krvácení však existují i postupy, kdy se prevence nízkomolekulárním heparinem zahajuje až po operaci (bemiparin). U vysoce rizikových nemocných se doporučuje přejít na podávání perorálních antikoagulancií a podávat je ještě po dobu asi jednoho měsíce [5–10].
Léčba žilních tromboembolismů nízkomolekulárními hepariny
Nízkomolekulární hepariny (LMWH) se používají v prevenci a léčbě arteriálních a žilních tromboembolismů již velmi dlouho. Jejich použití při léčbě hluboké žilní trombózy je součástí standardních doporučených postupů řady odborných společností. Stále více se nízkomolekulární hepariny uplatňují v léčbě trombóz koronárních a mozkových arterií. Prokazuje se, že ve srovnání s nefrakcionovaným heparinem (UFH) se vyznačují stejnou efektivitou, stejným rizikem reokluzí a podobným rizikem krvácení. Zvažuje se jejich ekonomická výhodnost oproti podání UFH.
Je nepochybné, že LMWH se vyznačují četnými odlišnými vlastnostmi, které tyto preparáty již předem teoreticky zvýhodňují proti UFH. LMWH má lepší biologickou využitelnost, neboť se méně váže na endotelie a na plazmatické bílkoviny. UFH se aktivně váže na endoteliální buňky a na makrofágy, a tím rychle mizí z cirkulace. LMWH nízkou afinitou k endoteliím a plazmatickým bílkovinám samozřejmě udržuje svoji vysokou plazmatickou hladinu i při bolusovém podání a pokles koncentrace není závislý na velikosti dávky heparinu. LMWH jsou standardizovány podle inhibiční aktivity k faktoru Xa. Je však třeba říci, že anti Xa aktivita není diferenciačním faktorem pro posuzování rozdílů u jednotlivých LMWH. Léčivé přípravky s vyšší aktivitou anti Xa nemají prokazatelně vyšší antitrombotický efekt. LMWH se eliminují ledvinami, což je třeba uvědomit si u starších osob s nižšími ledvinnými funkcemi. LMWH jsou charakterizovány poměrem aktivit anti IIa/anti Xa. Tento poměr se pohybuje u dosud známých preparátů v rozmezí 1 : 1,8–1 : 8 [11].
Studie prokázaly, že léčba nízkomolekulárním heparinem je stejně účinná u akutní hemodynamicky stabilní plicní embolie jako léčba standardním heparinem [12]. Výhodou nízkomolekulárního heparinu je skutečnost, že není třeba laboratorního monitorování léčby. Podle doporučení ACCP vydaných v roce 2004 [13, 14] je možné podat nízkomolekulární heparin u drobných a středních plicních embolií, mají-li pacienti zachovánu normální funkci pravé komory srdeční.
Průkazy účinnosti v léčbě žilních tromboembolismů existují pro:
– dalteparin v dávce 120 antifaktor-Xa j/kg s.c. 2krát denně,
– nadroparin v dávce 400 antifaktor-Xa j/kg rozdělené do 2 injekcí s.c. denně,
– enoxaparin v dávce 100 antifaktor-Xa j/kg/den – 200 UI/kg/den (1,5 mg/kg 1krát denně),
– reviparin podávaný v dávce 6300 antifaktor-Xa j 2krát denně pro nemocné s hmotností > 60 kg a v dávce 4200 j 2krát denně pro nemocné s hmotností 46–60 kg,
– tinzaparin v dávce 175 antifaktor-Xa j/kg 1krát denně s.c.,
– bemiparin v dávce 115 antifaktor Xa j/kg 1krát denně s.c.
Léčba plicní embolie pomocí LMWH
LMWH se používá v léčbě žilních tromboembolismů již více než 10 let. Farmakologicky a antitromboticky výhodnější podání LMWH se prokázalo ve studiích v polovině 90. let [15, 16]. Tyto studie prokázaly, že jak recidivy žilních trombóz a plicní embolie, tak krvácení, stejně jako mortalita jsou při léčbě žilních TEN stejné, a to jak při podání UFH, tak i LMWH. Četné studie srovnávaly léčbu LMWH a UFH z hlediska bezpečnosti, množství vedlejších účinků, rekurence tromboembolie a mortality. Metaanalýzy prokázaly, že léčba LMWH byla stejně účinná a stejně bezpečná jako terapie UFH. Stejně tak dopadly studie, které srovnávaly účinnost a bezpečnost LMWH u nemocných léčených doma s efektem a bezpečností UFH podávaného pacientům v nemocnici. LMWH podávaný při léčbě tromboembolií doma se ukázal jako levnější ve srovnání s UFH, jímž byli pacienti léčeni v nemocnici [17, 18].
Příčina dobrého efektu LMWH při léčbě plicní embolie vyplývá i ze skutečnosti, že celá řada nemocných s proximální trombózou žil na dolních končetinách má zřejmě i klinicky němou plicní embolii. Hull a kol. [13] prokázali také vyšší než 40% četnost scintigraficky prokazatelných plicních embolií, které nebyly klinicky manifestní. Je jisté, že část nemocných, kteří mají žilní trombózu, má i asymptomatickou TEN a tito nemocní jsou s úspěchem léčeni LMWH. Podle jiných autorů má 50–60 % nemocných s proximální hlubokou žilní trombózou na dolních končetinách asymptomatickou plicní embolii. Multicentrická studie uspořádaná Hullem a kol. v roce 2000 prokázala, že že tinzaparin v jedné denní dávce podávané s.c. je dokonce účinnější než UFH. U nemocných léčených LMWH nebyla zaznamenána žádná rekurence žilního tromboembolismu, a to v situacích, kdy sledovaný soubor tvořili nemocní pouze s proximální žilní trombózou, kteří byli již od počátku randomizováni do skupiny s UFH nebo s LMWH. Tato skutečnost by se dala vysvětlit i tím, že rekurence žilní TEN je podle dřívějších Hullových prací zcela závislá na rychlosti nastavení antikoagulační hladiny heparinu po zahájení léčby.
Bezpečnost léčby měřená počtem krvácivých komplikací a mortalitou byla pro UFH a LMWH srovnatelná. Léčba heparinem nebude vhodná v případě symptomatické plicní embolie u pacientů s poruchou funkce pravé komory.
Antikoagulační léčba u žilních tromboembolií (TEN) v onkologii
Rekurentní žilní trombóza se vyskytuje 3krát častěji u nemocných s malignitou než bez malignity. U nemocných s malignitou lze při léčbě žilních tromboembolismů očekávat významné krvácení, a to ve 13,3 % proti riziku krvácení 2,1 % u nemocných bez malignity. Nemocní léčení LMWH mají nižší mortalitu a méně krvácivých komplikací. Při zjišťování malignity u žilních tromboembolismů je nejčastěji nalézán karcinom prostaty, který představuje 13,5 % ze všech malignit s TEN. Dále nádory plic (10,5 %), nádory tračníku (8,6 %), nádory pankreatu (7,3 %) a nádory žaludku (5,9 %). Žilní trombóza byla zaznamenána u 5,6 % nově zjištěných nádorů ovaria [19].
Riziko TEN u nemocných s nádorovými chorobami se zvyšuje operacemi, chemoterapií, kanylací a imobilizací nemocných. Nemocní s nádorovými chorobami mají hyperkoagulační změny hemostázy, které se liší typem nádorového onemocnění, stadiem nádoru, klinickým stavem nemocného a závislostí na typu použité léčby. Koagulační změny se týkají zvýšené koncentrace faktoru VIIa, XIIa, trombin-antitrombinových komplexů a fragmentů PF1+2. U mužů je riziko TEN nejvyšší u nádorů prostaty (14 %), kolorektálního karcinomu (11 %) a mozkových nádorů (9 %), u žen je nečastější TEN u nádorů prsu (14 %), ovarií (7 %) a plic (5 %).
Léčba TEN u nádorových onemocnění je limitována předpokládaným zkrácením života, na druhé straně je antikoagulační léčba důležitá jako součást paliativní léčby dušnosti a bolestí. Nemocní s malignitami mohou být rezistentní i na léčbu vysokými dávkami nitrožilního heparinu, naproti tomu nemocní s malignitami mají vysoké riziko poheparinového krvácení. Pokud je to možné, měli by být nemocní s žilními tromboembolismy léčeni LMWH v domácím prostředí. Léčba LMWH doma by měla trvat alespoň 5 týdnů. Po počáteční léčbě LMWH v terapeutických dávkách by měla následovat léčba kumariny, alespoň po dobu tří měsíců. Ve studii CLOT byla sledována rekurence žilních tromboembolismů u prolongované léčby. Byl porovnáván efekt dlouhodobé sekundární profylaxe nízkomolekulárním heparinem a warfarinem u nemocných s žilní trombózou při nádorovém onemocnění. Otázkou bylo, zda je LMWH efektivnější než warfarin. Léčba byla v obou větvích prolongována na 3 měsíce. Warfarin byl podáván v plné léčebné dávce a dávkování LMWH bylo sníženo po dobu 3 měsíců na 75 %.
Cílem studie bylo zjistit počet rekurencí žilních tromboembolismů, četnost závažného krvácení a úmrtí. Bylo randomizováno 678 nemocných, rozdělených podle věku, pohlaví a typu nádoru. Ve skupině, kde probíhala prolongovaná léčba 75% dávkou LMWH (dalteparin), byla statisticky významně nižší četnost žilních tromboembolismů (p < 0,0017). Relativní riziko žilního tromboembolismu pokleslo o 52 %. Nebyl zaznamenán vyšší počet úmrtí a krvácivé komplikace byly srovnatelné [20]. Podle této studie je dlouhodobá léčba LMWH pro nemocné s žilními tromboembolismy a nádorovými chorobami přínosná.
Operace u maligních onemocnění
Prevence TEN u maligních onemocnění odpovídá doporučením pro nemocné ve vysokém riziku TEN. Historicky prokázanou možností je aplikace minimální dávky heparinu 3krát denně. Porovnání enoxaparinu a UFH ukázalo obdobnou účinnost obou látek.
Použití LMWH v léčbě a prevenci tromboembolie v těhotenství
Zvláště vysoké riziko tromboembolie vykazují ženy s anamnézou tromboembolie mimo těhotenství. K racionální prevenci tromboembolie (TEN) v graviditě je možné rozdělit těhotné se zvýšeným rizikem TEN do 3 skupin dle míry rizika (tab. 3) [21, 22]. Léčebné a terapeutické možnosti můžeme shrnout dle doporučení 7. konference ACCP (The American College of Chest Physicians) [22]:
– miniheparinizace UFH – 5000 jednotek s.c. po 12 hodinách,
– střednědávkovaný UFH – subkutánní aplikace dvou denních dávek dosahujících cílového nastavení anti Xa aktivity 0,1–0,3 IU/ml,
– adjustovaná dávka UFH – subkutánní aplikace dvou denních dávek dosahujících cílového nastavení terapeutických hodnot APTT,
– profylaktické dávkování LMWH – dalteparin 5000 jednotek s.c. 1krát denně či enoxaparin 40 mg s.c. 1krát denně, nadroparin 0,3 ml s.c. 1krát denně (ev. modifikace dávky zmíněných LMWH přepočtem na kg tělesné hmotnosti – 100 jednotek/kg tělesné hmotnosti 1krát denně),
– střednědávkovaný LMWH – dalteparin 5000 jednotek s.c. po 12 hodinách či enoxaparin 40 mg s.c. každých 12 hodin, nadroparin 0,3 ml s.c. po 12 hodinách (ev. modifikace dle tělesné hmotnosti: 100–150 jednotek/kg tělesné hmotnosti každých 24 hod.),
– adjustovaná dávka či plná léčebná dávka LMWH – dalteparin 200 jednotek/kg tělesné hmotnosti za 24 hod., enoxaparin 100 jednotek (1 mg)/kg tělesné hmotnosti po 12 hod., nadroparin 100 jednotek/kg tělesné hmotnosti po 12 hod.
Způsob aplikace: subkutánně, UFH je možné podat i intravenózně. Frekvence: v případě UFH 2–3krát denně, v případě LMWH 1–2krát denně. Dávkování: za preventivní dávku je považováno podání paušální doporučené dávky nebo dávky upravené dle tělesné hmotnosti s doporučením 100 IU LMWH (u UFH asi dvojnásobek) na kg tělesné hmotnosti každých 24 hod. z preventivních a 200 IU LMWH z léčebných důvodů. Kontrola účinku preventivní dávky heparinu: není vždy nutná, ale provádí-li se, jsou doporučena cílová rozmezí pro profylaxi či léčbu tzv. anti Xa aktivity (viz níže).
Léčba žen, které užívají dlouhodobou antikoagulační terapii a plánují těhotenství
Je doporučována náhrada perorálních antikoagulancií terapeutickým UFH nebo LMWH do 6. gestačního týdne.
Léčba TEN během těhotenství
Doporučuje se podávat adjustované dávky LMWH či adjustované dávky UFH (po intravenózní bolusové léčbě). Léčba sestává z 14denní aplikace léčebné dávky heparinu a z přechodu na profylaktickou dávku s přihlédnutím k trombofilním dispozicím. Po individuálním zhodnocení všech rizikových faktorů lze podávat terapeutickou dávku UFH nebo LMWH do porodu.
Domácí léčba žilní trombózy LMWH
Jednodušší způsob subkutánní aplikace nízkomolekulárních heparinů bez potřeby laboratorní kontroly vytváří předpoklady pro léčbu žilní trombózy v domácí péči, tj. bez hospitalizace, nebo jen s krátkým úvodním pobytem v nemocnici.
Dosavadní studie prokázaly, že při dodržení nutných podmínek je ambulantní léčba nízkomolekulárními hepariny přinejmenším stejně bezpečná jako při tradiční ústavní léčbě standardním heparinem [23]. V případě domácí léčby, která je navíc pro pacienty příjemnější, přistupují k významně lepším léčebným vlastnostem nízkomolekulárních heparinů nemalé úspory nákladů na hospitalizaci. Jak ukázaly studie, lze ambulantního způsobu léčby použít u většiny pacientů, i když v běžné praxi asi nebude dosahovat tak velkého počtu jako v klinických hodnoceních, kde tato varianta byla použita až u 80 % osob.
Ambulantní způsob léčby klade nepochybně větší nároky na zdravotnický personál, který jej provádí, než je tomu při předání pacienta k hospitalizaci. Volba léčby za hospitalizace může být často podmíněna spíše organizačními než medicínskými příčinami. Ambulantní způsob léčby se v zásadě neliší od postupu při hospitalizaci. Doporučované schéma dávkování jednotlivých nízkomolekulárních heparinů v léčbě žilní trombózy používá buď s.c. aplikaci 1krát denně nebo 2krát denně po 12 hodinách. Dosavadní klinické studie neprokázaly, že by některý z těchto způsobů byl vhodnější [24].
Při výběru vhodného pacienta je třeba hodnotit rozsah a klinickou závažnost trombotického postižení, stabilnost klinického nálezu, nekomplikovanost průběhu s normálními životními funkcemi pacienta, riziko krvácení a nepřítomnost pokročilé renální insuficience. Je třeba také zajištění technických podmínek tohoto způsobu léčby. Aplikaci nízkomolekulárních heparinů lze řešit různým způsobem – zácvikem samotného pacienta nebo rodinných příslušníků, denním dojížděním do ordinace, návštěvami u pacienta apod. Nutný je i dostatečně praktický systém dozoru nad ambulantně léčeným pacientem a monitorace souběžně probíhající perorální antikoagulační léčby [25]. Hlavní faktory pro kontraindikaci ambulantní léčby žilní trombózy jsou přehledně uvedeny v tab. 4.
Profylaxe tromboembolie v ortopedii
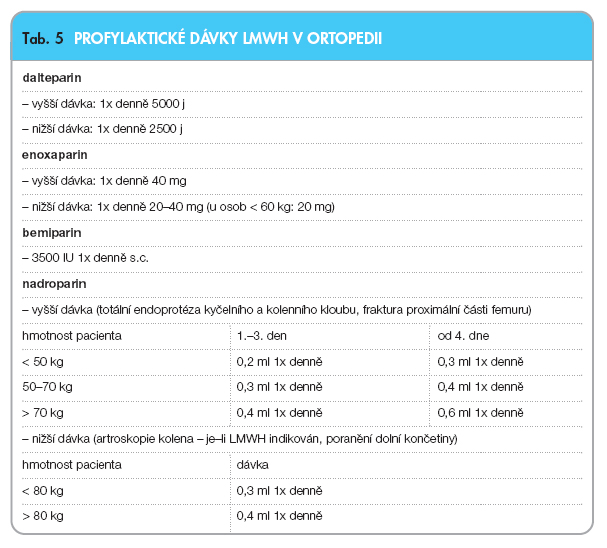
Nemocní hospitalizovaní pro zlomeniny končetin a pro ortopedické operace mají vysoké riziko žilní tromboembolie. Užití LMWH v ortopedii snižuje významně četnost fatální i nefatální plicní embolie. V tab. 5 jsou uvedeny obvyklé profylaktické dávky LMWH [26, 27].
LMWH a koronární syndromy
U nemocných s koronárními syndromy bez ST elevace na EKG bylo uskutečněno pět studií s nízkomolekulárními hepariny (dalteparin, nadroparin, enoxaparin) [28–31]. LMWH byly srovnávány se standardním léčebným postupem za použití UFH. V těchto pěti studiích (FRISC, FRIC, FRAXIS, ESSENCE, TIMI 11B) byly soustředěny informace od více než 10 000 nemocných. Studie sledovaly kombinovaný cíl, který zahrnoval počet zemřelých, počet nemocných s rozvojem do srdečního infarktu, nutnost provedení urgentního bypassu a progrese nálezu na EKG. Studie nebyly stejně konfigurovány a sledovaly změny v intervalu od 24 do 72 hodin. Všechny studie prokázaly, že není rozdíl v kombinovaném cíli mezi podáním LMWH a UFH. Ve studiích ESSENCE a TIMI 11B, které se uskutečnily s enoxaparinem, bylo navíc dosaženo 20% redukce mortality, infarktů a rekurence anginózních bolestí ve srovnání s konvenční léčbou UFH. LMWH v žádné ze studií nevykazovaly zvýšené riziko krvácení [32]. Ve studii ASSENT III bylo 6090 nemocných se srdečním infarktem. Kombinován byl LMWH s tenekteplázou. Studie prokázala, že kombinace LMWH a trombolytika je účinnější než trombolytikum v kombinaci s UFH [33].
Vybrané aspekty léčby LMWH
Laboratorní kontrola léčby LMWH
Léčba pomocí LMWH nevyžaduje v běžné klinické praxi laboratorní kontrolu účinnosti. Podání LMWH zpravidla neprodlužuje významně základní koagulační testy, včetně aktivovaného parciálního tromboplastinového času (aPTT). Individuálně je však užitečné kontrolovat antikoagulační odpověď na léčbu LMWH laboratorními testy. K dispozici je stanovení anti Xa aktivity (terapeutické rozpětí při léčbě enoxaparinem 0,6–1,1, při léčbě nadroparinem 0,5–1,0), Hep test nebo monitorování heparinémie. Laboratorní kontrola pomocí anti Xa se doporučuje u nemocných s renální insuficiencí, protože LMWH se vylučuje ledvinami, dále u gravidních, vzhledem k měnící se hmotnosti během gravidity, a u dětí pro rozdílné koagulační poměry.
Převod na léčbu kumariny je při podávání LMWH i UFH stejný. Souběžně se podává LMWH a warfarin 4–5 dní. Warfarin podáváme v dávce 5 mg denně za denních kontrol INR. Výsledná hodnota INR pro ambulantní sledování má být 2,0–3,0 [34].
Při léčbě LMWH je nutné kontrolovat hladinu trombocytů před léčbou a v průběhu léčby, stejně jako při podávání UFH. Její pokles pod hodnotu 100 x 109/l nebo pokles o více než jednu třetinu může svědčit pro HIT (imunopatologická heparinem indukovaná trombocytopenie). Ještě nedávno se soudilo, že výskyt HIT je po léčbě LMWH 10krát nižší než po podávání UFH. Současné poznatky tento názor mění.
Heparinem indukovaná trombocytopenie
Výskyt HIT je odlišný u interních nebo chirurgických nemocných. V ortopedii je častější po terapii UFH (5 %) a méně častý po léčbě LMWH (0,5 %), u interních nemocných je četnost výskytu po podávání obou heparinů stejná (UFH 0,8 %, LMWH 0,8 %). U těhotných žen je často při léčebných dávkách LMWH riziko až 6 %, ale při profylaktických dávkách je riziko velmi nízké.
Kritéria pro rozpoznání HIT jsou: normální počet destiček před zahájením léčby heparinem, trombocytopenie 5–21 dní po zahájení léčby heparinem (pokles o 50 % z původní hodnoty), okamžité tromboembolické komplikace během podávání heparinu; vyloučení jiných příčin trombocytopenie [24] (tab. 6, 7).
Osteoporóza po podávání heparinu
Dlouhodobé podávání heparinu (UFH i LMWH) vede u některých nemocných k riziku vzniku osteoporózy. Na toto riziko musíme myslet u nemocných, kteří mají indikovanou antikoagulační léčbu, během níž není možné využít warfarin pro některou z kontraindikací. Významné snížení denzity kostí je možné pozorovat u 30 % nemocných, kteří užívají heparin déle než jeden měsíc. Nejčastěji se projeví podávání heparinu frakturami obratlů, vyskytují se asi v 2–3 % u pacientů dlouhodobě užívajících heparin. Heparin na zvířecím modelu zvyšuje činnost osteoklastů. Heparinem indukovaná osteoporóza je vyvolána nepoměrem mezi zvýšenou kostní resorpcí a sníženou tvorbou kosti [36].
Možné protinádorové působení LMWH
Na počátku 90. let byly publikovány studie porovnávající léčebný účinek LMWH u nemocných s žilní TEN, která vznikla v průběhu nádorových onemocnění. Tyto studie prokázaly nevysvětlitelné snížení mortality na nádorová onemocnění. Metaanalýza 629 nemocných s nádorovým onemocněním prokázala snížení mortality na nádorová onemocnění u skupiny pacientů s LMWH oproti skupině léčené UFH. Není prokázáno, že by LMWH měl protinádorový účinek, ale studie prováděné na zvířatech prokazují, že po léčbě LMWH dochází k redukci metastáz a angioneogeneze [20, 37].
Práce vznikla za podpory VZMZ MZ 00179906.
Seznam použité literatury
- [1] Hirsh J, Warkentin TE, Shaughnessy SG, et al. Heparin and low molecular weight heparin. Chest 2001; 119: 64S–94S.
- [2] Agnelli G, Sonaglia F. Prevention of venous thrombosis. Thrombosis Res 2000; 97: V49–V62.
- [3] Andrew M, Brooker LA, Ginsberg JS, Kelton JG. Clinical problems in anticoagulation therapy. Hematology, Education program. Am Soc Hematol 1997; 8–28.
- [4] Turpie AG. Choice of low molecular weight heparins. J Thromb Haemost 2003; 1: 598.
- [5] Bergquist D, Benmoni G, Björgell O, et al. LMWH (enoxaparin) as prophylaxis against venous thromboembolism after total hip replacement. N Engl J Med 1996; 335: 696–700.
- [6] Breddin HK, Hach-Wunderle V, Nakov R, Kakkar VV, for the CORTES Investigators. Effects of a low molecular weight heparin on thrombus regression and recurrent thromboembolism in patients with deep vein thrombosis. N Engl J Med 2001; 344: 626–631.
- [7] Collins R, Scrimgeour A, Yusuf S, Peto R. Reduction of fatal pulmonary embolism and venous thrombosis by perioperative administration of subcutaneous heparin. Overview of results and randomized trials in general, orthopaedic and urologic surgery. N Engl J Med 1988; 318: 1162–1173.
- [8] Dahl OE, Andreassen G, Aspelin T, et al. Prolonged thromboprophylaxis following hip replacement surgery. Results of a double blind, prospective, randomised, placebo-controlled study with dalteparin (Fragmin). Thromb Haemostat 1997; 77: 26–31.
- [9] Heit JA, Berkowitz SD, Bona R, et al. Efficacy and safety of low molecular weight heparin (ardeparin sodium) compared to warfarin for prevention of venous thromboembolism following total knee replacement. A double blind dose-ranging study. Thromb Haemostat 1997; 77: 32–38.
- [10] Turpie AG, Norris TM. Thromboprophylaxix in medical patients, the role of low-molecular-weight heparin. Thromb Haemost 2004; 92: 3–12.
- [11] Task Force Report. Task Force on Pulmonary Embolism, European Society of Cardiology: Guidelines on diagnosis and management of acute pulmonary embolism. Eur Heart J 2000; 21: 1301–1336.
- [12] Théry C, Simonneau G, Meyer G, et al. Randomized trial of subcutaneous low-molecular-weight heparin CY 216 (fraxiparin) compared with intravenous unfractionated heparin in the curative treatment of submassive pulmonary embolism. A dose-ranging study. Circulation 1992; 85: 1380–1389.
- [13] Hull RD, Raskob GE, Brant RF, et al. Low-molecular-weight heparin vs. heparin in the treatment of patients with pulmonary embolism. Arch Intern Med 2000; 160: 229–236.
- [14] Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126, Suppl. 338S–400S.
- [15] Wells PS, Kovacs MJ, Forgie MA, et al. Expanding eligibility for outpatient treatment of deep venous thrombosis and pulmonary embolism with low molecular weight heparin: A comparison of patient self-injection to home care injection. Arch Intern Med 1998; 158: 1809–1812.
- [16] Savage KJ, Wells PS, Schulz V, et al. Outpatient use of low molecular weight heparin (Dalteparin) for the treatment of deep vein thrombosis of the upper extremity. Thromb Haemost 1999; 82: 1008–1010.
- [17] Levine M, Gent M, Hirsh J, et al. A comparison of low-molecular-weight heparin administered primarily at home with unfractionated heparin administered in the hospital for proximal deep-vein thrombosis. N Engl J Med 1996; 334: 677–681.
- [18] Kovacs MJ, Anderson D, Morrow B, et al. Outpatient treatment of pulmonary embolism with dalteparin. Thromb Haemost 2000; 83: 209–211.
- [19] Büller H, TenCate JW. Primary venous thromboembolism and cancer screening. Editorial. N Engl J Med 1998; 338: 1221–1222.
- [20] Lee AY, Levine MN, Baker RI, et al. Randomized Comparison of Low-Molecular-Weight Heparin versus Oral Anticoagulant Therapy for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer (CLOT) Investigators. N Engl J Med 2003; 349: 109–111.
- [21] Dulíček P, Penka M, Binder T, Unzeitig V. Návrh antitrombotické profylaxe a péče o trombofilní stavy v gynekologii a porodnictví. Vnitřní Lék 2006; 52 (S1): 58–62.
- [22] Bates SM, Greer IA, Hirsh J, et al. Use of antithrombotic agents during pregnancy. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126: 627–644.
- [23] The Columbus Investigators. Low molecular heparin in the treatment of patients with venous thromboembolism. N Engl J Med 1997; 337: 657–662.
- [24] Beer HJ, Burger M, Gretener S, et al. Outpatient treatment of pulmonary embolism is feasible and safe in a substantial proportion of patients. J Thromb Haemost 2003; 1: 186–187.
- [25] Hull RD, Pineo GF, Raskob GE. The economic impact of treating deep vein thrombosis with low-molecular-weight heparin: outcome of therapy and health economy aspects. Haemostasis 1998; 28 (Suppl. 3): 8–16.
- [26] Kessler P. Prevence žilního tromboembolismu v ortopedii. Vnitřní Lék 2006; 52 (Suppl. 1): 51–57.
- [27] Widimský J, Malý J, et al. Akutní plicní embolie a žilní trombóza. Praha, Triton 2005, 381 s. ISBN 80-7254-639-2.
- [28] Bijsterveld NR, Peters RJ, Murphy SA, et al. Recurrent cardiac ischemic events early after discontinuation of short-term heparin treatment in acute coronary syndromes: results from the Thrombolysis in Myocardial Infarction (TIMI) 11B and Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events (ESSENCE) studies. J Am Coll Cardiol 2003; 42: 2083–2089.
- [29] Cohen M, Antman EM, Gurfinkel EP, Radley D: ESSENCE (Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-wave Coronary Events) and TIMI (Thrombolysis in Myocardial Infarction) 11B Investigators. Enoxaparin in unstable angina/non-ST-segment elevation myocardial infarction: treatment benefits in prespecified subgroups. J Thromb Thrombolysis. 2001; 12: 199–206.
- [30] Spinler SA, Inverso SM, Cohen M, et al. ESSENCE and TIMI 11B Investigators. Safety and efficacy of unfractionated heparin versus enoxaparin in patients who are obese and patients with severe renal impairment: analysis from the ESSENCE and TIMI 11B studies. Am Heart J 2003; 146: 33–41.
- [31] Turpie AG, Antman EM. Low-molecular-weight heparins in the treatment of acute coronary syndromes. Arch Intern Med 2001; 161: 1484–1490.
- [32] Korkmaz ME. Low-molecular-weight heparins in acute coronary syndromes. Curr Vasc Pharmacol 2003; 1: 259–271.
- [33] Van de Werf F. ASSENT-3: implications for future trial design and clinical practice. Eur Heart J 2002; 23: 911–912.
- [34] Hyers TM, Agnelli G, Hull RD, et al. Antithrombotic therapy for venous thromboembolic International Consensus Statement. Prevention of venous thromboembolism. Guidelines compiled in accordance with the scientific evidence. Intern Angiol 2001; 20: 1–37.
- [35] Keeling D, Davidson S, Watson H. Haemostasis and Thrombosis Task Force of the British Committee for Standards in Haematology The management of heparin-induced thrombocytopenia, guidelines. Brit J Haematol 2006; 133: 259–269.
- [36] Shaughnessy SG, Hirsh J, Bhandari M, et al. A histomorphometric evaluation of heparin induces bone loss after discontinuation of heparin treatment in rats. Blood 1999; 93: 1231–1236.
- [37] Levine M. Treatment of Thrombotic Disorders in Cancer Patients. Haemostasis 1997; 27 (Suppl. 1): 38–43.