Nová antiagregancia a antikoagulancia ve světle doporučených postupů EKS 2012 pro léčbu pacientů s akutním infarktem myokardu s elevacemi úseku ST
Nová doporučení Evropské kardiologické společnosti (EKS) z roku 2012 týkající se farmakoterapie pacientů s akutním infarktem myokardu s elevacemi úseku ST shrnují nové poznatky o antiagregační a antikoagulační léčbě. Upřesňují postavení prasugrelu, tikagreloru a rivaroxabanu v léčbě akutního koronárního syndromu a zároveň otevírají mnohé, dosud nezodpovězené otázky. Na konci přehledu jsou nastíněny další možné směry antitrombotické léčby a limitace z pohledu medicíny založené na důkazech.
Protidestičková léčba u primární PCI
Pacientům s infarktem myokardu s elevacemi úseku ST (STEMI), kteří jsou léčeni katetrizačně – tzv. primární perkutánní koronární intervencí (PCI), má být podána duální protidestičková léčba (DAPT) kyselinou acetylsalicylovou (ASA) a blokátorem receptoru pro adenosindifosfát (ADP), co nejdříve je to možné před intervencí, spolu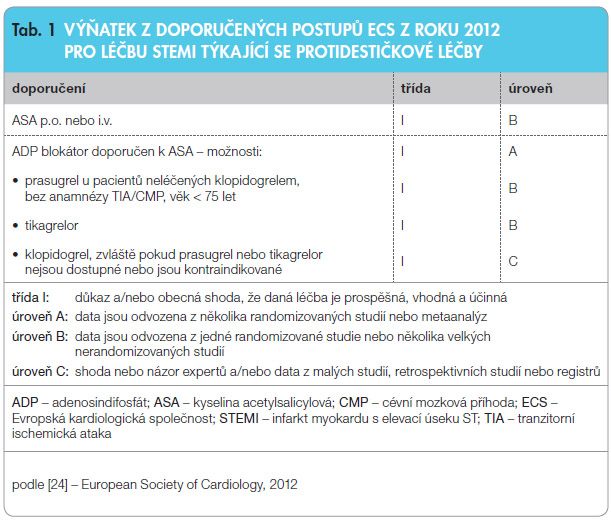 s parenterální antikoagulací (tab. 1). Žádná studie dodnes nesrovnávala zahájení DAPT před hospitalizací a za hospitalizace, stejně tak jako její začátek před nebo při primární PCI, nicméně tato praxe vychází z logické úvahy, že čím dříve je lék podán, tím dříve nastupuje jeho účinek.
s parenterální antikoagulací (tab. 1). Žádná studie dodnes nesrovnávala zahájení DAPT před hospitalizací a za hospitalizace, stejně tak jako její začátek před nebo při primární PCI, nicméně tato praxe vychází z logické úvahy, že čím dříve je lék podán, tím dříve nastupuje jeho účinek.
ASA má být podána perorálně (150–300 mg), čímž je dosaženo maximální inhibice agregace krevních destiček zprostředkované tromboxanem (TXA2). U pacientů, u kterých není možné perorální podání, lze ASA podat jako alternativu intravenózně. Pro dávku při intravenózním podání existuje málo dat, ale farmakologická data naznačují, že nižší dávka než u perorálního podání může zabránit inhibici prostacyklinu při zachované inhibici TXA2, a proto je pro intravenózní podání preferována bolusová dávka 80–150 mg.
Upřednostňovanými blokátory ADP receptorů jsou prasugrel (nasycovací dávka 60 mg p.o., udržovací dávka 10 mg) nebo tikagrelor (nasycovací dávka 180 mg p.o., udržovací dávka 90 mg 2krát denně); tato léčiva mají rychlejší nástup účinku, vyšší účinnost a ve velkých klinických studiích prokázala superioritu proti klopidogrelu [1, 2].
Ve studii TRITON-TIMI 38 (TRial to as-sess Improvement in Therapeutic Outcomes by optimizing platelet inhibitioN
with prasugrel – Thrombolysis In Myocardial Infarction 38) prasugrel snížil složený cílový ukazatel (kardiovaskulární mortalita, nefatální infarkt myokardu – IM, cévní mozková příhoda – CMP) u pacientů, kteří nebyli předléčeni klop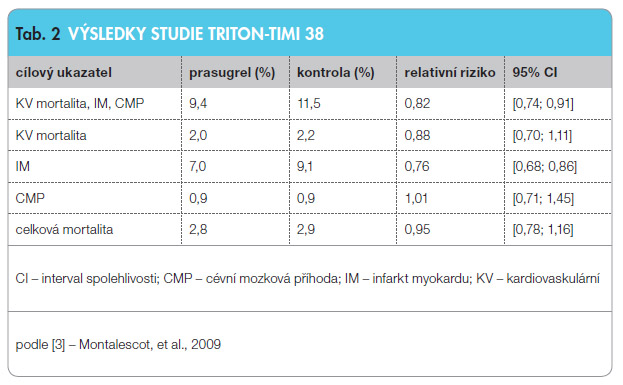 idogrelem a podstoupili ať už primární, nebo sekundární PCI pro STEMI, nebo intervenčně léčený středně až vysoce rizikový infarkt myokardu bez elevace úseku ST (NSTEMI), tab. 2. V celém souboru byla zaznamenána významně vyšší frekvence velkého krvácení definovaného ze souboru studií TIMI (Thrombolysis In Myocardial Infarction), které nebylo spojeno s chirurgickou revaskularizací – bypassem věnčitých tepen (CABG, coronary artery bypass graft). Avšak v podskupině pacientů se STEMI léčených primární nebo sekundární PCI snížení frekvence ischemických komplikací jasně převažovalo nad rizikem vyššího krvácení [3]. Prasugrel je kontraindikován u pacientů s předchozí CMP/tranzitorní ischemickou atakou (TIA). Obecně není doporučena léčba u pacientů starších 75 let či s nízkou tělesnou hmotností (< 60 kg), kde – kvůli vyššímu výskytu krvácení – byl výsledný účinek neutrální. Evropská doporučení u těchto pacientů uvádějí stejnou nasycovací dávku, ale udržovací dávku sníženou na 5 mg, byť pro tento postup neexistují žádná data a pro léčbu u těchto skupin pacientů existují alternativní blokátory ADP receptorů.
idogrelem a podstoupili ať už primární, nebo sekundární PCI pro STEMI, nebo intervenčně léčený středně až vysoce rizikový infarkt myokardu bez elevace úseku ST (NSTEMI), tab. 2. V celém souboru byla zaznamenána významně vyšší frekvence velkého krvácení definovaného ze souboru studií TIMI (Thrombolysis In Myocardial Infarction), které nebylo spojeno s chirurgickou revaskularizací – bypassem věnčitých tepen (CABG, coronary artery bypass graft). Avšak v podskupině pacientů se STEMI léčených primární nebo sekundární PCI snížení frekvence ischemických komplikací jasně převažovalo nad rizikem vyššího krvácení [3]. Prasugrel je kontraindikován u pacientů s předchozí CMP/tranzitorní ischemickou atakou (TIA). Obecně není doporučena léčba u pacientů starších 75 let či s nízkou tělesnou hmotností (< 60 kg), kde – kvůli vyššímu výskytu krvácení – byl výsledný účinek neutrální. Evropská doporučení u těchto pacientů uvádějí stejnou nasycovací dávku, ale udržovací dávku sníženou na 5 mg, byť pro tento postup neexistují žádná data a pro léčbu u těchto skupin pacientů existují alternativní blokátory ADP receptorů.
Ve studii PLATO (PLATelet inhibition and patient Outcomes) tikagrelor snižoval složený cílový ukazatel (kardiovaskulární mortalita, IM, CMP) a rovněž kardiovaskulární mortalitu u pacientů jak předléčených, tak nepředléčených klopidogrelem, jak se STEMI (léčených primární PCI), tak se středně či vysoce rizikovým NSTEMI, kteří byli léčeni jak intervenčně, tak konzervativně [1, 2]. Ačkoliv nebyl významný rozdíl v celkovém (PLATO definovaném) velkém krvácení mezi skupinou léčenou tikagrelorem a klopidogrelem, frekvence krvácení bez vztahu k CABG (definovaném jak PLATO, tak TIMI krvácením) byla vyšší ve skupině léčené tikagrelorem. V podskupině pacientů se STEMI však léčebný přínos převažoval (tab. 3) [4]. Tikagrelor může způsobovat na začátku podávání přechodnou dušnost, která však nebyla spojena s morfologickým či funkčním postižením plic a pouze výjimečně ved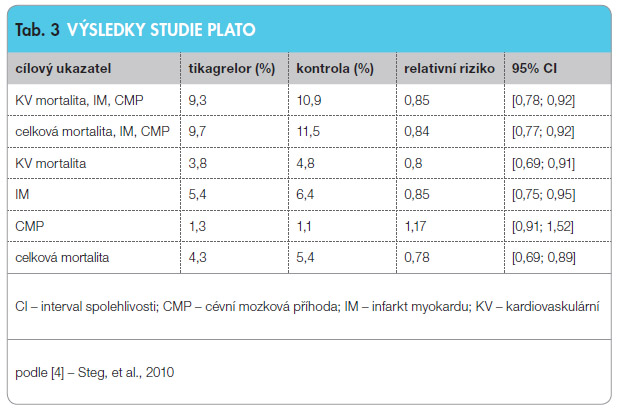 la k přerušení léčby [5]. Podávání tikagreloru může být během prvního týdne léčby též spojeno s asymptomatickou bradykardií. Žádné z účinnějších léčiv (prasugrel, tikagrelor) není doporučeno u pacientů s anamnézou hemoragické CMP nebo u pacientů se středním až těžkým jaterním postižením.
la k přerušení léčby [5]. Podávání tikagreloru může být během prvního týdne léčby též spojeno s asymptomatickou bradykardií. Žádné z účinnějších léčiv (prasugrel, tikagrelor) není doporučeno u pacientů s anamnézou hemoragické CMP nebo u pacientů se středním až těžkým jaterním postižením.
Jestliže není dostupný ani prasugrel, ani tikagrelor (nebo pokud jsou kontraindikovány), doporučeným blokátorem ADP receptorů je klopidogrel. Ten však nebyl ve studiích testován v indikaci STEMI a doporučená nasycovací dávka (600 mg p.o.) vychází z výsledků studie OASIS 7 (Optimal Antiplatelet Strategy for Interventions) [6], kde použití vyšší nasycovací dávky 600 mg prokázalo klinický přínos u pacientů s akutním koronárním syndromem (AKS) plánovaných k časné koronární intervenci (do 72 hodin) – tedy nikoliv u pacientů se STEMI podstupujících primární PCI. Extrapolace pro skupinu pacientů se STEMI vychází z konsenzu expertů. Předléčení vysokou dávkou klopidogrelu bylo též superiorní v laboratorních i observačních studiích [7, 8]. Všechny blokátory ADP receptorů musí být používány obezřetně u pacientů s vysokým rizikem krvácení nebo se signifikantní anémií.
Protidestičková léčba v subakutní fázi STEMI
Kyselina acetylsalicylová
Na základě znalostí ze sekundární prevence [9] je podávání ASA indikováno u pacientů se STEMI do konce života. Její dávka je předmětem debat. Velká randomizovaná studie CURRENT/OAISIS 7 (Clopidogrel optimal loading dose Usage to Reduce Recurrent EveNTs/Optimal Antiplatelet Strategy for InterventionS) neprokázala v prvních dnech léčby rozdíl v tvrdých cílových ukazatelích při srovnání nízké dávky ASA (75–100 mg denně) s relativně vyššími dávkami (300–325 mg denně) [6]. Při podávání nižších dávek však prokázala nižší výskyt gastrointestinálního krvácení. Pro dlouhodobou léčbu je proto doporučena dávka 75–100 mg denně. Data ze studia destičkové agregace naznačují, že rychlý destičkový obrat u pacientů s diabetem mellitem může vyžadovat vyšší dávku či častější dávkování k dosažení účinné blokády agregace [10], ale klinická data podporující tuto strategii nemáme. Nemocní s hypersenzitivitou k ASA mohou podstoupit desenzibilizaci a dále lék užívat doživotně [11–14]. Pacienti se skutečnou intolerancí mohou být v sekundární prevenci alternativně léčeni klopidogrelem (75 mg denně) [15].
Doba trvání DAPT po STEMI
DAPT kombinací ASA a blokátoru ADP receptoru (klopidogrel, prasugrel nebo tikagrelor) je u pacientů po STEMI léčeném primární PCI doporučena po dobu 12 měsíců. Výsledky některých studií naznačují, že není přínos z prodloužení duální antiagregační léčby za šest měsíců ve srovnání s 12 měsíci po implantaci DES (drug eluting stent) z hlediska výskytu ischemických příhod či trombózy stentu.
Tyto studie však zahrnovaly malý počet pacientů se STEMI a tato indikace spíše souvisí s prevencí trombózy stentu, než s indikací v sekundární prevenci [16]. Je zřejmé, že po implantaci stentu u pacientů s AKS léčených katetrizační intervencí, zvláště u STEMI, prodloužení duální antiagregace snižuje riziko trombózy stentu, reinfarktu a snižuje kardiovaskulární mortalitu. Na základě současných poznatků je tedy doporučena léčba DAPT po AKS po dobu 9–12 měsíců, u pacientů se STEMI léčených primární PCI po dobu 12 měsíců (sekundární prevence), nejméně však po dobu jednoho měsíce u pacientů po implantaci BMS (bare metal stent) a 6 měsíců u pacientů po implantaci DES (prevence trombózy stentu). V tomto duchu je třeba informovat jak pacienty, tak ošetřující lékaře, aby nedošlo k předčasnému ukončení léčby.
U pacientů se STEMI s fibrilací síní a nutností trvalé antikoagulace po primární PCI je doporučena trojkombinační léčba (triple therapy) kombinací ASA, blokátorem ADP receptorů a warfarinem ke snížení rizika tromboembolismu u fibrilací a zároveň ke snížení rizika trombózy stentu. Nicméně tento postup je spojen s vyšším rizikem krvácení a je předmětem řady kontroverzí [17].
Protektivní podávání inhibitorů protonové pumpy je indikováno zvláště u pacientů s anamnézou krvácení do gastrointestinálního traktu nebo s více rizikovými faktory pro toto krvácení (vyšší věk, současná nutnost antikoagulace, léčba kortikosteroidy, nesteroidními antiflogistiky včetně vysokých dávek ASA, infekce Helicobacter pylori). Nová antiagregancia nevykazují farmakokinetickou interakci s inhibitory protonové pumpy a studie nepotvrdily obavu, že by tato interakce přítomná při podávání klopidogrelu měla větší význam v klinické praxi [18]. V každém případě je nutné minimalizovat nebezpečí vzniku krvácení, a proto je protektivní podání těchto inhibitorů plně indikováno a jejich přínos převažuje nad diskuzí o případných farmakokinetických interakcích.
Kombinanční léčba novými antikoagulancii a DAPT
Studie ATLAS ACS 2-TIMI 51 (Anti Xa Therapy to Lower cardiovascular events in Addition to Standard therapy in subjects with Acute Coronary Syndrome – Thrombolysis in Myocardial Infarction 51) studovala kombinaci rivaroxabanu, ASA a klopidogrelu u pacientů po AKS [19]. Nízká dávka rivaroxabanu (2,5 mg 2krát denně) snižovala složený cílový ukazatel (kardiovaskulární mortalitu, IM a CMP), ale též celkovou mortalitu. Zajímavé je, že snižovala o třetinu výskyt trombózy stentu. Cenou za to bylo trojnásobné zvýšení výskytu závažných krvácení, která nebyla spojena s CABG, a to včetně mozkových krvácení. Při sečtení přínosu (primární cílový ukazatel) a odečtení rizika (krvácení) získáme v absolutních počtech zisk pouhých 0,2 %, což je klinicky prakticky zanedbatelné. Dalším poznatkem je, že vyšší dávka rivaroxabanu dále nezvyšovala léčebný přínos, ale zvyšovala výskyt závažných krvácení. Tato studie netestovala kombinaci rivaroxabanu s prasugrelem či tikagrelorem, která by byla pravděpodobně spojena jen s dalším zvýšením rizika krvácení. Studie APPRAISE-2 (Apixaban for Prevention of Acute Ischemic Events-2) [20] přínos kombinace vysoké dávky apixabanu a DAPT s klopidogrelem ve vysoce rizikové populaci pacientů s AKS neprokázala vůbec, naopak ve skupině s apixabanem byl vyšší výskyt krvácení.
Nakonec byly též testovány přípravky darexaban a dabigatran ve fázi II u pacientů po AKS [21, 22], které prokázaly při zvyšování dávky zvýšený výskyt krvácivých komplikací bez snížení počtu ischemických příhod. Ze souhrnu těchto poznatků vyplývá, že postavení nových antikoagulancií v kombinaci s DAPT zůstává nejasné. Přínos nízké dávky rivaroxabanu v kombinaci s DAPT ke snížení celkové mortality je zajímavý, nicméně možnost jeho využití v obecné populaci není jednoznačná.
Závěr
Tolik tedy výňatek z Doporučených postupů pro léčbu STEMI Evropské kardiologické společnosti z roku 2012 [23]. Dynamika a rychlý rozvoj poznatků jsou dokumentovány tím, že od zveřejnění postupů byla publikována celá řada dalších studií a některé z nich nastíněné otázky minimálně částečně zodpověděly. Na prvním místě je třeba zmínit studii WOEST [24], která se zabývala otázkou trojkombinační léčby (ASA, klopidogrel, warfarin) u pacientů s nutností antikoagulace, u kterých byl v rámci PCI implantován stent. Je třeba podotknout, že se nejednalo o pacienty s AKS, což je velkou limitací, a výsledky nelze extrapolovat pro pacienty s AKS. S vědomím těchto faktů lze říci, že duální terapie zahrnující warfarin a klopidogrel je z hlediska výskytu ischemických příhod stejně účinná a z hlediska rizika krvácení bezpečnější než trojkombinační léčba. Otázkou, zda tento závěr platí i pro pacienty s AKS, se tato studie nezabývala.
Tuto práci zmiňuji i z jiného důvodu, a to v souvislosti s předmětem kontroverzních debat mezi experty o postavení jednotlivých složek antiagregační a antikoagulační léčby v prevenci ischemických příhod. S narůstající agresivitou antitrombotické léčby a díky příchodu nových antiagregancií (prasugrel a tikagrelor) a antikoagulancií (dabigatran, rivaroxaban, apixaban) včetně jejich různých kombinací se zdá, že se potýkáme s tím, co je některými experty nazýváno tzv. hemokoagulační stabilitou. Znamená to, že organismus se už není schopen vyrovnat s takto agresivním antitrombotickým zásahem a dochází k nárůstu výskytu krvácení, aniž by docházelo k dalšímu snížení výskytu ischemických příhod. A v tomto bodě vyvstává otázka, u které složky antitrombotické terapie můžeme snížit dávkování či ji odebrat, abychom opět dosáhli takové rovnováhy mezi rizikem vzniku ischemických příhod a rizikem výskytu krvácení, kdy by léčba byla maximálně účinná za cenu ještě přijatelného rizika krvácení. Toto považuji v současnosti za nejdůležitější téma v diskusích o dalším směru vývoje antitrombotické léčby.
Svízelná je též odpověď na otázku, která je však předmětem denní klinické praxe – který z výše uvedených přípravků či jakou jejich kombinaci podat kterému pacientovi. Opět se setkáváme s problémem, jenž v současnosti prakticky nemá řešení. Při léčbě novými antitrombotiky je výskyt ischemických komplikací mezi jednotlivými léky prakticky srovnatelný, takže z důvodu statistické průkaznosti by studie musely zahrnovat tak obrovský počet pacientů, že je to z ekonomických důvodů nereálné. Zároveň se z pochopitelných příčin obtížně hledá sponzor pro vzájemné srovnání dvou léků (tzv. head-to-head), nemluvě o jejich kombinacích. A je otázkou, zda akademické instituce disponují takovými finančními prostředky, které by toto umožnily. Při možném počtu kombinací a při zachování principů léčby založené na důkazech se jeví zodpovězení výše nastíněných otázek v dohledné budoucnosti spíše jako nereálné. V současnosti se při nepřímé analýze dat dá alespoň říci, že ASA je stejně účinná jako klopidogrel (doklad ze studie CAPRIE jen u chronických forem ischemické choroby srdeční), nové reverzibilní i ireverzibilní blokátory ADP receptorů – díky efektu u zhruba 30 % nemocných neodpovídajících na klopidogrel – jsou účinnější než klopidogrel (doloženo jen pro AKS).
Pouze dokumentační charakter má z hlediska složitosti celé problematiky zcela recentní souhlasné stanovisko Evropské lékové komise (European Medicines Agency‘s Committee for Medicinal Products for Human Use) k indikaci rivaroxabanu v kombinační léčbě s DAPT u AKS a (prozatím) odmítnutí téhož Americkou lékovou komisí (Food and Drug Administration), přestože oběma komisím byly poskytnuty identické podklady ze studie ATLAS ACS 2-TIMI 51.
Přes všechna výše zmíněná úskalí postupuje výzkum v této oblasti velmi rychle kupředu a v dalších letech se lze nadít velkých změn v antitrombotické léčbě nejen AKS. Navíc bude velmi zajímavé sledovat, zda dojde ke vzkříšení myšlenky kombinace antiagregační a antikoagulační léčby v sekundární prevenci při použití nových přípravků.
Seznam použité literatury
- [1] Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001–2015.
- [2] Wallentin L, Becker RC, Budaj A, et al. Tikagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045–1057.
- [3] Montalescot G, Wiviott SD, Braunwald E, et al. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009; 373: 723–731.
- [4] Steg PG, James S, Harrington RA, et al. Ticagrelor versus clopidogrel in patients with ST-elevation acute coronary syndromes intended for reperfusion with primary percutaneous coronary intervention: A Platelet Inhibition and Patient Outcomes (PLATO) trial subgroup analysis. Circulation 2010; 122: 2131–2141.
- [5] Storey RF, Becker RC, Harrington RA, et al. Characterization of dyspnoea in PLATO study patients treated with ticagrelor or clopidogrel and its association with clinical outcomes. Eur Heart J 2011; 32: 2945–2953.
- [6] Mehta SR, Tanguay JF, Eikelboom JW, et al. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet 2010; 376: 1233–1243.
- [7] Koul S, Smith JG, Schersten F, et al. Effect of upstream clopidogrel treatment in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Eur Heart J 2011; 32: 2989–2997.
- [8] Dorler J, Edlinger M, Alber HF, et al. Clopidogrel pre-treatment is associated with reduced in-hospital mortality in primary percutaneous coronary intervention for acute ST-elevation myocardial infarction. Eur Heart J 2011; 32: 2954–2961.
- [9] Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373: 1849–1860.
- [10] Capodanno D, Patel A, Dharmashankar K, et al. Pharmacodynamic effects of different aspirin dosing regimens in type 2 diabetes mellitus patients with coronary artery disease. Circ Cardiovasc Interv 2011; 4: 180–187.
- [11] Henry P, Vermillet A, Boval B, et al. 24-hour time-dependent aspirin efficacy in patients with stable coronary artery disease. Thromb Haemost 2011; 105: 336–344.
- [12] Silberman S, Neukirch-Stoop C, Steg PG. Rapid desensitization procedure for patients with aspirin hypersensitivity undergoing coronary stenting. Am J Cardiol 2005; 95: 509–510.
- [13] Page NA, Schroeder WS. Rapid desensitization protocols for patients with cardiovascular disease and aspirin hypersensitivity in an era of dual antiplatelet therapy. Ann Pharmacother 2007; 41: 61–67.
- [14] Rossini R, Angiolillo DJ, Musumeci G, et al. Aspirin desensitization in patients undergoing percutaneous coronary interventions with stent implantation. Am J Cardiol 2008; 101: 786–789.
- [15] A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348: 1329–1339.
- [16] Gwon HC, Hahn JY, Park KW, et al. Six-Month versus Twelve-Month Dual Antiplatelet Therapy after Implantation of Drug-Eluting Stents: ’EXCELLENT’ Randomized, Multicenter Study. Circulation 2012; 125: 505–513.
- [17] Lip GY, Huber K, Andreotti F, et al. Antithrombotic management of atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing coronary stenting: executive summary – a Consensus Document of the European Society of Cardiology Working Group on Thrombosis, endorsed by the European Heart Rhythm Association (EHRA) and the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2010; 31: 1311–1318.
- [18] Gilard M, Arnaud B, Cornily JC, et al. Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole CLopidogrel Aspirin) study. J Am Coll Cardiol 2008; 51: 256–260.
- [19] Mega JL, Braunwald E, Wiviott SD, et al. Rivaroxaban in Patients with a Recent Acute Coronary Syndrome. N Engl J Med 2012; 366: 9–19.
- [20] Alexander JH, Lopes RD, James S, et al. Apixaban with antiplatelet therapy after acute coronary syndrome. N Engl J Med 2011; 365: 699–708.
- [21] Steg PG, Mehta SR, Jukema JW, et al. RUBY-1: a randomized, double-blind, placebo-controlled trial of the safety and tolerability of the novel oral factor Xa inhibitor darexaban (YM150) following acute coronary syndrome. Eur Heart J 2011; 32: 2541–2554.
- [22] Oldgren J, Budaj A, Granger CB, et al. Dabigatran vs. placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double-blind, phase II trial. Eur Heart J 2011; 32: 2781–2789.
- [23] ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33: 2569–2619.
- [24] Dewilde WJ, Oirbans T, Verheugt FW, et al., on behalf of the WOEST Investigators. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013; Feb 13:[Epub ahead of print], doi: 10.1016/S0140-6736(12)62177-1.