Nová antiepileptika
Souhrn:
Léčba epilepsie stále patří mezi zásadní problémy moderní neurologie. I přes veškeré snahy a medicínský pokrok nedosahuje značná část léčených pacientů přirozeného cíle léčby – bezzáchvatovosti, či alespoň uspokojivé kompenzace onemocnění. Farmaceutický průmysl vyvíjí nové přípravky, od kterých si slibujeme minimálně zmírnění probíhajícího onemocnění, v ideálním případě pak dosažení bezzáchvatovosti u pacientů trpících tímto onemocněním. V přehledovém článku se věnujeme základním charakteristikám nejnovějších antiepileptik: lacosamidu, eslicarbazepin acetátu, retigabinu, perampanelu a brivaracetamu, jejich základním indikacím a nežádoucím účinkům.
Key words: new anticonvulsants – lacosamide – eslicarbazepine acetate – retigabine – perampanel – brivaracetam – refractory epilepsy – partial seizures.
Summary:
Therapy of epilepsy remains an important and problematic issue in modern neurology. Despite the medical progress, we are still not able to reach seizure
freedom in many patients with epilepsy or even to get a good control over their seizures. Pharmaceutical industry tries hard to develop or find new
drugs which will be able to stop or at least to significantly reduce seizure frequency. In this review, we will describe the main characteristics of the newest antiepileptic drugs (lacosamide, eslicarbazepine‑acetate, retigabine, perampanel, and brivaracetam), their indications and adverse events.
Úvod
Epilepsie patří spolu s migrénou, cévní mozkovou příhodou a s Alzheimerovou demencí mezi nejčastější neurologická onemocnění. Výskyt epilepsie v populaci dosahuje zhruba 0,5–1 %. Její incidence se ve vyspělých zemích pohybuje kolem 50 případů na 100 000 obyvatel ročně, přičemž v rozvojových zemích je počet dvojnásobný. V České republice žije dle odhadů přibližně 70 000–100 000 jedinců s epilepsií. Ojedinělý, situačně navozený epileptický záchvat během života prodělá 1–4 % populace. Dle posledních studií je až 30–40 % pacientů s epilepsií i přes veškerou snahu farmakorezistentních. Farmakorezistence je v epileptologii definována jako selhání léčby nebo nedosažení bezzáchvatovosti při správně indikované a vytitrované medikaci minimálně dvěma antiepileptiky (ať již v rámci monoterapie nebo kombinované léčby).
Nová antiepileptika nám dávají naději, že alespoň u části pacientů s epilepsií budeme schopni zlepšit kvalitu jejich života a významně snížit počet záchvatů, nebo v ideálním případě dosáhnout bezzáchvatovosti.
Lacosamid
Po schválení Evropskou lékovou agenturou (European Medicines Agency, EMA) byl lacosamid v roce 2008 zaveden do klinické praxe. Přesný mechanismus účinku lacosamidu není zcela objasněn, ale předpokládá se jeho selektivně zesilující vliv na pomalou inaktivaci napěťově řízených sodíkových kanálů, a tím dosažení stabilizace hyperexcitabilní neuronové membrány (obr. 1). Lacosamid se plně 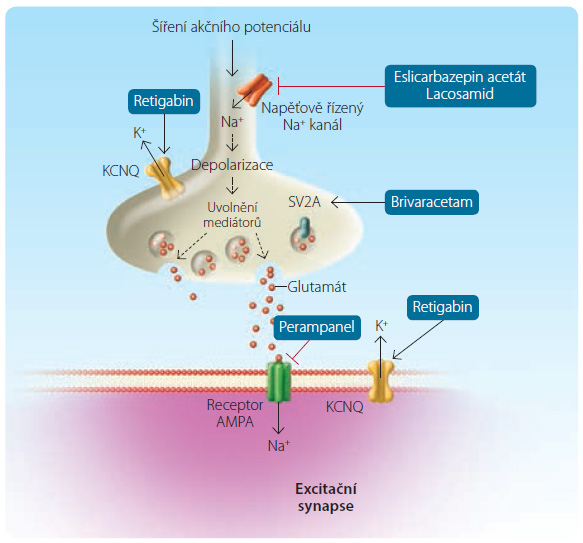 perorálně vstřebává a maximálních koncentrací je dosaženo přibližně za 0,5–4 hodiny po podání. Následně se z 95 % vylučuje močí, s biologickým poločasem eliminace 13 hodin. Přesný průběh jeho biotransformace není zcela objasněn.
perorálně vstřebává a maximálních koncentrací je dosaženo přibližně za 0,5–4 hodiny po podání. Následně se z 95 % vylučuje močí, s biologickým poločasem eliminace 13 hodin. Přesný průběh jeho biotransformace není zcela objasněn.
Tento přípravek je indikován jako přídatná léčba u pacientů s parciálními záchvaty se sekundární generalizací nebo bez ní, a to od věku 16 let. Účinnost byla prokázána třemi multicentrickými randomizovanými studiemi kontrolovanými placebem [1–3]. Lacosamid byl podáván v dávkách 200 mg/den, 400 mg/den a 600 mg/den. U dávky 600 mg/den se účinnost výrazně nelišila od dávky 400 mg/den, ale byl pozorován vyšší výskyt nežádoucích účinků. Proto maximální doporučená terapeutická dávka je 400 mg/den. Lacosamid v tomto dávkovacím schématu významně snížil frekvenci záchvatů u pacientů, u kterých nebylo dosaženo kontroly záchvatů i přes souběžné podávání s 1–3 antiepileptiky (při podávání dávky 200 mg/den došlo k 50% snížení počtu záchvatů u 34 % léčených nemocných a při dávce 400 mg/den u 40 % léčených pacientů). Pro podávání lacosamidu v monoterapii zatím není dostatek důkazů. Doporučené dávkování je dvakrát denně v celkové denní dávce 200–400 mg.
Výhodou lacosamidu může být jeho dostupnost v intravenózní (i.v.) formě a jeho případné parenterální použití při léčbě epileptického statusu. Zejména u pacientů se superrefrakterním statusem (tj. s chybějící účinností standardních i.v. antiepileptik – phenytoinu, kyseliny valproové a levetiracetamu) se jeví lacosamid jako účinná volba, byť nemá nyní v Souhrnu údajů o léčivém přípravku (SPC) ještě schválenu indikaci k tomuto podání [4]. Při léčbě statusu bývá použita bolusová dávka 400 mg lacosamidu a následně denní dávka 200–400 mg. Úspěšnost této léčby dosahuje dle literatury zhruba 56 % [5]. Parenterální formu lze s výhodou využít i tam, kde není p.o. podání možné. Rovněž již byly publikovány studie potvrzující účinnost lacosamidu v monoterapii fokálních epilepsií [6].
Mezi nejčastěji se vyskytující nežádoucí účinky při užívání lacosamidu patří závratě, bolesti hlavy a diplopie. Závažnějším nežádoucím účinkem léčby lacosamidem může být prodloužení PR intervalu, proto je nutná opatrnost u pacientů s poruchami srdečního převodu, případně u pacientů s tímto rizikem (např. kombinace léčiv s obdobným nežádoucím účinkem, včetně některých antiepileptik). Lacosamid má příznivý profil z hlediska kognitivních funkcí, který je srovnatelný s lamotriginem.
Zatím nejsou dostupné adekvátní údaje o bezpečnosti užívání tohoto přípravku v těhotenství. Proto jeho podávání nebo pokračování léčby u žen v průběhu těhotenství je na individuálním zvážení rizika a prospěchu pro konkrétní pacientku. Rovněž není známo, zda se lacosamid vylučuje do mateřského mléka. Jelikož v animálních studiích bylo vylučování do mateřského mléka prokázáno, doporučuje se po dobu podávání lacosamidu kojení přerušit.
Aktuálně je přípravek schválen k léčbě parciálních záchvatů se sekundární generalizací nebo bez ní u pacientů ve věku od 16 let. Současně se však objevují stále nové studie s použitím tohoto léčiva i u dětské populace. Již několik prací potvrdilo jeho účinnost a bezpečnost v léčbě parciálních i generalizovaných záchvatů u dětí. Výrazný účinek byl pozorován i u pacientů s Lennoxovým–Gastautovým syndromem, kde bylo dle Miskina a kol. prokázano 50% snížení počtu záchvatů u 67 % dětských pacientů. Terapeutické dávky se pohybovaly v pásmu 1,7–14,3 mg/kg/den (v některých studiích až do dávek 19,4 mg/kg/den). Jako nejčastěji se vyskytující nežádoucí účinky byly v těchto studiích popsány somnolence, zhoršení paměti, nauzea, závratě a tremor [7,8]. Rovněž byl prokázán účinek lacosamidu u refrakterního epileptického statusu u dětí (vyjma neonatálního období) jako alternativa k použití phenobarbitalu, a to v iniciální dávce 8,6 mg/kg a v maximální bezpečné dávce 14 mg/kg/den [9,10].
Eslicarbazepin acetát
Do klinické praxe byl eslicarbazepin acetát zaveden v roce 2009. Přesný mechanismus účinku eslicarbazepin acetátu není objasněn, ale je známo, že jeho metabolity stabilizují inaktivované napěťově řízené sodíkové kanály a brání jejich návratu do aktivované fáze (obr. 1). V lidském těle je hlavním účinným metabolitem eslicarbazepin, který má vysokou biologickou dostupnost a maximálních plazmatických koncentrací dosahuje za 2–3 hodiny po perorálním podání. Více než 90 % látky je následně vylučováno močí. Jeho vazba na plazmatické bílkoviny je relativně nízká, a proto neovlivňuje vazbu dalších léčiv, jako je např. warfarin, digoxin, diazepam či phenytoin.
Eslicarbazepin acetát je indikován jako přídatná léčba u dospělých s parciálními záchvaty se sekundární generalizací či bez ní. Jeho klinická účinnost byla prokázána čtyřmi dvojitě zaslepenými, randomizovanými studiemi kontrolovanými placebem. Účinnost eslicarbazepin acetátu byla hodnocena u dávek 400 mg, 800 mg a 1 200 mg na den. Při podávání dávky 400 mg nebyl signifikantní účinek oproti placebu prokázán. V případě dávek 800 mg a 1 200 mg jednou denně pak byl prokázán signifikantní účinek (30–35 %) na padesátiprocentní a vyšší redukci výskytu záchvatů u pacientů ve srovnání s placebem [11–14]. Doporučená denní terapeutická dávka eslicarbazepin acetátu je tedy 800–1 200 mg v jednom denním (zpravidla večerním) podání. Doporučená počáteční dávka je 400 mg s postupnou titrací (v průběhu 1–2 týdnů zvýšit na 800 mg a ev. dále dle účinnosti a snášenlivosti). U pacientů s poruchou ledvinných funkcí je potřeba dávku upravit. Při závažnější poruše funkce ledvin není tento přípravek, vzhledem k nedostatku klinických studií, indikován (konkrétně u pacientů s clearance kreatininu < 30 ml/min.).
Mezi hlavní nežádoucí účinky eslicarbazepin acetátu patří závratě, somnolence, bolest hlavy a nauzea. V klinické praxi méně často než u carbamazepinu, ale přesto můžeme pozorovat při podávání eslicarbazepin acetátu hyponatremii. Dále se může vyskytovat anemie, diplopie, depresivita, insomnie, palpitace, infekce močových cest, vyrážky či myalgie. Tyto nežádoucí účinky však patří mezi vzácné. Všeobecně je eslicarbazepin acetát dobře tolerován a zdá se, že příznivě působí na depresivní příznaky u pacientů s epilepsií. Recentně byly publikovány práce potvrzující účinnost a dobrou toleranci eslicarbazepin acetátu v monoterapii pacientů s parciálními záchvaty [15,16]. Eslicarbazepin acetát snižuje plazmatické koncentrace některých statinů a při vyšších dávkách může ovlivňovat (snižovat) plazmatickou koncentraci warfarinu. Proto zejména při zahajování léčby a následně při ev. ukončení léčby tímto přípravkem je nutné monitorovat hodnoty INR (International Normalized Ratio) a sérové koncentrace lipidů. U eslicarbazepin acetátu bylo prokázáno příznivé ovlivnění komorbidní depresivity, což může být pro pacienty s epilepsií přínosné.
Stejně jako u ostatních přípravků ze skupiny „nových antiepileptik“ chybí i u eslicarbazepin acetátu dostatek údajů o podávání těhotným ženám. Na animálních modelech byla prokázána reprodukční toxicita. Proto by se u žen užívajících eslicarbazepin acetát při plánování gravidity nebo při otěhotnění mělo jeho další podávání důsledně zvážit a pacientku informovat o možném riziku malformací plodu a pečlivě ji sledovat (včetně screeningu). Rovněž není známo, zda se tento lék vylučuje do mateřského mléka, proto je doporučeno v průběhu podávání eslicarbazepin acetátu kojení přerušit.
Účinnost a hlavně bezpečnost tohoto přípravku u dětí zatím nebyla stanovena. Poslední studie ukazují, že i pro dětské pacienty (testováni byli pacienti s epilepsií od věku dvou let) je při použití dávek 5–30 mg/kg/den eslicarbazepin acetát účinný v závislosti na dávce (17–43% snížení frekvence záchvatů). Účinek byl prokázán u dětí ve věku 2–7 let a u adolescentů ve věku 12–17 let. Ve skupině 7–11letých pacientů statisticky významná účinnost eslicarbazepin acetátu prokázána nebyla [17].
Retigabin
Retigabin jako dosud jediné antiepileptikum přímo ovlivňuje (otevírá) draslíkové kanály (konkrétně KCNQ2 a KCNQ3). Tím stabilizuje klidový membránový potenciál, snižuje excitabilitu neuronů a zabraňuje vzniku epileptických výbojů v mozku (obr. 1). Retigabin má pravděpodobně i další mechanismy účinku, které však doposud nejsou zcela objasněny. Toto léčivo je metabolizováno několika způsoby. Velká část je přeměněna na inaktivní N‑glukuronid. Další část je metabolizována na N‑acetyl – metabolit, který je opět glukuronizován. Retigabin je metabolizován v játrech, jeho eliminace probíhá zejména prostřednictvím renální exkrece. Jako jedno z mála léčiv není retigabin metabolizován přes cytochrom P450. Proto není při jeho použití za současného podávání induktorů či inhibitorů tohoto enzymu nutná obezřetnost.
Retigabin se používá jako přídatná léčba u parciálních epileptických záchvatů, kde byla jeho účinnost prokázána v několika klinických studiích. Při jeho užívání došlo přibližně u 30 % pacientů ke snížení frekvence záchvatů (dávkovací schéma bylo 600 mg, 900 mg a 1 200 mg při léčbě v trvání 16 týdnů, za redukci bylo považováno snížení frekvence záchvatů o 50 % a více) [18–20].
Do klinické praxe byl retigabin zaveden po schválení EMA v roce 2011. Avšak poměrně záhy, v roce 2013, byl zjištěn významný a bohužel nepříliš vzácný nežádoucí účinek retigabinu – šedo‑modrá pigmentace kůže a sliznic, či dokonce ukládání modrého pigmentu do sítnice. Tento nežádoucí účinek se zřejmě vyskytuje s odstupem několika let užívání retigabinu. Proto je léčba retigabinem aktuálně vnímána spíše jako ultimum refugium a pacient musí být před zahájením léčby plně informován o možném zhoršení zraku. Rovněž musí být provedeno oftalmologické vyšetření vždy před zahájením léčby a následně jednou za půl roku opakováno.
Jako další závažné nežádoucí účinky byly popsány retence moči a prodloužení intervalu QT (při dávce 1 200 mg/den). Nejčastějšími nežádoucími účinky léčby retigabinem jsou závratě, somnolence, zmatenost, poruchy řeči, tremor, amnézie, poruchy myšlení, poruchy chůze, parestezie a diplopie [18].
V současnosti je retigabin indikován jako přídatná léčba parciálních záchvatů u pacientů ve věku minimálně 18 let trpících farmakorezistentní epilepsií, a to pouze v případě, kdy jiná kombinovaná léčba nedostačovala nebo nebyla dobře tolerována. Maximální iniciální dávka je 300 mg denně (tedy 100 mg třikrát denně, vzhledem ke krátkému biologickému poločasu eliminace). Celkovou denní dávku je možné zvyšovat o maximálně 150 mg týdně do maximální denní dávky 1 200 mg. Předpokládaná účinná denní dávka je 600–1 200 mg.
Vzhledem k nedostatečnému množství údajů není retigabin doporučován v těhotenství a u žen ve fertilním věku, které neužívají hormonální antikoncepci. Rovněž není známo, zda je retigabin vylučován do mateřského mléka, proto je užívání retigabinu v průběhu kojení ponecháno na individuálním zvážení prospěchu a rizika.
Bezpečnost a účinnost retigabinu u pediatrické populace doposud nebyla stanovena, ani nejsou dostatečně známy studie či jednotlivé kasuistiky podporující použití tohoto léčiva v dětské populaci.
Perampanel
Perampanel je dosud posledním antiepileptikem uvedeným na trh (2012). Perampanel je selektivní, nekompetitivní antagonista ionotropního glutamátového receptoru AMPA (α‑amino‑3‑hydroxy‑5‑methyl‑4‑isoxazolepropionic acid) na postsynaptických neuronech (obr. 1). Aktivace AMPA receptoru pomocí glutamátu vede k excitaci a ke zrychlení synaptických přenosů v mozku. Ovlivnění této excitace je hlavním předpokládaným mechanismem účinku perampanelu u epileptických záchvatů.
Perampanel je snadno absorbován a přibližně z 95 % vázán na plazmatické bílkoviny. Primárně je oxidován pomocí CYP3A a následně metabolizován glukuronidací. Výrazněji neovlivňuje enzymy uridindifosfátglukuronyltransferázu (UGT) ani cytochrom P450. Při současném podávání s jinými antiepileptiky je prokázáno snížení plazmatické koncentrace perampanelu (po carbamazepinu, oxcarbazepinu, phenytoinu a topiramatu). Nejvýznamněji snižuje plazmatickou koncentraci perampanelu carbamazepin, proto je při jejich současném podávání doporučeno podávání vyšších dávek perampanelu (8–12 mg/den). Naopak užívání perampanelu vede k výraznému zvýšení plazmatické koncentrace oxcarbazepinu a ke snížení koncentrace carbamazepinu, kyseliny valproové, lamotriginu a clobazamu.
Účinnost perampanelu byla prokázána ve třech randomizovaných multicentrických klinických studiích kontrolovaných placebem, a to signifikantně při dávkách 4 mg a 8 mg za den. Klinicky testována byla i dávka 12 mg/den, nebyl však prokázán statisticky významný rozdíl ve snížení frekvence záchvatů mezi touto dávkou a dávkou 8 mg/den [21–24].
Perampanel je aktuálně indikován k přídatné léčbě parciálních záchvatů (se sekundární generalizací nebo bez ní) a k léčbě primárně generalizovaných tonicko‑klonických záchvatů u dospělých a dospívajících pacientů starších 12 let.
Perampanel se užívá v jedné perorální dávce za den, a to před spaním. Léčba má být zahájena dávkou 2 mg/den a zvyšována za 1–2 týdny o 2 mg do maximální denní dávky 8–12 mg.
Mezi jeho nežádoucí účinky patří zejména zvýšení chuti k jídlu a nárůst tělesné hmotnosti (může ale rovněž naopak snižovat chuť k jídlu). Dále se může objevit diplopie, závratě, únava, bolesti zad, pády, zmatenost či sklony k agresi.
Vzhledem k nedostatečnému množství údajů není podávání perampanelu v těhotenství doporučováno. Rovněž není známo, zda se perampanel či jeho metabolity vylučují do mateřského mléka. Proto je na individuálním posouzení, jestli přerušit léčbu, nebo přerušit kojení po dobu jeho podávání.
Zatím nebylo schváleno podávání tohoto přípravku u dětské populace, ale zdá se, že indikace a účinnost bude obdobná jako u dospělých pacientů s epilepsií. Ve studii s 58 dětskými pacienty ve věku 2–17 let s různými typy epilepsie (fokální epilepsie, blíže nespecifikovaná generalizovaná epilepsie, Lennoxův–Gastautův syndrom, syndrom Dravetové a Westův syndrom) došlo u 31 % pacientů ke snížení frekvence o 50 % a více [25].
Brivaracetam
Brivaracetam byl dne 14. 1. 2016 schválen v Evropské unii k léčbě parciálních záchvatů se sekundární generalizací nebo bez sekundární generalizace u dospělých a dospívajících pacientů s epilepsií ve věku od 16 let. Jeho zavedení do klinické praxe v ČR se očekává v příštím roce.
Hlavním mechanismem účinku brivaracetamu je vazba na synaptické vezikuly glykoproteinu 2A (SV2A) a následná inhibice napěťově řízených sodíkových kanálů. Brivaracetam je analogem velmi úspěšného antiepileptika levetiracetamu, oproti němu má však zhruba 20násobně vyšší afinitu k SV2A, neovlivňuje receptory AMPA, není substrátem transportního P‑glykoproteinu a současně výrazně snadněji a rychleji proniká do mozku.
Účinnost a bezpečnost brivaracetamu byla testována v šesti randomizovaných klinických studiích fáze IIb a III. Celkově bylo brivaracetamu vystaveno 3 673 pacientů, z nichž část je sledována již déle než osm let. Výsledky těchto studií prokázaly účinnost brivaracetamu v léčbě fokálních epilepsií a současně dobrou snášenlivost v dávkách 50 mg/den, 100 mg/den a 200 mg/den [26–28]. Výhodou tohoto léčiva je možnost podání cílové dávky bez nutnosti titrace a v neposlední řadě i jeho dostupnost v intravenózní formě [29]. Studie naznačují rovněž nižší výskyt psychických nežádoucích účinků oproti levetiracetamu. Mezi jeho nejčastější nežádoucí účinky patří únava, ospalost, závratě a bolesti hlavy.
Brivaracetam může být velmi vhodným lékem pro tzv. add‑on terapii fokální epilepsie dospělých a adolescentních pacientů ve věku od 16 let. Zahajovací dávka je doporučena na 50 mg/den nebo 100 mg/den rozdělených do dvou denních dávek. Dle účinnosti a snášenlivosti je možné její další zvýšení až do dávky 200 mg/den.
Závěr
Všechna uvedená nová antiepileptika přispívají nejen k významnému rozšíření dostupného farmakologického armamentária, ale především pomáhají zvýšit naději na bezpečnější a účinnější léčbu epileptických pacientů a současně na vyšší kvalitu jejich života.
Seznam použité literatury
- [1] Ben Menachen E, Biton V, Jatuzis D, et al. Efficacy and safety of oral lacosamide as adjunctive therapy in adults with partial onset seizures. Epilepsia 2007; 48: 1308–1317.
- [2] Halasz P, Kälviäinen R, Mazurkiewicz Beldzińska M, et al. Adjunctive lacosamide for partial onset seizures: Efficacy and safety results from a randomized controlled trial. Epilepsia 2009; 50: 443–453.
- [3] Chung S, Sperling MR, Biton V, et al. Lacosamide as adjunctive therapy for partial onset seizures: A randomized controlled trial. Epilepsia 2010; 51: 958–967.
- [4] Rantsch K, Walter U, Wittstock M, et al. Efficacy of intravenous lacosamide in refractory nonconvulsive status epilepticus and simple partial status epilepticus. Seizure 2011; 20: 529–532.
- [5] Trinka E, Höfler J, Leitinger M, et al. Pharmacotherapy for status epilepticus. Drugs 2015; 75: 1499–1521.
- [6] Wechsler RT, Li G, French J, et al. Conversion to lacosamide monotherapy in the treatment of focal epilepsy: Results from a historical controlled, multicenter, double blind study. Epilepsia 2014; 55: 1088–1098.
- [7] Casas Fernández C, Martínez Bermejo A, Rufo Campos M, et al. Efficacy and Tolerability of Lacosamide in the Concomitant Treatment of 130 Patients Under 16 Years of Age with Refractory Epilepsy. Drugs R D 2012; 12: 187–197.
- [8] Miskin C, Khurana DS, Valencia I, et al. Efficacy and Tolerability of Lacosamide in the Treatment of Children With Refractory Generalized Epilepsy. J Child Neurol 2016 Feb 16. pii: 0883073816630084.
- [9] Capovilla G, Beccaria F, Beghi, E, et al. Treatment of convulsive status epilepticus in childhood: recommendations of the Italian League Against Epilepsy. Epilepsia 2013; 54: 23–34.
- [10] Grosso S, Zamponi N, Bartocci A, et al. Lacosamide in children with refractory status epilepticus. A multicenter Italian experience. Eur J Paediatr Neurol 2014; 18: 604–608.
- [11] Almeida L, Bialer M, Soares da Silva P. Eslicarbazepine acetate. The Treatment of Epilepsy, Third Edition 2009; 485–498.
- [12] Elger C, Halász P, Maia J, et al. Efficacy and safety of eslicarbazepine acetate as adjunctive treatment in adults with refractory partial onset seizures: a randomized, double blind, placebo controlled, parallel group phase III study. Epilepsia 2009; 50: 454–463.
- [13] Gil Nagel A, Lopes Lima J, Almeida L, et al. Efficacy and safety of 800 and 1200 mg eslicarbazepine acetate as adjunctive treatment in adults with refractory partial onset seizures. Acta Neurol Scand 2009; 120: 281–287.
- [14] Ben Menachem E, Gabbai AA, Hufnagel A, et al. Eslicarbazepine acetate as adjunctive therapy in adult patients with partial epilepsy. Epilepsy Res 2010; 89: 278–285.
- [15] Jacobson MP, Pazdera L, Bhatia P, et al. Efficacy and safety of conversion to monotherapy with eslicarbazepine acetate in adults with uncontrolled partial onset seizures: a historical control phase III study. BMC Neurol 2015; 15: 46.
- [16] Sperling MR, Abou Khalil B, Harvey J, et al. Eslicarbazepine acetate as adjunctive therapy in patients with uncontrolled partial onset seizures: Results of a phase III, double blind, randomized, placebo controlled trial. Epilepsia 2015; 56: 244–253.
- [17] Almeida L, Minciu I, Nunes T, et al. Pharmacokinetics, efficacy, and tolerability of eslicarbazepine acetate in children and adolescents with epilepsy. J Clin Pharmacol 2008; 48: 966–977.
- [18] Porter RJ, Partiot A, Sachdeo R, et al. Randomized, multicenter, dose ranging trial of retigabine for partial onset seizures. Neurology 2007; 68: 1197–1204.
- [19] Brodie MJ, Lerche H, Gil Nagel A, et al. Efficacy and safety of adjunctive ezogabine (retigabine) in refractory partial epilepsy. Neurology 2010; 75: 1817–1824.
- [20] French JA, Abou Khalil BW, Leroy RF, et al. Randomized, double blind, placebo controlled trial of ezogabine (retigabine) in partial epilepsy. Neurology 2011; 76: 1555–1563.
- [21] Rektor I, Krauss GL, Bar M, et al. Perampanel Study 207: long term open label evaluation in patients with epilepsy. Acta Neurol Scand 2012; 126: 263–269.
- [22] French JA, Krauss GL, Biton V, et at. Adjunctive perampanel for refractory partial onset seizures Randomized phase III study 304. Neurology 2012; 79: 589–596.
- [23] Krauss GL, Serratosa JM, Villanueva V, et al. Randomized phase III study 306 Adjunctive perampanel for refractory partial onset seizures. Neurology 2012; 78: 1408–1415.
- [24] Hsu WW, Sing CW, He Y, et al. Systematic Review and Meta Analysis of the Efficacy and Safety of Perampanel in the Treatment of Partial Onset Epilepsy. CNS Drugs 2013; 27: 817–827.
- [25] Biró A, Stephani U, Tarallo T, et al. Effectiveness and Tolerability of Perampanel in Children and Adolescents with Refractory Epilepsies: First Experiences. Neuropediatrics 2015; 46: 110–115.
- [26] Ryvlin P, Werhahn KJ, Blaszczyk B, et al. Adjunctive brivaracetam in adults with uncontrolled focal epilepsy: Results from a double blind, randomized, placebo controlled trial. Epilepsia 2014; 55: 47–56.
- [27] Biton V, Berkovic SF, Abou Khalil B, et al. Brivaracetam as adjunctive treatment for uncontrolled partial epilepsy in adults: A phase III randomized, double blind, placebo controlled trial. Epilepsia 2014; 55: 57–66.
- [28] Klein P, Schiemann J, Sperling MR, et al. A randomized, double blind, placebo controlled, multicenter, parallel group study to evaluate the efficacy and safety of adjunctive brivaracetam in adult patients with uncontrolled partial onset seizures. Epilepsia 2015; 56: 1890–1898.
- [29] Klein P, Tyrlikova I, Brazdil M, Rektor I. Brivaracetam For The Treatment Of Epilepsy. Expert Opin Pharmacother 2016; 17: 283–295.