Nová evropská doporučení pro léčbu hepatitidy C
Souhrn:
Léčba chronické hepatitidy C prodělala v posledních čtyřech letech mimořádně rychlý vývoj. Hlavní změnou je možnost léčby přímo působícími antivirotiky (DAA, direct acting antivirals), která se podávají v kombinaci s pegylovaným interferonem a ribavirinem nebo v tzv. interferon free, nebo dokonce v ribavirin free režimech. Doporučený postup Evropské asociace pro studium jater z dubna 2015 se věnuje především zásadním změnám v doporučených léčebných režimech pacientů s chronickou infekcí virem hepatitidy C.
Key words: hepatitis C – pegylated interferon – ribavirin – sofosbuvir – simeprevir – daclatasvir – ledipasvir – paritaprevir – ombitasvir – dasabuvir.
Summary:
Treatment of chronic hepatitis C made extraordinary development in the last four years. The main change is related to the possibility of therapy with direct acting antivirals (DAA) either in combination with pegylated interferon and ribavirin, or in interferon free or even ribavirin free regimes. European Association for the Study of the Liver (EASL) Recommendations on treatment of hepatitis C from April 2015 pay attention predominantly to the fundamental changes in recommended therapeutic regimens of chronic hepatitis C infection.
Úvod
Virus hepatitidy C (HCV) představuje celosvětově jednu z hlavních příčin jaterních onemocnění. Důsledky chronické infekce HCV jsou velmi variabilní – od minimálních histologických změn po pokročilou fibrózu, cirhózu nebo hepatocelulární karcinom. Odhadem dosahuje celosvětová prevalence chronické infekce HCV 3 %, to znamená asi 160 milionů chronicky infikovaných osob.
Léčba chronické hepatitidy C prodělává v posledních čtyřech letech zcela mimořádné změny. Do praxe se postupně zavádějí přímo působící antivirotika (direct‑acting antivirals, DAA), která se podávají v kombinaci s pegylovaným interferonem (PEG‑IFN) a ribavirinem nebo v tzv. interferon‑free režimech, nebo dokonce v ribavirin‑free režimech.
Velmi rychlé změny v možnostech léčby chronické hepatitidy C vedly k rychlým inovacím doporučených postupů. Evropská asociace pro studium jater (EASL, European Association for the Study of the Liver) vydala předchozí doporučení v dubnu 2014 [1] a během jednoho roku došlo k takovému vývoji léčebných možností, že v rámci 50. výročního zasedání EASL ve Vídni byla představena doporučení nová [2]. Americká asociace pro studium jater (AASLD, American Association for the Study of Liver Diseases) dokonce přestala svá doporučení vydávat v tištěné formě a zpřístupnila je pouze online na webových stránkách, kde jsou plynule doplňována o výsledky nových klinických hodnocení. Při každém stažení tohoto doporučeného postupu se k textu automaticky přiřadí datum, ve kterém daná verze platila a byla uživatelem získána [3].
Metodologie doporučení EASL
Poslední doporučení EASL z dubna 2015 používá, stejně jako předchozí verze z roku 2014, adaptovaný klasifikační systém GRADE. Kvalita důkazu uvedeného tvrzení je známkována v rozmezí A–C (A – vysoká, B – střední, C – nízká kvalita důkazu) a pro sílu doporučení se používá označení číslem 1 pro silné doporučení a číslem 2 pro slabé doporučení. Kombinací výsledků obou skórovacích systémů je stanovena škála od A1 (další vývoj velmi pravděpodobně nepovede ke změně názoru na daný problém a tato léčba či diagnostický postup se rozhodně doporučují) po C2 (další výzkum je nezbytný, změna pohledu na daný problém je možná, nebo dokonce pravděpodobná, proto je doporučení uplatňovat určitou diagnostickou či léčebnou metodu méně důrazné). V dalším textu je tato klasifikace opakovaně použita.
Screening chronické hepatitidy C
Úspěšnost a bezpečnost léčby chronické hepatitidy C se výrazně zlepšila, proto je nutné identifikovat v populaci osoby dlouhodobě bezpříznakově infikované HCV. Konkrétní screeningové programy v různých zemích závisejí na lokální epidemiologické situaci (A1). Screening HCV musí být založen na detekci protilátek anti‑HCV (A1). Rychlé diagnostické testy mohou být použity místo klasické metody enzymatické imunoeseje (B1). Lze při nich využít různý biologický materiál – sérum, plazmu, zaschlou kapku kapilární krve, sliny z oblasti mezi dásněmi a rty. Při průkazu protilátek anti‑HCV je nutné prokazovat přítomnost HCV RNA dostatečně senzitivní metodou, s dolním limitem detekovatelnosti ≤ 15 IU/ml (A1).
Cíle léčby chronické hepatitidy C
Primárním cílem léčby je eradikace infekce HCV, což je spojeno s prevencí vzniku hepatálních a extrahepatálních komplikací infekce HCV, včetně zánětlivě‑nekrotického jaterního procesu, fibrózy, cirhózy, dekompenzace cirhózy, závažných extrahepatálních manifestací a smrti (A1). Kritériem úspěšnosti eradikace HCV je HCV RNA nedetekovatelná (≤ 15 IU/ml) 12 nebo 24 týdnů po ukončení celkové doby léčby – setrvalá virologická odpověď (SVR, sustained virologic response) 12 a 24 (A1). Shoda SVR 12 se SVR 24 je zjišťována v 99 % případů a dosažení SVR koresponduje ve více než 99 % případů s definitivním vyléčením z infekce HCV. U pacientů s pokročilou fibrózou (F3 dle klasifikace METAVIR) a cirhózou (F4 dle klasifikace METAVIR) musí probíhat doživotní pravidelný screening hepatocelulárního karcinomu, a to i přes dosažení SVR (A1). V případě dekompenzované cirhózy snižuje dosažení SVR pravděpodobnost transplantace jater, zda má vliv na střednědobé a dlouhodobé přežívání pacientů, není známo (B2).
Vyšetření před zahájením léčby
Před léčbou chronické infekce HCV by měly být systematicky hledány jiné možné příčiny jaterního onemocnění a faktory, které by mohly ovlivnit přirozený průběh, progresi jaterního onemocnění a účinek antivirové léčby (A1). Nutné je posouzení závažnosti a pokročilosti jaterního poškození, s výjimkou pacientů s klinicky jasnou cirhózou, protože terapeutické doporučení pro pacienty bez cirhózy a s cirhózou se různí (A1).
Až do vydání tohoto doporučení byla jaterní biopsie uváděna jako zlatý standard pro posouzení aktivity a pokročilosti jaterního zánětu. Podle posledního doporučení se stupeň fibrózy iniciálně posuzuje neinvazivními metodami, především tranzientní nebo sonografickou elastografií, eventuálně analýzou panelu biomarkerů fibrózy v séru (A1). Jaterní biopsie je rezervována pro případy, kde výsledek neinvazivních metod není jasný nebo je možná i jiná etiologie jaterního onemocnění (A1). Samozřejmostí musí být určení vstupní výše viremie s citlivostí ≤ 15 IU/ml (A1), genotypu HCV a subtypů 1a a 1b (A1). Naopak určování genotypu IL28B nemá při léčbě novými DAA význam (A1). Testovat před léčbou rezistenci HCV na DAA se zatím nedoporučuje, protože úspěšnost moderní léčby je většinou vysoká i při přítomnosti rezistentních variant viru. Jedinou výjimkou je určování polymorfismu Q80K u genotypu 1a před léčbou trojkombinací simeprevir + PEG‑IFN + ribavirin (A1). V případě průkazu tohoto polymorfismu by pacient s genotypem 1a neměl být uvedenou kombinací léčen.
Indikace k léčbě – kdo by měl být léčen?
O léčbě by mělo být uvažováno u všech kompenzovaných i dekompenzovaných, dosud neléčených („naivních“) i dříve léčených pacientů s infekcí HCV (A1). Zvláštní naléhavost léčby je u pacientů se signifikantní fibrózou – stupeň F3 a F4 dle klasifikace METAVIR (A1). Dekompenzovaní cirhotici (Child‑Pugh B a C) by měli být urgentně léčeni bezinterferonovým režimem (A1). Bez ohledu na stupeň fibrózy je léčba prioritní při koinfekci s HBV (hepatitis B virus) nebo s HIV (human immunodeficiency virus), před transplantací a po transplantaci jater, při existenci signifikantních extrahepatálních manifestací infekce HCV (smíšená kryoglobulinemie, nefropatie, non‑hodgkinský B‑lymfom) a při vysilující únavě (A1). Přednostně by měly být léčeny i osoby s rizikem přenosu infekce HCV, včetně aktivních uživatelů injekčních drog, homosexuálních mužů s rizikovými sexuálními praktikami, žen, které plánují těhotenství, hemodialyzovaných osob a vězňů, a to bez ohledu na stupeň fibrózy (A1). Léčba je plně oprávněná i u osob se středním stupněm fibrózy – F2 dle METAVIR (A2). Individuální přístup k léčbě je možný v případě absence nebo přítomnosti mírné fibrózy (F0–F1) a pokud nejsou přítomny extrahepatální manifestace infekce HCV (B1). Léčba není doporučena při limitované délce života způsobené komorbiditami, které nejsou jaterního původu (B1).
Základní principy léčby hepatitidy C
Hlavní rozdíly oproti předchozí verzi doporučeného postupu spočívají v léčebných postupech. Zásadní změnou je důsledné opuštění kombinované léčby proteázovými inhibitory první generace – boceprevirem a telaprevirem – v kombinaci s PEG‑IFN a ribavirinem. Základem léčby se stává nová generace DAA buď v kombinaci s PEG‑IFN a ribavirinem (sofosbuvir, simeprevir) nebo vzájemná kombinace těchto perorálních léčiv v bezinterferonových režimech – sofosbuvir + simeprevir, sofosbuvir + ledipasvir, sofosbuvir + daclatasvir, sofosbuvir + ribavirin a kombinace paritaprevir (potencovaný ritonavirem) + ombitasvir ± dasabuvir.
Léčebná doporučení již nejsou různá pro pacienty dosud neléčené (naivní) a v minulosti neúspěšně léčené kombinací PEG‑IFN a ribavirinem. Rovněž doporučení pro pacienty koinfikované HIV/HCV jsou v principu stejná jako pro pacienty s monoinfekcí HCV. Doporučený léčebný postup je určen pouze genotypem viru (u genotypu 1 i subtypem 1a nebo 1b), pokročilostí jaterního procesu a předchozí léčbou DAA (nikoliv pouze kombinací PEG‑IFN a ribavirinu). Jednu skupinu představují pacienti bez jaterní cirhózy, druhou kompenzovaní cirhotici, třetí skupinu tvoří pacienti s dekompenzací jaterní cirhózy a poslední skupinou jsou nemocní neúspěšně léčení alespoň jedním DAA. Velký důraz je kladen na lékové interakce DAA s řadou léčiv užívaných běžně – statiny, léčiva působící na kardiovaskulární systém, psychofarmaka, i vzácněji – antiretrovirotika, imunosupresiva. Tyto lékové interakce jsou při léčbě DAA poměrně časté a mohou významně ovlivňovat účinnost jak léčiv proti HCV, tak konkomitantní medikace. Ze stejných důvodů jsou uvedeny i interakce s řadou drog [4].
Moderní léky pro léčbu hepatitidy C
Sofosbuvir je nukleotidový inhibitor NS5B polymerázy HCV, který in vitro vykazuje aktivitu vůči všem genotypům HCV. Podává se jedna tableta s obsahem 400 mg účinné látky jednou denně bez závislosti na jídle. Pro pacienty infikované genotypy 1–6 je doporučena trojkombinace sofosbuvir + PEG‑IFN + ribavirin a bezinterferonový režim sofosbuvir + daclatasvir. Druhý bezinterferonový režim sofosbuvir + simeprevir je určen pro nemocné s infekcí genotypy 1 a 4. Pro nemocné infikované genotypy 2 a 3 je možné použít i dvojkombinaci sofosbuvir + ribavirin.
Sofosbuvir a ledipasvir ve fixní jednotabletové kombinaci má široké pole uplatnění v léčbě pacientů infikovaných genotypy 1, 4, 5 a 6. Ledipasvir působí jako inhibitor komplexu NS5A. Blokuje dvě fáze virového replikačního cyklu, a sice syntézu RNA, ale také kompletaci virionu a pravděpodobně i proces jeho uvolnění z hepatocytu. Kombinovaná tableta obsahuje 400 mg sofosbuviru a 90 mg ledipasviru.
Simeprevir je inhibitorem proteázy NS3/4A druhé generace, někdy je označován jako proteázový inhibitor druhé vlny první generace. Podává se jedna kapsle se 150 mg účinné dávky jednou denně s jídlem. Je určen pro nemocné infikované genotypy 1 nebo 4, a to buď v kombinaci s PEG‑IFN a ribavirinem, nebo i v bezinterferonovém režimu se sofosbuvirem.
Daclatasvir je stejně jako ledipasvir inhibitorem replikačního komplexu NS5A. Daclatasvir je dostupný ve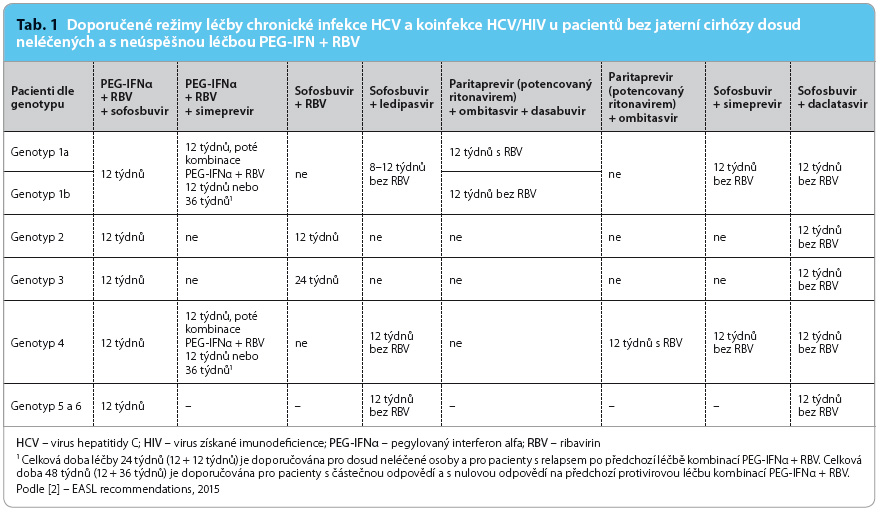 formě tablety obsahující 60 mg nebo 30 mg účinné látky. Nižší dávka se používá vzhledem k lékovým interakcím při současné léčbě s některými antibiotiky, antimykotiky a antiretrovirotiky. Současné místo daclatasviru je v bezinterferonovém režimu v kombinaci se sofosbuvirem, určeném pro všechny genotypy HCV.
formě tablety obsahující 60 mg nebo 30 mg účinné látky. Nižší dávka se používá vzhledem k lékovým interakcím při současné léčbě s některými antibiotiky, antimykotiky a antiretrovirotiky. Současné místo daclatasviru je v bezinterferonovém režimu v kombinaci se sofosbuvirem, určeném pro všechny genotypy HCV.
Zatím posledním schváleným přípravkem je fixní kombinace léčiv, která obsahuje v jedné tabletě paritaprevir (inhibitor NS3/4A proteázy) v dávce 75 mg potencovaný 50 mg ritonaviru a ombitasvir (inhibitor NS5A) v dávce 12,5 mg. Doporučenou dávku představují 2 tablety podávané jednou denně s jídlem. Ve druhé tabletě je dasabuvir, nenukleosidový inhibitor NS5B polymerázy v dávce 250 mg. Podává se 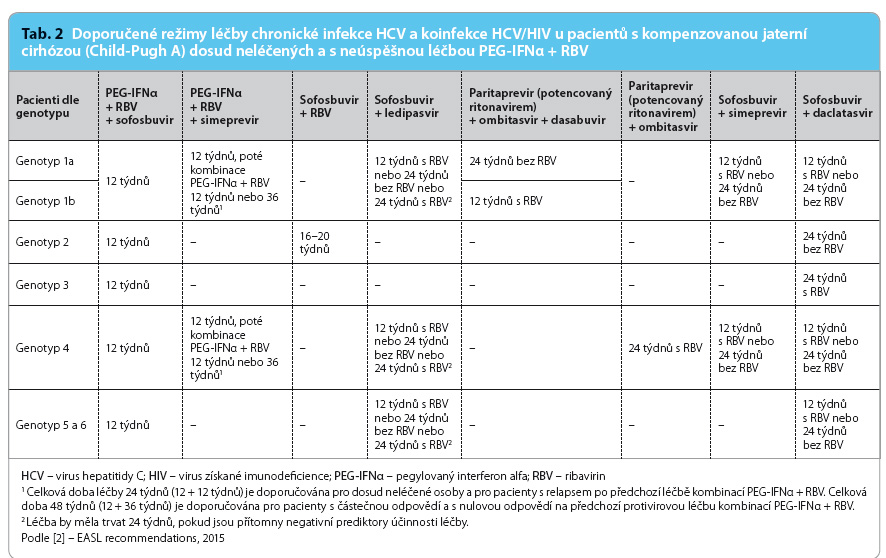 dvakrát denně jedna tableta. Tato kombinace léčiv blokuje všechny dosud známé úrovně replikace HCV. Ritonavir nepůsobí proti HCV, ovlivňuje farmakokinetiku a umožňuje podávání paritapreviru v nižší dávce a pouze jednou denně. Tato kombinace je určena pro léčbu pacientů infikovaných genotypem 1, v případě infekce genotypem 4 se používá pouze paritaprevir + ombitasvir, tedy bez dasabuviru. Doporučené postupy pro léčbu pacientů bez jaterní cirhózy a s kompenzovanou jaterní cirhózou jsou uvedeny v tab. 1 a 2.
dvakrát denně jedna tableta. Tato kombinace léčiv blokuje všechny dosud známé úrovně replikace HCV. Ritonavir nepůsobí proti HCV, ovlivňuje farmakokinetiku a umožňuje podávání paritapreviru v nižší dávce a pouze jednou denně. Tato kombinace je určena pro léčbu pacientů infikovaných genotypem 1, v případě infekce genotypem 4 se používá pouze paritaprevir + ombitasvir, tedy bez dasabuviru. Doporučené postupy pro léčbu pacientů bez jaterní cirhózy a s kompenzovanou jaterní cirhózou jsou uvedeny v tab. 1 a 2.
Léčba pacientů, u kterých selhala léčba s jedním nebo několika DAA, se řídí několika obecnými pravidly:
- jedná se výhradně o léčbu bezinterferonovou,
- pokud selhala léčba s proteázovým inhibitorem, nemá následná léčba obsahovat jiný proteázový inhibitor (možnost zkřížené rezistence),
- součástí nové kombinace DAA není léčivo obsažené v kombinaci DAA, která selhala.
Z těchto obecných pravidel existují některé výjimky, jež jsou přesně uvedeny v příslušné části doporučeného postupu z dubna 2015 [2].
Následující část textu se věnuje léčbě některých specifických skupin pacientů s infekcí HCV.
Léčba pacientů koinfikovaných HCV/HBV
U naprosté většiny nemocných je hodnota HBV DNA nízká nebo nedetekovatelná. V případě, že HCV replikuje (pozitivní HCV RNA v séru) a způsobuje jaterní chorobu, léčí se podle stejných pravidel jako u infikovaných jen HCV (B1). Existuje potenciální riziko reaktivace infekce HBV po útlumu replikace HCV úspěšnou antivirovou léčbou. Pokud je HBV DNA v séru signifikantně pozitivní, je nutné přidat do kombinace léčiv proti HCV i nukleos(t)idový analog účinný proti HBV (B1).
Léčba hemodialyzovaných pacientů
Infekce HCV je relativně častá mezi pacienty léčenými hemodialýzou a zvyšuje mortalitu celkovou i na jaterní choroby. Imunosuprese po transplantaci ledviny akceleruje jaterní postižení způsobené HCV. Proto je důraz kladen na léčbu infekce HCV před transplantací ledviny, tedy ještě u hemodialyzovaných pacientů (B1). Tito pacienti by měli být léčeni tzv. interferon‑free režimem, nejlépe i ribavirin‑free režimem, a to 12 týdnů, pokud nemají cirhózu, nebo 24 týdnů, pokud trpí cirhózou (B1). Simeprevir, daclatasvir a kombinace paritaprevir + ombitasvir + dasabuvir jsou metabolizovány játry a mohou být použity u pacientů se závažným ledvinným onemocněním (A1). Sofosbuvir se nesmí podávat při poklesu glomerulární filtrace pod hodnotu 30 ml/min/1,73 m2 nebo v konečném stadiu renálního selhání, dokud nebude k dispozici více informací (B2). Dávkování ribavirinu je přísně individuální – 200 mg/den, 200 mg obden, resp. 200 mg 3× týdně po hemodialýze. V každém případě je nutnost užití erytropoetinu častá. Protože zatím není známo, jak je třeba upravit dávky nových DAA u hemodialyzovatelných pacientů, je nutná extrémní opatrnost při léčení těchto komplikovaných a rizikových nemocných (B1).
Léčba aktivních uživatelů drog
Rozhodnutí o léčbě aktivních narkomanů by mělo být učiněno na základě individuálního posouzení multidisciplinárním týmem odborníků (A1). Lze tolerovat střední abúzus alkoholu nebo cannabisu, pokud nejsou přítomny známky pokročilé jaterní choroby (A1, B2). Podle klinických studií je obecně adherence, pravděpodobnost řádného ukončení léčby a dosažení SVR u aktivních narkomanů srovnatelná s ostatními pacienty (B1). Volba léčebného režimu je stejná jako u nemocných bez abúzu drog (B1). Narkomani se substituční terapií by měli být léčeni bezinterferonovým režimem (B1). Transplantace jater je léčebnou možností i u pacientů s anamnézou užívání drog (B1). Substituce opiátů není kontraindikací pro transplantaci jater, nedoporučuje se tuto substituci redukovat nebo ukončit v souvislosti s transplantací jater (B1). Epidemiologická nebezpečnost aktivních uživatelů drog pro jejich okolí z nich činí skupinu osob preferovanou pro časnou antivirovou léčbu (A1).
Léčba akutní hepatitidy C
Účelem léčby je zabránění progresi infekce do chronicity. Zatím má stále přednost monoterapie PEG‑IFN (12 týdnů) bez ohledu na genotyp, protože vede k dosažení SVR ve více než 90 % případů (A1). U pacientů koinfikovaných HIV/HCV se přidává ribavirin a léčba se prodlužuje na 24 týdnů (B1). Lze předpokládat, že bezinterferonové režimy jsou i v této indikaci velmi účinné, ale není zatím k dispozici dostatek informací. Proto se doporučují stejné režimy jako u chronické infekce HCV, a to bez ribavirinu (B1). Nepanuje shoda v tom, kdy léčbu zahájit, zda až při vzestupu aktivity alaninaminotransferázy, při přítomnosti klinických symptomů infekce, nebo již při pozitivitě HCV RNA po 12 týdnech od vzniku onemocnění. Postexpoziční profylaxe (nejčastěji po poranění použitou jehlou) není indikována (B1).
Sledování dosud neléčených a neúspěšně léčených pacientů
Neléčení a neúspěšně léčení pacienti musejí být pravidelně sledováni (A1). Je nutné jasně dokumentovat důvod neléčení nebo příčinu selhání léčby a stanovit charakter virologické odpovědi na předchozí léčbu. Pokročilost jaterního procesu by měla být posuzována každé 1–2 roky neinvazivními metodami (A1). U pacientů s pokročilou fibrózou (F3) a cirhózou (F4) musí probíhat doživotní pravidelný screening hepatocelulárního karcinomu, a to i přes dosažení SVR (A1) – nebezpečí vzniku hepatocelulárního karcinomu je u nich sníženo, ale ne zcela odstraněno.
Závěr
Doporučené postupy EASL jsou vždy vytvářeny celým panelem vysoce renomovaných hepatologů a jsou před svým uveřejněním opakovaně oponovány. Proto vznikají mimořádně kvalitní dokumenty, ve kterých lze nalézt přesnou odpověď na naprostou většinu diagnostických a terapeutických otázek. To bezvýhradně platí i pro nejnovější doporučení EASL pro léčbu hepatitidy C z dubna 2015. I proto se stávají vzorem pro tvorbu doporučení České hepatologické společnosti a Společnosti infekčního lékařství ČLS JEP. V současnosti se intenzivně pracuje na českých doporučeních pro léčbu hepatitidy C. Nový doporučený postup EASL zahrnuje i problematiku léčby dekompenzovaných cirhotiků a léčbu infekce HCV před transplantací a po transplantaci jater. V těchto případech jde o tak složitou problematiku, že bezvýhradně patří do rukou odborníků v transplantačních centrech, proto se jí uvedený článek nezabýval.
Seznam použité literatury
- [1] EASL recommendations on treatment of hepatitis C 2014. Dostupné na www.easl.eu
- [2] EASL recommendations on treatment of hepatitis C 2015. Dostupné na www.easl.eu
- [3] AASLD recommendation for testing, managing, and treating hepatitis C. Dostupné na www.hcvguidelines.org
- [4] University of Liverpool: Drug interactions charts. Dostupné na www.hep druginteractions.com